修回日期: 2012-02-15
接受日期: 2012-03-06
在线出版日期: 2012-04-18
目的: 探讨低表达Smad4调控上皮间质转化影响肝癌细胞(hepatocellular carcinoma cells, HCC)侵袭转移的相关机制.
方法: 采用Western blot法观察低表达Smad4对β-catenin和Vimentin总蛋白表达水平的影响; 逆转录PCR法测定低表达Smad4后, β-catenin和Vimentin mRNA表达的变化; 细胞免疫荧光法检测Smad4、β-catenin和Vimentin在肝癌细胞SMMC-7721及其转染组中的定位及荧光表达强度.
结果: 低表达Smad4后, 相较于CON组和RNAi-NC组, 在转染组RNAi-Smad4-2和RNAi-Smad4-12细胞中, β-catenin mRNA和相应总蛋白的表达水平明显增加(P<0.05), 并促使其发生了核转位的改变; 另一方面, 在RNAi-Smad4-2和RNAi-Smad4-12两转染组细胞中, Vimentin的蛋白表达水平和相应胞浆荧光的表达强度比对照组明显下调(P<0.05), 相应mRNA的表达水平在肝癌SMMC-7721细胞及其转染组无显著差异.
结论: 低表达Smad4可调控上皮间质转化相关标志物β-catenin和Vimentin的表达, 发挥抑制肝癌SMMC-7721细胞上皮间质转化的作用.
引文著录: 薛慧婷, 王宏刚, 黄晓丹, 沈鹏, 季国忠. 低表达Smad4对肝癌细胞SMMC-7721上皮间质转化的影响. 世界华人消化杂志 2012; 20(11): 923-929
Revised: February 15, 2012
Accepted: March 6, 2012
Published online: April 18, 2012
AIM: To investigate the influence of loss of Smad4 expression on TGF-β1-induced epithelial-mesenchymal transition in the human hepatocellular carcinoma cell line SMMC-7721.
METHODS: The influence of loss of Smad4 expression on the expression of β-catenin and Vimentin mRNAs and proteins was evaluated by RT-PCR and Western blot. Immunofluorescence was used to analyze the location and fluorescence intensity of Smad4, β-catenin, Vimentin in non-transfected SMMC-7721 cells and those transfected with Smad-specific siRNAs (RNAi-Smad4-2 and RNAi-Smad4-12) or unspecific siRNA (RNAi-NC).
RESULTS: Compared to non-transfected SMMC-7721 cells and those tranfected with RNAi-NC, the expression of β-catenin mRNA and protein remarkably increased in SMMC-7721 cells transfected with RNAi-Smad4-2 or RNAi-Smad4-12 (all P < 0.05). Loss of Smad4 expression promoted β-catenin nuclear translocation. Immunofluorescence assay revealed that β-catenin fluorescence was located in the nuclei of non-transfected SMMC-7721 cells and those tranfected with RNAi-NC, but in the cytoplasm of SMMC-7721 cells transfected with RNAi-Smad4-2 or RNAi-Smad4-12. On the other hand, loss of Smad4 expression down-regulated Vimentin protein expression (P < 0.05) and cytoplasmic fluorescence intensity, but had no significant impact on Vimentin mRNA expression in SMMC-7721 cells and those transfected with different siRNAs.
CONCLUSION: Loss of Smad4 expression regulates β-catenin and Vimentin and therefore plays an important role in inhibiting epithelial-mesenchymal transition in SMMC-7721 cells.
- Citation: Xue HT, Wang HG, Huang XD, Shen P, Ji GZ. Loss of Smad4 expression inhibits epithelial-mesenchymal transition in SMMC-7721 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(11): 923-929
- URL: https://www.wjgnet.com/1009-3079/full/v20/i11/923.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i11.923
肝癌是全球最常见的恶性肿瘤之一, 其中90%为肝细胞癌(hepatocellular carcinoma, HCC). 全球每年的肝癌新发病例数为74.8万, 死亡数为69.6万[1,2]. 我国是全球肝癌发病率最高的国家, 在常见肿瘤中肝癌发病率居第2位[3,4]. HCC症状不明显, 早期诊断率较低, 5年生存率小于5%, 确诊时多数已发展为中晚期, 发生远处扩散转移[5]. 因此, 研究HCC侵袭转移的发生机制, 对改善肝癌患者预后、延长患者生存期, 具有重要的意义. 肿瘤的侵袭、转移受多种因素的调控和影响, 近几年发现上皮间质转化(epithelial-mesenchymal transition, EMT)是一个关键因素[6]. EMT是指有极性的上皮细胞失去其上皮细胞的表现型, 转化成具有活动能力的间质细胞生物学特征的过程. 他与胚胎发育、创口愈合和肿瘤侵袭转移等密切相关[7,8]. 越来越多的证据[9,10]表明TGF-β1是引发EMT的关键始动因素, 在EMT过程中发挥关键作用. TGF-β信号通路的核心是Smad4, 有研究发现在多种肿瘤中, Smad4与EMT的发生密切相关[11,12], 但两者在肝癌组织中的关系国内外尚无相关报道.
本研究拟观察在肝癌细胞SMMC-7721中, 低表达Smad4对TGF-β1诱发EMT的影响, 初步探讨低表达Smad4引起细胞迁移和侵袭能力改变的相关作用机制, 以期为进一步解释HCC的侵袭转移机制提供实验依据.
人肝癌细胞株SMMC-7721购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所; 小鼠抗人Smad4单克隆抗体购自美国Cell Signaling Technology公司; 鼠抗人Vimentin单克隆抗体购自美国abcam公司; 兔抗人β-catenin单克隆抗体购自美国Cell Signaling Technology公司; 小鼠抗大鼠β-actin单克隆抗体和HRP标记的羊抗鼠、羊抗兔二抗购自武汉博士德公司; 重组人TGF-β1购自美国R&D Systems公司; 山羊抗鼠/兔IgG(H&L)-FITC购自武汉博士德公司; 逆转录试剂盒购自加拿大Fermentas公司; PCR试剂盒购自上海捷瑞生物工程有限公司; TRIzol Reagent购自美国Invitrogen公司.
1.2.1 细胞转染: 课题组前期[13]构建的Smad4 RNA干扰(RNA interference, RNAi)慢病毒载体, 经包装、浓缩及检测病毒滴度后感染肝癌细胞SMMC-7721, 筛选出两组Smad4干扰效率高的细胞, RNAi-Smad4-2组和RNAi-Smad4-12组, 对照组为肝癌细胞CON和感染慢病毒空载体的肝癌细胞RNAi-NC.
1.2.2 细胞培养: CON组、RNAi-NC组及转染组细胞, 以含100 mL/L胎牛血清的高糖DMEM培养基, 于37 ℃、50 mL/L CO2培养箱中培养, 胰酶消化、传代, 取对数生长期细胞实验.
1.2.3 细胞计数: 在24孔板中接种3×104个/孔的CON组细胞悬液, 培养至70%融合时, 用无血清的培养基同步化24 h, 分为5组, 分别用0 μg/L、1 μg/L、5 μg/L、10 μg/L、20 μg/L的TGF-β1孵育, 0 h、24 h、48 h、72 h后分别计数.
1.2.4 Western blot检测Smad4、β-catenin和Vimentin蛋白的表达: 提取细胞总蛋白, BCA法测定各组蛋白浓度. 根据浓度上样行电泳后, 转膜至PVDF膜上, 5%脱脂奶粉的TBST封闭1 h, 加一抗(β-actin 1∶500、Smad4 1∶300、Vimentin 1∶500、β-catenin 1∶1 000)4 ℃杂交过夜, TBST漂洗, 加二抗(1∶2 000)室温孵育2 h, TBST漂洗, 化学发光试剂检测蛋白条带, 测定各条带积分吸光度(A)值, 定量分析.
1.2.5 RT-PCR检测β-catenin和Vimentin mRNA的表达: 用PBS洗涤各组细胞3次, 每孔中加入1 mL TRIzol RNA提取液, 按说明书步骤提取总RNA, 紫外分光光度仪测A260/A280的比值, 重复3次, 计算RNA浓度. 将RNA逆转录为cDNA后进行循环扩增. PCR引物由美国Invitrogen公司上海分公司合成, 引物序列: GAPDH上游引物5'-ATGGGGAAGGTGAAGGTCG-3', 下游引物5'-GGGTCATTGATGGCAACAATATC-3'; β-catenin上游引物5'-GCTGCTGTTTTGTTCCGAATGT-3', 下游引物5'-GCCATTGGCTCTGTTCTGAAGA-3'; Vimentin上游引物5'-CCAAACTTTTCCTCCCTGAACC-3', 下游引物5'-GTGATGCTGAGAAGTTTCGTTGA-3'.
反应条件均为: 95 ℃, 3 min预变性; 94 ℃, 30 s; 48 ℃, 30 s, 72 ℃, 1 min, 35个循环; 72 ℃终末延伸5 min. PCR产物经15 g/L琼脂糖凝胶电泳, 凝胶图像扫描系统成像并进行灰度扫描, 用GAPDH的表达量校正, 将两者A值的相对量进行分析, 重复3次.
1.2.6 细胞免疫荧光法检测Smad4、β-catenin和Vimentin的表达: 0.01%多聚赖氨酸处理盖玻片, 高压灭菌后备用. 在6孔板中分别加入一片处理好的盖玻片, 将细胞接种于此(细胞分组情况同前, 每组设3个孔). 待上述各组SMMC-7721细胞在盖玻片上生长融合到90%-95%时, 取4%多聚甲醛固定细胞15 min, 0.5% Triton X-100透化4 min, 5% BSA/PBS封闭20 min, 加入一抗Smad4、β-catenin(1∶120), Vimentin(1∶200), 4 ℃ 2 h, PBS漂洗, 加入二抗避光孵育1 h, 晾干、封片, 奥林巴斯正置荧光显微镜观察蛋白定位表达情况.
统计学处理 所有实验均重复3次以上, 用SPSS 18.0软件进行统计分析, 定量结果采用mean±SD表示, 多组均数间比较采用单因素方差分析, 两两组间比较采用组间q检验, 以P<0.05为差异有统计学意义.
在1、5、10 μg/L浓度的TGF-β1孵育下, 细胞呈浓度依赖性增长; TGF-β1浓度达到20 μg/L后, 细胞增长的趋势明显减弱, 且有抑制现象. 而在同一浓度TGF-β1刺激下的CON组细胞, 在0 h、24 h、48 h时间点, 呈时间依赖性增长, 48-72 h间, 细胞增长趋势明显减弱, 即10 μg/L TGF-β1孵育48 h时, 细胞增殖幅度达顶峰(表1), 后续实验遂采用此浓度和时间点处理细胞.
| 0 μg/L | 1 μg/L | 5 μg/L | 10 μg/L | 20 μg/L | |
| 0 h | 3.0 | 3.0 | 3.0 | 3.0 | 3.0 |
| 24 h | 5.7 | 8.2 | 15.4 | 22.9 | 18.9 |
| 48 h | 13.0 | 15.3 | 19.1 | 26.8 | 17.8 |
| 72 h | 5.3 | 6.2 | 9.0 | 11.2 | 8.3 |
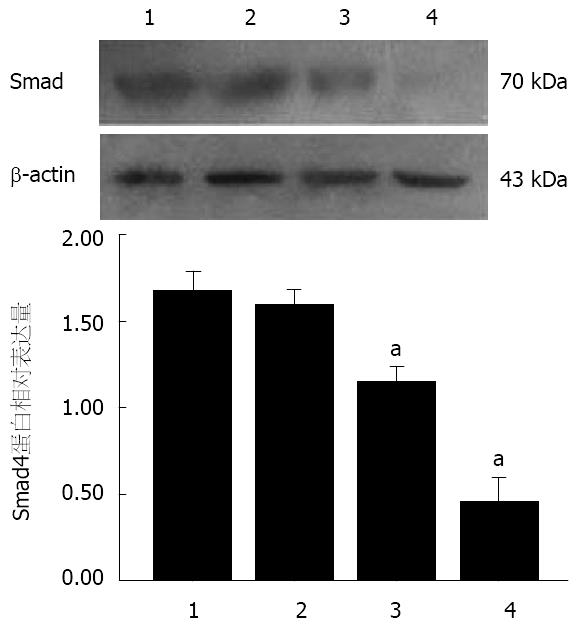
与CON组(1.60±0.06)及RNAi-NC组(1.60±0.14)相比, RNAi-Smad4-12组(1.15±0.02)和RNAi-Smad4-2组(0.45±0.11)细胞中Smad4蛋白表达明显降低(P<0.05, 图1); 而CON组和RNAi-NC组细胞间比较, Smad4蛋白的表达无明显差异.
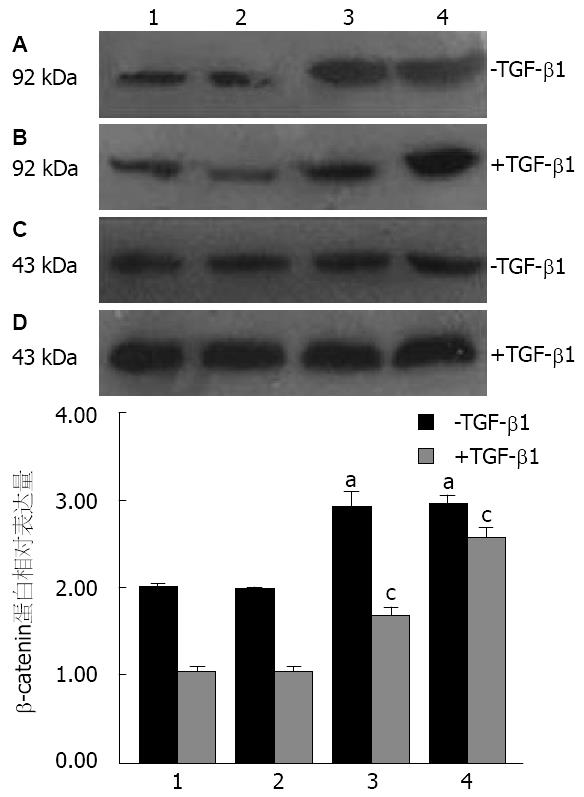
与CON组和RNAi-NC组相比, TGF-β1刺激前RNAi-Smad4-2和RNAi-Smad4-12组β-catenin蛋白表达明显升高(P<0.05). 加入10 μg/L TGF-β1孵育细胞48 h后, CON组和RNAi-NC组β-catenin蛋白表达都较未处理时明显减少, RNAi-Smad4-12组相对减少, 而RNAi-Smad4-2组减少的趋势不显著(P<0.05, 图2).
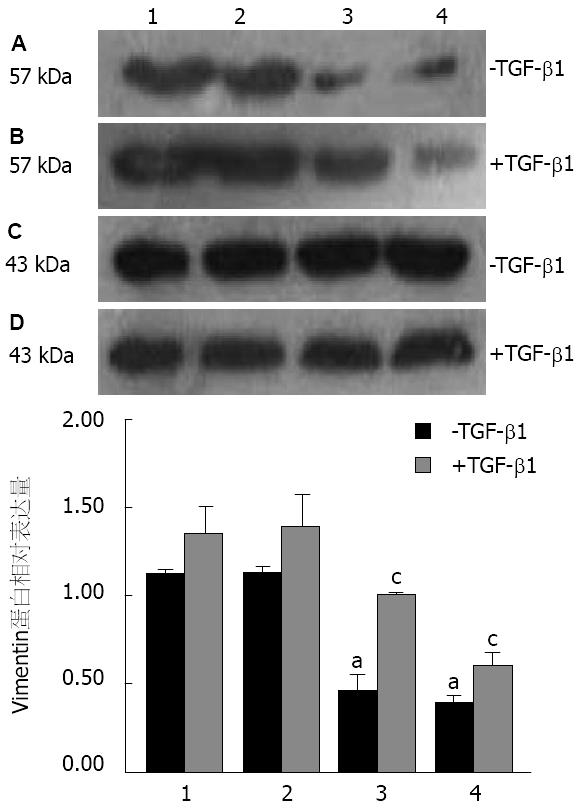
TGF-β1刺激前RNAi-Smad4-2和RNAi-Smad4-12组Vimentin蛋白表达相较于CON组和RNAi-NC组明显减少(P<0.05). 加入10 μg/L TGF-β1孵育细胞48 h后, CON组和RNAi-NC组Vimentin表达都较未处理时明显升高, RNAi-Smad4-12组相对升高, 而RNAi-Smad4-2组升高则不显著(P>0.05, 图3).
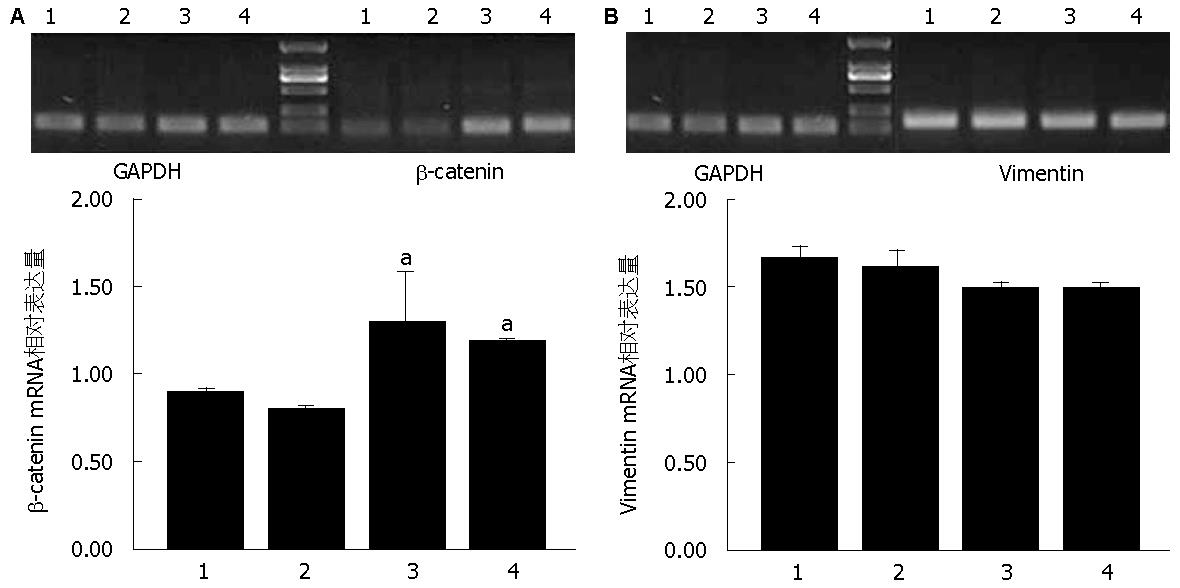
以GAPDH作为内参照, 各组β-catenin mRNA相对表达量分别为: CON组(0.91±0.01), RNAi-NC组(0.81±0.01), RNAi-Smad4-12组(1.30±0.22), RNAi-Smad4-2组(1.19±0.01). 与CON组及RNAi-NC组相比, 2个转染组β-catenin mRNA表达明显升高(P<0.05, 图4A). 4组间的Vimentin mRNA的表达无明显差异(P>0.05, 图4B).
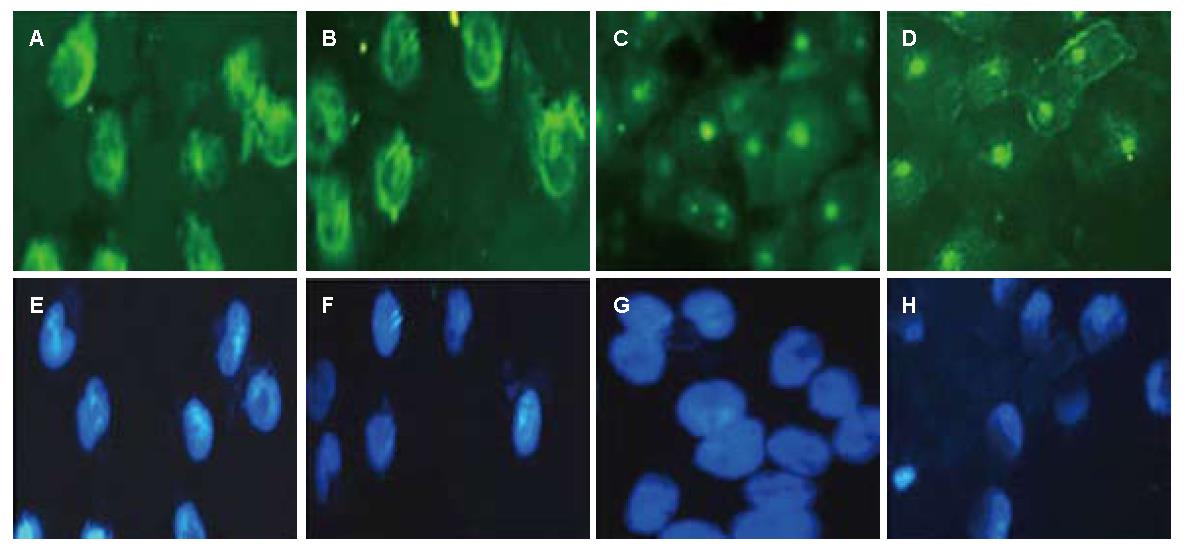
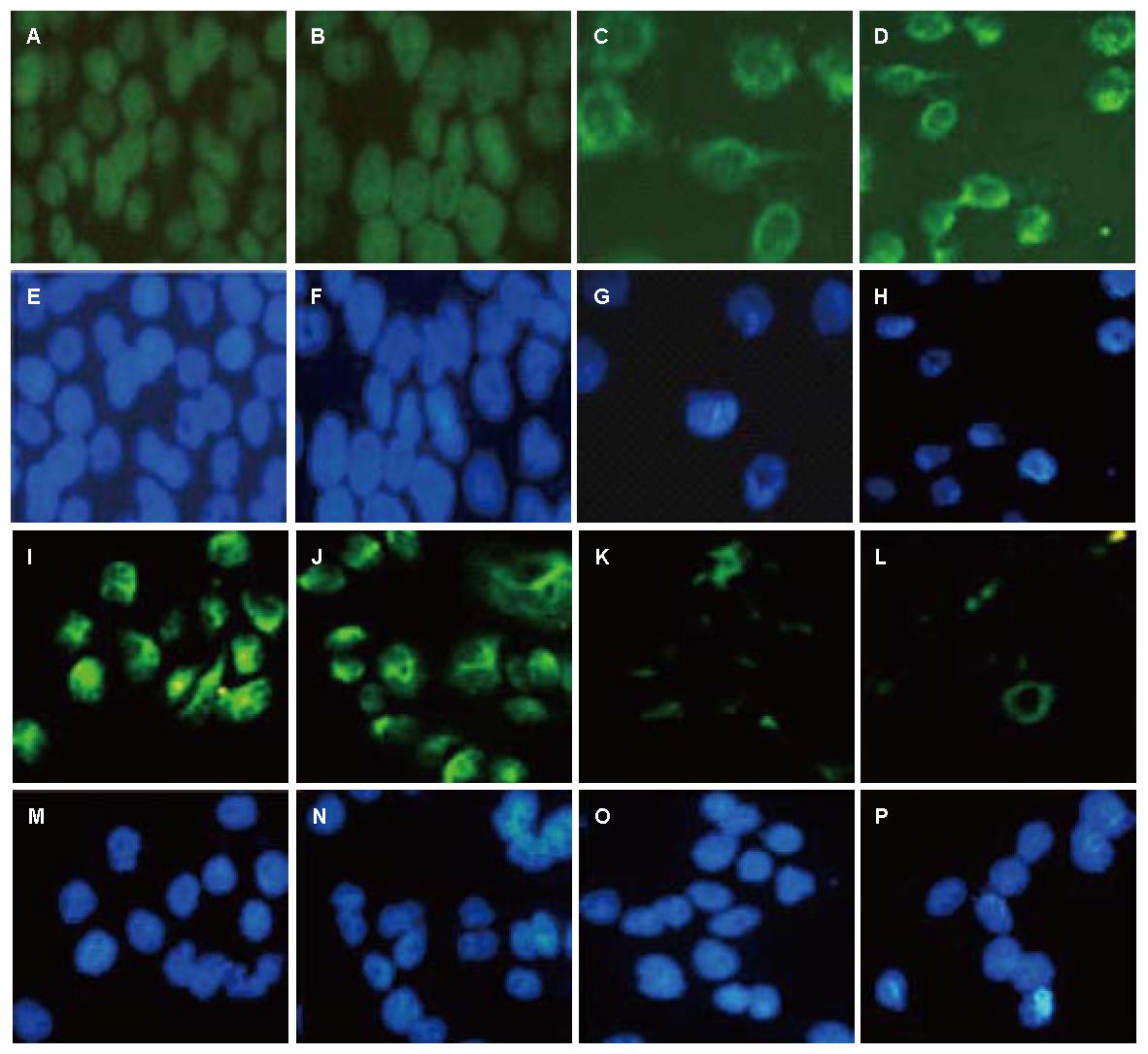
免疫荧光染色结果显示, CON组和RNAi-NC组的Smad4表达在细胞浆处, 转染组的Smad4胞浆表达明显减少(图5).
CON组和RNAi-NC组的β-catenin主要表达在细胞核上, 胞浆几乎缺如; RNAi-Smad4-12和RNAi-Smad4-2组则主要定位于胞浆处, 细胞核上表达明显减少, β-catenin有明显的核转位变化. 而Vimentin在4组细胞中都主要定位于细胞浆和细胞膜上, 2个转染组的Vimentin细胞荧光表达较CON组和RNAi-NC组减弱, 核转位改变不明显(图6).
EMT主要的特征包括[14]: 上皮标志物表达的下调(E-cadherin、β-catenin等), 间质标志物表达的上调(Vimentin、N-cadherin等), 角蛋白为主的细胞骨架转化为波形蛋白为主的细胞骨架, 以及形态由上皮细胞转化为具有间充质特征的细胞等. 其中上皮标志物β-catenin表达的下调和间质细胞标志物Vimentin表达的增加是EMT发生的一个重要标志. β-catenin是分子量为92 KDa的一种多功能蛋白, 研究[15]表明, 由β-catenin与cadherin形成的蛋白复合物在细胞-细胞以及细胞-基质的相互关系中具有关键作用. 当β-catenin表达上调时, 增强细胞间的黏附作用, 使细胞不容易发生侵袭和转移; 相反, 当β-catenin表达下调时, 细胞间的黏附作用被破坏, 细胞更容易发生侵袭和转移. 而Vimentin是分子量为57 KDa的波形蛋白, 构成成纤维细胞中的中间纤维, 是细胞骨架成分, 具有调节细胞骨架蛋白、细胞黏附分子等蛋白间的相互作用, 在很多间叶组织中表达, 在EMT过程中可作为间叶组织的标志[16].
越来越多的证据表明, EMT参与多种肿瘤的侵袭和转移过程, 包括乳腺癌[17,18]、前列腺癌[19]、肝癌[20]、结肠癌[21]、肺癌[22]及宫颈癌[23]等, 而且肿瘤组织中发生EMT的肿瘤细胞数目与病变组织的侵袭转移程度有关[20].
EMT的发生受到诸多因素的影响[24,25], 其中TGF-β是引发EMT的关键始动因素[26,27], 并且参与EMT的全过程. Smad4分子是TGF-β-Smad信号通路中的关键应答分子, 处于TGF-β信号转导的中枢地位, 他能够参与调控多种下游靶基因的表达[28]. 课题组前期[13]采用RNAi技术, 构建了针对Smad4的RNAi慢病毒载体, 使Smad4低表达并转染SMMC-7721细胞, 成功构建了多组低表达Smad4的SMMC-7721细胞. 前期研究发现, 低表达Smad4后SMMC-7721细胞的侵袭和迁移能力增加.
近年来的研究表明, Smad4在多种肿瘤进展、侵袭和转移中起重要作用[29,30]. EMT参与多种肿瘤侵袭转移的过程, 有研究[12,31,32]发现, Smad4参与肿瘤组织的EMT过程. 由此提出Smad4是否通过EMT介导细胞迁移和侵袭能力从而影响HCC的侵袭和转移的假设.
本实验中, 通过Western blot法来验证Smad4基因敲低后相应蛋白的表达情况, 显示2个转染组相较于对照组都有不同程度的减少; 细胞免疫荧光结果也显示, 转染组的Smad4在细胞浆上的荧光表达较CON组和RNAi-NC组明显减少, 均证实了转染的成功性和稳定性. 进一步研究结果显示: 与对照组相比, Smad4低表达会上调β-catenin mRNA和总蛋白表达量; 下调Vimentin蛋白表达量, Vimentin mRNA表达未受明显影响. 利用免疫荧光技术, 发现低表达Smad4会使Vimentin在胞浆中的表达出现不同程度的缺失, β-catenin发生核转位. 这些研究均表明低表达Smad4会抑制EMT的发生. 当用10 μg/L TGF-β1孵育细胞48 h后, 空白对照组和转空组β-catenin总蛋白表达量都较未处理时明显减少, 而转染组减少的程度并不显著, Vimentin蛋白表达量在用TGF-β1刺激后则与β-catenin结果相悖. 众所周知, TGF-β1经由依赖Smad4途径和包括Wnt、Ras、MAPK等多条通路的非依赖Smad4途径[33-35]诱导了EMT的发生, 当低表达Smad4后, 极大程度地抑制了依赖Smad4途径, TGF-β1可能即循非依赖Smad4途径诱导了EMT的发生. 而在转染组中, 低表达Smad4会潜在抑制非依赖性途径诱发EMT的现象, 又再次证明了依赖性途径在TGF-β1诱发EMT过程中的主要性[36,37].
总之, 本实验的研究结果表明在肝癌细胞SMMC-7721中, 低表达Smad4可能通过抑制TGF-β1诱发的EMT来改变肝癌细胞的侵袭转移能力.
上皮间质转化(epithelial-mesenchymal transition, EMT)在胚胎发育、创口愈合和肿瘤侵袭转移中起着重要作用. Smad4是TGF-β通路的关键分子, 研究发现Smad4与多种肿瘤的侵袭转移密切相关.
倪润洲, 教授, 南通大学附属医院消化内科
早期转移和复发是延长肝癌患者生存期、提高远期疗效的瓶颈问题. 肿瘤细胞通过EMT而实现转移过程, 是近年来肿瘤领域的研究热点.
进一步明确EMT在HCC中的侵袭转移发生中的作用, 探讨HCC的侵袭转移机制, 将有利于早期预测预防肝癌转移发生, 从而提高肿瘤患者的生存率.
本文创新性地在肝癌细胞SMMC-7721中, 初步探讨了Smad4通过调控EMT从而影响HCC侵袭和转移的机制.
本文创新性地将TGF-β和Wnt/β-catenin信号通路联系在一起来研究肝癌细胞株SMMC-7721中Smad4表达水平降低后对EMT的影响, 进而探讨了其在HCC侵袭转移中的作用意义, 该文研究水平较高, 创新性强.
编辑: 张姗姗 电编: 鲁亚静
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Siegel R, Ward E, Brawley O, Jemal A. Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths. CA Cancer J Clin. 2011;61:212-236. [PubMed] [DOI] |
| 4. | Xu LB, Wang J, Liu C, Pang HW, Chen YJ, Ou QJ, Chen JS. Staging systems for predicting survival of patients with hepatocellular carcinoma after surgery. World J Gastroenterol. 2010;16:5257-5262. [PubMed] [DOI] |
| 5. | Pak SI, Chang KS. Performance estimation of a Venturi scrubber using a computational model for capturing dust particles with liquid spray. J Hazard Mater. 2006;138:560-573. [PubMed] [DOI] |
| 6. | Potenta S, Zeisberg E, Kalluri R. The role of endothelial-to-mesenchymal transition in cancer progression. Br J Cancer. 2008;99:1375-1379. [PubMed] [DOI] |
| 7. | Thiery JP, Acloque H, Huang RY, Nieto MA. Epithelial-mesenchymal transitions in development and disease. Cell. 2009;139:871-890. [PubMed] [DOI] |
| 8. | Natalwala A, Spychal R, Tselepis C. Epithelial-mesenchymal transition mediated tumourigenesis in the gastrointestinal tract. World J Gastroenterol. 2008;14:3792-3797. [PubMed] [DOI] |
| 9. | Wendt MK, Allington TM, Schiemann WP. Mechanisms of the epithelial-mesenchymal transition by TGF-beta. Future Oncol. 2009;5:1145-1168. [PubMed] [DOI] |
| 10. | Hills CE, Squires PE. The role of TGF-β and epithelial-to mesenchymal transition in diabetic nephropathy. Cytokine Growth Factor Rev. 2011;22:131-139. [PubMed] [DOI] |
| 11. | Hesling C, Fattet L, Teyre G, Jury D, Gonzalo P, Lopez J, Vanbelle C, Morel AP, Gillet G, Mikaelian I. Antagonistic regulation of EMT by TIF1γ and Smad4 in mammary epithelial cells. EMBO Rep. 2011;12:665-672. [PubMed] [DOI] |
| 12. | Vincent T, Neve EP, Johnson JR, Kukalev A, Rojo F, Albanell J, Pietras K, Virtanen I, Philipson L, Leopold PL. A SNAIL1-SMAD3/4 transcriptional repressor complex promotes TGF-beta mediated epithelial-mesenchymal transition. Nat Cell Biol. 2009;11:943-950. [PubMed] [DOI] |
| 13. | 韩 香, 黄 晓丹, 薛 慧婷, 黄 曙, 张 发明, 季 国忠. Smad4通过fascin和cortactin影响肝癌细胞SMMC-7721迁移的研究. 医学研究生学报. 2011;24:676-682. |
| 15. | Huber O, Bierkamp C, Kemler R. Cadherins and catenins in development. Curr Opin Cell Biol. 1996;8:685-691. [PubMed] [DOI] |
| 16. | Satelli A, Li S. Vimentin in cancer and its potential as a molecular target for cancer therapy. Cell Mol Life Sci. 2011;68:3033-3046. [PubMed] [DOI] |
| 17. | Gjerdrum C, Tiron C, Høiby T, Stefansson I, Haugen H, Sandal T, Collett K, Li S, McCormack E, Gjertsen BT. Axl is an essential epithelial-to-mesenchymal transition-induced regulator of breast cancer metastasis and patient survival. Proc Natl Acad Sci USA. 2010;107:1124-1129. [PubMed] [DOI] |
| 18. | Micalizzi DS, Christensen KL, Jedlicka P, Coletta RD, Barón AE, Harrell JC, Horwitz KB, Billheimer D, Heichman KA, Welm AL. The Six1 homeoprotein induces human mammary carcinoma cells to undergo epithelial-mesenchymal transition and metastasis in mice through increasing TGF-beta signaling. J Clin Invest. 2009;119:2678-2690. [PubMed] [DOI] |
| 19. | Zhau HE, Odero-Marah V, Lue HW, Nomura T, Wang R, Chu G, Liu ZR, Zhou BP, Huang WC, Chung LW. Epithelial to mesenchymal transition (EMT) in human prostate cancer: lessons learned from ARCaP model. Clin Exp Metastasis. 2008;25:601-610. [PubMed] [DOI] |
| 20. | Yang MH, Chen CL, Chau GY, Chiou SH, Su CW, Chou TY, Peng WL, Wu JC. Comprehensive analysis of the independent effect of twist and snail in promoting metastasis of hepatocellular carcinoma. Hepatology. 2009;50:1464-1474. [PubMed] [DOI] |
| 21. | Brabletz T, Jung A, Reu S, Porzner M, Hlubek F, Kunz-Schughart LA, Knuechel R, Kirchner T. Variable beta-catenin expression in colorectal cancers indicates tumor progression driven by the tumor environment. Proc Natl Acad Sci USA. 2001;98:10356-10361. [PubMed] [DOI] |
| 22. | Saito RA, Watabe T, Horiguchi K, Kohyama T, Saitoh M, Nagase T, Miyazono K. Thyroid transcription factor-1 inhibits transforming growth factor-beta-mediated epithelial-to-mesenchymal transition in lung adenocarcinoma cells. Cancer Res. 2009;69:2783-2791. [PubMed] [DOI] |
| 23. | Lee MY, Chou CY, Tang MJ, Shen MR. Epithelial-mesenchymal transition in cervical cancer: correlation with tumor progression, epidermal growth factor receptor overexpression, and snail up-regulation. Clin Cancer Res. 2008;14:4743-4750. [PubMed] [DOI] |
| 24. | Boyer B, Vallés AM, Edme N. Induction and regulation of epithelial-mesenchymal transitions. Biochem Pharmacol. 2000;60:1091-1099. [PubMed] [DOI] |
| 25. | Savagner P. Leaving the neighborhood: molecular mechanisms involved during epithelial-mesenchymal transition. Bioessays. 2001;23:912-923. [PubMed] [DOI] |
| 26. | Kaimori A, Potter J, Kaimori JY, Wang C, Mezey E, Koteish A. Transforming growth factor-beta1 induces an epithelial-to-mesenchymal transition state in mouse hepatocytes in vitro. J Biol Chem. 2007;282:22089-22101. [PubMed] [DOI] |
| 27. | Zavadil J, Böttinger EP. TGF-beta and epithelial-to-mesenchymal transitions. Oncogene. 2005;24:5764-5774. [PubMed] [DOI] |
| 28. | Singh P, Wig JD, Srinivasan R. The Smad family and its role in pancreatic cancer. Indian J Cancer. 2011;48:351-360. [PubMed] [DOI] |
| 29. | Huang S, Zhang F, Miao L, Zhang H, Fan Z, Wang X, Ji G. Lentiviral-mediated Smad4 RNAi induced anti-proliferation by p16 up-regulation and apoptosis by caspase 3 down-regulation in hepatoma SMMC-7721 cells. Oncol Rep. 2008;20:1053-1059. [PubMed] |
| 31. | Mesker WE, Liefers GJ, Junggeburt JM, van Pelt GW, Alberici P, Kuppen PJ, Miranda NF, van Leeuwen KA, Morreau H, Szuhai K. Presence of a high amount of stroma and downregulation of SMAD4 predict for worse survival for stage I-II colon cancer patients. Cell Oncol. 2009;31:169-178. [PubMed] |
| 32. | Zhao S, Venkatasubbarao K, Lazor JW, Sperry J, Jin C, Cao L, Freeman JW. Inhibition of STAT3 Tyr705 phosphorylation by Smad4 suppresses transforming growth factor beta-mediated invasion and metastasis in pancreatic cancer cells. Cancer Res. 2008;68:4221-4228. [PubMed] [DOI] |
| 33. | Rees JR, Onwuegbusi BA, Save VE, Alderson D, Fitzgerald RC. In vivo and in vitro evidence for transforming growth factor-beta1-mediated epithelial to mesenchymal transition in esophageal adenocarcinoma. Cancer Res. 2006;66:9583-9590. [PubMed] [DOI] |
| 34. | Xu J, Lamouille S, Derynck R. TGF-beta-induced epithelial to mesenchymal transition. Cell Res. 2009;19:156-172. [PubMed] [DOI] |
| 35. | Moustakas A, Heldin CH. Signaling networks guiding epithelial-mesenchymal transitions during embryogenesis and cancer progression. Cancer Sci. 2007;98:1512-1520. [PubMed] [DOI] |
| 36. | Miyazono K. Transforming growth factor-beta signaling in epithelial-mesenchymal transition and progression of cancer. Proc Jpn Acad Ser B Phys Biol Sci. 2009;85:314-323. [PubMed] [DOI] |