修回日期: 2012-01-20
接受日期: 2012-03-15
在线出版日期: 2012-04-18
目的: 比较人脐带间充质干细胞(human amniotic membrane-derived mesenchymal stem cells, hAM-MSCs)和人羊膜间充质干细胞(human umbilical cord-derived mesenchymal stem cells, hUC-MSCs)对模型大鼠肝硬化的治疗效果.
方法: 分离培养hAM-MSCs和hUC-MSCs, 流式检测CD29、CD44和CD34. CCl4诱导大鼠肝硬化模型, 在第8周时, 杀死5只大鼠做病理检测以确诊为肝硬化. 30只成模大鼠随机分为脐带干细胞组(n = 10)、羊膜干细胞组(n = 10)和对照组(n = 10), 分别注入hAM-MSCs、hUC-MSCs 2 mL(细胞数量2×106)和等量生理盐水. 细胞移植前和移植4 wk后, 检测大鼠肝功能; 肝组织HE染色、Masson染色; 免疫组织化学法检测α-SMA在肝脏中的表达.
结果: 2种细胞表达CD29、CD44, 不表达CD34. 移植后, 与对照组相比, 脐带干细胞组和羊膜干细胞组ALT和AST明显降低(204.6±16.4, 195.6±21.2 vs 539.8±36.2; 180.1±25.2, 167.5±19.0 vs 337.4±23.4, P<0.05); 胶原沉积减少; 组织病理学评分有显著性差异(P<0.05); 肝脏α-SMA表达量减少(130.6±3.0, 127.0±2.6 vs 152.2±5.4, P<0.05). 脐带干细胞组和羊膜干细胞组的肝功能、肝组织病理学评分及肝脏α-SMA表达量均无明显差异.
结论: hAM-MSCs和hUC-MSCs能有效改善肝硬化大鼠模型的肝功能和肝硬化程度, 两者治疗效果无明显差异.
引文著录: 高琳琳, 关方霞, 郑鹏远, 杨波, 迟连凯, 梁硕, 邹润钦, 刘志强. 人羊膜脐带源性间充质干细胞对大鼠肝硬化的治疗作用. 世界华人消化杂志 2012; 20(11): 916-922
Revised: January 20, 2012
Accepted: March 15, 2012
Published online: April 18, 2012
AIM: To evaluate the therapeutic effect of transplantation of human amniotic membrane-derived mesenchymal stem cells (hAM-MSCs) and human umbilical cord-derived mesenchymal stem cells (hUC-MSCs) on carbon tetrachloride (CCl4)-induced hepatic cirrhosis in rats.
METHODS: hAM-MSCs and hUC-MSCs were isolated and analyzed by flow cytometry for detection of expression of CD44, CD29 and CD34. Hepatic cirrhosis was induced in rats with CCl4. At week 8, five rats were killed to conduct pathological examination to confirm successful induction of hepatic cirrhosis, and 30 rats with hepatic cirrhosis were randomly and equally divided into three groups: hAM-MSCs group, hUC-MSCs group and control group. The hAM-MSCs and hUC-MSCs groups were infused wit 2×106 MSCs in 2 mL of saline via the tail vein, while the control group was given equal volume of saline. Liver function was examined before cell transplantation and 4 wk after cell transplantation. HE staining and Masson dyeing were performed to observe pathological changes in the liver. The expression of alpha-smooth muscle actin (α-SMA) in the liver was determined by immunohistochemistry.
RESULTS: Both isolated hAM-MSCs and hUC-MSCs expressed CD29 and CD44, but did not express CD34. After cell transplantation, liver function parameters were markedly improved (all P < 0.05) and the expression of α-SMA was reduced in the hAM-MSCs and hUC-MSCs groups compared to the control group (130.6 ± 3.0, 127.0 ± 2.6 vs 152.2 ± 5.4, both P < 0.05). There were no statistically significant differences in liver function parameters and α-SMA expression between the hAM-MSCs and hUC-MSCs groups.
CONCLUSION: Transplantation of hAM-MSCs and hUC-MSCs could efficiently improve liver functions and inhibit liver fibrosis in rats.
- Citation: Gao LL, Guan FX, Zheng PY, Yang B, Chi LK, Liang S, Zou RQ, Liu ZQ. Therapeutic effect of transplantation of human amniotic membrane- and umbilical cord-derived mesenchymal stem cells on hepatic cirrhosis in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(11): 916-922
- URL: https://www.wjgnet.com/1009-3079/full/v20/i11/916.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i11.916
肝硬化(liver cirrhosis)是各种慢性肝病发展的晚期阶段, 原位肝移植(orthotopic liver transplantation, OLT)是治疗肝硬化的有效治疗方法, 但是存在供肝短缺、术后并发症、免疫排斥、高额费用及伦理道德等因素, 大部分患者不能进行有效治疗, 最终发展为肝癌或肝衰竭[1]. 近年来国内外研究的干细胞移植治疗方法具有光明前景. 目前, 已经有研究人员从人胎盘来源的脐带和羊膜中分离出间充质干细胞(mesenchymal stem cells, MSCs), 证明他们具有与骨髓间充质干细胞相似的表面标志物和多向分化潜能[2-6]. 近期发现, 脐带MSCs和羊膜MSCs能够分化为肝细胞样细胞, 移植到鼠肝硬化模型体内能够改善其肝功能和缓解肝纤维化. 胎盘是胎儿分娩后的弃物, 可以大量获取并且没有伦理道德限制, 是骨髓MSCs较好的替代物. 本研究旨在比较人脐带MSCs和人羊膜MSCs异体移植治疗CCl4诱导的大鼠肝硬化模型的疗效差异, 旨在为提供最适宜的干细胞移植来源提供科学依据.
♀, SD大鼠35只, 胎牛血清, DMEM培养基, Ⅳ型胶原酶, CCl4(分析纯, 浓度99.5%), 2.5 g/L胰酶消化液. 单抗CD29、CD44、CD34, 倒置相差显微镜, SP9000试剂盒.
1.2.1 肝硬化大鼠模型的制备: 将CCl4与大豆油溶液按1∶1混匀, 首次以5 mL/kg的剂量大鼠腹部皮下注射, 以后均以3 mL/kg皮下注射, 每周2次, 共注射8 wk. 8 wk后随机处死5只大鼠, 经病理切片证实成模(成模率80%).
1.2.2 人脐带MSCs的分离培养: 在无菌条件下取足月妊娠剖宫产健康胎儿的脐带, 以PBS缓冲液充分洗涤残留的血液. 将脐带剪切成约1 cm的小段, 去除脐带外膜、脐静脉(1条)和脐动脉(2条), 将剩余组织剪碎成大小约1 mm3置于培养瓶中, 加入含体积分数为10%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的DMEM/F12培养基, 放置在37 ℃、50 mL/L CO2饱和湿度培养箱中培养. 培养瓶静置7 d左右, 细胞贴壁后换液, 此后3 d或4 d换液1次. 细胞达80%融合后用2.5 g/L的胰蛋白酶消化, 以1∶2-1∶3的比例传代培养.
1.2.3 羊膜MSCs的分离培养: 无菌条件下取足月妊娠剖宫术中的胎膜组织10 cm×10 cm, 钝性分离胎盘脐带面的羊膜, 用PBS缓冲液充分冲洗去除细胞碎片、血液. 将羊膜尽可能剪碎置于无菌的培养皿中, 加入2.5 g/L胰蛋白酶, 37 ℃消化30 min, 终止消化后用生理盐水冲洗, 再加入浓度为1.0 g/L的胶原酶Ⅳ和0.1 g/L DNA酶37 ℃消化120 min, 取出后吸取消化液分别过80、200不锈钢目网. 将消化下来的细胞1 000 r/min离心10 min, 台盼蓝染色, 计数活细胞, 以2×105/mL接种于75 mL培养瓶内, 加入含10%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的DMEM/F12培养液, 置于37 ℃、50 mL/L CO2饱和湿度的孵箱内培养. 48-72 h后, 更换培养液, 弃去未贴壁的细胞, 以后每3-4 d全量换液1次. 待细胞达到80%-90%融合时用2.5 g/L的胰蛋白酶消化, 以1∶2-1∶3的比例传代培养.
1.2.4 人脐带MSCs和羊膜MSCs表面抗原分析: 待P3细胞融合至90%左右, 加0.25%胰蛋白酶消化1 min, PBS洗涤2次, 倒置显微镜下计数, 调整每个监测样本的细胞数为1×106, 分装至EP管中, 1 000 r/min室温离心7 min, 弃上清, 于待检测的样本中各加入90 μL PBS, 轻轻吹打成细胞悬液, 分别加入单抗CD29-PE、CD44-PE、CD34-PE及同行对照各10 μL, 充分吹打混匀, 37 ℃避光孵育30 min, 测试前再加400 μL PBS至总体积500 μL, 充分混匀, 用流式细胞仪检测CD29、CD44、CD34.
1.2.5 MSCs的移植: 成模大鼠随机分为3组: 对照组(n = 10)、脐带干细胞组(n = 10)和羊膜干细胞组(n = 10). 将第5-6代人脐带MSCs和人羊膜MSCs混悬液各2 mL(细胞数目为2×106)分别注入脐带干细胞组和羊膜干细胞组的大鼠尾静脉中, 生理盐水2 mL注入对照组大鼠尾静脉中.
1.2.6 肝功能的检测: 细胞移植前取大鼠尾静脉血2 mL和移植后第4周大鼠左心室采血3 mL, 分别检测谷氨酸转移酶(AST)、丙氨酸转移酶(ALT)、白蛋白(ALB)及总胆红素(TBIL)的水平.
1.2.7 肝组织HE和胶原染色: 细胞移植后4 wk处死所有大鼠, 取出肝脏, 生理盐水冲洗后观察肝硬化大体标本情况. 标本用100 g/L甲醛溶液固定72 h, 石蜡包埋切片后常规HE染色, 胶原三重染色(Masson染色)观察肝脏胶原沉积量. 光学显微镜下观察各组标本肝脏假小叶形成及肝细胞坏死情况, 参照文献[7]对纤维化程度、肝细胞坏死及脂肪变性程度进行病理分级评分: 肝细胞变性坏死程度分级: 0 分为无, 1分为少量, 2分为轻度, 3分为中度, 4分为重度. 纤维化分级: 0级为正常肝脏, 1级为胶原增多而无间隔形成, 2级为不完全间隔形成, 3级为完全间隔形成(假小叶形成)但间隔较细, 4级为较厚的完全间隔形成及假小叶明显. 脂肪变性评分: 0分为无脂肪变性, 1分为有少量脂肪变细胞, 2分为脂肪变性占小叶比例<1/3, 3分为脂肪变性占小叶比例1/3-2/3, 4分为脂肪变性占小叶比例>2/3. 对病理分级评分进行统计学分析.
1.2.8 免疫组织化学检测α-平滑肌蛋白(α-SMA): 免疫组织化学采用Sp(streptavidin-perosidase)法. 将肝组织切片脱蜡脱水, PBS洗3遍, 柠檬酸抗原修复10 min. 室温3%H2O2封闭内源性过氧化物酶20 min. 滴加山羊血清50 μL封闭, 滴加一抗(单克隆兔抗鼠α-平滑肌蛋白, 1∶100), 4 ℃过夜. 滴加二抗, 37 ℃孵育30 min. 滴加辣根酶标记卵霉链白素, 37 ℃ 30 min. 各步之间用PBS充分洗涤. 显微镜下控制DAB显色, 自来水中止, 苏木素复染, 梯度酒精脱水, 二甲苯透明, 中性树胶封片. 光镜(×200)下观察, 阳性细胞核染为棕黄色. 每张切片(每例动物标本)随机选取4个视野, 每例切片共有5个数据, 用图像分析技术检测每个视野阳性细胞的积分(灰度值).
统计学处理 所有数据录入SPSS17.0统计软件包, 数据以mean±SD表示, 3组间样本采用完全随机设计两两均数比较(t检验)进行统计学分析, P<0.05为差异有统计学意义.
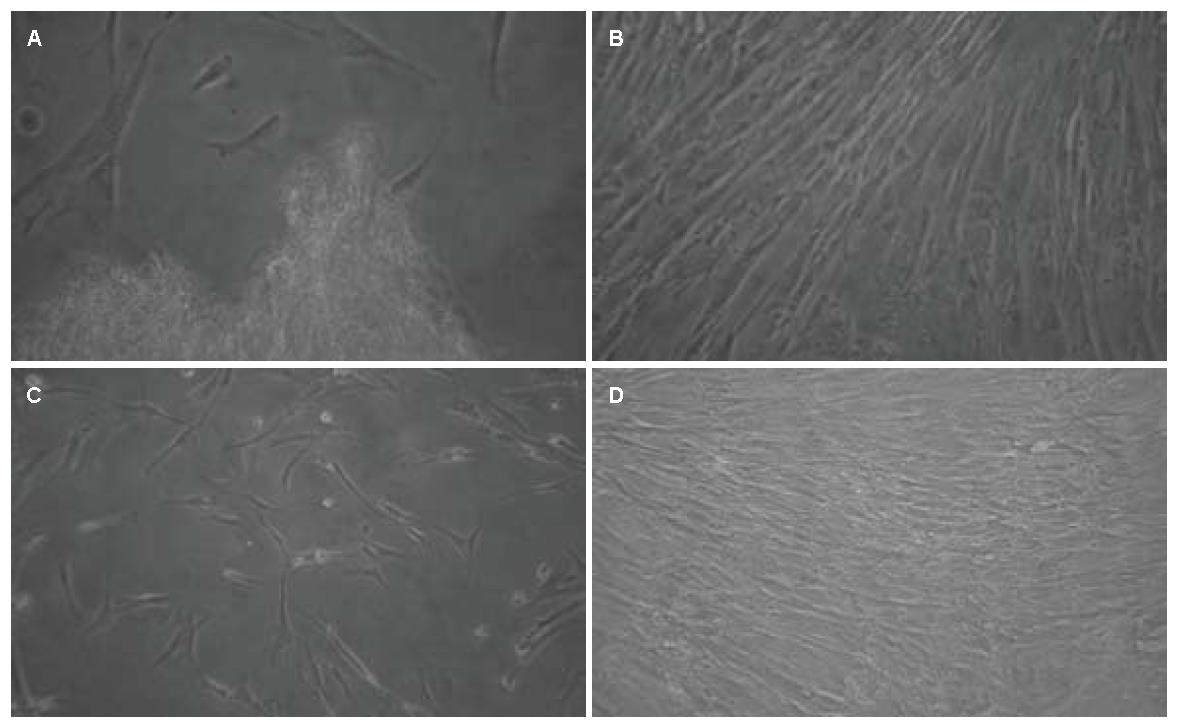
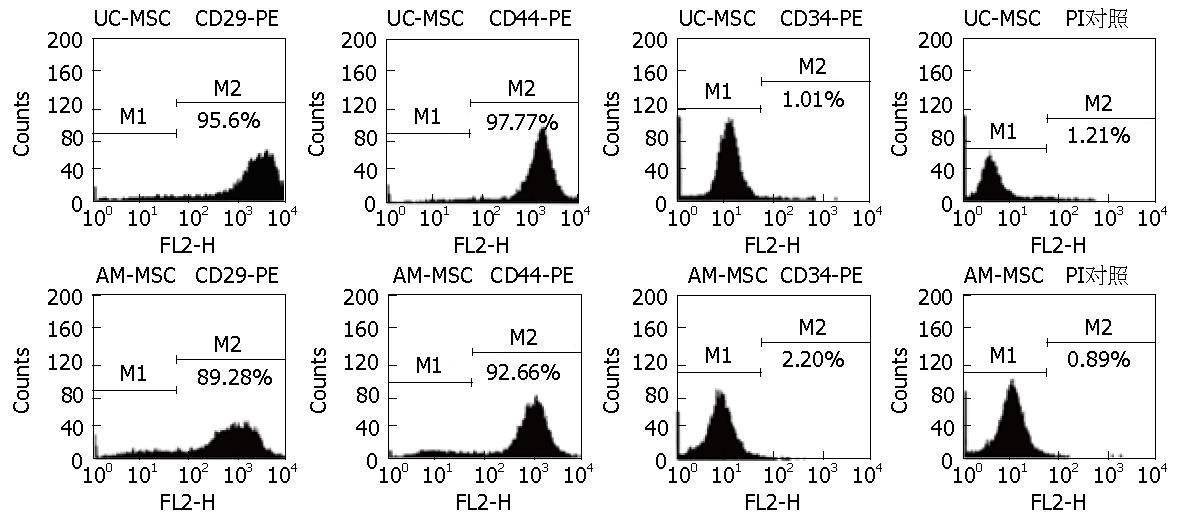
人脐带MSCs培养至3 d, 有散在的细胞自组织块中游出, 培养7 d左右, 大量细胞从组织块中游出并贴壁, 大部分细胞形态呈梭形, 原代细胞培养15 d左右可达到80%-90%融合, 细胞呈平行排列或漩涡状集落生长. 传代后, 细胞增殖速度明显增快, 5-7 d即可长满培养瓶底. 多次传代后细胞形态均一, 以梭形细胞为主, 呈漩涡状生长(图1). FCM分析结果显示, 第3代人脐带MSCs表达CD44、CD29, 不表达CD34(图2).
人羊膜MSCs接种24-48 h后细胞开始贴壁生长, 72 h观察, 细胞呈圆形、纤维样或小多角形, 通过全量换液逐渐去除未贴壁细胞, 10 d左右细胞可达培养瓶底面积的80%-90%融合, 细胞呈长梭形, 集落样生长, 排列紧密呈放射状或漩涡状分布. 传代后4 h后细胞基本贴壁, 7-10 d长满瓶底的80%-90%, 传至3代后, 细胞纯度好, 各代细胞形态无明显变化(图1). 流式细胞仪分析结果显示, 第3代人羊膜MSCs表达CD29、CD44, 不表达CD34(图2).
移植前大鼠肝脏颜色呈暗红色, 边缘圆钝, 质地较硬, 表面粗糙, 可见大小不等的硬化结节分布. 对照组肝脏质地硬, 表面仍可见大小不等硬化结节分布; 脐带干细胞组和羊膜干细胞组肝脏边缘变钝, 表面结节均较对照组减少.
细胞移植前, 脐带干细胞组、羊膜干细胞组与对照组大鼠肝功能指标AST、ALT、ALB及TBIL差异均无统计学意义(P>0.05, 未列表). 移植4 wk后, 脐带干细胞组和羊膜干细胞组分别与对照组做统计学对比, 其肝功能指标AST、ALT差异有统计学意义(P<0.05), ALB、TBIL差异无统计学意义(P>0.05); 脐带干细胞组和羊膜干细胞组大鼠肝功能指标AST、ALT、ALB、TBIL差异无统计学意义(表1).
| 分组 | ALT | AST | TBIL | ALB |
| 脐带干细胞组 | 204.6±16.4 | 180.1±25.2 | 16.2±1.8 | 21.2±1.8 |
| 羊膜干细胞组 | 195.6±21.2 | 167.5±19.0 | 15.3±1.3 | 22.1±2.1 |
| 对照组 | 539.8±36.2 | 337.4±23.4 | 16.0±1.6 | 20.7±2.3 |
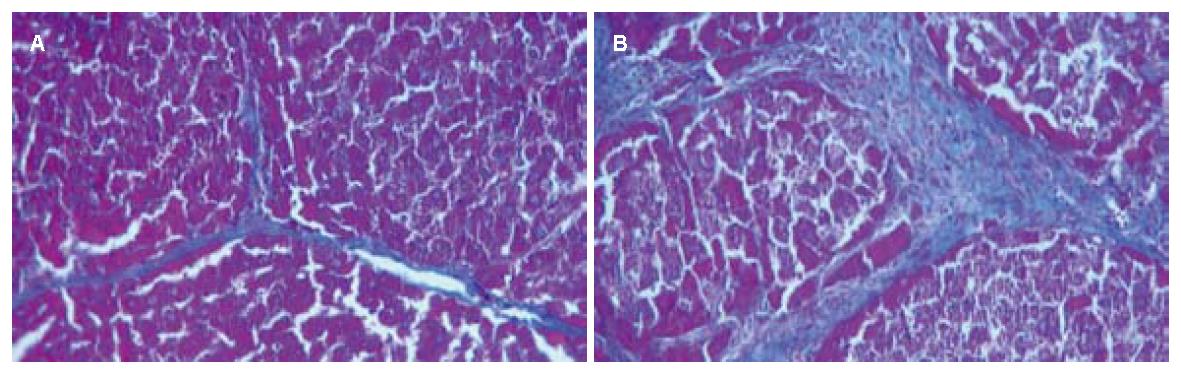
HE染色显示: 对照组大鼠肝脏组织切片显示重度纤维化, 纤维间隔增粗, 假小叶形成明显, 细胞脂肪样变性坏死; 脐带干细胞组大鼠肝脏轻中度纤维化, 亦可见假小叶形成, 平均视野下数量较对照组少, 肝脂肪变性较前者减轻; 羊膜干细胞组大鼠肝脏呈轻中度纤维化. Masson染色显示: 对照组可见明显的粗条状或片状染为绿色的胶原纤维, 包绕汇管区和中央静脉区; 脐带干细胞组和羊膜干细胞组大鼠肝组织内胶原纤维成细丝状, 明显少于对照组, 其中羊膜干细胞组胶原沉积区较脐带干细胞组少(图3). 结果表明, 移植组较对照组在肝纤维化、肝细胞变性坏死及脂肪变性等方面均有不同程度改善, 组织病理学评分差异有统计学意义(P<0.05); 羊膜干细胞组和脐带干细胞组间组织病理学评分无明显差别(P>0.05, 表2).
| 分组 | 肝纤维化 | 肝细胞变性坏死 | 脂肪变性 |
| 脐带干细胞组 | 2.54±0.29 | 1.43±0.22 | 1.60±0.21 |
| 羊膜干细胞组 | 2.47±0.23 | 1.40±0.27 | 1.56±0.24 |
| 对照组 | 3.5±0.19 | 2.23±0.34 | 3.53±0.30 |
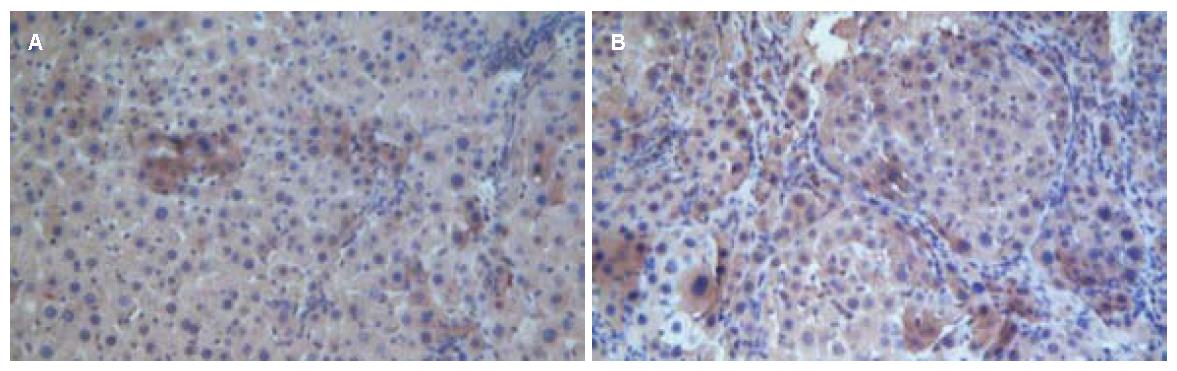
对照组α-SMA广泛分布于肝窦周围、汇管区、纤维间隔及增生的胆管周围细胞. 脐带干细胞组和羊膜干细胞组α-SMA阳性细胞的百分比减少(图4), 脐带干细胞组、羊膜干细胞组与对照组相比α-SMA表达差异有统计学意义(130.6±3.0, 127.0±2.6 vs 152.2±5.4, P<0.05); 脐带干细胞组和羊膜干细胞组α-SMA表达差异无统计学意义(P>0.05).
细胞移植(肝细胞移植或干细胞移植)作为原位肝移植过渡期治疗或替代治疗手段, 是失代偿期肝硬化患者极具潜力的治疗策略[8-11]. MSCs因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点而日益受到人们的关注[11,12]. 最早发现的骨髓MSCs已经明确具有肝源性分化和减轻肝纤维化的能力[3,11,13], 但因骨髓取材困难供者难以接受, 并且受年龄影响和容易引起病毒和细菌污染等限制了其使用.
目前研究证明脐带MSCs和羊膜MSCs具有骨髓MSCs相似的形态、免疫表型和多向分化潜能, 并表达胚胎干细胞标志如Oct4、SSEA-3、SSEA-4[2,4,6,14-19]. 本实验通过组织块法从人脐带中分离出人脐带MSCs, 采用胰酶-胶原酶二酶消化法从羊膜组织中分离出人羊膜MSCs. 流式检测分析2种细胞均高表达CD29、CD44, 而不表达CD34, 说明分离的人脐带MSCs和人羊膜MSCs纯度较高.
研究发现脐带MSCs能够在肝细胞生长因子、碱性成纤维生长因子和致瘤素M等的作用下, 分化为肝细胞样细胞(differentiated hepatocyte-like cells, DHC), DHC具有摄取LDL、合成糖原和尿素、分泌ALB等肝细胞特有的生物学功能[5,14,20-22]. 羊膜MSCs是从羊膜中胚层分化而来, 被证明比骨髓MSCs有更强的增殖能力和干细胞特征, 免疫源性低、无致瘤性, 在一定诱导因子作用下可以分化为DHC[23-25]. Tsai等[26]证明脐带MSCs移植到CCl4诱导的肝硬化大鼠模型体内, 可以改善肝功能, 减轻肝纤维化, 移植后的脐带MSCs分散到肝组织内, 分泌各种修复肝功和促进肝再生的活性因子. Lee等[27]证明羊膜MSCs移植到CCl4诱导肝损伤鼠体内, 可以改善肝功能, 鼠肝脏的α-SMA量和胶原沉积均减少. Zhang等[28]研究证明羊膜MSCs注入CCl4诱导的肝纤维化鼠模型的脾内, 延缓了疾病进展并修复了肝功; 羊膜MSCs能够阻止HSC的活性; 羊膜MSCs移植可以减少肝细胞凋亡, 促进肝细胞增殖; 羊膜MSCs移植减轻肝细胞衰老; 移植的羊膜MSCs迁移到损伤肝脏中并表达人白蛋白和人甲胎蛋白.
肝纤维化主要与肝脏星状细胞的激活有关, 大量研究证实检测到α-SMA表达是肝星状细胞激活的可靠标志[29,30]. 本实验将未分化的脐带MSCs和羊膜MSCs经尾静脉移植入肝硬化大鼠模型体内, 肝脏α-SMA均减少, 说明人脐带MSCs和人羊膜MSCs移植后可以抑制肝纤维化的发展. 就脐带MSCs和羊膜MSCs的生物学特性比较有报道[2], 本试验首次比较了两种细胞治疗肝硬化模型的疗效. 两种细胞对改善肝硬化大鼠模型的肝功能、肝脏病理学评分和α-SMA水平均无明显差异. 两种细胞分别移植到大鼠体内后, 大鼠未出现排异反应, 这与以前研究的MSCs的低免疫源性相一致[12,31].
总之, 脐带和羊膜是胎儿分娩后的弃物, 可以大量获取, 伦理问题不显著, 分离培养的人脐带MSCs和人羊膜MSCs增殖能力强和免疫源性低, 使其有望成为治疗肝硬化的新的MSCs来源, 其确切疗效和可能的机制仍有待进一步探索.
感谢郑州大学211三期工程项目干细胞研究的支持.
肝硬化在我国为常见肝脏疾病, 严重威胁人类健康, 进入失代偿期后病情常难以逆转. 目前缺乏有效的治疗方法, 鉴于人羊膜和脐带间充质干细胞的诸多优势, 可能成为治疗肝硬化的新干细胞来源.
朴云峰, 教授, 吉林大学第一临床医院消化内科
人羊膜和脐带间充质干细胞的体内外分化和作用机制等问题是该领域的研究热点.
有研究发现羊膜和脐带间充质干细胞在体外能够分化为肝细胞样细胞, 移植到体内可以减轻CCl4诱导的肝纤维化大鼠模型的肝功能和纤维化程度.
本研究比较人羊膜和脐带间充质干细胞治疗肝硬化动物模型, 通过检测肝功能、进行病理评分及α-平滑肌蛋白检测, 比较其疗效有无差异.
本研究结果提示人羊膜和脐带间充质干细胞均可以缓解动物肝硬化程度, 两者之间疗效无明显差别, 为进一步深入研究提供初步实验基础.
假小叶: 肝硬化时镜下可见正常肝小叶结构被破坏, 由广泛增生的纤维组织将肝细胞再生结节分割包绕成大小不等、圆形或椭圆形的肝细胞团, 称为假小叶.
该研究发现羊膜脐带源性间充质干细胞具有同样的增殖能力及较低的免疫原性,可成为新的间充质干细胞来源. 选题新颖, 设计合理, 结论可靠.
编辑: 张姗姗 电编: 鲁亚静
| 1. | Selzner N, Grant DR, Shalev I, Levy GA. The immunosuppressive pipeline: meeting unmet needs in liver transplantation. Liver Transpl. 2010;16:1359-1372. [PubMed] [DOI] |
| 2. | Filioli Uranio M, Valentini L, Lange-Consiglio A, Caira M, Guaricci AC, L'Abbate A, Catacchio CR, Ventura M, Cremonesi F, Dell'Aquila ME. Isolation, proliferation, cytogenetic, and molecular characterization and in vitro differentiation potency of canine stem cells from foetal adnexa: a comparative study of amniotic fluid, amnion, and umbilical cord matrix. Mol Reprod Dev. 2011;78:361-373. [PubMed] [DOI] |
| 3. | Yagi K, Kojima M, Oyagi S, Ikeda E, Hirose M, Isoda K, Kawase M, Kondoh M, Ohgushi H. [Application of mesenchymal stem cells to liver regenerative medicine]. Yakugaku Zasshi. 2008;128:3-9. [PubMed] [DOI] |
| 4. | In 't Anker PS, Scherjon SA, Kleijburg-van der Keur C, de Groot-Swings GM, Claas FH, Fibbe WE, Kanhai HH. Isolation of mesenchymal stem cells of fetal or maternal origin from human placenta. Stem Cells. 2004;22:1338-1345. [PubMed] [DOI] |
| 5. | Forraz N, McGuckin CP. The umbilical cord: a rich and ethical stem cell source to advance regenerative medicine. Cell Prolif. 2011;44 Suppl 1:60-69. [PubMed] [DOI] |
| 6. | Cai J, Li W, Su H, Qin D, Yang J, Zhu F, Xu J, He W, Guo X, Labuda K. Generation of human induced pluripotent stem cells from umbilical cord matrix and amniotic membrane mesenchymal cells. J Biol Chem. 2010;285:11227-11234. [PubMed] [DOI] |
| 8. | Lanfranchi A, Porta F, Chirico G. Stem cells and the frontiers of neonatology. Early Hum Dev. 2009;85:S15-S18. [PubMed] [DOI] |
| 9. | Pai M, Spalding D, Xi F, Habib N. Autologous bone marrow stem cells in the treatment of chronic liver disease. Int J Hepatol. 2012;2012:307165. [PubMed] |
| 10. | Sakai Y, Kaneko S. Mesenchymal stem cell therapy on murine model of nonalcoholic steatohepatitis. Methods Mol Biol. 2012;826:217-223. [PubMed] [DOI] |
| 11. | Gilchrist ES, Plevris JN. Bone marrow-derived stem cells in liver repair: 10 years down the line. Liver Transpl. 2010;16:118-129. [PubMed] [DOI] |
| 12. | Shi M, Liu ZW, Wang FS. Immunomodulatory properties and therapeutic application of mesenchymal stem cells. Clin Exp Immunol. 2011;164:1-8. [PubMed] [DOI] |
| 13. | Subramanian K, Owens DJ, O'Brien TD, Verfaillie CM, Hu WS. Enhanced differentiation of adult bone marrow-derived stem cells to liver lineage in aggregate culture. Tissue Eng Part A. 2011;17:2331-2341. [PubMed] [DOI] |
| 14. | Liang XJ, Chen XJ, Yang DH, Huang SM, Sun GD, Chen YP. Differentiation of human umbilical cord mesenchymal stem cells into hepatocyte-like cells by hTERT gene transfection in vitro. Cell Biol Int. 2012;36:215-221. [PubMed] [DOI] |
| 15. | Fan CG, Zhang QJ, Zhou JR. Therapeutic potentials of mesenchymal stem cells derived from human umbilical cord. Stem Cell Rev. 2011;7:195-207. [PubMed] [DOI] |
| 16. | Díaz-Prado S, Muiños-López E, Hermida-Gómez T, Cicione C, Rendal-Vázquez ME, Fuentes-Boquete I, de Toro FJ, Blanco FJ. Human amniotic membrane as an alternative source of stem cells for regenerative medicine. Differentiation. 2011;81:162-171. [PubMed] [DOI] |
| 17. | Shuang-zhi H, Ping S, Xi-ning P. Culture and identification of human amniotic mesenchymal stem cells. Chin Med Sci J. 2010;25:211-214. [PubMed] [DOI] |
| 18. | Manochantr S, Tantrawatpan C, Kheolamai P, U-pratya Y, Supokawej A, Issaragrisil S. Isolation, characterization and neural differentiation potential of amnion derived mesenchymal stem cells. J Med Assoc Thai. 2010;93 Suppl 7:S183-S191. [PubMed] |
| 19. | Ilancheran S, Moodley Y, Manuelpillai U. Human fetal membranes: a source of stem cells for tissue regeneration and repair? Placenta. 2009;30:2-10. [PubMed] [DOI] |
| 20. | Lin SZ, Chang YJ, Liu JW, Chang LF, Sun LY, Li YS, Luo GH, Liao CH, Chen PH, Chen TM. Transplantation of human Wharton's Jelly-derived stem cells alleviates chemically induced liver fibrosis in rats. Cell Transplant. 2010;19:1451-1463. [PubMed] [DOI] |
| 21. | Campard D, Lysy PA, Najimi M, Sokal EM. Native umbilical cord matrix stem cells express hepatic markers and differentiate into hepatocyte-like cells. Gastroenterology. 2008;134:833-848. [PubMed] [DOI] |
| 22. | Zhang YN, Lie PC, Wei X. Differentiation of mesenchymal stromal cells derived from umbilical cord Wharton's jelly into hepatocyte-like cells. Cytotherapy. 2009;11:548-558. [PubMed] [DOI] |
| 23. | Tsuji H, Miyoshi S, Ikegami Y, Hida N, Asada H, Togashi I, Suzuki J, Satake M, Nakamizo H, Tanaka M. Xenografted human amniotic membrane-derived mesenchymal stem cells are immunologically tolerated and transdifferentiated into cardiomyocytes. Circ Res. 2010;106:1613-1623. [PubMed] [DOI] |
| 24. | Kita K, Gauglitz GG, Phan TT, Herndon DN, Jeschke MG. Isolation and characterization of mesenchymal stem cells from the sub-amniotic human umbilical cord lining membrane. Stem Cells Dev. 2010;19:491-502. [PubMed] [DOI] |
| 25. | Sant'Anna LB, Cargnoni A, Ressel L, Vanosi G, Parolini O. Amniotic membrane application reduces liver fibrosis in a bile duct ligation rat model. Cell Transplant. 2011;20:441-453. [PubMed] [DOI] |
| 26. | Tsai PC, Fu TW, Chen YM, Ko TL, Chen TH, Shih YH, Hung SC, Fu YS. The therapeutic potential of human umbilical mesenchymal stem cells from Wharton's jelly in the treatment of rat liver fibrosis. Liver Transpl. 2009;15:484-495. [PubMed] [DOI] |
| 27. | Lee MJ, Jung J, Na KH, Moon JS, Lee HJ, Kim JH, Kim GI, Kwon SW, Hwang SG, Kim GJ. Anti-fibrotic effect of chorionic plate-derived mesenchymal stem cells isolated from human placenta in a rat model of CCl(4)-injured liver: potential application to the treatment of hepatic diseases. J Cell Biochem. 2010;111:1453-1463. [PubMed] [DOI] |
| 28. | Zhang D, Jiang M, Miao D. Transplanted human amniotic membrane-derived mesenchymal stem cells ameliorate carbon tetrachloride-induced liver cirrhosis in mouse. PLoS One. 2011;6:e16789. [PubMed] [DOI] |
| 29. | Szuster-Ciesielska A, Plewka K, Kandefer-Szerszeń M. Betulin, betulinic acid and butein are inhibitors of acetaldehyde-induced activation of liver stellate cells. Pharmacol Rep. 2011;63:1109-1123. [PubMed] [DOI] |
| 31. | Tipnis S, Viswanathan C, Majumdar AS. Immunosuppressive properties of human umbilical cord-derived mesenchymal stem cells: role of B7-H1 and IDO. Immunol Cell Biol. 2010;88:795-806. [PubMed] [DOI] |