修回日期: 2012-01-19
接受日期: 2012-03-15
在线出版日期: 2012-04-08
目的: 研究氯吡格雷对大鼠急性胃黏膜损伤愈合的影响作用及其机制.
方法: 40只健康♂SD大鼠随机分为4组, 每组10只: 阴性对照组、单纯损伤组、10 mg/kg氯吡格雷处理组、30 mg/kg氯吡格雷处理组; 以大剂量阿司匹林灌胃制造大鼠急性胃黏膜损伤模型后, 对氯吡格雷处理组的大鼠以相应剂量的氯吡格雷进行灌胃处理, 给药3 d, 每天1次. 分别测定各组大鼠的胃黏膜损伤指数(lesion index, LI); 观察大鼠胃黏膜组织学变化; 免疫组织化学法检测各组紧密连接蛋白Occludin的表达情况; 免疫蛋白印迹法(Western blot)检测紧密连接蛋白Occludin、ZO-1以及MAPK信号通路中磷酸化P38、磷酸化ERK及磷酸化JNK蛋白的表达量.
结果: 与损伤组相比, 氯吡格雷处理组大鼠胃黏膜损伤加重, 且30 mg/kg组损伤重于10 mg/kg组(39.8±5.05 vs 35.3±3.86, P<0.05); 在阴性对照组、单纯损伤组、10 mg/kg氯吡格雷处理组、30 mg/kg氯吡格雷处理组中, 大鼠胃黏膜中的紧密连接蛋白Occludin、ZO-1蛋白的表达逐渐下降, 呈递减趋势(P = 0.000), 而磷酸化P38、磷酸化ERK蛋白表达则逐渐上升, 呈递增趋势(P = 0.000).
结论: 氯吡格雷能够抑制大鼠急性胃黏膜损伤的愈合, 其可能是通过激活MAPK中的p38和ERK信号通路, 下调胃黏膜上皮细胞间紧密连接蛋白Occludin和ZO-1的表达, 破坏大鼠胃黏膜的屏障.
引文著录: 高欣, 吴海露, 张振玉, 胡可伟, 姜宗丹, 杨小兵, 王劲松. 氯吡格雷对大鼠急性胃黏膜损伤愈合的影响及机制. 世界华人消化杂志 2012; 20(10): 861-865
Revised: January 19, 2012
Accepted: March 15, 2012
Published online: April 8, 2012
AIM: To determine the effect of clopidogrel on the healing of aspirin-induced gastric mucosal lesions in rats and to explore possible mechanisms involved.
METHODS: Forty healthy male SD rats were randomly and equally divided into four groups: normal group, injury group, and two clopidogrel groups (10 mg/kg and 30 mg/kg). Gastric mucosal lesions were induced in rats by oral administration of aspirin (200 mg/kg). Rats of the clopidogrel groups were continuously administrated with clopidogrel for 3 days. After treatment, histological changes were evaluated under a microscope; the distribution of gastric epithelial tight junction protein occludin was determined by immunohistochemistry; and the expression levels of ZO-1, occludin, as well as phosphorylated ERK (p-ERK), P38 (p-P38) and JNK (p-JNK) were determined by Western blot.
RESULTS: Compared to the injury group, the lesion indices of the clopidogrel groups were significantly increased (39.8 ± 5.05 vs 35.3 ± 3.86, P < 0.05), and the increase was more significant in the high-does group than in the low-dose group (P < 0.05). In clopidogrel groups, the expression levels of occludin and ZO-1 were lower in the clopidogrel groups than in the injury group (P < 0.05), and in the high-does group than in the low-does group. Activation of P38 and ERK were more obvious in the clopidogrel groups than in the injury group (P < 0.05).
CONCLUSION: Clopidogrel significantly delays the healing of gastric lesions in rats probably by decreasing the expression of tight junction protein occludin and ZO-1 through the p38 and ERK signaling pathways.
- Citation: Gao X, Wu HL, Zhang ZY, Hu KW, Jiang ZD, Yang XB, Wang JS. Clopidogrel delays the healing of aspirin-induced gastric mucosal lesions in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(10): 861-865
- URL: https://www.wjgnet.com/1009-3079/full/v20/i10/861.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i10.861
氯吡格雷为二磷酸腺苷受体拮抗剂, 具有较好的抗血小板作用, 可显著减少各类心脑血管疾病缺血事件的发生[1,2]. 随着近年来在临床上的广泛应用, 氯吡格雷相关胃黏膜损伤甚至消化系出血的报道逐渐增多. 临床资料显示有消化性溃疡病史患者服用氯吡格雷一年中再出血率达12%, 而且出血部位多为既往溃疡部位[3]. 动物研究发现同类二磷酸腺苷受体拮抗剂药物抵克力得可延迟消化性溃疡愈合[4]. 本研究以阿司匹林致大鼠急性胃黏膜损伤模型为基础, 观察氯吡格雷对损伤愈合的影响, 并初步探讨可能存在的机制.
2月龄体质量在180-200 g之间的健康♂SD大鼠40只(由南京医科大学附属南京第一医院动物实验中心提供); 阿司匹林原料药购自山东新华制药股份有限公司(批号0702285), 由0.5%羧甲基纤维素钠(carboxymethyl cellulose, CMC)溶液配成悬浊液; 硫酸氯吡格雷购自北京诺德恒信化工技术有限公司(批号: NDS0060513), 由0.5%CMC配成悬浊液; β-actin、ZO-1抗体购自Santa Cruz; 磷酸化ERK(p-ERK)、磷酸化JNK(p-JNK)、磷酸化P38(p-P38)、Occludin抗体购自cell signal公司.
1.2.1 动物分组: 将40只大鼠随机分为4组: 1组, 阴性对照组; 2组, 阿司匹林单纯损伤组; 3组, 10 mg/kg氯吡格雷处理组; 4组, 30 mg/kg氯吡格雷处理组(n = 10).
1.2.2 造模: 所有大鼠禁食不禁水18 h后, 1组予以0.5%CMC溶液、2-4组按200 mg/kg剂量予阿司匹林进行灌胃1次, 制造大鼠急性胃黏膜损伤模型. 造模后1-2组继续予0.5%CMC溶液, 3-4组分别按10 mg/kg、30 mg/kg剂量予以氯吡格雷进行灌胃, 每天1次, 连续3 d. 以上所有大鼠每次灌胃液体量均按10 mL/kg计算. 末次灌胃后所有大鼠禁食不禁水18 h, 以10%水合氯醛按3 mL/kg行腹腔注射麻醉处死动物, 取胃组织, 沿大弯侧剪开后, 以生理盐水洗净展平, 在解剖显微镜(×100)下按Guth标准给予计分. 计分后, 将胃部分置于4%中性甲醛固定标本制备石蜡标本, 部分置于冻存管液氮保存以提取蛋白.
1.2.3 胃黏膜损伤指数判定: 按Guth标准累积计算损伤指数(lesion index, LI): 斑点样损伤 = 1分, 损伤直径(长度)<1 mm为2分, 损伤直径(长度)1-2 mm为3分, 损伤直径(长度)2-4 mm为4分, 损伤直径(长度)>4 mm为5分, 宽度>2 mm的损伤积分值×2.
1.2.4 组织学观察: 胃组织经4%中性甲醛固定24 h, 经常规脱水、透明、石蜡包埋切片, HE染色, 光镜下观察.
1.2.5 Occludin免疫组织化学染色: 采用Envision法, 石蜡切片脱蜡至水, 蛋白酶E 37 ℃ 10 min消化, PBS冲洗, 加Occludin抗体4 ℃过夜, PBS冲洗, 加Envision二抗37 ℃ 30 min, PBS冲洗, DAB显色, 镜下控制显色时间, 苏木精复染, 脱水, 透明, 树胶封片.
1.2.6 Western blot: 取约100 mg胃黏膜层组织, 加入蛋白裂解液, 4 ℃裂解, 10 000 r/min离心15 min, 取上清为全蛋白提取物. 将蛋白提取物与蛋白上样缓冲液混合, 煮沸5 min, 分装保存于-80 ℃冰箱. 进行SDS-PAGE凝胶电泳, 转膜, 封闭后加入一抗4 ℃过夜. 再加入辣根过氧化物酶标记的二抗, 孵育后ECL法显色于X光片后照相, 以β-actin作为内参照, 使用ImageJ1.44p软件分析处理.
统计学处理 采用SPSS17.0软件进行处理及分析, 实验数据用mean±SD表示, 多组间比较采用One-way ANOVA分析, 两组间比较采用t检验, P<0.05为差异具有统计学意义.
1组大鼠胃黏膜光滑, 无糜烂、溃疡出血, 胃黏膜LI均为0分; 2组胃腺部黏膜充血水肿, 可见散在分布点状及少数条状、片状出血糜烂; 3、4组胃腺部黏膜除充血水肿外, 可见多处条状、片状出血糜烂病灶. 2组、3组、4组的LI分别为25.0±4.47、35.3±3.86、39.8±5.05, 各组间比较, 差异均具有统计学意义(F = 28.586, P = 0.000).
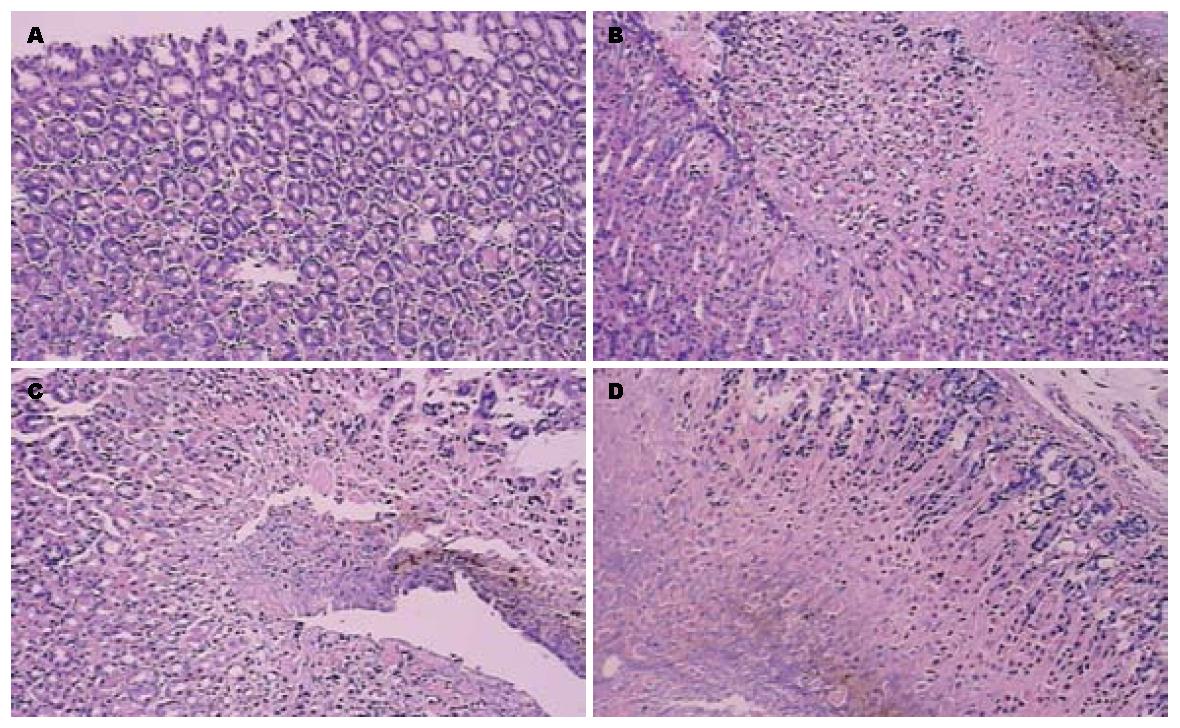
1组胃黏膜组织结构完整, 腺体排列紧密; 2-4组的黏膜结构失去完整性和连续性, 可见出血及坏死病灶, 深入黏膜深层, 同时可见炎性细胞浸润, 损伤面积及程度不断加重, 以4组损伤最重(图1).
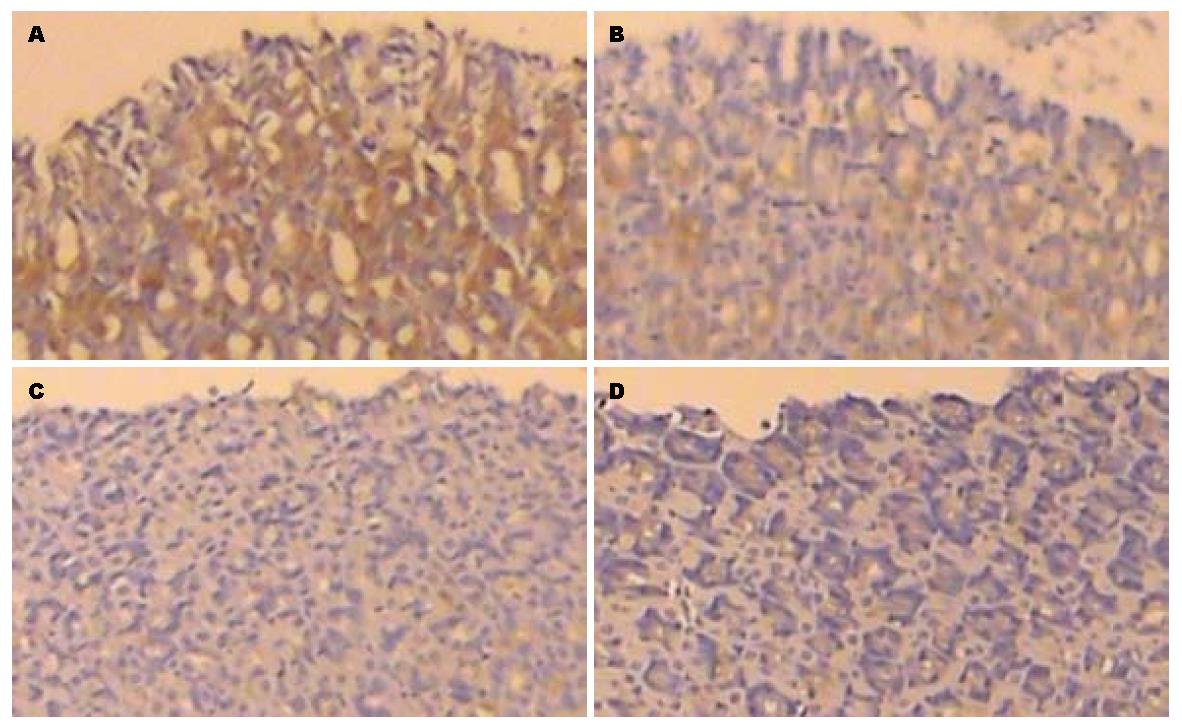
1组Occludin蛋白分布于胃黏膜上皮细胞膜, 呈表达很强的棕褐色信号; 2-4组则表达程度不断降低, 呈递减趋势, 4组胃黏膜上皮均呈弱表达或基本不表达(图2).
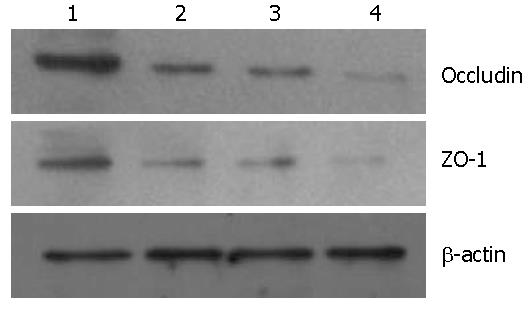
2.4.1 Occludin和ZO-1蛋白表达: 在阴性对照组、单纯损伤组、10 mg/kg氯吡格雷干预组、30 mg/kg氯吡格雷干预组中紧密连接蛋白Occludin和ZO-1表达逐渐下降, 呈递减趋势(图3).
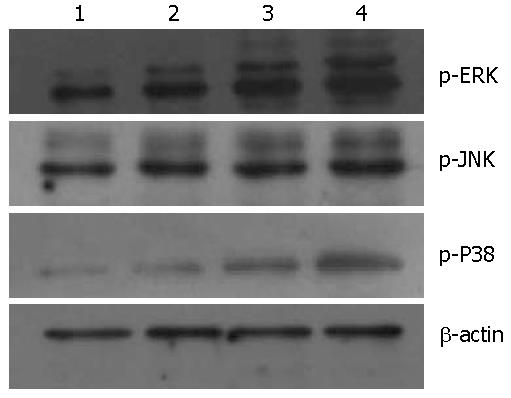
2.4.2 p-ERK、p-JNK和p-P38蛋白表达: 在阴性对照组、单纯损伤组、10 mg/kg氯吡格雷干预组、30 mg/kg氯吡格雷干预组中p-ERK和p-P38表达逐渐增加, 呈递增趋势, 而p-JNK蛋白表达未见上述变化(图4).
氯吡格雷为新型抗血小板药物, 常与阿司匹林合用治疗心脑血管疾病. 长期单独使用小剂量氯吡格雷(75 mg/d)的胃肠道不良反应风险与小剂量阿司匹林(100 mg/d)相似[5], 而联合用药则引起胃肠道损伤的危险更大, 严重上消化系出血的危险增加7.4倍[6,7]. ACCF/ACG/AHA 2008联合专家共识也指出氯吡格雷的胃肠道出血危险不比阿司匹林低, 为减少胃肠道出血而用氯吡格雷代替阿司匹林也不是一种安全的策略[8]. 我们之前的研究已经证实氯吡格雷能够抑制人胃黏膜上皮细胞(GES-1)的增殖, 诱导细胞发生凋亡[9,10].
本实验以大剂量阿司匹林对大鼠胃黏膜造成初始损伤, 观察氯吡格雷对胃黏膜损伤修复的影响. 实验结果表明, 经过氯吡格雷处理的大鼠, 胃黏膜损伤的情况明显重于单纯损伤组(P<0.05), 且30 mg/kg氯吡格雷组比10 mg/kg组损伤情况严重(P<0.05); 同时大鼠胃黏膜病理结果符合上述变化. 因此, 我们认为, 氯吡格雷能够明显延迟阿司匹林引起的大鼠胃损伤的愈合.
紧密连接复合体为上皮细胞间连接的重要结构, 由多种蛋白构成, 对保护胃黏膜层结构完整, 维持胃黏膜屏障功能有重要作用. Occludin和ZO-1蛋白为紧密连接复合体中的重要组成蛋白. 根据免疫组织化学及Western blot结果发现, 大鼠胃黏膜组织中Occludin和ZO-1蛋白的表达在阴性对照组、单纯损伤组、10 mg/kg和30 mg/kg氯吡格雷处理组的表达呈减增趋势(P = 0. 000), 与观察到的胃黏膜损伤情况一致. 因此认为, 氯吡格雷延迟大鼠胃黏膜愈合可能与降低胃黏膜上皮Occludin和ZO-1蛋白的表达, 抑制细胞间紧密连接复合体修复有关.
MAPK信号传导通路主要由ERK、p38和JNK这3个家族组成. 其中ERK主要调节细胞的增殖、分化; 而p38、JNK则主要调节细胞的分化和凋亡. 相关研究发现MAPK信号通路(包括ERK和p38)参与了胃黏膜损伤及修复过程[11-13]. 根据Western blot实验结果, 大鼠胃黏膜组织中p-ERK和p-P38蛋白在阴性对照组、单纯损伤组、10 mg/kg和30 mg/kg氯吡格雷处理组的表达呈递增趋势(P = 0.000), 即氯吡格雷作用于受损的胃黏膜后, ERK和P38蛋白磷酸化程度较单纯损伤组增加, 且氯吡格雷处理组中30 mg/kg组磷酸化程度>10 mg/kg组. 因此我们认为氯吡格雷抑制胃黏膜损伤愈合可能是与激活MAPK信号通路中的ERK和p38途径有关.
MAPK信号通路已证实参与了包括Occludin和ZO-1在内的多种紧密连接蛋白的调节, 对上皮细胞屏障功能密切相关[12,14-16]. 在本实验中氯吡格雷能够上调表达大鼠胃黏膜中紧密连接蛋白Occludin和ZO-1, 可能是通过激活ERK和p38途径, 使ERK和P38蛋白磷酸化表达增加而实现的.
基于此, 我们认为: 氯吡格雷可能通过激活MAPK中的ERK和p38途径, 下调大鼠胃黏膜上皮细胞间紧密连接蛋白Occludin和ZO-1表达, 破坏紧密连接复合体, 抑制大鼠胃黏膜屏障功能修复, 从而延迟大鼠胃黏膜损伤的愈合.
随着质子泵抑制剂(proton pump inhibitors, PPI)在预防氯吡格雷相关的胃肠道损害中心血管事件发生率和死亡率的升高, 氯吡格雷对胃肠道的损害及其防治引起了临床医师的广泛关注.
陈国忠, 副主任医师, 广西医科大学消化内科
目前关于氯吡格雷对人胃肠道黏膜损害的资料报道不多, 针对氯吡格雷影响胃肠黏膜损伤修复方面的研究很少, 具体机制目前尚不明确, 有待基础及临床实验进一步探索.
Sibilia等证实与氯吡格雷同类的二磷酸腺苷受体拮抗剂药物抵克力得可延迟酒精引起的大鼠胃溃疡的愈合.
氯吡格雷替代阿司匹林用于心脑血管疾病的治疗并不是绝对安全的, 尤其是针对既往有胃溃疡和胃炎病史的患者应尤其注意, 避免胃肠道不良反应的发生.
本研究立意较好, 课题有一定的创新性, 课题设计合理, 实验方法可行, 具有一定的科学意义和临床应用意义.
编辑: 曹丽鸥 电编: 闫晋利
| 1. | Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med. 2001;345:494-502. [PubMed] [DOI] |
| 2. | Steinhubl SR, Berger PB, Mann JT, Fry ET, DeLago A, Wilmer C, Topol EJ. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA. 2002;288:2411-2420. [PubMed] [DOI] |
| 3. | Ng FH, Wong SY, Chang CM, Chen WH, Kng C, Lanas AI, Wong BC. High incidence of clopidogrel-associated gastrointestinal bleeding in patients with previous peptic ulcer disease. Aliment Pharmacol Ther. 2003;18:443-449. [PubMed] [DOI] |
| 4. | Sibilia V, Pagani F, Lattuada N, De Luca V, Guidobono F, Soglian A, Netti C. Ticlopidine prevents the formation but delays the healing of ethanol-induced gastric lesions in the rat. Pharmacol Res. 2007;55:418-425. [PubMed] [DOI] |
| 5. | Serebruany VL, Malinin AI, Eisert RM, Sane DC. Risk of bleeding complications with antiplatelet agents: meta-analysis of 338,191 patients enrolled in 50 randomized controlled trials. Am J Hematol. 2004;75:40-47. [PubMed] [DOI] |
| 6. | Peters RJ, Mehta SR, Fox KA, Zhao F, Lewis BS, Kopecky SL, Diaz R, Commerford PJ, Valentin V, Yusuf S. Effects of aspirin dose when used alone or in combination with clopidogrel in patients with acute coronary syndromes: observations from the Clopidogrel in Unstable angina to prevent Recurrent Events (CURE) study. Circulation. 2003;108:1682-1687. [PubMed] [DOI] |
| 7. | Hallas J, Dall M, Andries A, Andersen BS, Aalykke C, Hansen JM, Andersen M, Lassen AT. Use of single and combined antithrombotic therapy and risk of serious upper gastrointestinal bleeding: population based case-control study. BMJ. 2006;333:726. [PubMed] [DOI] |
| 8. | Bhatt DL, Scheiman J, Abraham NS, Antman EM, Chan FK, Furberg CD, Johnson DA, Mahaffey KW, Quigley EM, Harrington RA. ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use. Am J Gastroenterol. 2008;103:2890-2907. [PubMed] [DOI] |
| 11. | Jia YT, Wei W, Ma B, Xu Y, Liu WJ, Wang Y, Lv KY, Tang HT, Wei D, Xia ZF. Activation of p38 MAPK by reactive oxygen species is essential in a rat model of stress-induced gastric mucosal injury. J Immunol. 2007;179:7808-7819. [PubMed] [DOI] |
| 12. | Oshima T, Miwa H, Joh T. Aspirin induces gastric epithelial barrier dysfunction by activating p38 MAPK via claudin-7. Am J Physiol Cell Physiol. 2008;295:C800-C806. [PubMed] [DOI] |
| 13. | Jones MK, Sasaki E, Halter F, Pai R, Nakamura T, Arakawa T, Kuroki T, Tarnawski AS. HGF triggers activation of the COX-2 gene in rat gastric epithelial cells: action mediated through the ERK2 signaling pathway. FASEB J. 1999;13:2186-2194. [PubMed] |
| 14. | Kevil CG, Oshima T, Alexander JS. The role of p38 MAP kinase in hydrogen peroxide mediated endothelial solute permeability. Endothelium. 2001;8:107-116. [PubMed] [DOI] |
| 15. | Lui WY, Lee WM, Cheng CY. TGF-betas: their role in testicular function and Sertoli cell tight junction dynamics. Int J Androl. 2003;26:147-160. [PubMed] [DOI] |
| 16. | Oshima T, Sasaki M, Kataoka H, Miwa H, Takeuchi T, Joh T. Wip1 protects hydrogen peroxide-induced colonic epithelial barrier dysfunction. Cell Mol Life Sci. 2007;64:3139-3147. [PubMed] [DOI] |