修回日期: 2011-12-05
接受日期: 2011-12-18
在线出版日期: 2012-01-08
目的: 探索亚砷酸(As2O3)对BEL-7402的作用, 研究其与硼替佐米联合的化疗效果.
方法: As2O3不同浓度及作用时间处理细胞, 或与硼替佐米联合作用, 倒置显微镜观察细胞形态, MTT法检测增殖, 流式AnnexinⅤ-PI双染法检测凋亡, Western blot及EMSA法检测NF-kB活性.
结果: 细胞形态及生长抑制率随亚砷酸作用时间及浓度变化而变化, 呈时间和浓度依赖性, 细胞凋亡率随时间增加而提高(3-48 h: 5.23%±0.55%, 5.24%±0.28%, 4.92%±0.91%, 4.73%±0.83%, 17.54%±1.49%), 双药联合作用时, NF-kB活性受到抑制, 细胞凋亡率也提升(24 h: 8.41%±0.78%).
结论: As2O3对BEL-7402有明显抑制作用; 联合硼替佐米作用, 可以增强肿瘤细胞对药物的敏感性, 提高肿瘤治疗的效果.
引文著录: 刘婷, 刘静, 褚艳杰, 胡丽红, 刘冰熔. 亚砷酸联合硼替佐米对肝癌细胞系BEL-7402的作用. 世界华人消化杂志 2012; 20(1): 9-14
Revised: December 5, 2011
Accepted: December 18, 2011
Published online: January 8, 2012
AIM: To evaluate the impact of combined treatment with arsenous acid and bortezomib on the growth and apoptosis of BEL-7402 cells.
METHODS: After BEL-7402 cells were treated with arsenous acid alone or in combination with bortezomib, cell morphology was observed by inverted microscopy; cell proliferation was analyzed by MTT assay; apoptosis was detected by flow cytometry; and NF-kB activity was detected by Western blot and electrophoretic mobility shift assay (EMSA).
RESULTS: Arsenous acid inhibited cell proliferation in a time- and concentration-dependent manner, and promoted apoptosis in a time-dependent manner (3-48 h: 5.23% ± 0.55%, 5.24% ± 0.28%, 4.92% ± 0.91%, 4.73% ± 0.83%, 17.54% ± 1.49%). Bortezomib enhanced arsenous acid-mediated growth inhibition and apoptosis induction (24 h: 8.41% ± 0.78%), and restrained NF-kB activity.
CONCLUSION: Arsenous acid could obviously inhibit growth and promote apoptosis of BEL-7402 cells. Bortezomib could enhance the sensitivity of BEL-7402 cells to arsenous acid.
- Citation: Liu T, Liu J, Chu YJ, Hu LH, Liu BR. Bortezomib enhances arsenous acid-induced growth inhibition and apoptosis of BEL-7402 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(1): 9-14
- URL: https://www.wjgnet.com/1009-3079/full/v20/i1/9.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i1.9
亚砷酸(As2O3)治疗急性早幼粒细胞白血病疗效良好[1], 主要与其诱导细胞凋亡有关[2-5]. 许多研究表明砷剂不仅对白血病细胞且对一些实体性肿瘤细胞如胃癌、鼻咽癌等亦有诱导凋亡作用[6-8]. 蛋白酶体抑制剂可通过抑制泛素-蛋白酶体通路调节细胞周期, 促进细胞凋亡, 从而可能阻止或延缓肿瘤进展[9-11], 因此, 硼替佐米作为一种蛋白酶体抑制剂有潜在的抗肿瘤价值. 单用硼替佐米即可诱导人多种白血病细胞系的凋亡[12-14], 越来越多的研究致力于硼替佐米与常规化疗药物的联合作用, 显示二者具有协同或叠加效应[15-17]. 肝癌在我国的发病率和死亡率居高不下, 主要治疗方法为手术切除. 由于其不易早期发现, 多数患者确诊时已经失去手术治疗机会, 晚期肿瘤有局部进展或转移, 因此非手术全身化学治疗成为主要方法, 而肝癌对化疗很不明感, 所以寻求敏感的化疗方案为亟待解决的问题. 本实验以人原发肝癌细胞系BEL-7402为研究对象, 观察亚砷酸联合硼替佐米对肝癌细胞系BEL-7402的化疗效果.
肝癌细胞系BEL-7402购自中科院上海细胞所细胞库, 亚砷酸氯化钠注射液(As2O3)购于哈尔滨伊达药业有限公司, 硼替佐米(bortezomib)购于西安杨森制药公司, DMEM(高糖)培养基、胎牛血清购自美国HyClone公司; AnnexinⅤ-PI凋亡检测试剂盒于BD公司, BCA试剂盒、细胞裂解液等均购于碧云天生物技术研究所, 鼠抗人NF-kB p65抗体购于Santa Cruz生物技术有限公司, 核蛋白抽提试剂盒、凝胶电泳迁移率实验(EMSA)试剂盒等购于北京唯奥基因科技发展有限公司.
100 mL/L胎牛血清DMEM培养液, 含1%青链霉素常规培养BEL-7402细胞, 0.25%胰蛋白酶消化, 2-3 d传代1次.
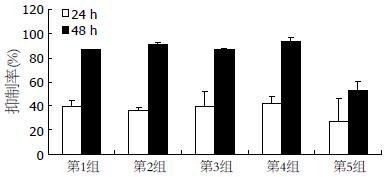
1.2.1 MTT法检测细胞增殖: 接种96孔板, 每孔加入100 mL细胞悬液约6×103个细胞, 次日细胞贴壁后加药. 单药时, As2O3终浓度依次为1.25, 2.5, 5, 10, 20 mg/L; bortezomib(nmol/L)终浓度依次为25, 50, 100, 200, 400; 然后选择100 nmol/L bortezomib与5 mg/L As2O3双药联合, 设5组: 第1组为二者同时加注, 第2组为bortezomib先作用2 h后二者共作用, 第3组为bortezomib先作用2 h后改为单用As2O3, 第4组为As2O3先作用2 h后二者共作用, 第5组为As2O3单独作用. 每次实验设5个复孔, 并设调零孔、对照组, 于50 mL/L CO2、37 ℃培养箱中孵育相应时间后, 倒置显微镜下观察记录后, 每孔加入5 g/L MTT 20 mL, 继续培养4 h, 吸弃培养液, 各孔加入150 mL二甲基亚砜, 充分溶解结晶物, 490 nm波长测量吸光度(A值), 重复3次. 抑制率 = (1-实验组A值/对照组A值)×100%.
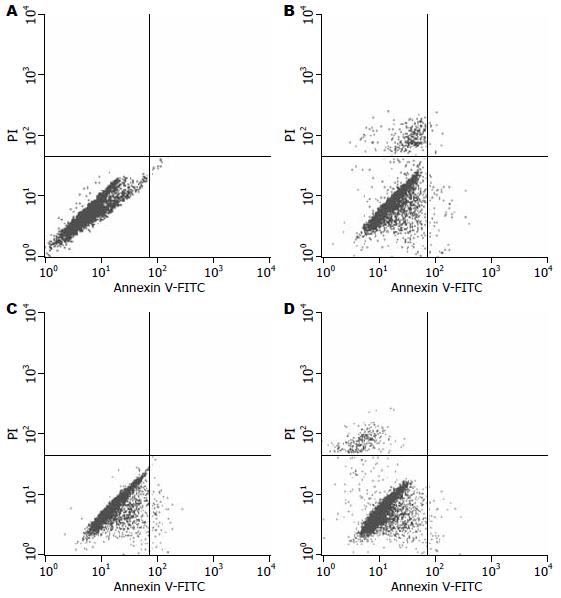
1.2.2 流式AnnexinⅤ-PI双染法检测凋亡: 75 mL培养瓶培养细胞, 5 mg/L As2O3单独作用3 h、6 h、12 h、24 h、48 h; 100 nmol/L bortezomib单独作用24 h或二者联合作用24 h后, 0.125%胰蛋白酶消化, 终止消化后PBS制备单细胞悬液, 按BD公司流式说明书操作, 流式细胞仪分析.
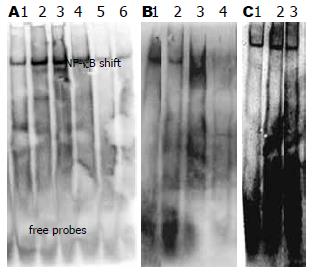
1.2.3 EMSA法检测NF-kB活性: 5 mg/L As2O3单独作用3 h、6 h、12 h、24 h、48 h或100 nmol/L bortezomib联合作用24 h后收集约2×107个细胞, 提核蛋白, 用BCA法检测其浓度符合要求后置-80 ℃保存备用. NF-kB探针: 5'-AGT TGA GGG GAC TTT CCC AGG C-3', 按唯奥基因科技发展有限公司提供的非放射性 EMSA试剂盒说明书操作, 分析核蛋白的DNA结合活性. 每孔加入20 mL样本, 凝胶电泳、转膜、交联、洗涤、底物结合反应、成像.
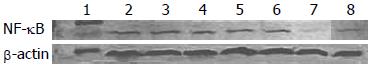
1.2.4 Western blot检测NF-kB活性: 5 mg/L As2O3单独作用3 h、6 h、12 h、24 h、48 h或100 nmol/L bortezomib联合作用24 h后, 收集细胞, 常规提取蛋白质样品, BCA法测蛋白浓度, 配制10%的SDS-PAGE分离胶和5%的积层胶, 上样, 于电泳缓冲液中, 恒压90 V电泳至样品进入分离胶, 改为110 V至目的蛋白分离; PVDF膜半干法转印, 牛奶封闭, 1:200鼠抗人NF-kB p65抗体4 ℃孵育过夜, TBST洗膜, 1:5 000 HRP二抗37 ℃作用1 h, 重复洗膜, DAB显色. 并用密度扫描仪(GIS全自动图像分析)测定差异条带面积和灰度, 以二者之乘积与内参b-actin之比值进行半定量分析.
统计学处理 数据结果用mean±SD表示, 配对t检验.
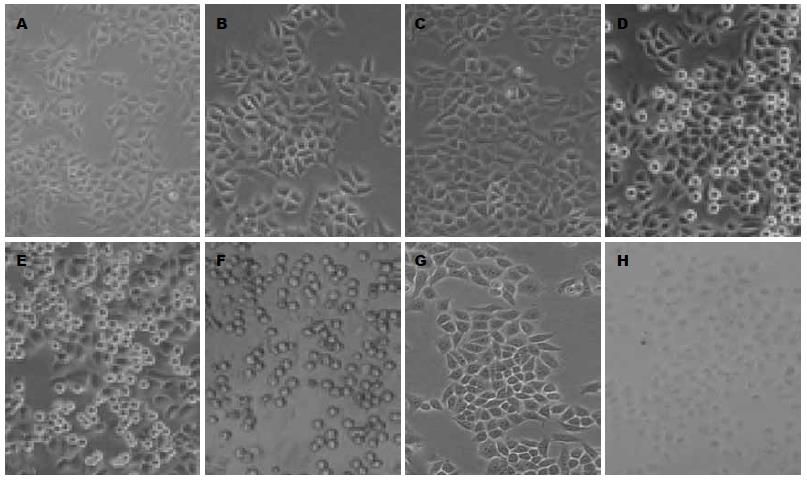
BEL-7402细胞随着As2O3作用时间的延长及浓度的提高, 细胞膜逐渐变模糊、折光度变小, 接着细胞渐变圆变小, 贴壁不良至死亡. Bortezomib单独作用时细胞膜也变模糊, 二者双药联合是改变较单药明显(图1).
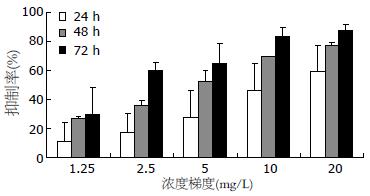
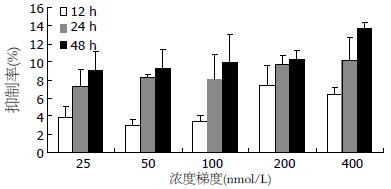
BEL-7402生长抑制率随亚砷酸作用时间的延长及浓度的升高而逐渐提高, 明显呈时间和浓度依赖, 除1.25 mg/L与2.5 mg/L作用24 h组相比 P>0.05外, 余均P<0.05(图2); 低浓度Bortezomib干预下, 细胞生长抑制率未随作用时间的延长及浓度的升高而明显改变(P>0.05, 图3); 100 nmol/L Bortezomib与5 mg/L As2O3双药联合时, 细胞生长抑制率明显高于单药作用, 但不同给药方式无明显差异(图4).
每样本分4个流式管, 1管不加染料为细胞浓度检测; 2管单加5 mL AnnexinⅤ, 3管单加5 mL PI, 二者用于调整象限; 4管AnnexinⅤ-PI双染各5 mL为检测管. 如表1所示, As2O3作用48 h时凋亡率急剧升高, 余无明显变化, 无统计学意义(图5).
| 药物 | 5 mg/L As2O3 | 双药联合 | 100 nmol/L Bortezomib | ||||
| 作用时间 | 3 h | 6 h | 12 h | 24 h | 48 h | 24 h | 24 h |
| 凋亡率(%) | 5.23±0.55 | 5.24±0.28 | 4.92±0.91 | 4.73±0.83 | 17.54±1.49 | 8.41±0.78 | 3.93±0.33 |
5 mg/L As2O3作用3 h、6 h、12 h、24 h、48 h, P65表达先随作用时间延长而活化核转移增多再随时间延长而减弱, 6 h活化最多(图6A). 100 nmol/L Bortezomib单独作用6 h、12 h、24 h, P65表达随作用时间延长被抑制(图6B). 二者联合同时作用24 h, P65表达较As2O3单独作用明显被抑制(图6C).
5 mg/L As2O3单独作用NF-kB总蛋白表达先增加到48 h时减少, 与100 nmol/L Bortezomib联合作用24 h时表达较单药明显减少. 差异条带面积和灰度, 以二者之乘积与内参b-actin之比值进行半定量分析(图7).
随着分子生物学的飞速发展, 抗癌药物的代谢机制及其药物靶向性分子正在逐渐被人们所认知, 但由于在治疗中存在着肿瘤细胞的耐药, 使化疗效率仍不尽人意. As2O3最初用于急性早幼粒细胞白血病的治疗, 取得了极高的临床缓解率, 得到全世界的普遍认可. 近年来, 国内外学者尝试将砷剂用于肝癌和结肠癌的治疗, 同样取得了一定的效果[18-20].
核转录因子NF-kB及相应调控因子明显参与了恶性血液、固体瘤的细胞增殖、凋亡调控、新血管生成、转移等, 化疗药物在杀灭肿瘤细胞的同时又能激活NF-kB通路, 使肿瘤细胞的死亡/生存平衡向着生方向倾斜, 从而影响肿瘤治疗的效果, 抑制通路可增强化疗效果[21-26].
蛋白酶体抑制剂是NF-kB通路的抑制剂之一. 在NF-kB信号通路中, IkB被IKK磷酸化后发生多泛素化, 最终被26S蛋白酶体清除. 蛋白酶体抑制剂可以稳定IkB, 从而抑制NF-kB的活化[27]. Bortezomib是进入临床研究的第1个蛋白酶体抑制剂, 是细胞渗透性的小分子, 能选择性可逆性地与蛋白酶体结合, 有强大的细胞毒活性并且毒副作用非常小, 已被FDA和EMMA批准用来治疗复发的多发性骨髓瘤, 为肿瘤的治疗开拓了新视点. 作为一新兴的化疗药物, Bortezomib已被很多研究学者关注并进行试验或临床研究. 其对多发性骨髓瘤细胞有抑制细胞生长、诱导肿瘤细胞凋亡、抑制细胞黏附、抑制肿瘤血管生成等作用, 同时对血液系统其他恶性肿瘤具有显著的作用[14], 单独作用或与常规化疗药联合作用可提高化疗效果或逆转耐药性[15-17,28,29], 为逆转恶性肿瘤耐药提供了一个新的途径.
本研究我们用As2O3对BEL-7402进行干预, 证实As2O3能够明显抑制肿瘤细胞生长, 5 mg/L As2O3作用24 h、48 h、72 h对细胞的平均抑制率分别达27.1%±19.1%、52.7%±7.7%、65.0%±13.6%, 并随着药物作用浓度的提高, 抑制作用增强.
在我们的前期研究中发现正常肝细胞HL-7702中几乎没有NF-kB的活化, 而肝癌细胞系BEL-7402存在NF-kB组成性活化和As2O3的诱导性活化, 转染Ad-IkBaM可以明显抑制NF-kB活化. 应用转染Ad-IkBaM基因治疗抑制NF-kB通路和As2O3联合应用后凋亡细胞明显增多[30], 还发现As2O3可以诱导胃癌细胞SCG-7901中NF-kB通路活化, 感染Ad-IkBaM可以抑制NF-kB的活化. NF-kB通路的抑制能够显著增加胃癌细胞对化疗药物的敏感性, 凋亡细胞明显增多[31]. 因而本实验我们改用NF-kB通路的抑制剂Bortezomib替代基因治疗联合As2O3治疗肝癌, 应用MTT测增殖, 流式测凋亡, Western blot及EMSA法检测NF-kB活性, 结果表明, Bortezomib在无毒性、基本无细胞生长抑制的浓度下能有效抑制NF-kB活化, 提高As2O3的化疗效果, 抑制率24 h提高10%左右, 48 h提高20%以上, 并且与给药先后顺序无关; 细胞凋亡率亦有提高. 证实了Bortezomib与As2O3联合作用BEL-7402, 二者具有协同效应. 然而应用Bortezomib联合As2O3治疗肝癌的最佳联合浓度、最佳联合时机、是否在细胞发生化疗耐药后联合会效果更佳及其对其他细胞系的效果, 如何仍需我们进一步的探索、实验.
肝癌在我国的发病率和死亡率居高不下, 主要因为除早期诊断的早期癌能手术切除外, 多数以非手术全身化学为主要方法, 但其对现化疗方案很不明感, 故寻求敏感的化疗方案仍为热点问题.
管冬元, 副教授, 上海中医药大学基础医学院实验中医学教研室
As2O3及Bortezomib已广泛被用于血液系统肿瘤的研究治疗, 且取得相当可喜的治疗效果, 但其对实体瘤的作用仍未十分明确.
本文不仅研究了As2O3及Bortezomib单独作用于BEL-7402的效果, 且探索了二者联合作用下的化疗效果.
本文参阅了近年来大量国内外文献, 对As2O3及Bortezomib作用于肝癌进行探索性研究, 拓展了肝癌的诊疗思路.
本文参阅近年来大量国内外文献, 用多种实验方法研究了As2O3及Bortezomib对BEL-7402的作用, 论文内容新颖, 文字流畅, 条理清晰. 为肝癌的化疗治疗开拓了新视点.
编辑: 李军亮 电编:何基才
| 3. | Zhu J, Okumura H, Ohtake S, Nakamura S, Nakao S. The molecular mechanism of arsenic trioxide-induced apoptosis and oncosis in leukemia/lymphoma cell lines. Acta Haematol. 2003;110:1-10. [PubMed] [DOI] |
| 4. | 卢 香兰, 王 萍萍, 刘 云鹏, 李 霞, 侯 科佐, 刘 静, 岳 瑶. 三氧化二砷对人白血病细胞株NB4和K562及MOLt4的增殖、周期及凋亡的影响. 肿瘤防治杂志. 2004;11:586-588. |
| 5. | 麦 玉洁, 邱 录贵. 三氧化二砷治疗恶性血液系统疾病的机制. 国外医学•生理、病理科学及临床分册. 2004;24:166-169. |
| 9. | Hideshima T, Mitsiades C, Akiyama M, Hayashi T, Chauhan D, Richardson P, Schlossman R, Podar K, Munshi NC, Mitsiades N. Molecular mechanisms mediating antimyeloma activity of proteasome inhibitor PS-341. Blood. 2003;101:1530-1534. [PubMed] [DOI] |
| 12. | Horton TM, Gannavarapu A, Blaney SM, D'Argenio DZ, Plon SE, Berg SL. Bortezomib interactions with chemotherapy agents in acute leukemia in vitro. Cancer Chemother Pharmacol. 2006;58:13-23. [PubMed] [DOI] |
| 15. | Dai Y, Rahmani M, Pei XY, Dent P, Grant S. Bortezomib and flavopiridol interact synergistically to induce apoptosis in chronic myeloid leukemia cells resistant to imatinib mesylate through both Bcr/Abl-dependent and -independent mechanisms. Blood. 2004;104:509-518. [PubMed] [DOI] |
| 20. | Gu QL, Li NL, Zhu ZG, Yin HR, Lin YZ. A study on arsenic trioxide inducing in vitro apoptosis of gastric cancer cell lines. World J Gastroenterol. 2000;6:435-437. [PubMed] |
| 21. | Kim HJ, Hawke N, Baldwin AS. NF-kappaB and IKK as therapeutic targets in cancer. Cell Death Differ. 2006;13:738-747. [PubMed] [DOI] |
| 22. | Baldwin AS. Control of oncogenesis and cancer therapy resistance by the transcription factor NF-kappaB. J Clin Invest. 2001;107:241-246. [PubMed] [DOI] |
| 23. | Karin M, Cao Y, Greten FR, Li ZW. NF-kappaB in cancer: from innocent bystander to major culprit. Nat Rev Cancer. 2002;2:301-310. [PubMed] [DOI] |
| 24. | Nakanishi C, Toi M. Nuclear factor-kappaB inhibitors as sensitizers to anticancer drugs. Nat Rev Cancer. 2005;5:297-309. [PubMed] [DOI] |
| 25. | Wang CY, Cusack JC, Liu R, Baldwin AS. Control of inducible chemoresistance: enhanced anti-tumor therapy through increased apoptosis by inhibition of NF-kappaB. Nat Med. 1999;5:412-417. [PubMed] [DOI] |
| 26. | Cusack JC, Liu R, Houston M, Abendroth K, Elliott PJ, Adams J, Baldwin AS. Enhanced chemosensitivity to CPT-11 with proteasome inhibitor PS-341: implications for systemic nuclear factor-kappaB inhibition. Cancer Res. 2001;61:3535-3540. [PubMed] |
| 27. | Montagut C, Rovira A, Albanell J. The proteasome: a novel target for anticancer therapy. Clin Transl Oncol. 2006;8:313-317. [PubMed] [DOI] |
| 28. | Colado E, Alvarez-Fernández S, Maiso P, Martín-Sánchez J, Vidriales MB, Garayoa M, Ocio EM, Montero JC, Pandiella A, San Miguel JF. The effect of the proteasome inhibitor bortezomib on acute myeloid leukemia cells and drug resistance associated with the CD34+ immature phenotype. Haematologica. 2008;93:57-66. [PubMed] [DOI] |