修回日期: 2011-11-24
接受日期: 2011-12-23
在线出版日期: 2012-01-08
HBV感染作为引起慢性乙型肝炎、乙肝后肝硬化、原发性肝癌(hepatocellular carcinoma, HCC)的起始因素, 已成为世界性的健康问题. 据统计, 目前世界上已有超过5亿人感染HBV, 每年有1百万人死于乙肝相关疾病. HBx蛋白作为HBV的一个多功能调节蛋白, 已被证实在HCC的发生过程中起了重要作用. 近年来, 关于乙肝病毒X蛋白(HBV X protein, HBx)影响HBV的复制研究也有了一定的进展. 同时, 越来越多的HBx截短体在肝病发展过程中的作用也被重视. 本文将对HBx及其截短体在HBV复制中的作用作一综述.
引文著录: 杨旋, 何松. HBx及其截短体在乙型肝炎病毒复制中的作用. 世界华人消化杂志 2012; 20(1): 41-46
Revised: November 24, 2011
Accepted: December 23, 2011
Published online: January 8, 2012
As one of the principal causes of liver diseases, such as chronic hepatitis B, hepatic cirrhosis and hepatocellular carcinoma (HCC), hepatitis B virus (HBV) infection has been a major health problem worldwide. It is estimated that more than 500 million individuals have been infected with HBV worldwide and 1 million die of HBV infection-associated diseases annually. HBV X protein (HBx) is a multifunctional protein that can modulate various cellular processes and plays a crucial role in the pathogenesis of HCC. In recent years, the role of HBx in HBV replication has been more or less confirmed. In addition, more and more natural HBx truncated mutants and their roles in HBV replication have been found. This review aims to elucidate the roles of HBx and truncated HBx in HBV replication.
- Citation: Yang X, He S. Role of HBx and truncated HBx in HBV replication. Shijie Huaren Xiaohua Zazhi 2012; 20(1): 41-46
- URL: https://www.wjgnet.com/1009-3079/full/v20/i1/41.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i1.41
HBx是乙型肝炎病毒(hepatitis B virus, HBV)最小的开放阅读框(open reading frame, ORF)编码的1个154个氨基酸(aa), 分子量约17 kDa的蛋白, 尽管他在乙型肝炎及诱导体液、细胞免疫反应时仅仅处于很低的水平[1-5], 大量转染细胞中的研究已经证实HBx通过多种作用影响HBV的复制, 如细胞周期、胞质信号转导以及与胞核转录作用元件的直接作用[6-10]. HBx结构包含C-端2/3(aa51-154)反式激活作用区域与N-端1/3(aa1-50)负性调节区域[6,11,12]. 使用丙氨酸诱变突变扫描方法证实aa52-65及aa88-154对增强HBx在HBV中的复制十分重要[13], 并且HBx的转录反式激活作用对增强HBV的复制能力可能是至关重要的, 因此C-端反式激活区域对于增强HBV的复制能力以及3.5 kb的HBV RNA合成是需要的. C-端缺失不同氨基酸长度的截短体对HCC的发生以及HBV的复制起着不同的作用, 而N-端截短体对此并未产生明显的影响.
HBV在静止的肝细胞中复制不活跃, 而需要HBx介导细胞由G0期进入G1期增强其复制能力. 研究表明[14-16]HBx一方面通过下调P15、P16这些阻碍细胞进入G1期的蛋白水平, 阻碍G1末期和S期蛋白激酶的作用; 另一方面增加P21、细胞周期蛋白D1、E这些促使细胞进入G1期的蛋白水平, 增加G1期蛋白激酶、细胞周期依赖蛋白激酶4(cyclin A-cyclindependent kinase 4, CDK4)的作用来促使细胞从G0期进入G1, 并停滞在G1/S期. 而之所以促使细胞进入G1期从而为HBV复制创造一个有利的环境, 可能与增加脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate, dNTP)水平有关, 因为G0期细胞的dNTPs水平相对较低, 而经历G1期后增加了dNTPs的合成, HBV正是利用宿主的dNTPs来复制本身基因的.
HBV共价闭合环状DNA(covalently closed circular DNA, cccDNA)作为所有HBV RNA, 包括前基因组RNA(pregenomic RNA, pgRNA)的转录模板, 在HBV复制中起到至关重要的作用. 在胞核中, cccDNA与组蛋白、非组蛋白结合成核蛋白复合体, 即微型染色体. cccDNA结合组蛋白乙酰化水平的提高与HBV复制水平的显著提高相平行[17].
最近研究表明[17]在转染了HBx突变体的细胞中, p300乙酰转移酶的募集作用明显受损, 而组蛋白去乙酰化酶1(histone deacetylase 1, HDAC1)和hSirtl的募集作用增强, 从而cccDNA结合的组蛋白很快地去乙酰化. HBx通过影响组蛋白的乙酰化作用影响cccDNA转录为pgRNA过程影响HBV复制. 并且, 本实验室前期研究[18]表明, HBx在影响组蛋白乙酰化作用的同时, 也影响其甲基化和磷酸化作用, 从而影响HBV复制水平.
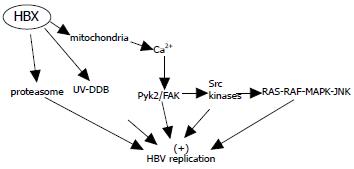
最近的研究证实[19]在HBx表达缺失的细胞中, HBV的复制水平的降低可以被钙激活剂(优降糖)作用所弥补. 但在野生型的HBV复制中, 并未起到任何作用, 而优降糖恰恰可以增加胞质中钙水平. 多个研究中心已经通过不同作用机制的钙通道拮抗剂证实HBx部分通过作用于电压依赖阴离子通道(voltage-dependent anion channel, VDAC3)线粒体转变孔, 影响线粒体结构, 引起膜的去极化, 从而促进胞内钙蓄积的释放, 提高胞质中钙的水平, 进一步增强HBV复制[20-22]. HBx通过钙通路调节HBV复制的作用可能是通过调节胞质离子稳态从而创造一个增强多种胞质信号转导通路活性的环境来实现的, 如富含脯氨酸的非受体酪氨酸激酶/粘着斑激酶(Proline-rich tyrosine kinase 2/Focal adhesion kinase, Pyk2/FAK)通路、Src激酶通路、RAS-RAF-MAPK-JNK通路. 且这种影响作用涉及了转录、DNA复制及pgRNA的壳体化(图1).
1.3.1 Pyk2/FAK途径: Pyk2以及与之具有一定同源性的FAK, 构成了细胞质的非受体酪氨酸激酶家族. 已有研究证实HBx通过增强Pyk2和FAK的作用影响了HBV的复制[23]. Pyk2/FAK通路影响HBV复制的机制是多方面的: 一方面通过直接影响信号转导和转录激活因子通路(just another kinase/signal transducers and activators of transcription, JAK/STAT)影响cccDNA转录从而影响HBV复制; 另一方面通过影响Src激酶或是进一步影响RAS-RAF-MAPK-JNK途径影响HBV复制.
1.3.2 Src激酶途径: Src激酶家族是具有酪氨酸激酶活性的蛋白质, 作为连接许多细胞外和细胞内重要信号途径的膜结合开关分子, Src激酶在受体介导的信号传递及细胞间通讯中具中心调节作用.
已有研究证实[24], HBx可以激活Src激酶, 而这种激活作用对于HBx的很多作用是必需的, 包括诱导细胞增殖、激活转录因子和刺激HBV DNA的复制. 在Src激酶影响HBV复制的机制也是多方面的: 其一, Src激酶信号转导通路的激活, 激活细胞周期蛋白A及细胞周期依赖蛋白激酶2(cyclin A-cyclin dependent kinase 2, CDK2)的活性, 促使细胞从G1早期进入S期节点[16]; 其二, 最近研究[23]证实了阻断酪氨酸激酶的活性, 抑制了HBV的复制, 而细胞中核心颗粒与聚合酶本身水平并未减少, 由此可以推断, HBx通过Src激酶介导的信号转导通路影响胞质中聚合酶的活性水平, 影响HBV的复制; 其三, Src激酶通过进一步影响RAS-RAF-MAPK-JNK途径影响HBV复制[24]. 另外, 核心蛋白的磷酸化与HBV DNA合成相关, 而磷酸化过程是否需要Src激酶也引起了科研工作者的关注[25].
1.3.3 RAS-RAF-MAPK-JNK途径: HBx通过调节胞质钙水平激活Pyk2/FAK和Src激酶活性, 同时在多种细胞因子的刺激下通过Pyk2/FAK激酶N末端自身磷酸化位点的磷酸化作用形成1个与Src激酶相结合的SH2区域, 两者的结合进一步激活Pyk2或FAK激酶活性. 磷酸化作用和增强的Pyk2或FAK活性, 募集其他的信号蛋白, 如Shc、生长受体结合蛋白2(growth receptor bound protein 2, Grb2)等, 最终激活RAS-RAF-MAPK-JNK级联反应[21,23]. 其中RAS通过增强细胞周期蛋白A作用使细胞进入G1期, 从而增强HBV复制[12]; 另一方面, 此途径通过激活转录因子活化蛋白AP-1增强依赖于RNA聚合酶Ⅰ和Ⅲ的cccDNA转录, 从而增强HBV复制; 最后JNK也可以使细胞从G0期进入G1期, 从而影响HBV复制[23,26,27].
HBx已被证实[28-30]与20S蛋白酶体复合物的a亚单位PSMA7、19S调节因子亚单位PSMC1有相互作用. 而且最近研究表明[31]蛋白酶体特异抑制物可以恢复HBx缺失突变体造成的病毒复制的减少, 但并未影响野生型病毒, 提示HBx在蛋白酶体途径对病毒复制的作用中可能扮演了蛋白酶体抑制物的角色,而且是在翻译后水平和装配阶段起作用. 在装配阶段, HBx可能通过抑制蛋白酶体阻碍了核衣壳的降解, 以此作为促进病毒复制和阻碍细胞抗病毒作用的机制[32]. 也有研究证实[33]HBx通过与Skp2 F box的直接作用阻碍泛素蛋白和c-Myc降解, 从而为病毒复制创造一个更优的环境, 并且使其逃逸宿主免疫反应.
HBx与P53的相互作用在HCC发生发展中起了至关重要的作用[3], 而P53作为可以结合HBV增强子并且抑制其活性的作用蛋白, 抑制了HBV复制, 而这种结合后的抑制作用可以被HBx表达所释放[34-38]. 因为, Wang等[34]证实HBx影响P53与DNA的序列特异性结合, 从而使P53在胞质中的抑制HBV增强子的作用消失,增强HBV复制.
损伤DNA结合蛋白1(damage-specific DNA binding protein 1, DDB1)作为一个多功能蛋白, 参与DNA损伤修复、HBV转录激活以及与cul4A基础遍在蛋白连接酶的作用[39,40]. Tang等[41]通过RNA干扰DDB1表达的实验证明DDB1的缺失使得HBV复制受到一定程度的影响, 而DDB1对HBV复制的作用正是通过与HBx结合实现的[42]. 最新研究表明[43]DDB1与HBx蛋白主要结合位点位于96位精氨酸、98位亮氨酸、99位甘氨酸. 而这种结合已经被证实阻碍蛋白酶体介导的HBx蛋白降解, 增加其稳定性, 从而增强HBV复制[44,45].
HBx作为一个多功能蛋白, 在胞核和胞质中均存在, 这种双重定位与其多元活性是一致的, 在病毒复制时HBx的定位不仅依赖于HBx的浓度, 而且取决于胞核及胞质中细胞伴侣的活性. Cha等[46]的研究表明细胞质和细胞核中的HBx都参与了HBV的复制. 但Keasler等[47,48]在最新的研究中, 使用质粒转染HepG2细胞以及注射感染小鼠的方法证实胞核定位的HBx对HBV的复制产生了重要影响, 而且在HBx缺失型突变体存在的细胞中, 携带胞核定位HBx质粒的转染及转入, 使HBx蛋白在一个低于免疫沉淀法(immunoprecipitate, IP)/Western blot可检测出的水平就可以弥补HBx缺失的HBV病毒复制, 但胞质定位的HBx并未弥补HBx缺失的HBV复制.
这种胞核定位HBx影响HBV复制的机制可能是通过HBx与胞核相互作用元件的相互作用实现的, 这些相互作用包括通过与HBV增强子和DNA结合位点相互作用影响转录来增加HBVmRNA水平[13,39,47]、与环化腺核苷一磷酸反应结合蛋白(cAMP-response element binding protein, CREB)的亮氨酸拉链区域的相互作用[10], 以及与DDB1的结合[39]. 但HBx也通过多种胞质信号转导途径影响HBV复制, 如RAS-RAF-MAPK-JNK途径, 并且这种作用最终都是通过线粒体钙的释放调节细胞质环境影响的[6]. 为什么在Keasler的实验中胞核外HBx质粒的转染及转入小鼠没有弥补HBx缺失的HBV复制, 这可能是因为胞质中HBx需要转移到胞核发挥作用.
HBV感染过程中需要HBV基因组整合到宿主基因组中, 而HBV DBA的整合位点恰好位于HBx基因区, 在整合过程中, 为了更好地适应宿主的免疫反应, 逃逸宿主免疫反应清除, 整合基因组上的HBx常常发生断裂不全, 这种断裂的HBx基因连接在细胞DNA上, 转录成融合的蛋白, 这种蛋白即为HBx蛋白截短体.
近年来, 不同的研究者团体通过对不同地区慢性肝病不同阶段患者的血清和组织中发现了不同长度核苷酸的缺失, 从而造成了氨基酸的缺失. 如Hsia等[49]和Tu等[50]的科研团队均发现了C-端截短20个氨基酸的HBx截短体, 张玉霞等[51]发现了C-端缺失35个氨基酸的HBx截短体, 而张航等发现了只有前面127个氨基酸的HBx C-端截短体[52].
HBx114aa-154aa区域不仅处于HBx的反式激活域, 而且包含HBV的基本核心启动子BCP、DRⅡ, 并且是与抑癌基因p53结合的主要位点. HBx反式激活作用是HBV复制所需要的, 他可反式激活HBV本身的调节序列, 如核心启动子、增强子I等, 从而启动pgRNA转录, 增强HBV的复制和表达. 因此C-端缺失不同长度HBx C-端截短体必定对HBV复制产生不同程度的影响.
在HBV基因组中, 核心启动子有重要作用, 他介导前核心mRNA和前基因mRNA的转录. CP区无TATA盒(TATA box), 但含有4个TA富含区(TA1-TA4), 分别位于nt1752-1755、nt1758-1762、nt177l-1775、nt1789-1795. TA1-TA3决定前核心mRNA转录起始, 而TA4决定前基因组mRNA的转录起始. 国外学者[53]新近通过体外细胞转染结果表明, CP区8 bp(nt1768-1775)缺失株可使前核心mRNA及前基因组mRNA转录均下调, 从而使病毒蛋白合成量明显减少, 病毒复制水平显著降低. 国内实验[54]也通过体外细胞转染结果表明CP区20/21 bp(nt1748/1747-nt1767) 缺失变异, 使TA1-TA2全部序列缺失, 启动子活性显著低于无缺失的启动子活性.
DRⅡ位于HBx C-端3-10区域, 其为HBV复制所必需, 10个氨基酸缺失可能致HBx的DNA复制下降. 刘晓红等[55]研究表明C-端缺失10个氨基酸的截短体, 会明显使细胞出现G0/G1期阻滞, S期比例下降, 而G0/G1期细胞中因为dNTPs相对低下, HBV的复制是不活跃的, 细胞经历G0期进入G1期后dNTPs显著增加, HBV复制也大大增强. 同样, C-端缺失30个氨基酸的截短体对细胞周期产生了相似的影响, 因此阻碍了HBV的复制. 而C-端缺失20和40个氨基酸的截短体, 恰恰产生了相反的作用, 其具体机制尚待进一步研究. HBx的C-端同样包括了P53结合的主要位点(aa102-136)[36], 因此此段的缺失, 使得HBx不能与P53结合, 那么P53就与HBV增强子结合, 从而抑制HBV增强子活性, 使HBV复制能力减弱.
HBx的C-端aa58-119对活化MAPK信号传导通路是必需的[26]. 因此此段的缺失, 必将会使HBx参与的多种胞质信号转导通路受到影响, 从而影响HBV复制.
尽管目前已有如此广泛深入的研究, HBx在HBV复制以及HCC发生发展中的确切作用仍然值得探讨. 多数研究表明, 即使HBx在HBV复制中不是必需的, 他对HBV复制起到举足轻重的作用, 在胞质中通过多种依赖钙通道的信号转导通路, 胞核中通过与转录因子直接作用, 以及直接或间接影响细胞周期影响了HBV的复制. 同时, 在HBV整合到宿主基因的过程中, HBx常常发生突变, 随着研究的深入, 越来越多的HBx自然截短体被发现, 并且证实在HBV复制及HCC发生发展过程中发挥不同的作用. 但目前的研究仅仅是HBx这个多功能蛋白作用的冰山一角, 对其作用的更深认识必将对乙型肝炎抗病毒治疗及预防进展为原发性肝癌带来新的曙光.
据统计, 目前世界上已有超过5亿人感染HBV, 每年有1百万人死于乙肝相关疾病. HBx蛋白作为HBV的一个多功能调节蛋白, 在肝细胞癌(hepatocellular carcinoma, HCC)的发生过程中起了重要作用, 并且发现HBx蛋白与其截短体在HBV复制中也起到一定作用.
吴君, 主任医师, 贵阳医学院附属医院感染科
HBx通过诸多胞质信号转导通路影响HBV复制, 具体通过哪些通路及相应的作用机制是目前研究的重点和热点. 同样, 不同的研究者对细胞核内外定位的HBx对HBV复制产生的作用提出了不同的观点, 所以对其作用的具体机制值得进一步研究证实.
Keasler等在最新的研究中, 使用质粒转染HepG2细胞以及注射感染小鼠的方法, 证实了胞核定位的HBx对HBV的复制产生了重要影响, 但胞质定位的HBx并未弥补HBx缺失的HBV复制.
本文将HBx影响HBV复制目前研究表明的机制作了综述, 从胞质信号转导通路、各胞核相互作用元件分别作了叙述, 并对目前发现HBx截短体对HBV复制的影响及影响机制作了叙述.
本文可以让读者更直观系统地了解HBx及其截短体在HBV复制中的作用及作用机制. 在未来的抗病毒治疗中, 可以研发针对HBx影响HBV复制的胞质信号转导通路以及胞核相互作用元件的药物.
文中将近10年来国内外对"HBx及其截短体在HBV复制中的作用"方面的研究进展进行综述, 有一定的新颖性、学术价值.
编辑: 张姗姗 电编:何基才
| 1. | Neuveut C, Wei Y, Buendia MA. Mechanisms of HBV-related hepatocarcinogenesis. J Hepatol. 2010;52:594-604. [PubMed] [DOI] |
| 2. | Fung J, Lai CL, Yuen MF. Hepatitis B and C virus-related carcinogenesis. Clin Microbiol Infect. 2009;15:964-970. [PubMed] [DOI] |
| 3. | Chung TW, Lee YC, Ko JH, Kim CH. Hepatitis B Virus X protein modulates the expression of PTEN by inhibiting the function of p53, a transcriptional activator in liver cells. Cancer Res. 2003;63:3453-3458. [PubMed] |
| 4. | Peng Z, Zhang Y, Gu W, Wang Z, Li D, Zhang F, Qiu G, Xie K. Integration of the hepatitis B virus X fragment in hepatocellular carcinoma and its effects on the expression of multiple molecules: a key to the cell cycle and apoptosis. Int J Oncol. 2005;26:467-473. [PubMed] |
| 5. | Koike K. Hepatocarcinogenesis in hepatitis viral infection: lessons from transgenic mouse studies. J Gastroenterol. 2002;37 Suppl 13:55-64. [PubMed] [DOI] |
| 6. | Bouchard MJ, Schneider RJ. The enigmatic X gene of hepatitis B virus. J Virol. 2004;78:12725-12734. [PubMed] [DOI] |
| 7. | Malmassari S, Lone YC, Zhang M, Transy C, Michel ML. In vivo hierarchy of immunodominant and subdominant HLA-A*0201-restricted T-cell epitopes of HBx antigen of hepatitis B virus. Microbes Infect. 2005;7:626-634. [PubMed] [DOI] |
| 8. | Hwang YK, Kim NK, Park JM, Lee K, Han WK, Kim HI, Cheong HS. HLA-A2 1 restricted peptides from the HBx antigen induce specific CTL responses in vitro and in vivo. Vaccine. 2002;20:3770-3777. [PubMed] [DOI] |
| 9. | Chun E, Lee J, Cheong HS, Lee KY. Tumor eradication by hepatitis B virus X antigen-specific CD8+ T cells in xenografted nude mice. J Immunol. 2003;170:1183-1190. [PubMed] |
| 10. | Cougot D, Wu Y, Cairo S, Caramel J, Renard CA, Lévy L, Buendia MA, Neuveut C. The hepatitis B virus X protein functionally interacts with CREB-binding protein/p300 in the regulation of CREB-mediated transcription. J Biol Chem. 2007;282:4277-4287. [PubMed] [DOI] |
| 11. | Tang H, Oishi N, Kaneko S, Murakami S. Molecular functions and biological roles of hepatitis B virus x protein. Cancer Sci. 2006;97:977-983. [PubMed] [DOI] |
| 12. | Doria M, Klein N, Lucito R, Schneider RJ. The hepatitis B virus HBx protein is a dual specificity cytoplasmic activator of Ras and nuclear activator of transcription factors. EMBO J. 1995;14:4747-4757. [PubMed] |
| 13. | Tang H, Delgermaa L, Huang F, Oishi N, Liu L, He F, Zhao L, Murakami S. The transcriptional transactivation function of HBx protein is important for its augmentation role in hepatitis B virus replication. J Virol. 2005;79:5548-5556. [PubMed] [DOI] |
| 14. | Gearhart TL, Bouchard MJ. The hepatitis B virus X protein modulates hepatocyte proliferation pathways to stimulate viral replication. J Virol. 2010;84:2675-2686. [PubMed] [DOI] |
| 15. | Chin R, Earnest-Silveira L, Koeberlein B, Franz S, Zentgraf H, Dong X, Gowans E, Bock CT, Torresi J. Modulation of MAPK pathways and cell cycle by replicating hepatitis B virus: factors contributing to hepatocarcinogenesis. J Hepatol. 2007;47:325-337. [PubMed] [DOI] |
| 16. | Bouchard M, Giannakopoulos S, Wang EH, Tanese N, Schneider RJ. Hepatitis B virus HBx protein activation of cyclin A-cyclin-dependent kinase 2 complexes and G1 transit via a Src kinase pathway. J Virol. 2001;75:4247-4257. [PubMed] [DOI] |
| 17. | Belloni L, Pollicino T, De Nicola F, Guerrieri F, Raffa G, Fanciulli M, Raimondo G, Levrero M. Nuclear HBx binds the HBV minichromosome and modifies the epigenetic regulation of cccDNA function. Proc Natl Acad Sci U S A. 2009;106:19975-19979. [PubMed] |
| 18. | Gong Q, Chen S, Guo J, Sun H, Zheng G, Liu Q, Ren H, He S. Chromosome remodeling related to hepatitis B virus replication in HepG2 cells. DNA Cell Biol. 2011;30:347-354. [PubMed] [DOI] |
| 19. | Bouchard MJ, Wang LH, Schneider RJ. Calcium signaling by HBx protein in hepatitis B virus DNA replication. Science. 2001;294:2376-2378. [PubMed] [DOI] |
| 20. | Kim S, Kim HY, Lee S, Kim SW, Sohn S, Kim K, Cho H. Hepatitis B virus x protein induces perinuclear mitochondrial clustering in microtubule- and Dynein-dependent manners. J Virol. 2007;81:1714-1726. [PubMed] [DOI] |
| 21. | McClain SL, Clippinger AJ, Lizzano R, Bouchard MJ. Hepatitis B virus replication is associated with an HBx-dependent mitochondrion-regulated increase in cytosolic calcium levels. J Virol. 2007;81:12061-12065. [PubMed] [DOI] |
| 22. | Clippinger AJ, Bouchard MJ. Hepatitis B virus HBx protein localizes to mitochondria in primary rat hepatocytes and modulates mitochondrial membrane potential. J Virol. 2008;82:6798-6811. [PubMed] [DOI] |
| 23. | Bouchard MJ, Wang L, Schneider RJ. Activation of focal adhesion kinase by hepatitis B virus HBx protein: Multiple functions in viral replication. J Virol. 2006;80:4406-4414. [PubMed] [DOI] |
| 24. | Klein NP, Bouchard MJ, Wang LH, Kobarg C, Schneider RJ. Src kinases involved in hepatitis B virus replication. EMBO J. 1999;18:5019-5027. [PubMed] [DOI] |
| 25. | Melegari M, Wolf SK, Schneider RJ. Hepatitis B virus DNA replication is coordinated by core protein serine phosphorylation and HBx expression. J Virol. 2005;79:9810-9820. [PubMed] [DOI] |
| 26. | Nijhara R, Jana SS, Goswami SK, Rana A, Majumdar SS, Kumar V, Sarkar DP. Sustained activation of mitogen-activated protein kinases and activator protein 1 by the hepatitis B virus X protein in mouse hepatocytes in vivo. J Virol. 2001;75:10348-10358. [PubMed] [DOI] |
| 27. | Johnson SA, Mandavia N, Wang HD, Johnson DL. Transcriptional regulation of the TATA-binding protein by Ras cellular signaling. Mol Cell Biol. 2000;20:5000-5009. [PubMed] [DOI] |
| 28. | Hu Z, Zhang Z, Doo E, Coux O, Goldberg AL, Liang TJ. Hepatitis B virus X protein is both a substrate and a potential inhibitor of the proteasome complex. J Virol. 1999;73:7231-7240. [PubMed] |
| 29. | Sirma H, Weil R, Rosmorduc O, Urban S, Israël A, Kremsdorf D, Bréchot C. Cytosol is the prime compartment of hepatitis B virus X protein where it colocalizes with the proteasome. Oncogene. 1998;16:2051-2063. [PubMed] [DOI] |
| 30. | Zhang Z, Torii N, Furusaka A, Malayaman N, Hu Z, Liang TJ. Structural and functional characterization of interaction between hepatitis B virus X protein and the proteasome complex. J Biol Chem. 2000;275:15157-15165. [PubMed] [DOI] |
| 31. | Zhang Z, Protzer U, Hu Z, Jacob J, Liang TJ. Inhibition of cellular proteasome activities enhances hepadnavirus replication in an HBX-dependent manner. J Virol. 2004;78:4566-4572. [PubMed] [DOI] |
| 32. | Ling MT, Chiu YT, Lee TK, Leung SC, Fung MK, Wang X, Wong KF, Wong YC. Id-1 induces proteasome-dependent degradation of the HBX protein. J Mol Biol. 2008;382:34-43. [PubMed] [DOI] |
| 33. | Kalra N, Kumar V. The X protein of hepatitis B virus binds to the F box protein Skp2 and inhibits the ubiquitination and proteasomal degradation of c-Myc. FEBS Lett. 2006;580:431-436. [PubMed] [DOI] |
| 34. | Wang XW, Forrester K, Yeh H, Feitelson MA, Gu JR, Harris CC. Hepatitis B virus X protein inhibits p53 sequence-specific DNA binding, transcriptional activity, and association with transcription factor ERCC3. Proc Natl Acad Sci U S A. 1994;91:2230-2234. [PubMed] [DOI] |
| 35. | Doitsh G, Shaul Y. HBV transcription repression in response to genotoxic stress is p53-dependent and abrogated by pX. Oncogene. 1999;18:7506-7513. [PubMed] [DOI] |
| 36. | Ori A, Zauberman A, Doitsh G, Paran N, Oren M, Shaul Y. p53 binds and represses the HBV enhancer: an adjacent enhancer element can reverse the transcription effect of p53. EMBO J. 1998;17:544-553. [PubMed] [DOI] |
| 37. | Park SG, Min JY, Chung C, Hsieh A, Jung G. Tumor suppressor protein p53 induces degradation of the oncogenic protein HBx. Cancer Lett. 2009;282:229-237. [PubMed] [DOI] |
| 38. | Elmore LW, Hancock AR, Chang SF, Wang XW, Chang S, Callahan CP, Geller DA, Will H, Harris CC. Hepatitis B virus X protein and p53 tumor suppressor interactions in the modulation of apoptosis. Proc Natl Acad Sci U S A. 1997;94:14707-14712. [PubMed] [DOI] |
| 39. | Leupin O, Bontron S, Schaeffer C, Strubin M. Hepatitis B virus X protein stimulates viral genome replication via a DDB1-dependent pathway distinct from that leading to cell death. J Virol. 2005;79:4238-4245. [PubMed] [DOI] |
| 40. | Rui E, Moura PR, Gonçalves KA, Rooney RJ, Kobarg J. Interaction of the hepatitis B virus protein HBx with the human transcription regulatory protein p120E4F in vitro. Virus Res. 2006;115:31-42. [PubMed] [DOI] |
| 41. | Tang KF, Xie J, Chen M, Liu Q, Zhou XY, Zeng W, Huang AL, Zuo GQ, Wang Y, Xiang R. Knockdown of damage-specific DNA binding protein 1 (DDB1) enhances the HBx-siRNA-mediated inhibition of HBV replication. Biologicals. 2008;36:177-183. [PubMed] [DOI] |
| 42. | Scrima A, Konícková R, Czyzewski BK, Kawasaki Y, Jeffrey PD, Groisman R, Nakatani Y, Iwai S, Pavletich NP, Thomä NH. Structural basis of UV DNA-damage recognition by the DDB1-DDB2 complex. Cell. 2008;135:1213-1223. [PubMed] [DOI] |
| 43. | Li T, Robert EI, van Breugel PC, Strubin M, Zheng N. A promiscuous alpha-helical motif anchors viral hijackers and substrate receptors to the CUL4-DDB1 ubiquitin ligase machinery. Nat Struct Mol Biol. 2010;17:105-111. [PubMed] [DOI] |
| 44. | Kim JH, Sohn SY, Benedict Yen TS, Ahn BY. Ubiquitin-dependent and -independent proteasomal degradation of hepatitis B virus X protein. Biochem Biophys Res Commun. 2008;366:1036-1042. [PubMed] [DOI] |
| 45. | Bergametti F, Sitterlin D, Transy C. Turnover of hepatitis B virus X protein is regulated by damaged DNA-binding complex. J Virol. 2002;76:6495-6501. [PubMed] [DOI] |
| 46. | Cha MY, Ryu DK, Jung HS, Chang HE, Ryu WS. Stimulation of hepatitis B virus genome replication by HBx is linked to both nuclear and cytoplasmic HBx expression. J Gen Virol. 2009;90:978-986. [PubMed] [DOI] |
| 47. | Keasler VV, Hodgson AJ, Madden CR, Slagle BL. Enhancement of hepatitis B virus replication by the regulatory X protein in vitro and in vivo. J Virol. 2007;81:2656-2662. [PubMed] [DOI] |
| 48. | Keasler VV, Hodgson AJ, Madden CR, Slagle BL. Hepatitis B virus HBx protein localized to the nucleus restores HBx-deficient virus replication in HepG2 cells and in vivo in hydrodynamically-injected mice. Virology. 2009;390:122-129. [PubMed] [DOI] |
| 49. | Hsia CC, Nakashima Y, Tabor E. Deletion mutants of the hepatitis B virus X gene in human hepatocellular carcinoma. Biochem Biophys Res Commun. 1997;241:726-729. [PubMed] [DOI] |
| 50. | Tu H, Bonura C, Giannini C, Mouly H, Soussan P, Kew M, Paterlini-Bréchot P, Bréchot C, Kremsdorf D. Biological impact of natural COOH-terminal deletions of hepatitis B virus X protein in hepatocellular carcinoma tissues. Cancer Res. 2001;61:7803-7810. [PubMed] |
| 52. | Zhang H, Shan CL, Li N, Zhang X, Zhang XZ, Xu FQ, Zhang S, Qiu LY, Ye LH, Zhang XD. Identification of a natural mutant of HBV X protein truncated 27 amino acids at the COOH terminal and its effect on liver cell proliferation. Acta Pharmacol Sin. 2008;29:473-480. [PubMed] [DOI] |
| 53. | Kohno K, Nishizono A, Terao H, Hiraga M, Mifune K. Reduced transcription and progeny virus production of hepatitis B virus containing an 8-bp deletion in basic core promoter. J Med Virol. 2000;61:15-22. [PubMed] [DOI] |
| 54. | 彭 劫, 骆 抗先, 郭 亚兵, 侯 金林, 陈 金军. 乙肝病毒核心启动子部分缺失对其活性及X蛋白转式激活作用的影响. 中华微生物学和免疫学杂志. 2002;22:266-268. |
| 56. | Benhenda S, Cougot D, Buendia MA, Neuveut C. Hepatitis B virus X protein molecular functions and its role in virus life cycle and pathogenesis. Adv Cancer Res. 2009;103:75-109. [PubMed] [DOI] |