修回日期: 2011-03-02
接受日期: 2011-03-08
在线出版日期: 2011-03-28
目的: 探讨环氧合酶-2(COX-2)和15-羟基前列腺素脱氢酶(15-PGDH)在结直肠息肉组织中的表达及在息肉恶变中的作用.
方法: 选取2009-02/2009-10肠镜下摘除的结直腺瘤性息肉48例及增生性息肉25例, 活检或外科手术的结直肠腺癌15例及正常结肠黏膜15例作为对照. 采用RT-PCR和Western blot分别检测各组织中COX-2、15-PGDH mRNA和蛋白的表达.
结果: COX-2 mRNA和蛋白的相对表达量在正常黏膜、增生性息肉、腺瘤性息肉和腺癌组中逐渐增加, 在腺癌组中表达量最多(429.184±45.721 vs 9.859±1.151, 83.387±15.957, 155.732±28.395; 0.772±1.054 vs 0.138±0.025, 0.557±0.131, 0.509±0.087, 均P<0.05), COX-2蛋白在腺瘤组与增生性息肉组之间比较无差异, 余各组之间差异比较均有统计学意义. 15-PGDH mRNA和蛋白相对表达量在正常黏膜、增生性息肉、腺瘤性息肉及腺癌组中表达逐渐降低(5.234±0.358 vs 918.260±82.116, 125.380±28.713, 12.036±3.509; 0.186±0.058 vs 0.762±0.165, 0.443±0.085, 0.202±0.042, 均P<0.05), 在腺瘤组和腺癌组中均可见到表达缺失, 腺瘤组与腺癌组之间比较无差异, 余各组之间比较差异均有统计学意义.
结论: COX-2表达的升高和15-PGDH表达的降低或缺失可共同作用于结肠癌发生和发展中, 二者可能具有协同致癌的作用.
引文著录: 方兴国, 赵逵, 杨芳, 周元昆, 王红. COX-2、15-PGDH在结直息肉组织中的表达及其作用. 世界华人消化杂志 2011; 19(9): 972-975
Revised: March 2, 2011
Accepted: March 8, 2011
Published online: March 28, 2011
AIM: To investigate the role of cyclooxygenase (COX)-2 and 15-hydroxyprostaglandin dehydrogenase (15-PGDH) expression in colorectal tumorigenesis.
METHODS: Dissected samples of colorectal polyps from 48 consecutive patients with adenomatous polyps and 25 patients with hyperplastic polyps, who underwent colonoscopy at our hospital from February 2009 to October 2009, were used in this study. Carcinomatous tissue samples surgically dissected from 15 patients with colorectal adenocarcinoma and 15 endoscopically taken normal colorectal mucosal samples were used as controls. The protein and mRNA expression of COX-2 and 15-PGDH was analyzed by RT-PCR and Western blot, respectively.
RESULTS: Colorectal adenocarcinoma showed the highest expression level of COX-2 mRNA and protein, followed by adenomatous polyps, hyperplastic polyps, and normal mucosa (429.184 ± 45.721 vs 9.859 ± 1.151, 83.387 ± 15.957, 155.732 ± 28.395; 0.772 ± 1.054 vs 0.138 ± 0.025, 0.557 ± 0.131, 0.509 ± 0.087, all P < 0.05). There was no significant difference in COX-2 protein expression level between adenomatous polyps and hyperplastic polyps though significant differences were noted among normal mucosa, polyps, and carcinoma. Normal colorectal mucosa showed the highest expression level of 15-PGDH mRNA and protein, followed by hyperplastic polyps, adenomatous polyps and adenocarcinoma (5.234 ± 0.358 vs 918.260 ± 82.116, 125.380 ± 28.713, 12.036 ± 3.509; 0.186 ± 0.058 vs 0.762 ± 0.165, 0.443 ± 0.085, 0.202 ± 0.042, all P < 0.05). The absence of 15-PGDH protein expression was found in both adenocarcinoma and adenomatous polyps. There was no significant difference in 15-PGDH protein expression level between adenomatous polyps and adenocarcinoma though significant differences were noted in 15-PGDH protein expression levels among normal mucosa, hyperplastic polyps, and carcinoma.
CONCLUSION: Increased COX-2 expression and decreased 15-PGDH expression may be involved in colorectal carcinogenesis.
- Citation: Fang XG, Zhao K, Yang F, Zhou YK, Wang H. Role of COX-2 and 15-PGDH expression in colorectal tumorigenesis. Shijie Huaren Xiaohua Zazhi 2011; 19(9): 972-975
- URL: https://www.wjgnet.com/1009-3079/full/v19/i9/972.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i9.972
结直肠癌是影响人类健康的最常见恶性肿瘤之一, 近年来随着人们生活方式和生活习惯的改变, 其发病率在不断上升. 研究已证实超过80%以上的结直肠癌是由息肉恶变而来, 使得结肠息肉(尤其是腺瘤性息肉)被公认是结肠癌的癌前病变. 研究发现, 环氧合酶-2(cyclooxygenase-2, COX-2)表达的升高及15-羟基前列腺素脱氢酶(15-hydroxyprostaglandin dehydrogenase, 15-PGDH)表达的降低或缺失与多种癌症的发生、发展密切相关[1-6]. 但他们在结直肠息肉中的表达如何以及对息肉恶变的影响目前研究较少. 本实验采用RT-PCR和Western blot法分别对结直肠腺瘤性息肉、增生性息肉、结直肠腺癌及正常结肠黏膜组织中COX-2、15-PGDH mRNA和蛋白质的表达进行检测, 以探讨二者在结直肠息肉组织中的作用关系及对息肉恶变的影响.
选取2009-02/2009-10在遵义医学院肠镜检查或外科手术并经病理确诊的结直肠腺瘤性息肉48例, 男25例, 女23例, 平均为46岁±2岁; 结直肠增生性息肉25例, 男13例, 女12例, 平均为42岁±3岁; 结直肠腺癌15例, 男7例, 女8例, 平均为50岁±5岁; 正常肠黏膜组织15例, 男9例, 女6例, 平均为40岁±2岁. 所选的所有病例近半年来无长期服用非甾体抗炎药, 无严重的炎症性疾病及其他肿瘤病史. 将留取部分各组织标本放入福尔马林中送病理以确定组织学类型, 余下组织剪成大小约0.2 cm×0.2 cm×0.5 cm组织块, 用生理盐水反复冲洗数次去除粪质和血液残留物, 装入EP管标记后转入液氮罐中保存备用.
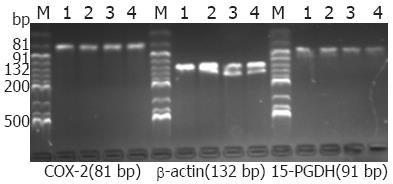
1.2.1 COX-2、15-PGDH mRNA表达的检测: 用TRIzol(Invitrogen公司)提取各组织中的总RNA, 紫外分光光度计法定量RNA. 按逆转录试剂盒(宝生物工程有限公司)说明合成cDNA, 逆转录反应: 37 ℃反应15 min, 逆转录酶的失活反应: 85 ℃反应5 s. 根据基因设计要求从GenBank查出相关引物碱基序列(由大连宝生物工程公司合成): COX-2(81 bp): 上游引物5'CTGGAACATGGAATTACCCAGTTTG3', 下游引物5'TGGAACATTCCTACCACCAGCA3'; 15-PGDH(91 bp): 上游引物5'AAGCATGGCATAGTTGGATTCACA3', 下游引物5'AGCCTGGACAAATGGCATTCA3'; β-actin(132 bp): 上游引物5'TGGCACCCAGCACAATGAA3', 下游引物5'CTAAGTCATAGTCCGCCTAGAAGCA3'. PCR反应条件: 95 ℃预变性10 s, 1个循环, PCR反应95 ℃ 5 s, 58.5 ℃ 20 s, 40个循环, 融解曲线55 ℃, 80个循环. PCR产物的定性: 取PCR产物2 μL置2.5%琼脂糖凝胶电泳, 用全自动凝胶成像分析系统(美国SYGENE公司)进行拍照, 以15-PGDH/β-actin比值×100分别表示COX-2、15-PGDH mRNA相对表达量.
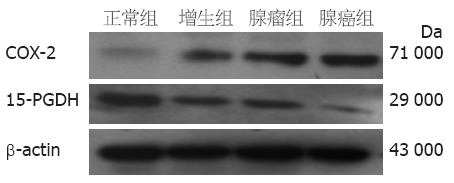
1.2.2 COX-2、15-PGDH蛋白的表达检测: 从液氮罐中取出各组织剪碎后, 加入细胞裂解液裂解匀浆使其充分裂解(操作在冰上进行); 4 ℃ 12 000 r/min离心15 min, 将上清液转移至新管; BCA(上海捷瑞生物工程有限公司)法测定蛋白含量. 以40 μg蛋白质上样, 常规进行SDS-PAGE电泳后转印至PVDF膜, 用5%的脱脂奶粉(用PBS-T配置)封闭; 山羊抗人COX-2多克隆抗体(按1∶200稀释)(Santa Cruz公司), 兔抗人15-PGDH多克隆抗体(1∶500)(Cayman公司), 小鼠抗人β-actin抗体(1∶1 000)(Santa Cruz公司)作为一抗; 兔抗山羊、山羊抗兔IgG (H+L)(均为1∶500)和山羊抗小鼠(1∶2 000)(均为中杉金桥公司)作为二抗. ECL发光, X线胶片感光, 自动洗片机洗片; 用全自动凝胶成像分析系统扫描Western blot胶片并测定各组蛋白电泳带积分吸光度值, 以COX-2/β-actin、15-PGDH/β-actin比值分别表示COX-2、15-PGDH蛋白相对表达量.
统计学处理 实验完全按照随机原则设计, 各数据以mean±SD表示, 采用单因素方差进行分析, P<0.05为有统计学意义.
COX-2 mRNA在正常结直肠黏膜、增生性息肉、腺瘤性息肉及结直肠腺癌中从低表达逐渐增加, 在腺癌组织中表达最高. 统计显示, 各组之间比较均有统计学意义(P<0.05, 表1). 而15-PGDH mRNA在正常结直肠黏膜、增生性息肉、腺瘤息肉及结直肠腺癌中从高表达逐渐降低, 在腺癌组织中呈低表达. 结直肠腺瘤组与结直肠腺癌组之间比较, 无统计学意义(P = 0.151), 余各组之间比较均有统计学意义(P<0.05, 表1). 在实验中见各组标本的荧光定量扩增曲线呈典型的S型, 熔解曲线为单峰, 产物凝胶电泳图在对应位置处见特异性产物条带(图1).
COX-2蛋白在正常结直肠黏膜、增生性息肉、腺瘤性息肉及结直肠腺癌中从弱表达或不表达也逐渐增加. 结直肠腺瘤组与增生性息肉组之间比较, 无统计学意义(P = 0.058), 余各组之间比较均有统计学意义(P<0.05, 表1, 图2). 而15-PGDH蛋白在正常结直肠黏膜、增生性息肉、腺瘤息肉及结直肠腺癌中从高表达逐渐降低, 在腺瘤组织和腺癌组织中都可见到表达缺失. 结直肠腺瘤组与结直肠腺癌组之间比较, 无统计学意义(P = 0.255), 余两组之间比较均有统计学意义(P<0.05, 表1, 图2).
环氧合酶是催化花生四烯酸转变为前列腺素的限速酶, 可分为COX-1和COX-2两个亚型. COX-1在机体内以固有形式表达, 对维持组织恒定中起重要的作用, 然而COX-2作为一种诱导酶, 在正常组织中仅微量表达或不表达, 但在炎症、肿瘤等因子刺激下可使其表达上调. 我们以前通过免疫组织化学染色研究显示, COX-2在腺瘤性息肉及结肠癌中均呈高表达, 在腺瘤中的的表达还跟组织分化程度相关[5,6]. Wasilewicz等[7]通过对结肠息肉研究中又发现, 腺瘤性息肉中COX-2表达明显高于其他息肉, 除与腺瘤的分化程度有关外, 还跟腺瘤生长的部位及大小同样相关. 本组研究数据表明, COX-2在基因和蛋白两个层面上均可看到在正常结肠黏膜、增生性息肉、腺瘤性息肉和结直肠腺癌中从弱表达或不表达逐渐增加为强表达, 以腺癌中最明显. 这一结果进一步说明了, COX-2从正常结肠黏膜到腺癌的序列转变中担当着重要的角色. 其致癌作用可能是通过抑制免疫反应及抑制细胞凋亡, 增加上皮细胞的转移能力以及促进血管生成有关[8].
15-PGDH广泛分布于人和哺乳动物的胃肠道、肺、肾等正常组织中. 研究发现, 15-PGDH在胃癌、结直肠癌、肺癌等多种肿瘤中存在表达的降低或缺失[9-11]. 本研究结果显示, 15-PGDH mRNA和蛋白在正常结直肠黏膜中呈高表达, 在增生性息肉、腺瘤息肉及腺癌中从表达均逐渐降低, 在腺瘤组织和腺癌组织中都可见到表达缺失. 由此表明, 15-PGDH表达的降低或缺失在息肉恶变前已存在, 15-PGDH表达的下调或缺失可能是结直肠癌发生的早期事件之一. Myung等[12]研究认为15-PGDH的作用可作结肠肿瘤生成的有效抑制剂, 他的灭活可促使结肠肿瘤的形成和发展.
近年来, COX-2和15-PGDH在癌细胞中的相互表达关系受到了一些研究者们的关注. Tong等[13]对能表达COX-2和15-PGDH两种基因的肺腺癌细胞A549研究显示, 静息状态下的A549细胞仅微量表达COX-2, 但高表达15-PGDH, 当在肿瘤诱导剂(如LI-1β, TNF-α)作用下COX-2表达显著增加, 而15-PGDH表达反而下降; Liu等[14]对分别被转染COX-2 siRNA质粒和COX-2 cDNA的胃癌细胞SGC7901研究中发现, 15-PGDH下调也可通过COX-2表达来实现. Chi等[15]发现非甾体抗炎药在抑制结直肠癌HT-29细胞中的COX-2的同时上调了15-PGDH表达和减少15-PGDH的降解. 从我们上面究结果中同样看出, COX-2和15-PGDH在人体正常结肠黏膜、结直肠息肉和结直肠癌中具有相互调节的作用; 在结肠癌癌前病变结肠息肉(特别是腺瘤性息肉)中也同时存在COX-2表达的明显增加和15-PGDH表达的降低或缺失, 由此推断二者在结肠息肉恶变过程中可能起到协同作用, 可能为结肠肿瘤的防治找到新的切入点.
结直肠癌是影响人类健康的最常见恶性肿瘤之一, 近年来随着人们生活方式和生活习惯的改变, 其发病率在不断上升. 研究已证实超过80%以上的结直肠癌是由息肉恶变而来, 使得结肠息肉(尤其是腺瘤性息肉)被公认是结肠癌的癌前病变.
刘宝林, 教授, 中国医科大学附属盛京医院普通外科
Myung等研究认为15-PGDH的作用可作结肠肿瘤生成的有效抑制剂, 他的灭活可促使结肠肿瘤的形成和发展.
COX-2和15- PGDH在人体正常结肠黏膜、结直肠息肉和结直肠癌中具有相互调节的作用; 在结肠癌癌前病变结肠息肉(特别是腺瘤性息肉)中也同时存在COX-2表达的明显增加和15-PGDH表达的降低或缺失, 由此推断二者在结肠息肉恶变过程中可能起到协同作用, 可能为结肠肿瘤的防治找到新的切入点.
本文设计合理, 结论可靠, 具有较好的科学价值和临床借鉴意义.
编辑: 李军亮 电编:何基才
| 1. | Zhao JH, Jiang YG, Wu CT, Luo Y, Hou Z, He DL. [Expression of COX-2 in different human prostate cancer cell lines and its significance]. Zhonghua Nankexue. 2010;16:689-692. [PubMed] |
| 4. | Tseng-Rogenski S, Gee J, Ignatoski KW, Kunju LP, Bucheit A, Kintner HJ, Morris D, Tallman C, Evron J, Wood CG. Loss of 15-hydroxyprostaglandin dehydrogenase expression contributes to bladder cancer progression. Am J Pathol. 2010;176:1462-1468. [PubMed] [DOI] |
| 7. | Wasilewicz MP, Kołodziej B, Bojułko T, Kaczmarczyk M, Sulzyc-Bielicka V, Bielicki D. Expression of cyclooxygenase-2 in colonic polyps. Pol Arch Med Wewn. 2010;120:313-320. [PubMed] |
| 9. | Thiel A, Ganesan A, Mrena J, Junnila S, Nykänen A, Hemmes A, Tai HH, Monni O, Kokkola A, Haglund C. 15-hydroxyprostaglandin dehydrogenase is down-regulated in gastric cancer. Clin Cancer Res. 2009;15:4572-4580. [PubMed] [DOI] |
| 10. | Backlund MG, Mann JR, Holla VR, Buchanan FG, Tai HH, Musiek ES, Milne GL, Katkuri S, DuBois RN. 15-Hydroxyprostaglandin dehydrogenase is down-regulated in colorectal cancer. J Biol Chem. 2005;280:3217-3223. [PubMed] [DOI] |
| 11. | Tai HH, Tong M, Ding Y. 15-hydroxyprostaglandin dehydrogenase (15-PGDH) and lung cancer. Prostaglandins Other Lipid Mediat. 2007;83:203-208. [PubMed] [DOI] |
| 12. | Myung SJ, Rerko RM, Yan M, Platzer P, Guda K, Dotson A, Lawrence E, Dannenberg AJ, Lovgren AK, Luo G. 15-Hydroxyprostaglandin dehydrogenase is an in vivo suppressor of colon tumorigenesis. Proc Natl Acad Sci USA. 2006;103:12098-12102. [PubMed] [DOI] |
| 13. | Tong M, Ding Y, Tai HH. Reciprocal regulation of cyclooxygenase-2 and 15-hydroxyprostaglandin dehydrogenase expression in A549 human lung adenocarcinoma cells. Carcinogenesis. 2006;27:2170-2179. [PubMed] [DOI] |
| 14. | Liu Z, Wang X, Lu Y, Han S, Zhang F, Zhai H, Lei T, Liang J, Wang J, Wu K. Expression of 15-PGDH is downregulated by COX-2 in gastric cancer. Carcinogenesis. 2008;29:1219-1227. [PubMed] [DOI] |
| 15. | Chi X, Freeman BM, Tong M, Zhao Y, Tai HH. 15-Hydroxyprostaglandin dehydrogenase (15-PGDH) is up-regulated by flurbiprofen and other non-steroidal anti-inflammatory drugs in human colon cancer HT29 cells. Arch Biochem Biophys. 2009;487:139-145. [PubMed] [DOI] |