修回日期: 2011-03-03
接受日期: 2011-03-08
在线出版日期: 2011-03-28
目的: 探讨联合转染Survivin短发夹RNA(short hairpin RNA, shRNA)和CD44v3 shRNA对结直肠癌SW480细胞增殖和侵袭能力的影响, 为结直肠癌的基因治疗提供实验依据.
方法: 设计并构建能够稳定转录shRNA并干扰Survivin和CD44v3分子表达的质粒, 将其单独及联合转染结直肠癌SW480细胞后, 分阴性对照组、空白质粒对照组, Survivin组、CD44v3组和共转染组. Western blot检测转染后Survivin和CD44v3蛋白表达的变化, 流式细胞仪及MTT法检测细胞凋亡和细胞增殖的变化, Transwell小室检测细胞迁移能力的改变.
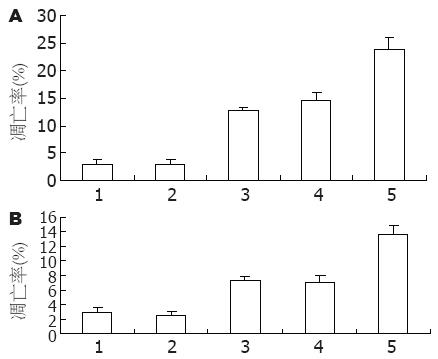
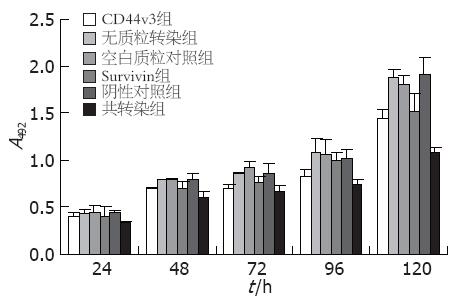
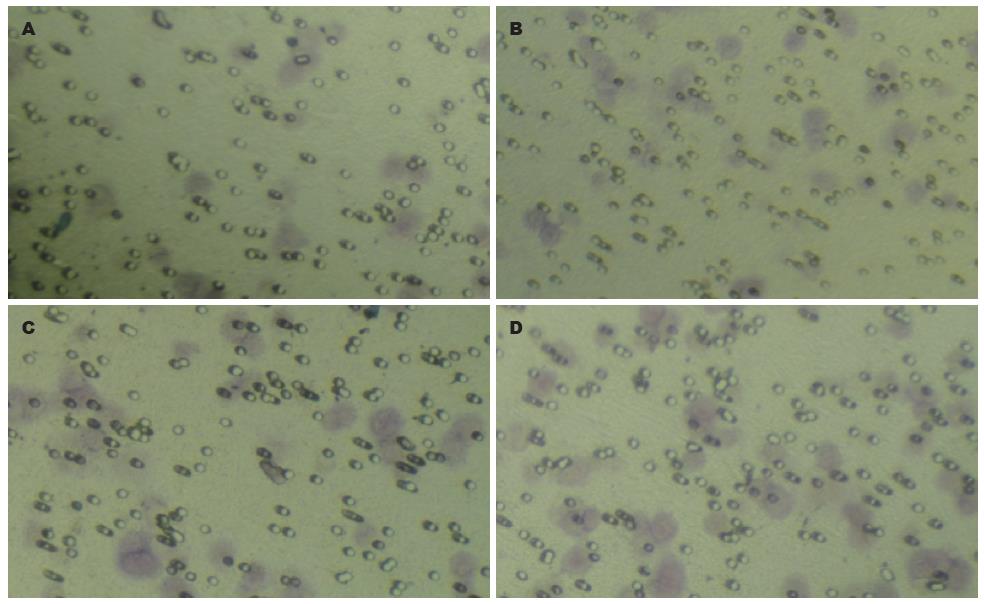
结果: 测序证明表达载体构建成功, 共转染组Survivin和CD44v3的蛋白表达抑制率分别为84.2%±0.3%和77.3%±0.1%, 与单独转染组相比差异有统计学意义(P<0.05). 转染120 h后, 共转染组、Survivin组和CD44v3组细胞生长抑制率分别为44.3%±0.1%、21.5%±0.2%、26.4%±0.2%, 共转染组抑制效果最明显(P<0.05), 总凋亡率分别为37.6%±2.3%、20.0%±0.4%、21.6%±1.6%, 共转染组凋亡率最高(P<0.05), 小室穿膜细胞数分别为66.12个±4.04个, 89.35个±3.06个、93.53个±5.13个, 共转染组与各组差异显著(P<0.05).
结论: Survivin shRNA和CD44v3 shRNA可分别下调Survivin和CD44v3蛋白的表达, 抑制结直肠癌细胞的增殖, 促进其凋亡, 减弱其迁移能力, 而两者的联合转染能进一步抑制细胞的生长增殖, 减弱细胞的侵袭能力.
引文著录: 郭勇杭, 刘中宏, 许军, 姚媛媛, 黄平. 联合转染Survivin shRNA和CD44v3 shRNA对结直肠癌SW480细胞增殖和侵袭能力的影响. 世界华人消化杂志 2011; 19(9): 905-911
Revised: March 3, 2011
Accepted: March 8, 2011
Published online: March 28, 2011
AIM: To investigate the effect of combined transfection of short hairpin RNAs (shRNAs) targeting survivin and CD44v3 on cell proliferation and invasion in human colorectal carcinoma cell line SW480 and to provide experiment evidence for gene therapy of colorectal carcinoma.
METHODS: Plasmids carrying shRNAs targeting survivin and CD44v3 were designed, constructed and transfected into SW480 cells. SW480 cells were divided into negative control group, blank control group, survivin shRNA group, CD44v3 shRNA group and co-transfection group. Survivin and CD44v3 protein expression was analyzed by Western blot. Cell apoptosis, proliferation and invasion were measured by flow cytometry, MTT assay and Transwell chamber assay, respectively.
RESULTS: The expression of survivin and CD44v3 proteins in the co-transfection group was reduced by 84.2% ± 0.3% and 77.3% ± 0.1%, respectively. Co-transfection inhibited protein expression more efficiently than single-plasmid transfection (P < 0.05). After transfection for 120 h, the reduced rate of cell growth was 44.3% ± 0.1% in the co-transfection group, 21.5% ± 0.2% in the survivin shRNA group, and 26.4% ± 0.2% in the CD44v3 shRNA group. Combined transfection inhibited cell proliferation more efficiently than single-plasmid transfection (P < 0.05). The overall apoptosis rate was 37.6% ± 2.3% in the co-transfection group, 20.0% ± 0.4% in the survivin shRNA group, and 21.6% ± 1.6% in the CD44v3 shRNA group. Combined transfection induced cell apoptosis more efficiently than single-plasmid transfection (P < 0.05). The number of cells passing the Transwell chamber was 66.12 ± 4.04 in the co-transfection group, 89.35 ± 3.06 in the survivin shRNA group, and 93.53 ± 5.13 in the CD44v3 shRNA group. Combined transfection reduced cell invasion more significantly than single-plasmid transfection (P < 0.05).
CONCLUSION: Transfection of either survivin shRNA or CD44v3 shRNA could significantly inhibit cell proliferation, reduce cell invasion and induce cell apoptosis in human colorectal carcinoma cell line SW480. Co-transfection of survivin and CD44v3 shRNAs has a synergistic effect in inhibiting proliferation and weakening invasion of SW480 cells.
- Citation: Guo YH, Liu ZH, Xu J, Yao YY, Huang P. Combined transfection of shRNAs targeting survivin and CD44v3 inhibits proliferation and reduces invasion in human colorectal carcinoma cell line SW480. Shijie Huaren Xiaohua Zazhi 2011; 19(9): 905-911
- URL: https://www.wjgnet.com/1009-3079/full/v19/i9/905.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i9.905
小干扰RNA(small interfering RNA, siRNA)是一种短片断双链RNA分子, 能够以同源互补序列的mRNA为靶目标降解特定的mRNA, 导致其相应的基因沉默, 这种现象被称为RNA干扰(RNA interference, RNAi)[1], 是目前分子生物学的研究热点. Survivin是凋亡抑制蛋白(inhibitor of apoptosis proteins, IAPs)家族的成员. 黏附分子CD44v3是细胞黏附分子CD44变异型中的一个, 两者在人体正常组织中不表达或微量表达, 但在肿瘤组织中表达, 且表达水平与恶性肿瘤的侵袭性及预后有关, 并具有抑制细胞凋亡和调节细胞周期和细胞分裂的功能[2-9]. 本研究用RNAi的方法单独及联合转染靶向这两个基因的短发夹RNA(short hairpin RNA, shRNA), 探讨这两种基因对结直肠癌细胞生物学行为的影响, 及两者作用机制的相关性.
人结直肠癌细胞株SW480、KeyGenTrans Ⅲ聚阳离子转染试剂购自南京凯基生物公司, Survivin和CD44v3基因的siRNA表达载体pGCsi-H1/Neo/GFP/RNAi由上海吉凯生物公司构建, 上海英骏生物技术公司测序. Survivin和CD44v3多克隆抗体购自Santa Cruz公司.
1.2.1 RNA靶序列: Survivin与CD44v3基因序列来自GenBank, 利用GeneChemTM siRNA的设计工具, 参照siRNA的设计原则, 分别设计选取19 nt的siRNA靶序列模板, GGCTGGCTTCATCCACTGC(86-104) GGCTTTCAATAGCACCTTG (86-104), 经Blast分析证明与人类其他编码序列无同源性. 序列的5'端对应于BamHⅠ酶切位点, 3'末端带有T6序列, 对应于HindⅢ的酶切位点, 正义链和反义链之间是9个碱基的环序列(TTCAAGAGA), 同时设计针对GFP的siRNA靶序列转录模板作为阳性对照, 以pGCsi-H1/Neo/GFP/NON RNAi载体作阴性对照, 不干扰待研究的内源性基因. Survivin shRNA序列: 5'-GATCCCGGCTGGCTTCATCCACTGCTTCAAGAGAGCAGTGGATGAAGCCAGCCTTTTTGGAT-3', CD44v3 shRNA序列: 5'-GATCCCGGCTTTCAATAGCACCTTGTTCAAGAGACAAGGTGCTATTGAAAGCCTTTTTGGAT-3'.
1.2.2 细胞培养: 水浴复苏人结肠癌细胞株SW480, 接种于30 mL培养瓶, 在37 ℃, 50 mL/L CO2培养箱中, 用含100 mL/L小牛血清, 100 kU/L青霉素和100 mg/L链霉素的DMEM培养液中培养, 细胞贴壁生长, 2.5 g/L胰蛋白酶消化传代.
1.2.3 细胞转染: 转染前1 d, 胰酶消化并计数, 细胞铺板在0.5 mL含血清不含抗生素的培养基中, 调整细胞密度, 按每孔3×105个细胞等量加到6孔培养扳中培养. 分组转染(转染试剂∶DNA = 2∶1), 实验设阴性对照组、空白质粒对照组, 单独转染Survivin shRNA实验组(简称Survivin组)、单独转染CD44v3 shRNA实验组(简称CD44v3组)、共转染组, 放置37 ℃, 50 mL/L CO2孵育箱孵育24-48 h, 转染过程按转染试剂盒说明书进行.
1.2.4 Western blot检测各组Survivin蛋白和CD44v3蛋白表达水平的变化: 转染后48 h, 收集各组细胞及培养液上清, 以SDS煮沸法裂解细胞提取总蛋白, 紫外分光光度计法进行蛋白定量, 40 μg蛋白进行SDS-PAGE, 电泳后转至PVDF膜, 室温封闭2 h, 加入一抗(1∶1 000兔抗人Survivin抗体), 4 ℃孵育过夜, PBS洗膜, 加入二抗(1∶4 000鼠抗兔IgG/HRP), 室温孵育2 h, 洗膜3次, 化学发光试剂反应5 min, ECL压片、曝光、显影, 实验重复3次, 检测CD44v3蛋白操作步骤同上. 目标蛋白的相对表达量 = A目标蛋白/Aβ-actin, 抑制率 = (1-转染组目标蛋白的相对表达量/阴性对照组的相对表达量)×100%.
1.2.5 流式细胞仪检测各组细胞凋亡: 转染后48 h, 将各组细胞用2.5 g/L胰酶(不含EDTA)消化收集, 用PBS洗涤细胞两次(离心2 000 r/min, 5 min)收集5×105个细胞, 加入500 μL Binding Buffer悬浮细胞, 再加入5 μL Annexin V-FITC混匀后, 加入5 μL PI混匀, 室温避光反应5-15 min, 用流式细胞仪检测(Ex = 488 nm; Em = 530 nm)细胞凋亡的情况.
1.2.6 MTT比色法检测细胞增殖活性: 取对数生长期细胞, 胰酶消化并吹打成单个细胞悬液, 把细胞悬浮在含100 mL/L小牛血清的DMEM培养液中, 调整细胞浓度为8×104/mL, 以每孔8 000个细胞接种于96孔板中, 设空白质粒对照组、阴性对照组、只加转染试剂对照组(简称无质粒转染组)、Survivin shRNA组(简称Survivin组)、CD44v3 shRNA组(简称CD44v3组)、共转染组, 每组5个复孔, 在37 ℃, 50 mL/L CO2的培养箱中培养24 h后, 分别转染各组细胞. 分别于24、48、72、96、120 h取出一块培养板, 每孔加MTT染液(5 g/L)20 μL, 在37 ℃, 50 mL/L CO2的培养箱中继续培养4-6 h, 小心弃去上清液, 每孔加入DMSO 200 μL, 振摇10 min, 使结晶物充分溶解. 选择492 nm波长, 在酶联免疫检测仪上测定各孔吸光度(A)值, 以空白调零, 记录结果, 重复实验3次, 抑制率 = (1-转染组A值/阴性对照组A值)×100%.
1.2.7 Transwell小室测细胞迁移能力: 转染后48 h, 将各组细胞用胰酶消化后, 把细胞悬浮在无血清的DMEM培养液中, 调整浓度为1×107/mL, 将小室放入24孔板中在8.0 µm孔径小室的上室加入100 µL细胞悬液, 下室加入500 µL含100 mL/L小牛血清的DMEM培养液, 培养12 h后, 取出小室用棉签擦去上室细胞并用Giemsa染色, 在倒置显微镜下按一定顺序选取9个视野观察并计数, 以穿出小室细胞数表示肿瘤细胞的迁移能力. 实验分阴性对照组、Survivin组、CD44v3组、共转染组, 每组重复3次.
统计学处理 实验数据处理应用SPSS软件, 进行统计分析. 数据以mean±SD表示, 进行方差分析, 各组均数间差异显著性比较采用t检验进行, P<0.05为统计学差异显著.
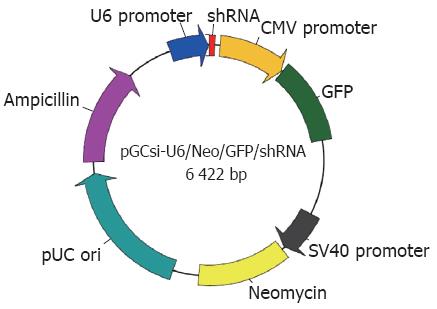
联合应用限制性内切酶BamHⅠ、HindⅢ及DNA连接酶等将分别靶向Survivin和CD44v3的shRNA目的基因插入所构建质粒的基因组, U6 promoter、CMV promoter以及SV40 promoter均是为启动子, Neomycin和Ampicillin是G418抗性基因, 有利于成功转染细胞的筛选, GFP能编码绿色荧光蛋白有利于观察转染效率及目的基因的沉默率(图1).
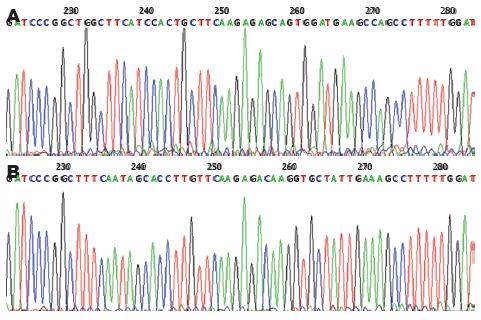
重组质粒shRNA编码序列与我们设计的靶向Survivin和CD44v3的核苷酸序列完全一致, 表明成功构建了重组载体pGCsiRNA-Survivin和pGCsiRNA-CD44v3(图2).
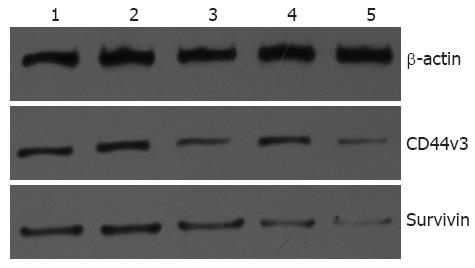
实验转染组Survivin蛋白和CD44v3蛋白表达下调, 目标蛋白的相对表达量为: Survivin 0.697±0.021(阴性对照组)、0.663±0.025(空白质粒对照组)、0.297±0.025(Survivin组)、0.597±0.015(CD44v3组)、0.113±0.015(共转染组), CD44v3 0.727±0.025(阴性对照组)、0.69±0.01(空白质粒对照组)、0.407±0.015(Survivin组)、0.5916±0.021(CD44v3组)、0.173±0.015(共转染组), 转染组目标蛋白的相对表达量低于阴性对照和空白对照组, 其中共转染组最低, 统计学分析差异有显著(P<0.05), 而在空白对照组和阴性对照组内Survivin蛋白和CD44v3蛋白表达无明显差异. 其中共转染组的蛋白表达抑制率为84.2±0.3%(Survivin)和77.3±0.1%(CD44v3), 与单独转染组相比差异有统计学意义(P<0.05, 图3, 4).
转染组不论在细胞的早期凋亡方面还是晚期凋亡方面其凋亡率均高于阴性对照组和空白质粒对照组(P<0.05), 阴性对照组和空白质粒对照组之间差异无统计学意义. 且早期凋亡率高于晚期凋亡率, 共转染组早期和晚期凋亡率分别为23.9%±2.3%、13.7±2.2%, 均高于单独转染组的早晚期凋亡率12.8±0.4%、7.2±0.5%(survivin组)和14.6%±1.6%、7.0%±2.1%(CD44v3组), 差异有统计学意义(P<0.05, 图5).
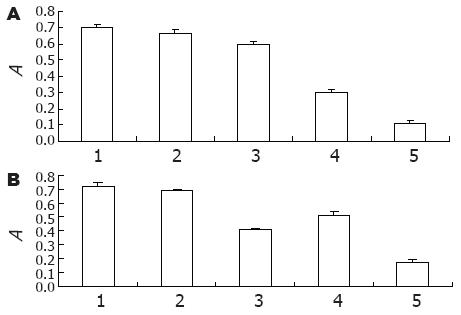
转染72 h后, 转染组与空白质粒对照组、阴性对照组差别明显, 转染120 h后, 差别最明显, A值分别为1.07±0.14(共转染组)、1.52±0.39(Survivin组)、1.43±0.19(CD44v3组)、1.91±0.34(阴性对照组), 且共转染组与单独转染组相比差异有统计学意义(P<0.05), 细胞生长抑制率为44.3%±0.1%(共转染组)、21.5%±0.2%(Survivin组)、26.4%±0.2%(CD44v3组), 空白质粒对照组、无质粒转染组、阴性对照组间差异无显著性(图6).
共转染组穿过细胞数(个)为66.12±4.04, CD44v3组89.35±3.06, Survivin组93.53±5.13, 阴性对照组120.64±5.65, 结果显示针对目的基因CD44v3、Survivin的RNAi单独转染组与阴性对照组相比, 穿过细胞数少, 细胞的迁移能力减弱, 差异有统计学意义(P<0.05), 而且共转染组穿越细胞数最少, 与单独转染组比, 差异显著(P<0.05, 图7), 细胞的迁移能力明显减弱.
肿瘤的发生和发展是多基因、多因素共同作用的结果. 其之所以治疗困难一方面是因为肿瘤细胞的凋亡受阻; 另一方面是因为肿瘤细胞迁移力增强.
Survivin蛋白是凋亡IAPs家族成员之一, 基因定位于染色体17q25, 其表达发生在结直肠腺癌恶性转化的早期, 在癌变过程中起重要作用[10,11], 是一种具有调控细胞凋亡和细胞增殖双重功能的调控子[12], 其机制是Survivin通过抑制caspase3和caspase7的活性抑制细胞凋亡. caspase是控制细胞凋亡的核心环节, Survivin直接作用于caspase, 阻止由caspase激活剂或凋亡诱导剂诱导的细胞内相关自杀酶的积累, 从而起到抑制细胞凋亡的作用[13]. Survivin主要在G2/M期表达, G2/M期控制点负责保持遗传的准确性, 通过Survivin对细胞周期的调节作用, 使肿瘤细胞逃避细胞周期G2/M期检测点的监测, 从而抵抗因DNA损伤或突变自身诱导的细胞凋亡, 导致肿瘤细胞异常分裂增殖[14]. 有研究表明, Survivin的表达上调与直肠癌凋亡指数下降、转移率增高、总体存活率缩短、预后不良和复发率增加有关[15]. 这些研究提示, 通过抑制Survivin的表达来诱导肿瘤细胞的凋亡、降低转移率是行之有效的, 在前期的研究中, 我们已经证实应用RNAi技术靶向Survivin的shRNA可以降低Survivin蛋白的表达, 抑制结肠癌细胞的增殖[16]. 熊英等[17]也得出相似的结论. 有关胃癌[18]、子宫内膜癌[19]、前列腺癌[20]、肺癌[21]等的研究也有相关的报道.
CD44是分布广泛的单链膜表面糖蛋白, 可赋予肿瘤细胞很强的侵袭及迁移能力, 其基因位于人类第11号染色体短臂上, 分为: (1)CD44标准体(CD44s); (2)CD44拼接变异体(CD44v). Tanabe等[22]认为: CD44变异型主要通过与胞外多种基质成分结合(如透明质酸等), 一方面介导了肿瘤细胞与胞外基质的黏附, 有利于肿瘤细胞在原发病灶部位"定居"; 另一方面还可以激发活体细胞内某些信号的传导机制, 使肿瘤细胞分泌蛋白水解酶, 加速胞外基质的降解, 赋予他们很强的浸出行为及迁移能力, 从而构成肿瘤细胞的侵袭性和易转移性, 有利于肿瘤细胞的扩散. CD44v表达阳性的癌细胞与激活的淋巴细胞具有很多共性, 其模仿淋巴细胞执行了细胞-细胞和细胞-基质的相互作用, 并最终进入循环系统渗入周围组织, 这些为肿瘤扩散所必须[23]. 同时卓文磊等[24]也推测转移机制与淋巴有关. CD44v3是细胞黏附分子CD44变异型中的一个, 介导细胞和细胞外基质之间的相互作用, 参与肿瘤细胞的增殖、分化、黏附、迁移及肿瘤血管形成等重要过程, 在肿瘤的发展和转移中起重要作用. Mayer等[25]发现, CD44v3在胃癌中的表达与淋巴管浸润和淋巴转移密切相关. Wang等[26]研究表明CD44v3在头颈肿瘤患者转移性淋巴结中有过度表达.
在恶性肿瘤发生的癌基因研究中, 不少学者提出了多基因协同作用的假设, 认为在肿瘤发生发展的各阶段, 至少有两个或两个以上功能不同的异常激活的癌基因各自发挥不同作用, 并在时间和空间上相互配合, 协同加强了细胞的癌变[27]. 有实验研究表明, Survivin、Bcl-2在胃癌的发生中存在协同作用[28], 张东梅等[29]研究表明, FUS1和IL-12联合转染在诱导肺癌细胞凋亡方面具有良好的协同作用. 本研究结果也显示, Survivin蛋白和CD44v3蛋白在SW480结直肠癌细胞中高表达, 分别靶向两者基因的实验组在抑制细胞生长增殖、加速细胞凋亡、减弱细胞迁移力以及减少蛋白表达方面作用程度相当, 而共转染组与单独转染组相比抑制作用更强, 其中蛋白抑制率达到84.2%±0.3%(Survivin)和77.3%±0.1%(CD44v3), 这提示两基因在大肠癌的发生和发展方面很可能存在协同或互补作用.
首先, Survivin和CD44v3可能在细胞周期调控点上存在协同作用. CD44分子是目前已知的透明质酸酶和透明质酸的主要受体, 透明质酸主要是通过CD44受体途径对肿瘤细胞、内皮细胞产生一系列影响. Lisignoli等[30]的研究结果表明, 透明质酸可以降低抗Fas抗体介导的凋亡, 其机制之一就是与其配体CD44结合. 细胞周期能否启动进行细胞增殖主要调控点在G1期, 称为限制点, 一旦通过该点, 势必进入S期, 完成整个细胞增殖周期. 研究发现, 透明质酸酶的cDNA上的一个蜕皮激素诱导的启动子结合在肿瘤细胞结构基因的上游, 促进其通过限制点进入S期, 从而使S期和G2-M期细胞比例增加G0-G1期细胞比例减少[31]. 而Survivin对细胞周期具有调节作用, 使肿瘤细胞逃避细胞周期G2/M期检测点的监测, 从而抵抗因DNA损伤或突变自身诱导的细胞凋亡, 导致肿瘤细胞异常分裂增殖, 由此可推测, Survivin和CD44v3在细胞周期调控点上存在某些相似机制; 其次, Survivin和CD44v3在增强肿瘤细胞迁移性或侵袭性方面可能存在协同作用. Coma等[32]研究发现, 使用针对Survivin反义核酸和siRNA均可促进肿瘤组织血管内皮细胞凋亡, 抑制血管内皮细胞迁移. 透明质酸能上调肿瘤细胞、内皮细胞表面CD44分子的表达[33], 实验表明, 透明质酸片段与内皮细胞表面的透明质酸受体(CD44等)结合后, 可以通过激活局部的MAP酶的途径, 促进内皮细胞的增殖和运动, 这一作用在体内、体外实验中均得到了证实[34], 由此可推测Survivin和CD44v3在增强肿瘤细胞迁移性或侵袭性方面存在相似性.
两者在以上两方面的协同作用可能同时影响细胞生物学行为的其他方面, 使共转染组在本实验中表现的抑制作用最强, 从而证明shRNA的联合转染在基因治疗肿瘤方面更具有有效性, 因而为肿瘤的基因治疗提供一种更有效的方法, 但两基因协同作用的具体作用机制以及结合位点还需要进一步研究和探讨, 而且此治疗方法对机体其他部位有无不良反应还需后续实验进一步验证.
RNA干扰是双链RNA(dsRNA)介导的转录后基因沉默, 能特异地降解靶基因的mRNA, 具有高度的特异性和有效性, 目前正成为研究基因功能、肿瘤和病毒性疾病治疗的有力工具. Survivin是凋亡抑制蛋白(IAPs)家族的成员, CD44v3是细胞黏附分子CD44变异型中的一个, 两者均在肿瘤组织中表达, 具有抑制细胞凋亡和调节细胞周期和细胞分裂的功能, 且表达水平与恶性肿瘤的侵袭性以及预后有关.
黄培林, 教授, 东南大学
小干扰RNA(siRNA)是一种短片断双链RNA分子, 能够以同源互补序列的mRNA为靶目标降解特定的mRNA, 导致其相应的基因沉默, 这种现象被称为RNA干扰(RNAi), 是目前分子生物学的研究热点.
周薇等研究表明, Survivin与胃癌的发生、发展和预后密切相关, Survivin蛋白表达与Bcl-2蛋白异常表达密切相关, 两基因在抗凋亡机制上既存在协同的一面, 又存在互补的一面.
本文运用RNAi技术联合转染Survivin shRNA和CD44v3 shRNA, 探讨结直肠癌基因治疗的新方法, 并与两基因单独转染方法的效果相比较, 得出联合转染更具有效性的结论, 为结直肠癌的基因治疗提供了一种新思路.
本实验方法若在以后的科研和临床工作中证实确实可行的话, 那么在肿瘤基因治疗的疗效方面将会取得更大突破, 各种化疗药物的应用将大大减少, 不仅医疗费用将会明显降低, 药物不良反应也会大幅降低.
本文为结直肠癌的治疗奠定了实验基础, 但可读性一般.
编辑: 曹丽鸥 电编:何基才
| 1. | Kasschau KD, Carrington JC. A counterdefensive strategy of plant viruses: suppression of posttranscriptional gene silencing. Cell. 1998;95:461-470. [PubMed] [DOI] |
| 2. | Tanaka K, Iwamoto S, Gon G, Nohara T, Iwamoto M, Tanigawa N. Expression of survivin and its relationship to loss of apoptosis in breast carcinomas. Clin Cancer Res. 2000;6:127-134. [PubMed] |
| 3. | Sarela AI, Macadam RC, Farmery SM, Markham AF, Guillou PJ. Expression of the antiapoptosis gene, survivin, predicts death from recurrent colorectal carcinoma. Gut. 2000;46:645-650. [PubMed] [DOI] |
| 4. | Turley EA, Noble PW, Bourguignon LY. Signaling properties of hyaluronan receptors. J Biol Chem. 2002;277:4589-4592. [PubMed] [DOI] |
| 5. | Knudson W, Chow G, Knudson CB. CD44-mediated uptake and degradation of hyaluronan. Matrix Biol. 2002;21:15-23. [PubMed] [DOI] |
| 6. | Altieri DC. Survivin and apoptosis control. Adv Cancer Res. 2003;88:31-52. [PubMed] [DOI] |
| 7. | Castedo M, Perfettini JL, Roumier T, Andreau K, Medema R, Kroemer G. Cell death by mitotic catastrophe: a molecular definition. Oncogene. 2004;23:2825-2837. [PubMed] [DOI] |
| 8. | Wheatley SP, Henzing AJ, Dodson H, Khaled W, Earnshaw WC. Aurora-B phosphorylation in vitro identifies a residue of survivin that is essential for its localization and binding to inner centromere protein (INCENP) in vivo. J Biol Chem. 2004;279:5655-5660. [PubMed] [DOI] |
| 9. | Kuniyasu H, Chihara Y, Kubozoe T, Takahashi T. Co-expression of CD44v3 and heparanase is correlated with metastasis of human colon cancer. Int J Mol Med. 2002;10:333-337. [PubMed] |
| 11. | Lin LJ, Zheng CQ, Jin Y, Ma Y, Jiang WG, Ma T. Expression of survivin protein in human colorectal carcinogenesis. World J Gastroenterol. 2003;9:974-977. [PubMed] |
| 12. | Watson AJ. An overview of apoptosis and the prevention of colorectal cancer. Crit Rev Oncol Hematol. 2006;57:107-121. [PubMed] [DOI] |
| 13. | Huh JR, Foe I, Muro I, Chen CH, Seol JH, Yoo SJ, Guo M, Park JM, Hay BA. The Drosophila inhibitor of apoptosis (IAP) DIAP2 is dispensable for cell survival, required for the innate immune response to gram-negative bacterial infection, and can be negatively regulated by the reaper/hid/grim family of IAP-binding apoptosis inducers. J Biol Chem. 2007;282:2056-2068. [PubMed] [DOI] |
| 14. | Chandele A, Prasad V, Jagtap JC, Shukla R, Shastry PR. Upregulation of survivin in G2/M cells and inhibition of caspase 9 activity enhances resistance in staurosporine-induced apoptosis. Neoplasia. 2004;6:29-40. [PubMed] |
| 15. | Rödel F, Hoffmann J, Grabenbauer GG, Papadopoulos T, Weiss C, Günther K, Schick C, Sauer R, Rödel C. High survivin expression is associated with reduced apoptosis in rectal cancer and may predict disease-free survival after preoperative radiochemotherapy and surgical resection. Strahlenther Onkol. 2002;178:426-435. [PubMed] [DOI] |
| 17. | 熊 英, 王 爱民, 郭 文. 导入靶向survivin基因的shRNA质粒表达载体对大肠癌细胞生物学行为的影响. 中华实用诊断和治疗杂志. 2009;23:741-743. |
| 20. | 刘 艳波, 沈 维高, 芦 丽莉, 葛 贺, 盖 晓东, 赵 雪俭. Survivin-siRNA对前列腺癌DU145细胞的促凋亡作用. 中国病理生理杂志. 2010;26:1474-1478. |
| 22. | Tanabe KK, Ellis LM, Saya H. Expression of CD44R1 adhesion molecule in colon carcinomas and metastases. Lancet. 1993;341:725-726. [PubMed] [DOI] |
| 23. | Birch M, Mitchell S, Hart IR. Isolation and characterization of human melanoma cell variants expressing high and low levels of CD44. Cancer Res. 1991;51:6660-6667. [PubMed] |
| 25. | Mayer B, Jauch KW, Günthert U, Figdor CG, Schildberg FW, Funke I, Johnson JP. De-novo expression of CD44 and survival in gastric cancer. Lancet. 1993;342:1019-1022. [PubMed] [DOI] |
| 26. | Wang SJ, Wreesmann VB, Bourguignon LY. Association of CD44 V3-containing isoforms with tumor cell growth, migration, matrix metalloproteinase expression, and lymph node metastasis in head and neck cancer. Head Neck. 2007;29:550-558. [PubMed] [DOI] |
| 27. | Gadd SL, Hobbs G, Miller MR. Acetaminophen-induced proliferation of estrogen-responsive breast cancer cells is associated with increases in c-myc RNA expression and NF-kappaB activity. Toxicol Sci. 2002;66:233-243. [PubMed] [DOI] |
| 29. | 张 冬梅, 杨 寒朔, 朱 文, 冯 志华, 邓 洪新, 魏 于全. FUS1 和IL-12双基因真核共表达质粒的构建及对A549细胞促凋亡作用研究. 四川大学学报(医学版). 2009;40:569-574. |
| 30. | Lisignoli G, Grassi F, Zini N, Toneguzzi S, Piacentini A, Guidolin D, Bevilacqua C, Facchini A. Anti-Fas-induced apoptosis in chondrocytes reduced by hyaluronan: evidence for CD44 and CD54 (intercellular adhesion molecule 1) invovement. Arthritis Rheum. 2001;44:1800-1807. [PubMed] [DOI] |
| 31. | Lin G, Stern R. Plasma hyaluronidase (Hyal-1) promotes tumor cell cycling. Cancer Lett. 2001;163:95-101. [PubMed] [DOI] |
| 32. | Coma S, Noe V, Lavarino C, Adán J, Rivas M, López-Matas M, Pagan R, Mitjans F, Vilaró S, Piulats J. Use of siRNAs and antisense oligonucleotides against survivin RNA to inhibit steps leading to tumor angiogenesis. Oligonucleotides. 2004;14:100-113. [PubMed] [DOI] |
| 33. | Stern R, Shuster S, Wiley TS, Formby B. Hyaluronidase can modulate expression of CD44. Exp Cell Res. 2001;266:167-176. [PubMed] [DOI] |
| 34. | Savani RC, Cao G, Pooler PM, Zaman A, Zhou Z, DeLisser HM. Differential involvement of the hyaluronan (HA) receptors CD44 and receptor for HA-mediated motility in endothelial cell function and angiogenesis. J Biol Chem. 2001;276:36770-36778. [PubMed] [DOI] |