修回日期: 2011-01-30
接受日期: 2011-02-15
在线出版日期: 2011-03-28
目的: 探讨在人结肠癌多药耐药细胞株HCT8/V中JNK信号传导通路与多药耐药1(MDR1)基因表达的关系.
方法: MTT法检测人结肠癌多药耐药细胞株HCT8/V及其敏感株HCT8细胞对多种抗肿瘤药物的敏感性; 抑制JNK信号通路的激活后, 采用双荧光素酶活性报告基因检测MDR1启动子转录活性的表达; 实时荧光定量PCR检测MDR1 mRNA的表达; Western blot分析对P-糖蛋白(P-gp)表达的影响.
结果: HCT8/V细胞对长春新碱(VCR)的耐药倍数为10.49倍. 加入JNK特异性抑制剂sp600125(20 μmol/L)抑制后, HCT8/V细胞对VCR的半数抑制浓度(IC50)由191.08 mg/L±18.18 mg/L降低到50.34 mg/L±15.71 mg/L, 逆转指数为3.80(P<0.01). HCT8/V细胞加入JNK抑制剂后, MDR1启动子活性从0.03647±0.00191降低到0.01362±0.00196, 下降了2.52倍(P<0.01). 实时荧光定量PCR、Western blot检测结果提示, 抑制JNK通路的激活后, HCT8/V细胞的MDR1 mRNA从0.34275±0.0339下降到0.13625±0.0196(P<0.01), P-gp表达从0.88132±0.1026下降到0.56174±0.1014(P<0.01).
结论: JNK信号通路通过介导MDR1/P-gp调控人肠癌多要耐药, 抑制JNK信号通路可降低MDR1/P-gp的水平, 逆转人结肠癌HCT8/V细胞的多药耐药性.
引文著录: 隋华, 周利红, 殷佩浩, 王炎, 范忠泽, 周树峰, 李琦. JNK信号通路介导MDR1/P-gp调控人结肠癌多药耐药. 世界华人消化杂志 2011; 19(9): 892-898
Revised: January 30, 2011
Accepted: February 15, 2011
Published online: March 28, 2011
AIM: To investigate the relationship between the JNK (c-Jun NH2-terminal kinase) signal transduction pathway and multidrug resistance 1 (MDR1)/P-glycoprotein (P-gp)-mediated multidrug resistance of human colon carcinoma HCT8/V cells.
METHODS: The sensitivity of multidrug-resistant HCT8/V cells and drug-sensitive HCT8 cells to a variety of antitumor drugs was evaluated by MTT assay. After inhibition of the activation of the JNK signaling pathway, MDR1 promoter transcriptional activity and expression of MDR1 mRNA and P-gp were evaluated by luciferase activity assay, real-time fluorescence quantitative PCR (RFQ-PCR) and Western blot, respectively.
RESULTS: HCT8/V cells exhibited 10.49-fold higher resistance to vincristine than their parental counterparts. The IC50 value of SP600125 (20 μmol/L) decreased from 191.08 mg/L ± 18.18 mg/L to 50.34 mg/L ± 15.71 mg/L and resistance index (RI) reached 3.80 (P < 0.01). After inhibition of the activation of the JNK signaling pathway with a JNK specific inhibitor, MDR1 promoter transcriptional activity showed a 2.55-fold decrease (0.03647 ± 0.00191 vs 0.01362 ± 0.00196, P < 0.01) and the expression of MDR1/P-gp was significantly down-regulated (0.34275 ± 0.0339 vs 0.13625 ± 0.0196, 0.88132 ± 0.1026 vs 0.56174 ± 0.1014, both P < 0.01) in HCT8/V cells.
CONCLUSION: The JNK signal transduction pathway regulates MDR1/P-glycoprotein-mediated multidrug resistance of HCT8/V cells possibly by up-regulating MDR1/P-gp expression.
- Citation: Sui H, Zhou LH, Yin PH, Wang Y, Fan ZZ, Zhou SF, Li Q. JNK signal transduction pathway regulates MDR1/P-glycoprotein-mediated multidrug resistance in colon carcinoma cells. Shijie Huaren Xiaohua Zazhi 2011; 19(9): 892-898
- URL: https://www.wjgnet.com/1009-3079/full/v19/i9/892.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i9.892
肿瘤细胞的多药耐药(muhidrug resistance, MDR)的产生主要是由于MDR1基因编码的P-糖蛋白(P-glycoprotein, P-gp)的表达增加[1-3]. 促分裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK)的信号传导途径, 是细胞生长和分化的重要环节. 以c-Jun为中心的c-Jun氨基末端激酶(c-Jun NH2-terminal kinase, JNK)信号转导途径, 是MAKP众多通路中的一个. 目前越来越多的报道证实了JNK信号通路具有调控MDR基因表达的作用[4-6]. 有研究表明表明化疗药物可增加c-Jun磷酸化水平, 使肿瘤细胞产生化疗耐受[7-9], 但是目前对JNK信号通路与MDR产生和逆转关系的研究仍较少. 本实验选用人结肠癌MDR细胞株HCT8/V及其敏感株HCT8细胞, 给予JNK信号通路特异性抑制剂(sp600125)干预, 观察细胞的药物敏感性、MDR1 mRNA水平等方面的变化, 以探讨JNK信号通路与人结肠癌MDR的可能关系.
人结肠癌细胞株HCT8及人结肠癌MDR细胞株HCT8/V购于上海博谷生物科技公司. MTT购自Sigma公司, 载体质粒pGL3-Basic、内参质粒pRL-SV40由华东理工大学药学院药理研究室馈赠. MDR1基因启动子重组质粒pGL3-Basic-MDR1-promoter为本实验室保存. 转染脂质体Lipofectamine2000购自美国Invitrogen公司; 双荧光素酶检测试剂盒(dual luciferase assay system)与化学发光仪(GloMax 20/20 Luminometer)购自美国Promega公司. JNK特异性的抑制剂sp600125购于美国Serologllcais公司; 总RNA抽提试剂RNAiso Reagent、荧光定量PCR试剂购自日本TaKaRa公司; GAPDH和MDR1上下游引物和探针由上海闪晶生物公司设计并合成. Mastercycler EP银质梯度PCR仪、Biophotometer生物分光光度计、5804R高速冷冻离心机德国Eppendorf公司; ABI7300实时定量PCR仪美国ABI公司; CKX41/U-RFLT50荧光倒置显微镜购自日本Olympus; Chemidox化学发光成像仪购自Bio-Rad公司. 蛋白质抽提试剂试剂盒(Sangon S-415)、BCA蛋白质定量试剂、兔抗人P-gp单克隆抗体是Merk公司产品; SDS-PAGE电泳试剂购自上海博彩生物技术有限公司.
1.2.1 细胞培养: HCT8/V及其敏感细胞HCT8在37 ℃、50 mL/L CO2、饱和湿度条件下置于含100 mL/L小牛血清的RPMI 1640完全培养液中, 常规培养. HCT8/V细胞培养体系中加入终浓度为2 mg/L的长春新碱(vincristine, VCR)以维持耐药性, HCT8/V细胞在无药培养液中培养2 wk后进行实验.
1.2.2 MTT法检测HCT8/V细胞的药物敏感性: 取对数生长期人结肠癌敏感细胞株HCT8和耐VCR细胞株HCT8/V, 分别调整细胞浓度至1×108/L, 以每孔100 μL接种于96孔细胞培养板中, 在50 mL/L CO2、饱和湿度、37 ℃孵箱中常规培养, 待细胞贴壁后3-5 h后, 除对照组外各自加入含不同浓度化疗药物的培养基100 μL, 每组设4个复孔. 培养48 h后每孔加入MTT(5 g/L)20 μL, 37℃孵育4 h后弃上清, 加入150 μL DMSO, 震荡混匀使MTT还原产物充分溶解后, 于酶标仪检测570 nm波长处吸光度(A值). 计算细胞的生长抑制率和耐药指数(resistance factor, RF). 计算公式: 生长抑制率 = (1-实验组A平均值/对照组A平均值)×100%; RF = 某种药物针对抗药性细胞的IC50/某种药物针对敏感性细胞的IC50. 以上实验重复3次.
1.2.3 JNK对HCT8/V耐药性的影响: 所用方法同1.2.2, 加VCR 2 h前, 加入JNK抑制剂sp600125 (20 μmol/L). 计算HCT8/V细胞对VCR耐药的降低程度. 逆转指数(reversal index, RI)的计算公式如下: RI = 不加逆转剂时某种药物针对抗药性细胞的IC50/加入逆转剂后某种药物针对抗药性细胞的IC50. 以上实验重复3次.
1.2.4 双荧光素酶活性报告基因检测MDR1启动子质粒转然的表达: 质粒共转染人结肠癌细胞: 按照1×105个细胞/孔的量在96孔板中接种指数生长期的各组细胞中, 在37 ℃, 50 mL/L CO2培养箱中过夜培养, 直到细胞到80%汇片. 在EP管中配置重组质粒PGL3-Basic-MDR1-promoter、内参载体质粒pRL-SV40、转染脂质体Lipofectamine2000复合物. 将重组质粒PGL3-Basic-MDR1-promoter、内参载体质粒pRL-SV40各5 μL/孔(96孔)稀释至25 μL/孔不含血清和抗生素的RPMI 1640中, 用加样枪混合均匀. 然后将脂质体悬液(0.5 μL/孔)加入25 μL/孔不含血清和抗生素的RPMI 1640中, 在室温孵育5 min, 最后将两者混合在一起, 充分混匀静置20 min, 使质粒与脂质体充分结合. 分别吸取接种到96孔板中, 用不含血清和抗生素的RPMI 1640洗1次, 在每个孔中加入50 μL的质粒/脂质体混合物. 在37 ℃, 50 mL/L CO2培养箱中培养3-5 h后, 向各孔加入150 μL的RPMI 1640培养液培养48 h. 收集样品, 进行双荧光素酶活性检测. 双荧光素酶报告基因活性测定: 将转染有pGL3-Basic-mdr1-promoter和pRL-SV40的各组细胞经过一定时间的培养后收集, 吸弃培养基, 用PBS洗1次. 加入裂解液20 μL/孔, 室温摇动15 min. 按照双荧光素酶检测试剂盒(Dual Luciferase Assay System)的操作说明书, 取100 μL Luciferase Assay Buffer Ⅱ于1.5 mL的离心管中, 设定化学发光仪延迟2 s, 发光仪测读10 s, 将全部细胞裂解液加入到离心管中, 用加样枪轻轻抽吸2-3次混匀, 将离心管放入GloMax20/20Luminometer化学发光仪中测萤火虫荧光素酶发光值; 将离心管移出发光仪, 加入100 μL Stop & Glo Reagent, 快速旋涡混匀后, 将离心管重放回发光仪中测海肾荧光素酶发光值.
1.2.5 实时荧光定量PCR检测JNK对人结肠癌细胞内MDR1 mRNA表达的影响: 细胞总RNA的提取: 将各组细胞分别加入RNAiso 1 mL, 用移液器吹打混匀, 分装入EP管中, 每管再加入4 ℃预冷氯仿200 μL, 颠倒混匀, 室温静置5 min, 4 ℃, 12 000 r/min离心15 min. 小心吸出水层, 加入等体积的异丙醇(约500 μL), 混匀, 置于-20 ℃冰箱30 min后, 4 ℃, 12 000 r/min, 离心15 min, 弃上清. 用1 mL 4 ℃预冷的750 mL/L乙醇(DEPC处理水配制)洗涤沉淀, 4 ℃, 8 000 r/min, 离心5 min, 吸弃上清. 静置5 min, 加入60 μL DEPC处理水, 溶解RNA, 生物分光光度计测定RNA浓度, A260/A280为1.8-2.0, RNA产物置-80 ℃冰箱保存备用. 实时荧光定量PCR反应: 首先将mRNA逆转为cDNA, 按试剂盒说明, 取1 000 ng的mRNA, 加入5×Buffer 4 μL, Oligo dT primer 1 μL, Random 6 mers 1 μL, PrimeScriptTM RT Enzyme Mix 1 μL, 再加入RNase Free dH2O至20 μL, 进行反转录反应, 反应条件: 37 ℃ 15 min, 85 ℃ 5 s, 所得cDNA于-20 ℃保存. MDR1和GAPDH引物探针由上海闪晶生物公司设计并合成(表1). 荧光定量PCR反应体系均如下: Premix EX TaqTM 10 μL, Rox Reference Dye 0.4 μL, 上下游引物各0.4 μL, 荧光探针0.8 μL, dH2O 6 μL, cDNA 2 μL, 20 μL体系, 反应条件如下: (1)预变性: 95 ℃ 10 s; (2)变性: 95 ℃ 5 s; (3)退火、延伸: 60 ℃ 31 s, 40个循环, 数据采用ABI 7300 SDS Software分析. 实验重复3次. 相对mRNA表达水平的计算: 每个样本靶基因(检测基因)的相对mRNA表达水平, 能直接用样品各自的内源控制物GAPDH表达来标准化加入的初始RNA量. 即每个样品的靶基因的相对mRNA表达水平可以用以下公式计算: 相对mRNA表达 = 2-ΔCt, ΔCt值 = 靶基因Ct值-GAPDH Ct值. 以GAPDH作为内参照, 每组均做3个样本, 取均数.
| 基因 | 基因号 | 引物 | 探针 |
| MDR1 | NM000927 | Forward: 5'CCACTCCTCCACCTTTGAC3' | |
| Reverse: 5'ACCCTGTTGCTGTAGCCA3' | 5'TTGCCCTCAACGACCACTTTGTC3' | ||
| GAPDH | AF261085 | Forward: 5'CCACTCCTCCACCTTTGAC3' | |
| Reverse: 5'ACCCTGTTGCTGTAGCCA3' | 5'TTGCCCTCAACGACCACTTTGTC3' |
1.2.6 Western blot法检测JNK对HCT8/V细胞中P-gp的影响: 各组细胞用预冷PBS洗2次, 吸弃PBS, 加入预冷的含抑制剂的蛋白质抽提试剂, 轻轻摇动5 min; 后用一预冷的橡胶和塑料细胞刮刮下培养瓶壁上细胞, 转移细胞悬液到离心管中, 冰浴15 min进行裂解. 裂解液于预冷的离心机中14 000 g离心15 min, 吸弃上清; BCA分析试剂测定蛋白质浓度. 50 μg总蛋白质在SDS聚丙烯酰胺凝胶电泳分离后, 电转移至PVDF膜, 膜在5% BSA溶液中室温孵育1 h以封闭膜上的非特异结合. 封闭过的膜加入一级抗体4 ℃过夜, 抗原抗体结合. TBST洗膜3次, 每次5 min,再加入HRP标记的二级抗体以结合一级抗体及HRP标记的抗生物素抗体以结合分子量标准, 室温孵育膜1 h, TBST洗膜3次, 每次5 min; 同样方法标记鼠单克隆抗GAPDH作对照. 洗完膜稍干后, 按1∶1加入AB显影液(与二抗HRP结合), 在Bio-Rad的化学发光成像仪上显影. 然后分析灰度值, 再进行计算灰度系数比.
统计学处理 数据以 mean±SD表示, 多个样本均数间的比较先进行方差齐性检验, 方差相等时采用t检验或者方差分析, 用Stata7.0统计软件处理数据, 以P<0.05表示差别有统计学意义.
HCT8/V耐药细胞不仅对原诱导药物具有高度的耐药性, 耐药倍数达到10.49倍, 同时对结构和作用各异的其他化疗药物亦具有交叉耐药性. HCT8/V对4种化疗药物的IC50值及耐药指数见表2.
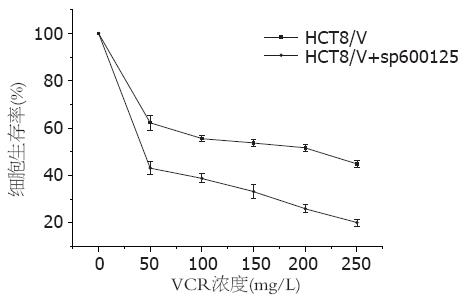
人肠癌MDR细胞被sp600125(20 μmol/L)干预后, 50、100、150、200、250 mg/L不同浓度的VCR对HCT8/V细胞生存率的影响均比对照组有所下降; IC50从191.08 mg/L±18.18 mg/L下降到50.34 mg/L±15.71 mg/L, 两者比较差异有统计学意义(P<0.01, 图1). 提示抑制JNK信号通路的激活可以影响耐药细胞HCT8/V对化疗药物VCR的敏感性(P<0.01).
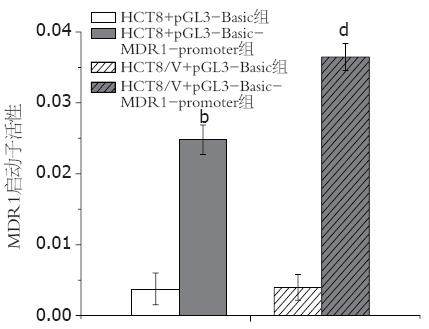
2.3.1 人结肠癌细胞对pGL3-Basic-MDR1启动子转录活性的表达: pGL3-Basic-MDR1转染人结肠癌HCT8和HCT8/V细胞后, MDR1启动子的活性明显高于载体质粒转染对照组(P<0.01). HCT8+pGL3-Basic-MDR1组是HCT8+pGL3-Basic组的6.58倍, 而HCT8/V+pGL3-Basic-MDR1组高于HCT8/V+pGL3-Basic组9.19倍, 提示转染入MDR1基因的肠癌敏感和耐药细胞, 其MDR1基因启动子的荧光素酶活性的表达均高于未转入该基因质粒的对照组(表3, 图2).
| 分组 | MDR1启动子活性 |
| HCT8+pGL3-Basic组 | 0.003767±0.002237 |
| HCT8+pGL3-Basic-MDR1组 | 0.024800±0.002081 |
| HCT8/V+pGL3-Basic组 | 0.003967±0.001801 |
| HCT8/V+pGL3-Basic-MDR1组 | 0.036467±0.001914 |
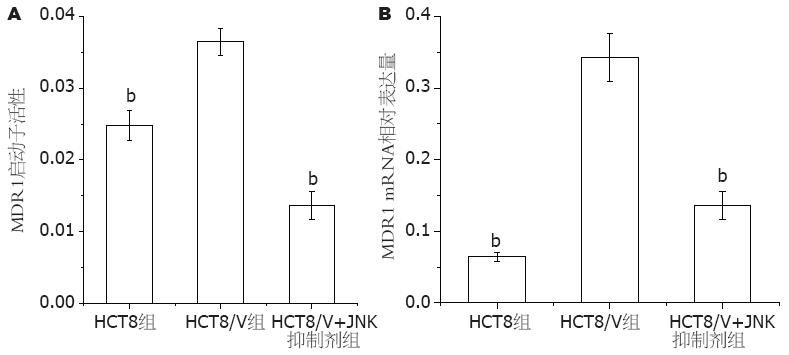
2.3.2 JNK调控HCT8/V细胞MDR1启动子活性的表达: 耐药细胞HCT8/V的MDR1基因启动子的荧光素酶活性呈高表达, JNK抑制剂sp600125(20 μmol/L)作用2 h后, HCT8/V细胞中MDR1基因启动子的荧光素酶活性表达明显降低, 下降了2.68倍, 两者比较差异有统计学意义(P<0.01, 图3A).
敏感细胞HCT8低表达MDR1, 耐药细胞HCT8/V的MDR1 mRNA表达明显高于敏感细胞. JNK抑制剂sp600125(20 μmol/L)作用2 h后, HCT8/V细胞中MDR1表达明显降低, 下降了2.55倍, 两者比较差异有统计学意义(P<0.01, 图3B).
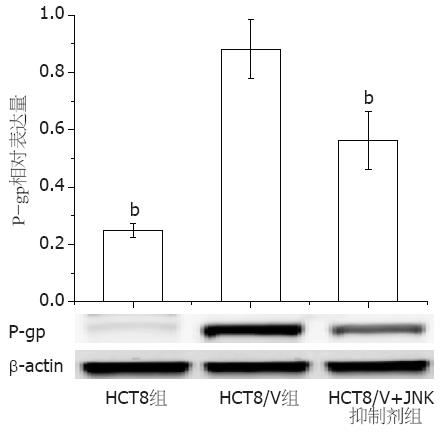
耐药细胞HCT8/V的P-gp蛋白表达明显高于对照组(P<0.01). 并且JNK抑制剂sp600125(20 μmol/L)作用HCT8/V细胞2 h后, P-gp蛋白表达下降了1.57倍, 差异呈显著性(P<0.01, 图4), 提示抑制JNK信号通路的激活后HCT8/V细胞的P-gp表达降低.
MDR是指肿瘤细胞长期接触某一化疗药物, 不仅对此种化疗药物产生耐药性, 而且对其他结构和功能不同的抗肿瘤药物也产生交叉耐药性现象[10-14], 这是造成化疗失败的主要原因. 因此, 探索MDR机制是解决耐药问题、改善化疗效果的关键. 近年来, 人们为逆转肿瘤细胞的MDR进行了大量尝试, 目前能在临床证实跟一些肿瘤耐药相关的基因只有MDR1/P-gp[15-17]. 大量研究认为细胞信号转导通路逆转MDR1的表达有望成为逆转耐药的一个新靶点.
JNK又被称为应激活化蛋白激酶(stress-activated protein kinase, SAPK), 他是哺乳类动物细胞中MAPK家族中的重要一员, 于1991年首次被发现. JNK信号通路可被细胞因子、生长因子、应激(如电离辐射、渗透压、热休克和氧化损伤)等多种因素激活[18-21], 大量实验提示JNK信号通路在细胞分化、细胞凋亡、应激反应以及多种人类疾病的发生与发展中起着至关重要的作用. 在JNK途径中, MAPKKK对MAPKK的丝氨酸、苏氨酸双位点磷酸化而将其活化, JNK接受上游信号被激活后, 可以进一步使核内的转录因子c-Jun氨基末端的第63、73位丝氨酸残基磷酸化, 进而激活c-Jun[22-24]. 激活的JNK通路可通过磷酸化转录因子、细胞骨架相关蛋白、酶类等多种底物来调节细胞的生理过程.
由于目前有关MAPK通路与MDR逆转治疗的研究尚处于起步阶段[25], 两者之间的作用机制仍未清楚[26-28]. sp600125是一种广泛应用的JNK抑制剂, 可阻断JNK信号转导通路[29,30]. 有研究发现[31], 未采用逆转剂抑制P-gp的外排功能, 仅通过抑制JNK/SAPK活性, 可以使耐药细胞株FM3A/M中的P-gp表达降低, 提示JNK的激活可能是介导MDR的原因之一. 进一步研究发现, 其发挥作用的可能是JNK通路中的上游激酶PEBG-SEK. 另有实验证实[32], 在人胃癌耐药细胞EPG85-257/RDB和胰腺癌耐药细胞EPP85-181/RDB中, 阻断JNK信号转导通路, P-gp表达下调, 并发现细胞内抗癌药物浓度增加, 说明JNK信号转导通路与MDR有一定的相关性. Kawasaki等[33]报道, 阻断JNK通路后, 明显降低MCF7/ADR细胞内P-gp的表达, 增加对阿霉素的敏感性, 并推测JNK通路可能是作用于耐药细胞的MDR1基因, 从而使MDR1的转录和翻译增加, 将化疗药物泵出细胞外从而逆转MCF7/ADR细胞的MDR.
本实验证实, JNK特异性抑制剂sp600125能使人结肠癌MDR细胞对VCR更加敏感. JNK特异性抑制剂sp600125能降低细胞的耐药性而增加VCR的细胞杀伤作用, 使HCT8/V细胞凋亡增加, IC50由191.08 mg/L±18.18 mg/L降低到50.34 mg/L±15.71 mg/L. 说明sp600125可以部分逆转细胞的耐药性, 使其耐药性下降. 同时, 采用双荧光素酶活性报告基因检测MDR1启动子质粒转然表达的结果发现, pGL3-Basic-MDR1转染人结肠癌HCT8和HCT8/V细胞后, MDR1启动子的活性明显高于载体质粒转染对照组. 加入JNK抑制剂sp600125(20 μmol/L)2 h后, HCT8/V细胞中MDR1基因启动子的荧光素酶活性表达明显降低, 比耐药组下降了2.52倍. 结果提示阻断JNK通路抑制了信号传导, 使人结肠癌耐药细胞的MDR1的表达降低, 从而降低了细胞的耐药性. 为了更进一步证实这种想法, 我们采用RFQ-PCR检测耐药细胞MDR1 mRNA的表达, Western blot检测P-gp的表达, 结果发现, 抑制JNK通路的激活后, HCT8/V细胞的MDR1/P-gp表达明显降低. 提示肿瘤的耐药性有可能是通过JNK信号传导通路, 作用于细胞的MDRl基因, 从而使MDR1的转录和翻译增加, 调节细胞内的P-gp表达, 将化疗药物泵出细胞外, 产生耐药性[34,35].
总之, 人结肠癌HCT8/V细胞较HCT8细胞具有MDR1基因的高表达, 阻断JNK通路后, 可降低MDR1的表达, 逆转MDR性. 但该信号通路的激活究竟在MDR1的表达过程中发挥怎样的作用, 有待于进一步研究.
多药耐药是肿瘤化疗失败的主要原因, 国内外相继证实了MDR1基因编码的P-糖蛋白途径是肿瘤细胞耐药性发生发展的经典途径. 同时MAPK信号转导途径中的JNK信号通路的激活参与了肿瘤细胞的MDR基因的表达, 但JNK通路参与MDR的机制尚不明确.
牛英才, 副研究员, 齐齐哈尔医学院医药科学研究所
Kawasaki等报道, 阻断JNK通路后, 明显降低MCF7/ADR细胞内P-gp的表达, 增加对阿霉素的敏感性, 并推测JNK通路可能是作用于耐药细胞的MDR1基因, 从而使MDR1的转录和翻译增加, 将化疗药物泵出细胞外从而逆转细胞的MDR.
本研究首次在人肠癌多药耐药细胞中研究P-gp与JNK信号通路的相关性.
JNK通路的激活诱导P糖蛋白的高表达, 对肿瘤多药耐药的发生发展过程起着重要作用, 本研究有助于对人结直肠癌患者化疗失败, 临床症状改善不明显等发病机制的阐明, 并为肿瘤的诊治提供更充分的理论依据.
本文科学性和创新性较强, 能较好地反映我国胃肠病学基础研究的水平.
编辑: 李薇 电编:何基才
| 1. | Goldstein LJ, Galski H, Fojo A, Willingham M, Lai SL, Gazdar A, Pirker R, Green A, Crist W, Brodeur GM. Expression of a multidrug resistance gene in human cancers. J Natl Cancer Inst. 1989;81:116-124. [PubMed] [DOI] |
| 2. | Kuwazuru Y, Yoshimura A, Hanada S, Utsunomiya A, Makino T, Ishibashi K, Kodama M, Iwahashi M, Arima T, Akiyama S. Expression of the multidrug transporter, P-glycoprotein, in acute leukemia cells and correlation to clinical drug resistance. Cancer. 1990;66:868-873. [PubMed] [DOI] |
| 3. | Choi K, Frommel TO, Stern RK, Perez CF, Kriegler M, Tsuruo T, Roninson IB. Multidrug resistance after retroviral transfer of the human MDR1 gene correlates with P-glycoprotein density in the plasma membrane and is not affected by cytotoxic selection. Proc Natl Acad Sci USA. 1991;88:7386-7390. [PubMed] [DOI] |
| 4. | Xia Z, Dickens M, Raingeaud J, Davis RJ, Greenberg ME. Opposing effects of ERK and JNK-p38 MAP kinases on apoptosis. Science. 1995;270:1326-1331. [PubMed] [DOI] |
| 5. | Yoshida K, Behrens A, Le-Niculescu H, Wagner EF, Harada T, Imaki J, Ohno S, Karin M. Amino-terminal phosphorylation of c-Jun regulates apoptosis in the retinal ganglion cells by optic nerve transection. Invest Ophthalmol Vis Sci. 2002;43:1631-1635. [PubMed] |
| 6. | Kinoshita M, Eguchi Y, Hynynen K. Activation of Bak in ultrasound-induced, JNK- and p38-independent apoptosis and its inhibition by Bcl-2. Biochem Biophys Res Commun. 2007;353:515-521. [PubMed] [DOI] |
| 8. | Davis RJ. Signal transduction by the JNK group of MAP kinases. Cell. 2000;103:239-252. [PubMed] [DOI] |
| 9. | Yan F, Wang XM, Liu ZC, Pan C, Yuan SB, Ma QM. JNK1, JNK2, and JNK3 are involved in P-glycoprotein-mediated multidrug resistance of hepatocellular carcinoma cells. Hepatobiliary Pancreat Dis Int. 2010;9:287-295. [PubMed] |
| 10. | Shinoda C, Maruyama M, Fujishita T, Dohkan J, Oda H, Shinoda K, Yamada T, Miyabayashi K, Hayashi R, Kawagishi Y. Doxorubicin induces expression of multidrug resistance-associated protein 1 in human small cell lung cancer cell lines by the c-jun N-terminal kinase pathway. Int J Cancer. 2005;117:21-31. [PubMed] [DOI] |
| 11. | Ferguson LA, Rhoads J. Multidrug-resistant and extensively drug-resistant tuberculosis: The new face of an old disease. J Am Acad Nurse Pract. 2009;21:603-609. [PubMed] [DOI] |
| 12. | Gillet JP, Gottesman MM. Mechanisms of multidrug resistance in cancer. Methods Mol Biol. 2010;596:47-76. [PubMed] [DOI] |
| 13. | Lee CH. Reversing agents for ATP-binding cassette drug transporters. Methods Mol Biol. 2010;596:325-340. [PubMed] [DOI] |
| 14. | Coley HM. Overcoming multidrug resistance in cancer: clinical studies of p-glycoprotein inhibitors. Methods Mol Biol. 2010;596:341-358. [PubMed] [DOI] |
| 16. | Kuo MT. Roles of multidrug resistance genes in breast cancer chemoresistance. Adv Exp Med Biol. 2007;608:23-30. [PubMed] [DOI] |
| 17. | Krupoves A, Seidman EG, Mack D, Israel D, Morgan K, Lambrette P, Costea I, Deslandres C, Grimard G, Law L. Associations between ABCB1/MDR1 gene polymorphisms and Crohn's disease: a gene-wide study in a pediatric population. Inflamm Bowel Dis. 2009;15:900-908. [PubMed] [DOI] |
| 18. | Davis RJ. MAPKs: new JNK expands the group. Trends Biochem Sci. 1994;19:470-473. [PubMed] [DOI] |
| 19. | Chen YR, Wang X, Templeton D, Davis RJ, Tan TH. The role of c-Jun N-terminal kinase (JNK) in apoptosis induced by ultraviolet C and gamma radiation. Duration of JNK activation may determine cell death and proliferation. J Biol Chem. 1996;271:31929-31936. [PubMed] [DOI] |
| 20. | Zanke BW, Boudreau K, Rubie E, Winnett E, Tibbles LA, Zon L, Kyriakis J, Liu FF, Woodgett JR. The stress-activated protein kinase pathway mediates cell death following injury induced by cis-platinum, UV irradiation or heat. Curr Biol. 1996;6:606-613. [PubMed] [DOI] |
| 21. | Butterfield L, Storey B, Maas L, Heasley LE. c-Jun NH2-terminal kinase regulation of the apoptotic response of small cell lung cancer cells to ultraviolet radiation. J Biol Chem. 1997;272:10110-10116. [PubMed] [DOI] |
| 22. | Herdegen T, Skene P, Bähr M. The c-Jun transcription factor--bipotential mediator of neuronal death, survival and regeneration. Trends Neurosci. 1997;20:227-231. [PubMed] [DOI] |
| 23. | Guo YL, Baysal K, Kang B, Yang LJ, Williamson JR. Correlation between sustained c-Jun N-terminal protein kinase activation and apoptosis induced by tumor necrosis factor-alpha in rat mesangial cells. J Biol Chem. 1998;273:4027-4034. [PubMed] [DOI] |
| 24. | Bark H, Choi CH. PSC833, cyclosporine analogue, downregulates MDR1 expression by activating JNK/c-Jun/AP-1 and suppressing NF-kappaB. Cancer Chemother Pharmacol. 2010;65:1131-1136. [PubMed] [DOI] |
| 25. | 盛 雅萍, 李 建芳, 刘 炳亚, 罗 建明, 郑 磊贞, 陈 强, 郭 伟剑. 结肠癌耐药细胞株LoVo/5-FU的建立及其差异表达基因的筛选. 世界华人消化杂志. 2007;15:1899-1904. [DOI] |
| 26. | Steiner E, Holzmann K, Elbling L, Micksche M, Berger W. Cellular functions of vaults and their involvement in multidrug resistance. Curr Drug Targets. 2006;7:923-934. [PubMed] [DOI] |
| 27. | Agarwal R, Agarwal C, Ichikawa H, Singh RP, Aggarwal BB. Anticancer potential of silymarin: from bench to bed side. Anticancer Res. 2006;26:4457-4498. [PubMed] |
| 29. | Bogoyevitch MA, Arthur PG. Inhibitors of c-Jun N-terminal kinases: JuNK no more? Biochim Biophys Acta. 2008;1784:76-93. [PubMed] |
| 30. | Chen X, Wu J, Hua D, Shu K, Wang JZ, Li L, Lei T. The c-Jun N-terminal kinase inhibitor SP600125 is neuroprotective in amygdala kindled rats. Brain Res. 2010;1357:104-114. [PubMed] [DOI] |
| 31. | Kang CD, Ahn BK, Jeong CS, Kim KW, Lee HJ, Yoo SD, Chung BS, Kim SH. Downregulation of JNK/SAPK activity is associated with the cross-resistance to P-glycoprotein-unrelated drugs in multidrug-resistant FM3A/M cells overexpressing P-glycoprotein. Exp Cell Res. 2000;256:300-307. [PubMed] [DOI] |
| 32. | Zhou J, Liu M, Aneja R, Chandra R, Lage H, Joshi HC. Reversal of P-glycoprotein-mediated multidrug resistance in cancer cells by the c-Jun NH2-terminal kinase. Cancer Res. 2006;66:445-452. [PubMed] [DOI] |
| 33. | Kawasaki K, Watanabe M, Sakaguchi M, Ogasawara Y, Ochiai K, Nasu Y, Doihara H, Kashiwakura Y, Huh NH, Kumon H. REIC/Dkk-3 overexpression downregulates P-glycoprotein in multidrug-resistant MCF7/ADR cells and induces apoptosis in breast cancer. Cancer Gene Ther. 2009;16:65-72. [PubMed] [DOI] |
| 34. | van der Kolk DM, de Vries EG, Müller M, Vellenga E. The role of drug efflux pumps in acute myeloid leukemia. Leuk Lymphoma. 2002;43:685-701. [PubMed] [DOI] |
| 35. | Ling X, Zhou Y, Li SW, Yan B, Wen L. Modulation of mitochondrial permeability transition pore affects multidrug resistance in human hepatocellular carcinoma cells. Int J Biol Sci. 2010;6:773-783. [PubMed] |