修回日期: 2011-01-15
接受日期: 2011-01-21
在线出版日期: 2011-03-18
目的: 评价血浆miR-21对胰腺癌的诊断价值, 探究新的胰腺癌诊断标志物.
方法: 对45例胰腺癌患者、45例慢性胰腺炎患者及30例正常对照的血标本进行血浆RNA抽提, 并进行miR-21的实时PCR检测, 分析血浆miR-21相对表达量与临床特征的关系, 评估血浆miR-21对胰腺癌的诊断效能.
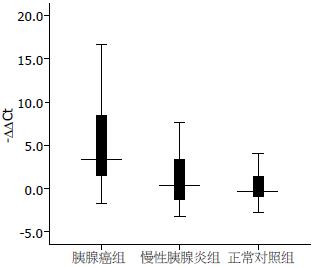
结果: miR-21在胰腺癌患者血浆中的相对表达量显著高于慢性胰腺炎患者及正常对照组(4.7±4.6 vs 1.0±2.9, -0.2±1.8; P<0.01), 胰腺癌患者血浆miR-21水平与肿瘤最大直径和TNM分期无显著相关性. 经Logistic回归及ROC曲线分析, miR-21对在胰腺癌患者和正常对照中诊断胰腺癌的AUC为0.868(95%CI: 0.788-0.948), 敏感性和特异性分别为77.8%和66.7%; 在胰腺癌患者和慢性胰腺炎中诊断胰腺癌的AUC为0.757(95%CI: 0.659-0.855), 敏感性和特异性分别为66.7%和71.7%; 在3组人群中诊断胰腺癌的AUC为0.801(95%CI: 0.721-0.882), 敏感性和特异性分别为71.1%和69.3%.
结论: 血浆miR-21可能成为新的胰腺癌分子诊断标志物.
引文著录: 刘建强, 高军, 任艳, 王小玮, 王卫卫, 路华. 血浆miR-21对胰腺癌的诊断价值. 世界华人消化杂志 2011; 19(8): 860-863
Revised: January 15, 2011
Accepted: January 21, 2011
Published online: March 18, 2011
AIM: To evaluate the diagnostic value of plasma miR-21 as a tumor biomarker in patients with pancreatic cancer.
METHODS: Forty-five patients with pancreatic ductal adenocarcinoma (PDAC), 45 patients with chronic pancreatitis, and 30 normal people were included in the study. Total RNA was extracted from plasma samples for measurement of miR-21 levels using real-time PCR. The relationship between miR-21 levels and clinical characteristics of PDAC patients was analyzed.
RESULTS: The relative abundance of plasma miR-21 was significantly higher in the PDAC group than in the chronic pancreatitis and normal group (4.7 ± 4.6 vs 1.0 ± 2.9, -0.2 ± 1.8, both P < 0.01). Plasma miR-21 levels showed no significant correlation with tumor diameter or TNM stage in PDAC patients. For discriminating PDAC patients from normal people, the area under the receiver operating characteristic curve (AUC-ROC) for plasma miR-21 was 0.868 (95%CI: 0.788-0.948), and the sensitivity and specificity were 77.8% and 66.7%%, respectively. For discriminating PDAC patients from those with chronic pancreatitis, the AUC-ROC was 0.757 (95%CI: 0.659-0.855), and the sensitivity and specificity were 66.7% and 71.7%, respectively. For discriminating PDAC patients from those with chronic pancreatitis and normal people, the AUC-ROC was 0.801 (95%CI: 0.721-0.882), and the sensitivity and specificity were 71.1% and 69.3%, respectively.
CONCLUSION: Plasma miR-21 may be a new pancreatic cancer biomarker.
- Citation: Liu JQ, Gao J, Ren Y, Wang XW, Wang WW, Lu H. Diagnostic value of plasma miR-21 in pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(8): 860-863
- URL: https://www.wjgnet.com/1009-3079/full/v19/i8/860.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i8.860
胰腺癌是一类早期发现困难、预后极差的消化系统恶性肿瘤, 手术切除率仅为10%-15%, 5年生存率低于5.0%[1]. 由于早期无明显症状加之诊断手段的局限性, 多数胰腺癌患者确诊时已到晚期并且大多发生了远处转移, 因而无法手术根治. 放化疗虽然一定程度上延长了生存期, 但大多预后不良, 中位生存期≤24 mo. 目前血清CA19-9在胰腺癌诊断中的敏感性为70%-80%[2], 而特异性甚至不到50%[3], 这就需要发现新的胰腺癌肿瘤标志物. 随着分子生物学技术的飞速发展, 基因组学、蛋白质组学等高通量研究方法不断进步, 众多研究结果表明微小RNA(microRNA, miRNA)与肿瘤的发病及预后相关, 但血浆miRNA是否可用于胰腺癌诊断尚不清楚.
2008-01/2009-12中国人民解放军第二军医大学附属长海医院收治的45例胰腺癌患者和45例慢性胰腺炎患者, 所有胰腺癌患者均经手术病理证实. 慢性胰腺炎患者为通过影像学诊断, 并随访半年以上无肿瘤发生. 30例正常对照为年龄、性别匹配的健康体检者, 血清CA19-9、CEA及腹部超声均未见异常, 无任何肿瘤病史. 血浆miRNA逆转录试剂盒Taqman microRNA Reverse Transcription Kit和实时定量PCR试剂盒Taqman microRNA Assays购自Applied Biosystems公司. 线虫miRNA cel-miR-39购自Qiagen公司; hsa-miR-21和cel-miR-39探针购自Applied Biosystems公司. PCR仪为Biometra Tprofessional standard Gradient Thrmocycler, ABI 7500型定量PCR仪(Applied Biosystems).
1.2.1 血浆准备: 采集患者的EDTA抗凝外周静脉血2 mL, 在常温下2 h内进行处理. 血标本在4 ℃下1 200 g离心10 min, 转移上层血浆至1.5 mL Eppendorf管, 然后在4 ℃下12 000 g离心10 min去除细胞成分. 转移血浆至新的1.5 mL Eppendorf管, -80 ℃保存以备miRNA抽提. 血浆miRNAs抽提: 每份血浆标本取200 μL加入50 pmol/L的cel-miR-39 5 μL, 然后加入20 μL 5 mol/L的醋酸和750 μL的TRI Regent BD. RNA抽提按TRI Regent BD的操作步骤进行, 抽得的RNA用40 μL的无核酸酶水溶解后-80 ℃保存.
1.2.2 血浆miRNA检测: 切取2 μL抽得的RNA用TaqMan microRNA Reverse Transcription Kit进行反转, 反转的反映条件为16 ℃ 30 min, 42 ℃ 30 min, 85 ℃ 5 min, 4 ℃ hold. 取反转产物2 μL作为模板, 用TaqMan Universal Master Mix Ⅱ试剂盒进行Real Time PCR检测, 所有反应采用三复孔, 反应条件为95 ℃ 1 min, 然后95 ℃ 15 s, 60 ℃ 30 s, 50个循环. 采用ABI 7500实时定量PCR仪进行检测, Ct值用SDS2.1软件计算, cel-miR-39作为内参, 相对定量值 = -ΔΔCt = -[(标本Cttarget-标本Ctcel-miR-39)-(参照Cttarget-参照Ctcel-miR-39)].
统计学处理 采用SPSS15.0统计软件进行处理. 计量资料采用mean±SD表示, 相对表达量成偏态分布、方差不齐采用Mann-Whitney U检验. 建立Logistic回归模型, 应用ROC曲线评价诊断效能. P<0.05为差异有统计学意义.
45例胰腺癌患者均经手术病理确诊, 均为导管腺癌. 男28例, 女17例, 中位年龄62(32-85)岁. 其中胰头癌31例, 胰体尾癌14例. TNM分期Ⅰ期8例、Ⅱ期10例、Ⅲ期11例, Ⅳ期16例.
胰腺癌患者的血浆miRNA水平显著高于慢性胰腺炎患者及正常对照组(P<0.01, 图1). 慢性胰腺炎患者血浆miRNA水平高于正常对照组, 但差异无统计学意义.
血浆miR-21水平与胰腺癌患者年龄、性别、肝功能、空腹血糖、肿瘤最大直径及肿瘤TNM分期无显著相关性, 但与CA19-9呈显著负相关(P = 0.009, 表1).
| 临床特征 | mean±SD | miR-21 | |
| r值 | P值 | ||
| 性别 | 0.024 | 0.878 | |
| 年龄(岁) | 61.81±10.57 | -0.265a | 0.078 |
| CA19-9(kU/L) | 528.70±440.20 | -0.386a | 0.009 |
| 总胆红素(μmol/L) | 84.60±102.60 | -0.175a | 0.250 |
| ALT(U/L) | 105.60±103.10 | 0.105a | 0.492 |
| AST(U/L) | 76.50±64.20 | 0.027a | 0.858 |
| 空腹血糖(mmol/L) | 6.10±1.80 | -0.005a | 0.976 |
| 肿瘤最大直径(cm) | 4.38±1.54 | 0.217a | 0.211 |
| T stage | -0.146 | 0.339 | |
| N stage | -0.227 | 0.134 | |
| M stage | -0.071 | 0.645 | |
| 临床分期 | -0.179 | 0.240 | |
根据Logistic回归模型计算血浆miR-21的ROC曲线下面积, 在胰腺癌+正常、胰腺癌+慢性胰腺炎、胰腺癌+慢性胰腺炎+正常的3组人群中诊断胰腺癌的AUC分别为0.868(95%CI: 0.788, 0.948)、0.757(95%CI: 0.659, 0.855)和0.801(95%CI: 0.721, 0.882).
根据不同人群中血浆miR-21相对表达量建立的Logistic回归模型, miR-21在鉴别胰腺癌与正常、胰腺癌与慢性胰腺炎中的准确性分别为73.3%和68.9%, 在胰腺癌+慢性胰腺炎+正常人群中诊断胰腺癌的敏感性和特异性分别为71.1%、69.3%, 准确性为70.0%(表2)
| 敏感性 | 特异性 | 准确性 | 阳性预测值 | 阴性预测值 | |
| 胰腺癌组 vs 正常组 | 77.8 | 66.7 | 73.3 | 77.8 | 66.7 |
| 胰腺癌组 vs 慢性胰腺炎组 | 66.7 | 71.1 | 68.9 | 73.2 | 65.3 |
| 胰腺癌组 vs 慢性胰腺炎+正常组 | 71.1 | 69.3 | 70.0 | 58.2 | 80.0 |
miRNA是一类内源性的非编码调控单链小分子RNA, 长度约18-25个核苷酸, 通过对mRNA的调控, 参与基因表达的调节[4], 其表达异常可导致肿瘤等疾病的发生[5-7]. Calin等[8]的研究表明, 50%以上的miRNA定位在肿瘤相关基因组区域, 其表达水平在许多肿瘤中发生改变, 可能起到原癌基因或抑癌基因的作用. 由于miRNA在不同肿瘤组织中具有特异性的miRNA表达谱, 提示miRNA可以作为新的肿瘤标志物.
作为具有癌基因特性的miRNA, miR-21在胰腺癌[9,10]、食管癌[11]、肺癌[12]及结肠癌[13]等恶性肿瘤中高表达, 并通过抑制凋亡而与肿瘤的发生及进展有关[14]. 而且组织中miR-21在胰腺癌组织中的表达显著高于慢性胰腺炎和正常胰腺[9], 尽管miR-21与肿瘤大小、分期、是否淋巴结转移无关, 但miR-21高表达与胰腺癌不良预后有关[15].
在本研究中, 血浆miR-21在胰腺癌血浆中相对表达量显著高于慢性胰腺炎和正常对照组, 而在慢性胰腺炎和正常组之间血浆miR-21表达量无统计学差异. 而且血浆miR-21水平与胰腺癌患者的年龄、性别、肿瘤最大直径及肿瘤TNM分期等临床特征之间无显著相关性, 这与Dillhoff等在胰腺癌组织中的研究结果一致[15]. miR-21在胰腺癌血浆中的表达水平及特点与在组织中的研究结果高度一致, 这也进一步证实了miR-21可能为胰腺癌特异的miRNA. 由于血清CA19-9与胰腺癌肿瘤大小和分期相关[16], 因此在本研究中血浆miR-21与血清CA19-9呈显著负相关. Logistic回归及ROC曲线分析表明血浆miR-21在胰腺癌和正常、胰腺癌和慢性胰腺炎、胰腺癌和慢性胰腺炎及正常等3组人群中诊断胰腺癌有一定的实用价值, 而且在3组人群中诊断胰腺癌的敏感性和特异性较理想.
目前胰腺癌诊断和治疗的现状决定了如何提高胰腺癌早期诊断水平仍然是一个困难而紧迫的问题. 本研究采用TaqMan miRNA试剂盒检测血浆miR-21, 操作快速、简单,灵敏度高, 仅需50 μL血浆即可完成稳定的定量检测. 血浆miR-21在胰腺癌患者中的特征与以往在组织中的研究结果高度一致, 表明血浆miRNA可反映组织中miRNA的表达情况, 这也提示我们血浆miR-21可作为新的胰腺癌诊断标志物. 随着研究的深入, 在血浆miRNA中可能会发现更为理想的胰腺癌标志物, 从而有助于提高胰腺癌的诊断水平, 改善胰腺癌的治疗效果及预后.
胰腺癌手术切除率低、预后极差, 5年生存率低于5.0%, 根本原因在于胰腺癌早期发现困难. 由于血清CA19-9等标志物在胰腺癌诊断中的敏感性和特异性不理想, 因此临床急需发现新的胰腺癌肿瘤标志物.
周国雄, 主任医师, 南通大学附属医院消化内科
miRNA通过对基因表达的沉默调控, 参与了肿瘤细胞增殖、分化、凋亡等过程的调节, 并通过分泌微囊等方式进入外周血中, 因此血浆中miRNA有可能成为胰腺癌诊断标志物.
研究表明, miR-21通过抑制细胞凋亡而与肿瘤的发生及进展有关, 并在胰腺癌组织中显著高表达, 而且其高表达水平与胰腺癌不良预后相关.
本文通过对胰腺癌、慢性胰腺炎及正常人群血浆miR-21相对表达量的检测, 分析其与胰腺癌临床特征的相关性, 评估了血浆miR-21作为胰腺癌分子标志物的诊断效能.
本研究采用Realtime PCR方法检测血浆miR-21的表达水平, 研究结果表明血浆miR-21可在胰腺癌和慢性胰腺炎及正常人群中鉴别诊断胰腺癌, 血浆miRNA可能成为新的胰腺癌诊断标志物.
本文方法先进, 数据统计可靠, 结论可信, 对临床有较好的应用价值.
编辑: 李薇 电编:李薇
| 1. | Kuhlmann KF, de Castro SM, Wesseling JG, ten Kate FJ, Offerhaus GJ, Busch OR, van Gulik TM, Obertop H, Gouma DJ. Surgical treatment of pancreatic adenocarcinoma; actual survival and prognostic factors in 343 patients. Eur J Cancer. 2004;40:549-558. [PubMed] [DOI] |
| 2. | Slesak B, Harlozinska-Szmyrka A, Knast W, Sedlaczek P, van Dalen A, Einarsson R. Tissue polypeptide specific antigen (TPS), a marker for differentiation between pancreatic carcinoma and chronic pancreatitis. A comparative study with CA 19-9. Cancer. 2000;89:83-88. [PubMed] [DOI] |
| 3. | Ni XG, Bai XF, Mao YL, Shao YF, Wu JX, Shan Y, Wang CF, Wang J, Tian YT, Liu Q. The clinical value of serum CEA, CA19-9, and CA242 in the diagnosis and prognosis of pancreatic cancer. Eur J Surg Oncol. 2005;31:164-169. |
| 4. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] [DOI] |
| 5. | Slack FJ, Weidhaas JB. MicroRNA in cancer prognosis. N Engl J Med. 2008;359:2720-2722. [PubMed] [DOI] |
| 6. | Visone R, Croce CM. MiRNAs and cancer. Am J Pathol. 2009;174:1131-1138. [PubMed] [DOI] |
| 7. | Mirnezami AH, Pickard K, Zhang L, Primrose JN, Packham G. MicroRNAs: key players in carcinogenesis and novel therapeutic targets. Eur J Surg Oncol. 2009;35:339-347. [PubMed] [DOI] |
| 8. | Calin GA, Dumitru CD, Shimizu M, Bichi R, Zupo S, Noch E, Aldler H, Rattan S, Keating M, Rai K. Frequent deletions and down-regulation of micro- RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc Natl Acad Sci U S A. 2002;99:15524-15529. [PubMed] [DOI] |
| 9. | Bloomston M, Frankel WL, Petrocca F, Volinia S, Alder H, Hagan JP, Liu CG, Bhatt D, Taccioli C, Croce CM. MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis. JAMA. 2007;297:1901-1908. [PubMed] [DOI] |
| 10. | Lee EJ, Gusev Y, Jiang J, Nuovo GJ, Lerner MR, Frankel WL, Morgan DL, Postier RG, Brackett DJ, Schmittgen TD. Expression profiling identifies microRNA signature in pancreatic cancer. Int J Cancer. 2007;120:1046-1054. [PubMed] |
| 11. | Feber A, Xi L, Luketich JD, Pennathur A, Landreneau RJ, Wu M, Swanson SJ, Godfrey TE, Litle VR. MicroRNA expression profiles of esophageal cancer. J Thorac Cardiovasc Surg. 2008;135:255-260; discussion 260. [PubMed] [DOI] |
| 12. | Yanaihara N, Caplen N, Bowman E, Seike M, Kumamoto K, Yi M, Stephens RM, Okamoto A, Yokota J, Tanaka T. Unique microRNA molecular profiles in lung cancer diagnosis and prognosis. Cancer Cell. 2006;9:189-198. [PubMed] [DOI] |
| 13. | Schetter AJ, Leung SY, Sohn JJ, Zanetti KA, Bowman ED, Yanaihara N, Yuen ST, Chan TL, Kwong DL, Au GK. MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma. JAMA. 2008;299:425-436. [PubMed] [DOI] |
| 14. | Chan JA, Krichevsky AM, Kosik KS. MicroRNA-21 is an antiapoptotic factor in human glioblastoma cells. Cancer Res. 2005;65:6029-6033. [PubMed] [DOI] |
| 15. | Dillhoff M, Liu J, Frankel W, Croce C, Bloomston M. MicroRNA-21 is overexpressed in pancreatic cancer and a potential predictor of survival. J Gastrointest Surg. 2008;12:2171-2176. [PubMed] [DOI] |