修回日期: 2011-02-28
接受日期: 2011-03-08
在线出版日期: 2011-03-18
目的: 观察双歧杆菌分泌型黏附素对肠上皮细胞形态学变化的影响.
方法: 肠上皮细胞经LPS、H2O2和双歧杆菌分泌型黏附素预孵处理后, 采用光镜、透射电镜和丫啶橙染色分别观察其形态学的变化.
结果: 光镜下观察见LPS或H2O2处理组细胞变小、变圆, 胞质颗粒明显增多, 部分细胞脱落漂浮于培养基中; 先经黏附素处理后, 变小、变圆, 胞质颗粒增多的细胞较单独LPS或H2O2处理组明显减少, 梭形细胞增多. 透射电镜和丫啶橙染色观察细胞形态学变化发现, LPS和H2O2处理组可见较多凋亡细胞, 核浓缩, 聚集于核周边或裂解成碎片; 而先经黏附素处理后, 凋亡细胞数则明显减少.
结论: 双歧杆菌分泌型黏附素可抑制LPS和H2O2对肠上皮细胞的损害作用, 对肠上皮细胞有保护作用.
引文著录: 钟世顺, 李淑梅, 张振书. 双歧杆菌分泌型黏附素对肠上皮细胞形态学的影响. 世界华人消化杂志 2011; 19(8): 836-840
Revised: February 28, 2011
Accepted: March 8, 2011
Published online: March 18, 2011
AIM: To observe the effect of Bifidobacterial secretory adhesin on the morphology of human intestinal epithelial cells in vitro.
METHODS: After human intestinal epithelial cells were pretreated with adhesin and then incubated with LPS or H2O2, cell morphological changes were observed by light microscopy, electron microscopy and acridine orange staining.
RESULTS: Light microscopic analysis showed that cells became smaller and rounder with abundant granules in the cytoplasm after treatment with LPS or H2O2. In addition, some cells shed and floated on culture medium. Acridine orange staining and electron microscopic analysis showed that LPS or H2O2 induced the apoptosis of Lovo cells. Ultrastructural changes consist of nuclear condensation, margination and fragmentation of nuclear chromatin. Pretreatment with adhesion significantly improved the above morphological changes and reduced the number of apoptotic cells in cells treated with LPS or H2O2.
CONCLUSION: Bifidobacterial adhesin could protect intestinal epithelial cells from LPS- and H2O2-induced damage.
- Citation: Zhong SS, Li SM, Zhang ZS. Protective effect of Bifidobacterial secretory adhesin on intestinal epithelial cells in vitro: a morphological observation. Shijie Huaren Xiaohua Zazhi 2011; 19(8): 836-840
- URL: https://www.wjgnet.com/1009-3079/full/v19/i8/836.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i8.836
正常肠屏障功能的维持依赖于完整的肠黏膜上皮、肠道内正常菌群、肠道内分泌物、蠕动、肠道免疫功能等, 其中最关键的是肠黏膜上皮屏障. 正常情况下, 肠道上皮细胞具有屏障作用, 可防止肠道内细菌和内毒素侵入血液循环. 因此, 有效维持肠黏膜结构的完整性、保护肠黏膜机械屏障, 对减轻肠道细菌和内毒素易位、防治肠源性感染及并发症都具有重要意义. 我们采用光镜、透射电镜和丫啶橙染色分别观察了肠上皮Lovo细胞经LPS、H2O2和双歧杆菌分泌型黏附素预孵处理后的生长情况、形态改变及其超微结构的变化, 以了解双歧杆菌分泌型黏附素对肠上皮细胞形态学变化的影响.
肠上皮细胞系Lovo细胞引自南方医科大学病理教研室, 将Lovo细胞置于含100 mL/L热灭活小牛血清、青霉素100 kU/L和链霉素100 mg/L的RPMI 1640培养基(37 ℃、50 mL/L CO2)中培养. 待细胞铺满瓶底后用于实验.
1.2.1 双歧杆菌分泌型黏附素的提取及纯化: 按郑跃杰等[1]报道的方法, 将细菌接种于硫乙醇酸盐液体培养基, 置厌氧培养箱37 ℃培养48 h离心收集培养上清, 经饱和硫酸铵沉淀, Superdex75柱凝胶过滤, Q-Sepharose FF离子交换层析后, 收集第一峰, 其相对分子量为16 000 Da, 冻干保存.
1.2.2 分组及光镜观察: 取对数生长期细胞, 黏附素(30 mg/L)预孵30 min后再加入LPS(100 µg/L)(黏附素+LPS处理组)、H2O2(200 µmol/L)(黏附素+H2O2处理组)或直接加入LPS(100 µg/L)(LPS处理组)、H2O2(200 µmol/L)(H2O2处理组)处理细胞3 h后, 将细胞培养瓶放在倒置显微镜下观察细胞形态, 并拍照.
1.2.3 透射电镜标本的制作和观察: 细胞经0.2%胰蛋白酶消化后, 收集于离心管中, 2 000 r/min离心沉淀, 用新鲜预冷的2.5%戊二醛4 ℃固定72 h, 0.2 mol/L PBS漂洗15 min, 共4次; 1%锇酸避光后固定2 h, 再用0.2 mol/L PBS漂洗15 min, 共4次; 丙酮脱水: 50%、70%、90%各15 min, 100% 15 min共3次; 纯丙酮:树脂(1:1)浸透1 h, 纯丙酮:树脂(1:2)浸透2 h, 纯树脂过夜. 胶囊内包埋, 72 ℃烤箱聚合8 h. 超薄切片, 醋酸铀-柠檬酸铅双染色, 透射电镜(日立H-600)观察.
1.2.4 丫啶橙染色: 根据《分子生物学常用实验方法》[2]进行染色. 滴加经各处理因素处理的细胞悬液于载玻片上, 成单细胞层. 甲醇固定5 min, 丫啶橙染色, 荧光显微镜下观察.
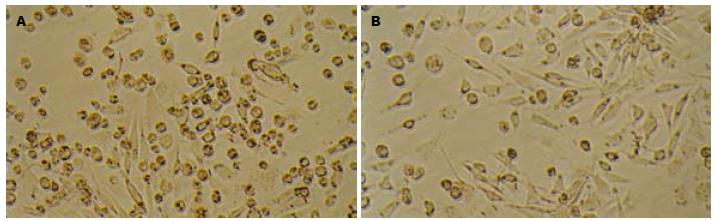
正常对照组细胞大小均匀一致, 呈梭形或圆形, 胞质透明, 几无颗粒; LPS或H2O2处理组细胞均表现为变小、变圆, 胞质颗粒明显增多, 部分细胞脱落漂浮于培养基中(图1A); 先经黏附素处理后, 变小、变圆, 胞质颗粒增多的细胞均较LPS或H2O2处理组明显减少, 梭形细胞增多(图1B).
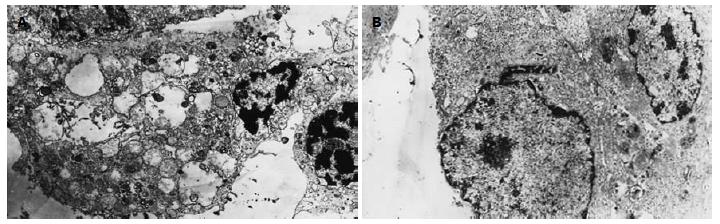
正常对照组细胞膜完整, 核圆形或椭圆形, 核大, 核浆比例大, 核仁区容易见到, 核内染色质分布均匀, 线粒体和内质网等细胞器清晰、无肿胀, 未见凋亡细胞. H2O2、LPS处理3 h细胞的透射电镜观察均表现为: 凋亡细胞多见, 细胞皱缩, 胞体缩小, 胞膜完整, 核缩小, 核膜完整, 染色质凝集、致密, 呈颗粒、块状均质无结构样物质, 分布在核膜内侧, 电子密度较高. 有些核呈环状分布于核膜内侧. 部分线粒体肿胀、模糊, 嵴断裂, 甚至可见空泡变性. 内质网轻度扩张, 部分脱颗粒(图2A). 黏附素预先处理后, 电镜观察见二组凋亡细胞均明显减少, 镜下所见大部与正常肠上皮细胞组相同(图2B).
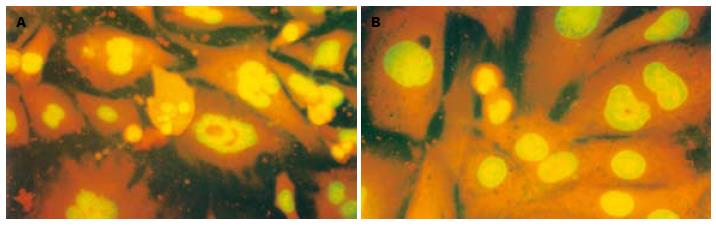
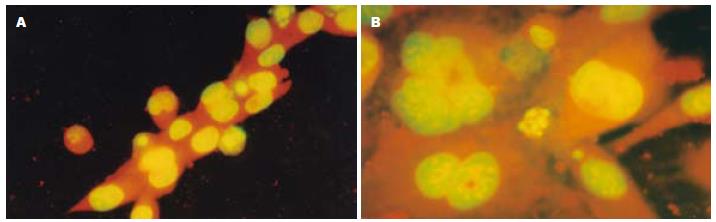
在荧光显微镜下, 正常对照组细胞胞核染色均匀, 呈黄绿色, 核浆比例一致. LPS处理组既可见细胞核处于分裂状态的增殖细胞, 又可见凋亡细胞, 其染色质呈浓染的块状或颗粒状荧光, 聚集于核周边或裂解成碎片(图3A); 而先经黏附素处理后, 增殖和凋亡细胞均明显减少(图3B); 而H2O2处理组可见更多凋亡细胞, 增殖细胞数量则较少(图4A); 先经黏附素处理后, 凋亡细胞数明显减少(图4B).
研究发现肠道不仅是消化和吸收营养素的器官, 也是阻止肠腔内细菌、毒素等有害物质侵入体内的重要屏障, 以及调节机体应激反应、生成炎症介质的重要器官, 在多功能障碍综合征(multiple organ dysfunction syndrome, MODS)的发生发展中起重要作用[3]. 双歧杆菌是人体肠道中一种最重要的生理菌, 对人体健康具有重要意义, 已有大量有关双歧杆菌黏附肠黏膜细胞、调节肠道免疫、阻断病原菌黏附提高黏膜屏障功能、抗肠道致病菌感染的报道[4-11]. 但双歧杆菌活菌制剂在应用于肠屏障功能障碍时也存在几个问题: 一是制造与保存活菌制剂的难度较大, 二是活菌在肠屏障功能障碍患者可能由于局部气体和生长底物的不足而难以足量繁殖, 且如果该菌穿过肠壁, 也可促进败血症的发生, 因此开发无细胞制剂应是以后发展的重点. 因此, 我们应用从青春型双歧杆菌1027株耗尽培养上清液中纯化出的一种相对分子质量为16 000 Da的蛋白质[12], 体外观察了双歧杆菌分泌型黏附素对经LPS、H2O2处理后肠上皮Lovo细胞形态学变化的影响.
LPS是革兰氏阴性菌细胞壁的主要成分之一, 由特异性多糖、核心多糖和脂类A组成. 当来自于肠道的和感染部位的革兰氏阴性菌产生的内毒素易位并大量进入体内引起炎症介质的大量合成、释放, 最终发生脓毒血症[13]. 脓毒血症时肠上皮细胞增生增多, 未成熟上皮细胞的比例增高, 肠细胞坏死及程序性死亡均增多. LPS还可增加机体NO、TNF-α等细胞因子的产生, 继而通过细胞因子介导组织损伤, 引起严重的炎症反应, 导致肠黏膜屏障功能不全[14-16]. Olaya等[17]研究发现LPS能促进肠上皮细胞IEC-6和LS-123的DNA合成, 脂类A至少部分参与了LPS的细胞丝裂原作用. 我们的研究也表明, 100 µg/L的LPS作用于肠上皮细胞时, 细胞增殖增加, 凋亡也增加. 尽管细胞增殖可能是维持组织完整性的重要的生理反应, 但由于NO、TNF-α等细胞因子以及细胞凋亡的逐渐增加, 肠黏膜屏障的完整性将逐渐受到破坏, 肠道细菌、内毒素易位, 导致肠屏障功能不全乃至衰竭. 而双歧杆菌纯化黏附素能抑制LPS对肠上皮细胞的这种促增殖、促凋亡作用, 显微镜下观察可见细胞形态保持良好. 提示纯化黏附素可能与LPS竞争肠上皮细胞上的结合位点, 使细胞形态保持完整, 从而维持肠上皮细胞增殖与凋亡间的生理平衡和肠黏膜屏障的完整性.
过氧化物自由基对细胞的作用存在一个剂量效应和时间效应关系, 高剂量有直接杀伤作用, 中剂量可引发凋亡, 低剂量具有细胞丝裂原的作用, 可刺激细胞增殖[18]. 在各种体外实验模型中, 如过氧化氢或超氧根离子等氧化剂能提高肠上皮细胞通透性, 并能通过促进过多的肌动蛋白聚合作用来破坏细胞骨架, 而细胞骨架是肠黏膜保持完整性的关键组成部分[19]. 反应性氧代谢产物能引起ATP耗竭[20], 也是引起肠屏障功能不全的一个重要因素. 有研究表明[21], 活性氧可以通过刺激线粒体释放细胞色素C引起caspases类的活化, 从而触发细胞凋亡发生的级联反应. 目前认为, 活性氧可能是细胞凋亡发生过程中普遍存在的中间介质[22]. Gu等[23]的研究表明, H2O2可通过抑制NF-κB的降解从而促进肠上皮细胞凋亡, 且这种作用具有浓度依赖性. 本研究采用200 µmol/L的H2O2作用于肠上皮Lovo细胞, 发现具有明显的抑制细胞增殖和促进细胞凋亡的作用. 肠上皮细胞增殖受到抑制, 凋亡增加将使肠黏膜细胞的数量不断减少, 肠通透性增强, 最终使肠黏膜屏障功能遭到破坏. 而预先经双歧杆菌纯化黏附素处理后, H2O2的这两种作用均明显减弱. 但其作用机制还不十分清楚, 有待进一步研究.
细胞凋亡不仅是机体细胞生理性死亡现象, 而且也参与了许多疾病的发病过程. LPS和活性氧的释放都可以通过诱导肠上皮细胞的死亡, 参与肠黏膜结构屏障的损伤. 细胞死亡可分为坏死和凋亡两种, 发生坏死时, 细胞肿大, 胞质和胞核溶解, 胞内物质溢出, 导致周围组织发生炎症; 凋亡是程序性细胞死亡(programmed cell death, PCD)在形态学上的独特形式. 表现为凋亡早期细胞间连接疏松, 胞质浓缩、细胞体积变小; 细胞核固缩, 染色质凝集成块, 靠近核膜; 胞质膜突起形成质膜小包, 继而胞核和细胞外形皱缩, DNA分子被特异性核酸内切酶切断, 核裂解形成凋亡小体被排出细胞外; 最后, 凋亡小体被邻近吞噬细胞、上皮细胞等吞噬, 并将其降解和消化[24]. 形态学观察是判断凋亡最客观的方法之一[25]. 我们用H2O2、LPS作用肠上皮Lovo细胞3 h诱导其凋亡, 电镜观察其超微结构特点是: 细胞皱缩, 胞体缩小, 胞膜完整, 核缩小, 核膜完整, 染色质凝集、致密, 向核膜下集中, 形成染色质块; 部分线粒体肿胀、模糊, 嵴断裂, 内质网轻度扩张, 部分脱颗粒. 而使用双歧杆菌分泌型黏附素预孵30 min后, 透射电镜观察发现凋亡细胞明显减少, 形态学上表现为胞膜完整, 核大, 核浆比例增大, 核仁区容易见到, 核内染色质分布均匀, 线粒体和内质网等细胞器清晰、无肿胀, 与正常肠上皮细胞类似. 我们的实验结果表明: H2O2、LPS作用肠上皮Lovo细胞3 h可以诱导细胞凋亡, 以凋亡早、中期的变化特征为主. 而双歧杆菌分泌型黏附素可抑制这种作用, 从而有效维持肠黏膜屏障的完整性.
总之, 本研究表明, 在体外, 双歧杆菌分泌型黏附素能抑制LPS和H2O2对肠上皮细胞的损害作用, 有效地维持肠黏膜上皮细胞增殖与凋亡的平衡, 从而保持肠黏膜屏障功能的完整性. 这也为肠黏膜屏障功能障碍的临床防治提供了一条新的思路.
正常情况下, 肠道上皮细胞具有屏障作用, 可防止肠道内细菌和内毒素侵入血液循环. 因此, 有效维持肠黏膜结构的完整性、保护肠黏膜机械屏障, 对减轻肠道细菌和内毒素易位、防治肠源性感染及并发症都具有重要意义.
姚登福, 教授, 南通大学附属医院分子医学中心; 谭学瑞, 教授, 汕大医学院第一附属医院
活菌在肠屏障功能障碍患者可能由于局部气体和生长底物的不足而难以足量繁殖, 且如果该菌穿过肠壁, 也可促进败血症的发生, 因此开发无细胞制剂应是以后发展的重点.
Gu等的研究表明, H2O2可通过抑制NF-κB的降解从而促进肠上皮细胞凋亡, 且这种作用具有浓度依赖性.
双歧杆菌分泌型黏附素可抑制LPS和H2O2对肠上皮细胞的损害作用, 对肠上皮细胞有保护作用.
本文创新性和学术性较好, 能反映我国胃肠病学基础研究水平.
编辑: 曹丽鸥 电编:何基才
| 3. | Ljungdahl M, Lundholm M, Katouli M, Rasmussen I, Engstrand L, Haglund U. Bacterial translocation in experimental shock is dependent on the strains in the intestinal flora. Scand J Gastroenterol. 2000;35:389-397. [PubMed] [DOI] |
| 4. | Liu C, Zhang ZY, Dong K, Guo XK. Adhesion and immunomodulatory effects of Bifidobacterium lactis HN019 on intestinal epithelial cells INT-407. World J Gastroenterol. 2010;16:2283-2290. [PubMed] [DOI] |
| 5. | Bai AP, Ouyang Q, Zhang W, Wang CH, Li SF. Probiotics inhibit TNF-alpha-induced interleukin-8 secretion of HT29 cells. World J Gastroenterol. 2004;10:455-457. [PubMed] |
| 6. | Trejo FM, Minnaard J, Perez PF, De Antoni GL. Inhibition of Clostridium difficile growth and adhesion to enterocytes by Bifidobacterium supernatants. Anaerobe. 2006;12:186-193. [PubMed] [DOI] |
| 7. | Collado MC, Gueimonde M, Hernández M, Sanz Y, Salminen S. Adhesion of selected Bifidobacterium strains to human intestinal mucus and the role of adhesion in enteropathogen exclusion. J Food Prot. 2005;68:2672-2678. [PubMed] |
| 8. | 张 利利, 郑 鹏远, 罗 予, 王 新亭, 刘 志强, 黄 煌, 罗 予. 双歧杆菌对食物过敏小鼠肠道屏障功能及Th1/Th2细胞因子的影响. 世界华人消化杂志. 2009;17:1091-1097. [DOI] |
| 10. | Zareie M, Johnson-Henry K, Jury J, Yang PC, Ngan BY, McKay DM, Soderholm JD, Perdue MH, Sherman PM. Probiotics prevent bacterial translocation and improve intestinal barrier function in rats following chronic psychological stress. Gut. 2006;55:1553-1560. [PubMed] [DOI] |
| 11. | Gareau MG, Jury J, MacQueen G, Sherman PM, Perdue MH. Probiotic treatment of rat pups normalises corticosterone release and ameliorates colonic dysfunction induced by maternal separation. Gut. 2007;56:1522-1528. [PubMed] [DOI] |
| 13. | Maes M, Kubera M, Leunis JC. The gut-brain barrier in major depression: intestinal mucosal dysfunction with an increased translocation of LPS from gram negative enterobacteria (leaky gut) plays a role in the inflammatory pathophysiology of depression. Neuro Endocrinol Lett. 2008;29:117-124. [PubMed] |
| 14. | Xu DZ, Lu Q, Deitch EA. Nitric oxide directly impairs intestinal barrier function. Shock. 2002;17:139-145. [PubMed] [DOI] |
| 15. | Ruemmele FM, Beaulieu JF, Dionne S, Levy E, Seidman EG, Cerf-Bensussan N, Lentze MJ. Lipopolysaccharide modulation of normal enterocyte turnover by toll-like receptors is mediated by endogenously produced tumour necrosis factor alpha. Gut. 2002;51:842-848. [PubMed] [DOI] |
| 16. | Forsythe RM, Xu DZ, Lu Q, Deitch EA. Lipopolysaccharide-induced enterocyte-derived nitric oxide induces intestinal monolayer permeability in an autocrine fashion. Shock. 2002;17:180-184. [PubMed] [DOI] |
| 17. | Olaya J, Neopikhanov V, Uribe A. Lipopolysaccharide of Escherichia coli, polyamines, and acetic acid stimulate cell proliferation in intestinal epithelial cells. In Vitro Cell Dev Biol Anim. 1999;35:43-48. [PubMed] |
| 19. | Banan A, Fitzpatrick L, Zhang Y, Keshavarzian A. OPC-compounds prevent oxidant-induced carbonylation and depolymerization of the F-actin cytoskeleton and intestinal barrier hyperpermeability. Free Radic Biol Med. 2001;30:287-298. [PubMed] [DOI] |
| 20. | Kumar S, Bharti A, Mishra NC, Raina D, Kharbanda S, Saxena S, Kufe D. Targeting of the c-Abl tyrosine kinase to mitochondria in the necrotic cell death response to oxidative stress. J Biol Chem. 2001;276:17281-17285. [PubMed] [DOI] |
| 22. | Lin HL, Liu TY, Wu CW, Chi CW. 2-Methoxyestradiol-induced caspase-3 activation and apoptosis occurs through G(2)/M arrest dependent and independent pathways in gastric carcinoma cells. Cancer. 2001;92:500-509. [PubMed] [DOI] |
| 23. | Gu BH, Minh NV, Lee SH, Lim SW, Lee YM, Lee KS, Kim DK. Deoxyschisandrin inhibits H2O2-induced apoptotic cell death in intestinal epithelial cells through nuclear factor-kappaB. Int J Mol Med. 2010;26:401-406. [PubMed] |
| 24. | Chen M, Quintans J, Fuks Z, Thompson C, Kufe DW, Weichselbaum RR. Suppression of Bcl-2 messenger RNA production may mediate apoptosis after ionizing radiation, tumor necrosis factor alpha, and ceramide. Cancer Res. 1995;55:991-994. [PubMed] |
| 25. | Büchi ER, Bernauer W, Daicker B. Cell death and disposal in retinoblastoma: an electron microscopic study. Graefes Arch Clin Exp Ophthalmol. 1994;232:635-645. [PubMed] |