修回日期: 2011-01-22
接受日期: 2011-02-15
在线出版日期: 2011-03-18
目的: 研究CADM1和DAL-1/4.1B两种抑癌基因在结直肠癌中的表达并分析两者之间及其与结直肠癌各临床病理参数之间的关系, 探讨CADM1和DAL-1/4.1B在结直肠癌发生发展中的作用, 为结直肠癌的基因治疗提出新的思路.
方法: 应用免疫组织化学(SABC法)检测30例结直肠癌组织, 10例结直肠腺瘤组织, 30例正常结直肠组织中CADM1和DAL-1/4.1B两种抑癌基因的表达; 应用Western blot法检测30例结直肠癌组织, 10例结直肠腺瘤组织, 30例正常结直肠组织中CADM1及DAL-1/4.1B的表达, 以图象分析软件进行半定量测定.
结果: 结直肠癌组织与结直肠腺瘤组织、正常对照组织中CADM1和DAL-1/4.1B表达阳性率差异有统计学意义(23.33% vs 70.00%, 86.67%; 26.67% vs 70.00%, 83.33%, 均P<0.05), Western blot条带经图象分析软件测得结直肠癌组织CADM1和DAL-1/4.1B吸光度与β-actin吸光度比值均显著低于结直肠腺瘤、正常对照组织(0.229±0.053 vs 0.299±0.068, 0.418±0.081; 0.223±0.052 vs 0.291±0.066, 0.333±0.061, 均P<0.05). CADM1和DAL-1/4.1B的表达部位和染色强度相似, 半定量分析也显示两者呈正相关(r = 0.710, P<0.05). CADM1和DAL-1/4.1B的表达与结直肠癌患者肿瘤分化程度、年龄、性别未见相关, 而两者在Dukes分期C+D中的表达阳性率低于Dukes分期A+B差异有统计学意义(P<0.05).
结论: 结直肠癌中CADMl和DAL-1/4.1B基因均呈现失活和蛋白表达下调, CADM1与DAL-1/4.1B通过相互作用共同发挥其肿瘤抑制作用并参与结直肠癌的发生、发展.
引文著录: 熊枝繁, 丁巍. CADM1与DAL-1/4.1B在结直肠癌中的表达及临床意义. 世界华人消化杂志 2011; 19(8): 807-813
Revised: January 22, 2011
Accepted: February 15, 2011
Published online: March 18, 2011
AIM: To investigate the clinicopathological significance of the expression of cell adhesion molecule 1 (CADM1) and differentially expressed in adenocarcinoma of the lung/4.1B (DAL-1/4.1B) proteins in colorectal carcinoma, colorectal adenoma and normal colorectal mucosa.
METHODS: Immunohistochemical staining was performed to detect the expression of CADM1 and DAL-1/4.1B proteins in 30 colorectal carcinoma specimens, 10 colorectal adenoma specimens, and 30 normal colorectal mucosal specimens. Western blot was used to measure the protein expression of CADM1 and DAL-1/4.1B in the above specimens. Semiquantitation was performed using image analysis software.
RESULTS: The positive rate of CADM1 and DAL-1/4.1B showed a downward trend in cancer , colorectal adenoma and normal mucosa. The positive rates of CADM1 and DAL-1/4.1B were 23.33%/26.67% in colorectal carcinoma, 70%/70% in colorectal adenoma, and 86.67%/83.33% in normal colorectal mucosa. Western blot analysis showed that the gray levels of CADM1 and DAL-1/4.1B in colorectal carcinoma were significantly lower than those in colorectal adenoma and normal colorectal mucosa (0.229 ± 0.053 vs 0.299 ± 0.068, 0.418 ± 0.081; 0.223 ± 0.052 vs 0.291 ± 0.066, 0.333 ± 0.061, all P < 0.05). The expression and localization of CADM1 protein were parallel to those of DAL-1/4.1B, and the immunoreactive intensity of the two proteins was similar. Semiquantitative analysis showed that there was a positive correlation between the expression of CADM1 and DAL-1/4.1B (r = 0.710, P < 0.05). The expression of CADM1 and DAL-1/4.1B showed no significant association with age, gender or histological differentiation (all P > 0.05). The expression of CADM1 in Dukes stage C+D carcinoma was much lower than that in Dukes stage A+B carcinoma (P < 0.05).
CONCLUSION: Down-regulation of CADM1 and DAL-1/4.1B protein expression occurs in colorectal carcinoma. Inactivation of CADM1 and DAL-1/4.1B genes may be associated with the development of colorectal carcinoma. CADM1 and DAL-1/4.1B can interact with each other during colorectal carcinogenesis.
- Citation: Xiong ZF, Ding W. Clinical significance of CADM1 and DAL-1/4.1B expression in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(8): 807-813
- URL: https://www.wjgnet.com/1009-3079/full/v19/i8/807.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i8.807
细胞黏附分子1(cell adhesion molecule 1, CADM1)是2001年由Kuramochi等应用功能性互补的方法在人类非小细胞肺癌(human non-small-cell lung cancer, NSCLC)中发现的一种定位于人类染色体1lq23.2上的基因并且证明他具有抑制肿瘤作用[1]. 肺腺癌差异表达因子4.1B(differentially expressed in adenocarcinoma of the lung/4.1B, DAL-1/4.1B)定位于人类染色体的18P11.3区域, 该基因编码的蛋白产物的N末端的300个氨基酸与存在于所有的4.1超家族的蛋白中的FERM(4.1/Ezrin/Radixin/Moesin)结构域有高度的一致性, 因此被认为是蛋白4.1超家族的一个新成员[2]. 多个研究表明二者共同参与细胞骨架的构建和维持正常细胞的黏附功能的稳定, 当CADM1或DAL-1/4.1B表达失活时就会引起肿瘤的转移和侵袭, 从而在人体的多种肿瘤中发挥重要的作用[3-5]. 本研究旨在探讨肿瘤抑制基因CADM1及DAL-1/4.1B在结直肠癌组织中的表达, 以及其在结直肠癌的发生发展中的可能机制, 为结直肠癌的基因治疗提供可能的背景资料.
兔抗人多克隆抗体CADM1购自Santa Cruz Biotechnology USA, 兔抗人多克隆抗体 DAL-1/4.1B购自Abcam公司, 免疫组织化学SABC试剂盒和DAB显色试剂盒均购自北京中杉生物技术有限公司. 收集华中科技大学同济医学院附属协和医院2010-03/2010-05手术切除的结直肠腺瘤标本10例, 结直肠癌标本30例, 同时取30例距癌中心10 cm处的正常组织作为正常对照组, 所取正常对照组织的断端组织均未发现癌细胞. 其中男12例, 女18例; 年龄28-73(56.80±12.45)岁; 并按国际癌症协会所定的标准行分化程度分级和Dukes分期, 所有癌组织均经病理检查确诊, 其中Dukes分期: A+B期8例, C+D期22例; 高、中分化腺癌22例, 低分化腺癌8例. 所有标本均经4%缓冲中性甲醛固定, 常规石蜡包埋, 4 μm厚度连续切片. Western blot检测标本组织切除后放入冰盒中, 去除脂肪组织并用生理盐水冲洗残留血液后立即转存于-80 ℃冰箱备用.
1.2.1 免疫组织化学SABC法检测CADM1及DAL-1/4.1B在结直肠癌中的表达: 用已知的CADM1及DAL-1/4.1B阳性的正常结直肠组织切片作为阳性对照, PBS缓冲液代替一抗作阴性对照. 切片经脱蜡处理后, 3% H2O2 20 min阻断内源性过氧化物酶, 96 ℃微波抗原热修复5 min, 正常山羊血清室温封闭30 min后, 按步骤分别滴加一抗CADM1及DAL-1/4.1B(1:100)和生物素化二抗(1:200)及SABC试剂, DAB染色, 然后常规复染、脱水、透明、封片后镜下观察.
1.2.2 Western blot法检测CADM1及DAL-1/4.1B蛋白在结直肠癌中的表达: 取冻存的结直肠癌组织, 结直肠腺瘤组织, 正常结直肠组织, 加入单去污剂裂解液, 冰上匀浆, 放入高速离心机离心取上清. 测蛋白浓度, 取等量10 μL上样样品, 以10%SDS-PAGE凝胶电泳分离CADM1及DAL-1/4.1B蛋白. 2 h电转移至硝酸纤维素膜, 取出膜后立春红染色观察条带, 然后在TBST中漂洗1 min, 用封闭液封闭过夜(含5%脱脂奶粉的TBST缓冲液). 室温孵育后弃去封闭液, 加入一抗(1:500)或内参(β-actin)一抗(1:2 000), 37 ℃温育2 h, TBST洗3×10 min. 加入二抗(1:4 000)温育2 h, TBST洗3×10 min. 最后加入ECL显色液暗室显色, 当出现条带后立即放人定影液中, 冲洗晾干胶片. 扫描胶片, 用凝胶图像分析系统Image pro-plus软件分析条带灰度(A)值.
1.2.3 染色结果判断: 用Olympus显微镜及显微摄像仪对染色组织切片进行观察、照相, 使用HMIAS-2000型全自动彩色图像分析系统进行图像分析. CADM1蛋白以细胞膜或细胞质内出现棕黄色颗粒判断为阳性细胞, DAL-1/4.1B蛋白以胞质或胞膜有棕黄色颗粒判断为阳性细胞. 按照国外文献[6]的方法, 先按染色强度计分: 0分为无色, 1分为浅黄色, 2分为棕黄色, 3分为棕褐色; 再在高倍镜下(×400倍)对每张切片随机选取5个高倍镜视野观察细胞, 每个视野500个细胞, 共计2 500个, 按阳性细胞所占的百分比计分: 0分为阴性, 1分为阳性细胞<10%, 2分为10%-50%, 3分为>50%, 染色强度与阳性细胞百分比的乘积≥2分为免疫组织化学阳性(+), 否则计为免疫组织化学阴性(-).
统计学处理 采用SPSS15.0统计软件进行χ2检验和四格表的精确概率法判断CADM1蛋白在结直肠癌、结直肠腺瘤, 正常结直肠组织中表达, 采用独立t检验判断CADM1蛋白在结直肠癌中表达与各病理指标的相互关系, P<0.05为差异有统计学意义. 运用Pearson相关系数来判断CADM1和DAL-1/4.1B蛋白表达之间的相关关系, P<0.05为差异有统计学意义.
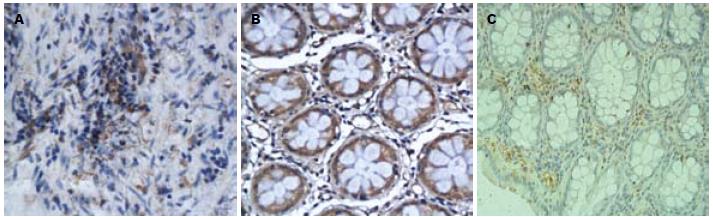
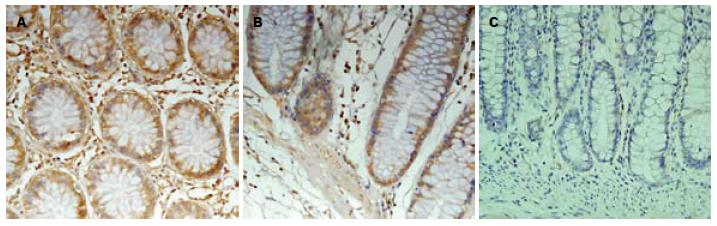
CADM1蛋白阳性表达以正常结直肠组织、结直肠腺瘤组织和结直肠癌细胞胞膜或胞质内出现棕黄色颗粒为标准(图1). DAL-1/4.1B蛋白阳性表达以细胞胞质出现棕黄色颗粒为标准, 部分细胞膜着色(图2). 阳性细胞呈弥漫分布, 少部分位于腺癌组织间质, 大部分位于腺癌腺体及细胞膜上, 间质阳性细胞染色深度稍大于腺体阳性细胞. 结直肠癌组织中CADM1和DAL-1/4.1B蛋白的阳性表达率明显较正常结直肠组织、结直肠腺瘤组织低, 差异有统计学意义(P<0.05). 而结直肠腺瘤组织中CADM1与DAL-1/4.1B蛋白的阳性表达率均较正常结直肠组织低, 差异无统计学意义(P>0.05, 表1).
| 分组 | n | CADM1 | DAL-1/4.1B | ||||
| 阳性(n) | 阴性(n) | 阳性率(%) | 阳性(n) | 阴性(n) | 阳性率(%) | ||
| 正常结直肠组织 | 30 | 26 | 4 | 86.67 | 25 | 5 | 83.33 |
| 结直肠腺瘤组织 | 10 | 7 | 3 | 70.00 | 7 | 3 | 70.00 |
| 结直肠癌组织 | 30 | 7 | 23 | 23.33ac | 8 | 22 | 26.67ac |
Western blot条带经图象处理软件分析其A值和内参β-actin A值比值, 发现结直肠癌组织CADM1和DAL-1/4.1B A值与β-actin A值比值均显著低于结直肠腺瘤和正常对照组织, 差异有统计学意义(0.229±0.053 vs 0.299±0.068, 0.418±0.081; 0.223±0.052 vs 0.291±0.066, 0.333±0.061, 均P<0.05, 表2).
Pearson相关检验检测30例结直肠癌患者组织中CADM1和DAL-1/4.1B与β-actin A值比值, 二者呈正相关(r = 0.710, P<0.05).
对CADM1与DAL-1/4.1B蛋白表达情况与30例结直肠癌患者的性别、年龄、分化程度(分为高中分化、低分化)及Dukes分期(分为A+B期, C+D期)等情况进行分析, 发现CADM1和DAL-1/4.1B蛋白在Dukes分期C+D中的表达阳性率低于Dukes分期A+B差异有统计学意义(P<0.05), 而跟年龄、性别、分化程度无关(表3).
| 临床病理特征 | n | CADM1 | DAL-1/4.1B | ||
| A值 | P值 | A值 | P值 | ||
| 性别 | |||||
| 男 | 12 | 0.237±0.065 | 0.215±0.049 | ||
| 女 | 18 | 0.224±0.045 | 0.534 | 0.228±0.055 | 0.516 |
| 年龄(岁) | |||||
| ≥55 | 18 | 0.237±0.046 | 0.217±0.056 | ||
| <55 | 12 | 0.214±0.062 | 0.258 | 0.227±0.051 | 0.622 |
| 分化程度 | |||||
| 高、中分化 | 22 | 0.220±0.048 | 0.223±0.054 | ||
| 低分化 | 8 | 0.256±0.063 | 0.105 | 0.224±0.052 | 0.942 |
| Dukes分期 | |||||
| A+B期 | 8 | 0.242±0.049 | 0.237±0.050 | ||
| C+D期 | 22 | 0.196±0.051 | 0.034 | 0.185±0.039 | 0.013 |
肿瘤的侵袭生长是一个多因素参与、多步骤完成的过程, 而其最初的步骤是细胞黏附功能的紊乱, 细胞内黏附分子的丢失及基底膜细胞的脱落使肿瘤细胞从原始位置脱离, 改变了细胞外基质, 肿瘤细胞进而形成一种更加能动和侵袭的表型, 最后导致肿瘤的转移和侵袭. CADM l属于细胞黏附分子中免疫球蛋白超家族成员, 定位于人类染色体11q23.2上, 全长大约300 kb, 含12个外显子. 在上皮细胞中其转录产物为4.4 kb或1.6 kb mRNA前体, 翻译产物为含有442个氨基酸残基的跨膜糖蛋白. 蛋白结构包含胞外区、跨膜区和胞质区, 胞外区含373个氨基酸, 通过二硫键形成3个免疫球蛋白样结构域, 胞质区结构与血型糖蛋白C类似, 含2个重要蛋白结构域: FERM结构域和PDZ(PSD-95/Dlg/ZO-1)结构域[2]. 目前国内外已经进行了一系列关于CADM1与各种肿瘤的研究(包括乳腺癌[7,8]、神经胶质瘤[9]、NSCLC[1,10-13]、神经母细胞瘤[14,15]、前列腺癌[16,17]、肝癌[18,19]、胃癌[20]、鼻咽癌[21,22]、食管癌[23]、胰腺癌[24,25]、宫颈癌[26,27]和结直肠癌[28]等). 在结直肠癌方面Chen等[28]应用RT-PCR、Western blot、免疫组织化学等方法测量了8个结直肠癌细胞系和54例结直肠癌组织和其相应的非癌组织中CADM1的表达水平, 并应用亚硫酸基因组测序和甲基特殊聚合酶链反应, 分析了CADM1基因启动子甲基化状态并评估了其与临床病理特征的关系. 结果在7/8(88%)的结直肠癌细胞系和39/54(72%)的结直肠癌中观察到CADM1的表达缺失和下降. 6/8(75%)结直肠癌细胞系中和32/54(59%)的结直肠癌中存在CADM1启动子区域的高甲基化, 并且与Dukes分期及肿瘤浸润深度有密切关系. 本实验结果显示CADM1在结直肠癌组织中的表达显著低于结直肠腺瘤组织和正常结直肠组织, 半定量分析也显示其在结直肠癌组织中的显著低于在结直肠腺瘤和正常结直肠组织, 且在三者间呈明显的递增趋势, 在蛋白水平证明了CADM1是影响肿瘤发生发展的重要因素, 此结果与国内外报道一致, 可以说CADM1确实是恶性侵袭性肿瘤的一个敏感性指标. 本实验中CADM1的表达与病理分化程度无关, 而与结直肠癌Dukes分期显著相关, C+D组显著低于A+B组. 说明CADM1与结直肠癌患者癌症进展密切相关, 肿瘤进展程度越高, 其表达越弱, 含量也越低, 而在结直肠癌组织, 结直肠腺瘤组织和正常结直肠组织间的表达和含量的递增趋势也提示CADM1随肿瘤的浸润侵袭而表达逐步降低. 提示CADM1表达减少可能是结直肠癌发生发展过程中的一个普遍性事件, 低表达的CADM1可能成为结直肠癌侵袭程度的一个判断指标.
DAL-1/4.1B(differentially expressed in adenocarcinoma of the lung/4.1B)基因是全长Epb41L3(erythrocyte membrane protein band 4.1-like 3)的一个片段, 他的蛋白产物4.1B拥有1个N端的FERM结构域, 1个血型糖蛋白结合域, 和1个C端结构域, 以及3个独特的结构域U1, U2, U3. 与其他4.1家族的成员一样, 4.1B被认为具有稳定纤维肌动蛋白细胞骨架上的膜蛋白, 作用为肺癌抑制基因的翻译产物, 是一种膜收缩蛋白-肌动蛋白结合蛋白[29,30], 在对乳腺癌[31]、脑膜癌[32]和卵巢癌[33]等多个研究中表明他与肿瘤抑制相关, 另外Cavanna等[34]建立了1个鼠间叶组织肿瘤模型, 研究发现DAL-1/4.1B抑制肿瘤转移的机制可能与稳定肌动蛋白紧张纤维的有序排列, 以及抑制增加转移可能性的细胞运动和趋化性有关. Ohno等[35]报道DAL-1/4.1B在消化系统中可能不仅有维持其正常结构构建的作用, 而且有维持正常细胞增殖和黏附的作用, 因此可抑制小肠上皮细胞的恶性转化. 本实验结果显示DAL-1/4.1B在结直肠癌组织中的表达显著低于结直肠腺瘤组织和正常结直肠组织, 半定量分析也显示其在结直肠癌组织中的表达显著低于在结直肠腺瘤和正常结直肠组织, 且在三者间呈明显的递增趋势. DAL-1/4.1B在结直肠癌中表达明显减少, 而其与结直肠癌Dukes分期显著相关, C+D组显著低于A+B组, 说明DAL-1/4.1B与结直肠癌患者癌症进展密切相关, 肿瘤进展程度越高, 其表达越弱, 含量也越低, 而在癌组织, 结直肠腺瘤组织和正常结直肠组织间的表达和含量的递增趋势也提示DAL-1/4.1B随肿瘤的浸润侵袭而表达逐步降低, 提示其在肿瘤发展和早期转移中起重要作用.
CADMl可通过FERM结构域直接与DAL-1蛋白4.1B相互作用共同发挥抑制肿瘤侵袭转移的功能. Ohno等[36]研究发现CADM1的免疫沉淀反应主要发生肾上腺髓质, 并且沿着嗜铬细胞膜散布, 而免疫荧光双标证实DAL-1/4.1B和CADM1同时位于嗜铬细胞的细胞膜上, 这些结果提示在鼠肾上腺髓质中CADM1与DAL-1/4.1B相互作用, 并且沿着嗜铬细胞膜散布. 通过对DAL-1/4.1B基因敲除小鼠的研究, 他们还发现CADM1的分布并不受DAL-1/4.1B基因敲除的影响, 而CADM1包含的FERM结合域的缺失会影响DAL-1/4.1B在细胞膜的表达, 其原因可能与CADM1的C端PDZ结合域与MAGuK家族的MPP3结合稳定细胞骨架, 及4.1超家族的其他成员与FERM结合拟补CADM1级联功能有关. 从而我们可以认为CADM1和DAL-1/4.1B是构成参与组织肌动蛋白细胞骨架级联的要素, 通过建立相邻细胞的稳定黏附, 一旦CADM1失活就会使DAL-1/4.1B及MPP3表达减少, 从而影响细胞膜和骨架的黏附和连接的稳定. 在我们的研究中, 通过免疫组织化学结果显示, 绝大部分组织中CADM1与DAL-1/4.1B表达部位相一致, CADM1与DAL-1/4.1B在结直肠癌组织、结直肠腺瘤组织、正常结直肠组织中的半定量分析呈现与染色强度一致的且明显的递减趋势. 可见, CADM1及DAL-1/4.1B的低表达与结直肠癌的侵袭和发展密切相关, 且该作用原因之一可能是CADM1的失活.
鉴于CADM1对DAL-1/4.1B的活性调节作用, 以及二者在结直肠癌组织中的低表达与肿瘤侵袭转移程度之间的密切关系, CADM1蛋白可能与DAL-1/4.1B蛋白共同参与结直肠癌的发生、发展和转移, 以后有望以此二者作为靶点开展进一步针对结直肠癌浸润转移的控制和治疗方面的研究.
CADM1作为一种新的抑癌基因参与细胞间黏附、细胞运动、信号转导及免疫调节, 在多种肿瘤中呈现异常表达, 并与肿瘤侵袭生长密切相关, 其作用的分子机制尚待进一步研究.
杜雅菊, 主任医师, 哈尔滨医科大学附属第二医院消化内科
Ohno等报道DAL-1/4.1B在消化系统中可能不仅有维持其正常结构构建的作用, 而且有维持正常细胞增殖和黏附的作用, 因此可抑制小肠上皮细胞的恶性转化.
本文在国内首次检测了抑癌基因CADM1在结直肠癌及结直肠腺瘤中的表达, 分析其与结直肠癌临床病理因素间的关系及与DAL-1/4.1B蛋白表达的相关性, 探讨CADM1基因在结直肠癌侵袭及生长中的作用及可能的分子机制
本文对CADM1及DAL-1/4.1B在结直肠肠癌中的相关性做了研究和探讨, 为明确CADM1级联在肿瘤发生发展的作用机制奠定了基础.
1 CADM1: CADM1属于免疫球蛋白超家族,位于染色体11q23.2, 与神经细胞黏附分子(NCAM)高度同源. CADM1又名免疫球蛋白超家族成员4(IGSF4), 是突触细胞黏附分子l(SynCAM1、RA175、柄蛋白样分子-2(Necl-2)及精子发生的免疫球蛋白超家族成员(SgIGSF). 2 MPP3: MPP3是果蝇肿瘤抑制基因的人类同系物, 与CASK、Pals2及syntenin等均属膜相关鸟苷酸激酶同系物(MAGuK)家族.
本文科学性较好, 对于临床研究具有一定的参考价值.
编辑: 李薇 电编:李薇
| 1. | Kuramochi M, Fukuhara H, Nobukuni T, Kanbe T, Maruyama T, Ghosh HP, Pletcher M, Isomura M, Onizuka M, Kitamura T. TSLC1 is a tumor-suppressor gene in human non-small-cell lung cancer. Nat Genet. 2001;27:427-430. [PubMed] |
| 2. | Tran YK, Bögler O, Gorse KM, Wieland I, Green MR, Newsham IF. A novel member of the NF2/ERM/4.1 superfamily with growth suppressing properties in lung cancer. Cancer Res. 1999;59:35-43. [PubMed] |
| 3. | Heller G, Geradts J, Ziegler B, Newsham I, Filipits M, Markis-Ritzinger EM, Kandioler D, Berger W, Stiglbauer W, Depisch D. Downregulation of TSLC1 and DAL-1 expression occurs frequently in breast cancer. Breast Cancer Res Treat. 2007;103:283-291. [PubMed] |
| 4. | Sakurai-Yageta M, Masuda M, Tsuboi Y, Ito A, Murakami Y. Tumor suppressor CADM1 is involved in epithelial cell structure. Biochem Biophys Res Commun. 2009;390:977-982. [PubMed] |
| 5. | Heller G, Fong KM, Girard L, Seidl S, End-Pfützenreuter A, Lang G, Gazdar AF, Minna JD, Zielinski CC, Zöchbauer-Müller S. Expression and methylation pattern of TSLC1 cascade genes in lung carcinomas. Oncogene. 2006;25:959-968. [PubMed] |
| 6. | Goto A, Niki T, Chi-Pin L, Matsubara D, Murakami Y, Funata N, Fukayama M. Loss of TSLC1 expression in lung adenocarcinoma: relationships with histological subtypes, sex and prognostic significance. Cancer Sci. 2005;96:480-486. [PubMed] |
| 7. | Allinen M, Peri L, Kujala S, Lahti-Domenici J, Outila K, Karppinen SM, Launonen V, Winqvist R. Analysis of 11q21-24 loss of heterozygosity candidate target genes in breast cancer: indications of TSLC1 promoter hypermethylation. Genes Chromosomes Cancer. 2002;34:384-389. [PubMed] |
| 8. | Bertolo C, Guerrero D, Vicente F, Cordoba A, Esteller M, Ropero S, Guillen-Grima F, Martinez-Peñuela JM, Lera JM. Differences and molecular immunohistochemical parameters in the subtypes of infiltrating ductal breast cancer. Am J Clin Pathol. 2008;130:414-424. [PubMed] |
| 9. | Houshmandi SS, Surace EI, Zhang HB, Fuller GN, Gutmann DH. Tumor suppressor in lung cancer-1 (TSLC1) functions as a glioma tumor suppressor. Neurology. 2006;67:1863-1866. [PubMed] |
| 10. | Fukami T, Fukuhara H, Kuramochi M, Maruyama T, Isogai K, Sakamoto M, Takamoto S, Murakami Y. Promoter methylation of the TSLC1 gene in advanced lung tumors and various cancer cell lines. Int J Cancer. 2003;107:53-59. [PubMed] |
| 11. | Uchino K, Ito A, Wakayama T, Koma Y, Okada T, Ohbayashi C, Iseki S, Kitamura Y, Tsubota N, Okita Y. Clinical implication and prognostic significance of the tumor suppressor TSLC1 gene detected in adenocarcinoma of the lung. Cancer. 2003;98:1002-1007. [PubMed] |
| 12. | Kikuchi S, Yamada D, Fukami T, Maruyama T, Ito A, Asamura H, Matsuno Y, Onizuka M, Murakami Y. Hypermethylation of the TSLC1/IGSF4 promoter is associated with tobacco smoking and a poor prognosis in primary nonsmall cell lung carcinoma. Cancer. 2006;106:1751-1758. [PubMed] |
| 13. | Kitamura Y, Kurosawa G, Tanaka M, Sumitomo M, Muramatsu C, Eguchi K, Akahori Y, Iba Y, Tsuda H, Sugiura M. Frequent overexpression of CADM1/IGSF4 in lung adenocarcinoma. Biochem Biophys Res Commun. 2009;383:480-484. [PubMed] |
| 14. | Michels E, Hoebeeck J, De Preter K, Schramm A, Brichard B, De Paepe A, Eggert A, Laureys G, Vandesompele J, Speleman F. CADM1 is a strong neuroblastoma candidate gene that maps within a 3.72 Mb critical region of loss on 11q23. BMC Cancer. 2008;8:173. [PubMed] |
| 15. | Nowacki S, Skowron M, Oberthuer A, Fagin A, Voth H, Brors B, Westermann F, Eggert A, Hero B, Berthold F. Expression of the tumour suppressor gene CADM1 is associated with favourable outcome and inhibits cell survival in neuroblastoma. Oncogene. 2008;27:3329-3338. [PubMed] |
| 16. | Fukuhara H, Kuramochi M, Fukami T, Kasahara K, Furuhata M, Nobukuni T, Maruyama T, Isogai K, Sekiya T, Shuin T. Promoter methylation of TSLC1 and tumor suppression by its gene product in human prostate cancer. Jpn J Cancer Res. 2002;93:605-609. [PubMed] |
| 17. | Williams YN, Masuda M, Sakurai-Yageta M, Maruyama T, Shibuya M, Murakami Y. Cell adhesion and prostate tumor-suppressor activity of TSLL2/IGSF4C, an immunoglobulin superfamily molecule homologous to TSLC1/IGSF4. Oncogene. 2006;25:1446-1453. [PubMed] |
| 18. | Murakami Y. Functional cloning of a tumor suppressor gene, TSLC1, in human non-small cell lung cancer. Oncogene. 2002;21:6936-6948. [PubMed] |
| 19. | Qin L, Zhu W, Xu T, Hao Y, Zhang Z, Tian Y, Yang D. Effect of TSLC1 gene on proliferation, invasion and apoptosis of human hepatocellular carcinoma cell line HepG2. J Huazhong Univ Sci Technolog Med Sci. 2007;27:535-537. [PubMed] |
| 20. | Honda T, Tamura G, Waki T, Jin Z, Sato K, Motoyama T, Kawata S, Kimura W, Nishizuka S, Murakami Y. Hypermethylation of the TSLC1 gene promoter in primary gastric cancers and gastric cancer cell lines. Jpn J Cancer Res. 2002;93:857-860. [PubMed] |
| 21. | Lung HL, Cheng Y, Kumaran MK, Liu ET, Murakami Y, Chan CY, Yau WL, Ko JM, Stanbridge EJ, Lung ML. Fine mapping of the 11q22-23 tumor suppressive region and involvement of TSLC1 in nasopharyngeal carcinoma. Int J Cancer. 2004;112:628-635. [PubMed] |
| 22. | Hui AB, Lo KW, Kwong J, Lam EC, Chan SY, Chow LS, Chan AS, Teo PM, Huang DP. Epigenetic inactivation of TSLC1 gene in nasopharyngeal carcinoma. Mol Carcinog. 2003;38:170-178. [PubMed] |
| 23. | Ito T, Shimada Y, Hashimoto Y, Kaganoi J, Kan T, Watanabe G, Murakami Y, Imamura M. Involvement of TSLC1 in progression of esophageal squamous cell carcinoma. Cancer Res. 2003;63:6320-6326. [PubMed] |
| 24. | Jansen M, Fukushima N, Rosty C, Walter K, Altink R, Heek TV, Hruban R, Offerhaus JG, Goggins M. Aberrant methylation of the 5' CpG island of TSLC1 is common in pancreatic ductal adenocarcinoma and is first manifest in high-grade PanlNs. Cancer Biol Ther. 2002;1:293-296. [PubMed] |
| 25. | Shimizu K, Onishi M, Sugata E, Fujii H, Honoki K, Tsujiuchi T. Aberrant DNA methylation of the 5' upstream region of Tslc1 gene in hamster pancreatic tumors. Biochem Biophys Res Commun. 2007;353:522-526. [PubMed] |
| 26. | Yang YX, Yang AH, Yang ZJ, Wang ZR, Xia XH. Involvement of tumor suppressor in lung cancer 1 gene expression in cervical carcinogenesis. Int J Gynecol Cancer. 2006;16:1868-1872. [PubMed] |
| 27. | Overmeer RM, Henken FE, Snijders PJ, Claassen-Kramer D, Berkhof J, Helmerhorst TJ, Heideman DA, Wilting SM, Murakami Y, Ito A. Association between dense CADM1 promoter methylation and reduced protein expression in high-grade CIN and cervical SCC. J Pathol. 2008;215:388-397. [PubMed] |
| 28. | Chen K, Wang G, Peng L, Liu S, Fu X, Zhou Y, Yu H, Li A, Li J, Zhang S. CADM1/TSLC1 inactivation by promoter hypermethylation is a frequent event in colorectal carcinogenesis and correlates with late stages of the disease. Int J Cancer. 2011;128:266-273. [PubMed] |
| 29. | Robb VA, Gerber MA, Hart-Mahon EK, Gutmann DH. Membrane localization of the U2 domain of Protein 4.1B is necessary and sufficient for meningioma growth suppression. Oncogene. 2005;24:1946-1957. [PubMed] |
| 30. | Kang Q, Wang T, Zhang H, Mohandas N, An X. A Golgi-associated protein 4.1B variant is required for assimilation of proteins in the membrane. J Cell Sci. 2009;122:1091-1099. [PubMed] |
| 31. | Jiang W, Newsham IF. The tumor suppressor DAL-1/4.1B and protein methylation cooperate in inducing apoptosis in MCF-7 breast cancer cells. Mol Cancer. 2006;5:4. [PubMed] |
| 32. | Gerber MA, Bahr SM, Gutmann DH. Protein 4.1B/differentially expressed in adenocarcinoma of the lung-1 functions as a growth suppressor in meningioma cells by activating Rac1-dependent c-Jun-NH(2)-kinase signaling. Cancer Res. 2006;66:5295-5303. [PubMed] |
| 33. | Dafou D, Grun B, Sinclair J, Lawrenson K, Benjamin EC, Hogdall E, Kruger-Kjaer S, Christensen L, Sowter HM, Al-Attar A. Microcell-mediated chromosome transfer identifies EPB41L3 as a functional suppressor of epithelial ovarian cancers. Neoplasia. 2010;12:579-589. [PubMed] |
| 34. | Cavanna T, Pokorná E, Veselý P, Gray C, Zicha D. Evidence for protein 4.1B acting as a metastasis suppressor. J Cell Sci. 2007;120:606-616. [PubMed] |
| 35. | Ohno N, Terada N, Murata S, Yamakawa H, Newsham IF, Katoh R, Ohara O, Ohno S. Immunolocalization of protein 4.1B/DAL-1 during neoplastic transformation of mouse and human intestinal epithelium. Histochem Cell Biol. 2004;122:579-586. [PubMed] |
| 36. | Ohno N, Terada N, Komada M, Saitoh S, Costantini F, Pace V, Germann PG, Weber K, Yamakawa H, Ohara O. Dispensable role of protein 4.1B/DAL-1 in rodent adrenal medulla regarding generation of pheochromocytoma and plasmalemmal localization of TSLC1. Biochim Biophys Acta. 2009;1793:506-515. [PubMed] |