修回日期: 2011-01-14
接受日期: 2011-01-21
在线出版日期: 2011-03-18
目的: 研究β胡萝卜素防治酒精性肝纤维化患者的效果.
方法: 203例受试者, 其中酒精性肝纤维化67例, 非酒精性肝纤维化74例, 慢性肝炎肝纤维化患者62例. 另选60例健康体检者. 采用肝纤维化血清透明质酸(HA)、层黏蛋白(LN)、Ⅳ型前胶原(Ⅳ-C)、Ⅲ型前胶原肽(PCⅢ)、血清结缔组织生长因子(CTGF)、血小板衍生生长因子-BB(PDGF-BB)、金属蛋白酶抑制剂-1(TIMP-1)、转化生长因子-β1(TGF-β1)、彩超进行组内组间比较, 分析β胡萝卜素防治酒精性肝纤维化患者的效果.
结果: HA、LN、Ⅳ-C、PCIII在肝纤维化S0-S1、S2-S4期患者治疗前较健康体检者均有显著性差异(均P<0.01). 治疗后, 除Ⅳ-C(μg/L) S2-S4期患者较健康体检者有统计学差异外(95.57±15.47, 100.16±13.70, 96.89±16.41 vs 84.05±24.16, 均P<0.05), 其他均无差异. CTGF、PDGF-BB、TIMP-1、TGF-β1在肝纤维化S0-S1、S2-S4期患者治疗较健康体检者均有统计学差异(均P<0.01). 治疗后, 除CTGF(μg/L)、PDGF-BB(μg/L) S2-S4期患者较健康体检者有统计学差异外(7.74±1.87, 7.68±1.72, 7.65±1.84 vs 4.53±1.21; 3.51±0.66, 3.30±0.65, 3.38±0.58 vs 2.81±0.57, 均P<0.01), 其他均无差异. 彩超显示酒精性肝纤维化患者β胡萝卜素治疗后有所改善.
结论: β胡萝卜素对酒精性肝纤维化患者有防治的效果, 并与β胡萝卜素防治慢性肝炎肝纤维化患者、非酒精性肝纤维化患者的效果基本一致.
引文著录: 潘洁, 万德芬, 吴小友, 胡红丁, 冯耀, 万莉萍. β胡萝卜素对酒精性肝纤维化的防治效果. 世界华人消化杂志 2011; 19(8): 800-806
Revised: January 14, 2011
Accepted: January 21, 2011
Published online: March 18, 2011
AIM: To observe the preventive and therapeutic effects of oral β-carotene against alcoholic liver fibrosis (ALF).
METHODS: A total of 203 patients, 67 patients with alcoholic liver fibrosis, 62 patients with chronic hepatitis-associated fibrosis, and 74 patients with non-alcoholic liver fibrosis, were included in this study. One hundred and twenty healthy volunteers were used as controls. Serum hyaluronic acid (HA), laminin (LN), type IV procollagen (IV-C), procollagen peptide III (PCIII), connective tissue growth factor (CTGF), platelet derived growth factor-BB (PDGF-BB), tissue inhibitor of metalloproteinase-1 (TIMP-1), and transforming growth factor-β1 (TGF-β1) were measured and color Doppler ultrasound were adopted to conduct intra-group and inter-group comparisons to analyze the preventive and therapeutic effects of oral β-carotene against ALF.
RESULTS: Before treatment, there were significant differences in serum HA, LN, IV-C, and PCIII between patients with liver fibrosis and normal controls (P < 0.01) as well as between patients with S0-S1 liver fibrosis and those with S2-S4 disease (P < 0.05). After treatment, although statistical differences were still noted in serum IV-C between patients with S2-S4 liver fibrosis and normal subjects (95.57 ± 15.47, 100.16 ± 13.70, 96.89 ± 16.41 vs 84.05 ± 24.16, all P < 0.05), there were no significant differences in other parameters among different groups. Before treatment, there were significant differences in serum CTGF, PDGF-BB, TIMP-1, and TGF-β1 between patients with liver fibrosis and normal controls (P < 0.01) as well as between patients with S0-S1 liver fibrosis and those with S2-S4 disease (P < 0.05). After treatment, although statistical differences were still noted in serum CTGF and PDGF-BB between patients with S2-S4 liver fibrosis and normal subjects (7.74 ± 1.87, 7.68 ± 1.72, 7.65 ± 1.84 vs 4.53 ± 1.21; 3.51 ± 0.66, 3.30 ± 0.65, 3.38 ± 0.58 vs 2.81 ± 0.57, all P < 0.01), there were no significant differences in other parameters among different groups. Color Doppler ultrasound showed that oral β-carotene could improve ALF.
CONCLUSION: Oral β-carotene has preventive and therapeutic effects against ALF.
- Citation: Pan J, Wang DF, Wu XY, Hu HD, Feng Y, Wang LP. Preventive and therapeutic effects of oral β-carotene against alcoholic liver fibrosis. Shijie Huaren Xiaohua Zazhi 2011; 19(8): 800-806
- URL: https://www.wjgnet.com/1009-3079/full/v19/i8/800.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i8.800
酗酒和酒精依赖是当今世界范围内一个重要的公共卫生问题. 近年来, 我国嗜酒人群呈上升的趋势, 酒精性肝病的发病率已仅次于病毒性肝炎而居第2位, 其危害日益受到医学界的重视[1]. 酒精性肝纤维化(alcoholic liver fibrosis, ALF)是在乙醇刺激下肝脏内弥漫性细胞外基质(extracellular matrix, ECM)(特别是胶原)过度沉积所致. 当少量乙醇使得肝实质损害时, 肝脏纤维增生是机体对于肝实质损伤的一种修复反应. 一旦病因去除则过多的ECM被降解, 肝组织内细胞与基质成分恢复正常, 因而不产生肝脏纤维化. 但长期大量饮酒所致的持续或反复的肝实质坏死可引起纤维结缔组织大量增生、而其降解活性相对或绝对不足, 因此大量ECM沉积下来形成肝纤维化[2]. ALF是酒精性肝病向肝硬化发展的一个重要病理过程, 且尚有可逆性, 因而是阻断酒精性肝病向肝硬化发展的关键. 我们采用β胡萝卜素防治ALF, 在临床上有一定的效果. 为了了解β胡萝卜素防治ALF及其他病因引起的肝纤维化的作用, 本研究对β胡萝卜素防治ALF、肝炎引起的肝纤维化及非ALF进行对照分析, 研究结果分析如下.
203例受试者, 男133例, 女70例, 年龄26-60(平均45.12±16.54)岁. 其中ALF[3]67例, 慢性肝炎肝纤维化[4]患者62例, 非ALF[5]74例. 另选60例健康体检者, 男39例, 女21例, 年龄27-58(44.12±16.73)岁. 203例病理检查纤维化分期, S0-S1期118例, S2-S4期85例. 血清肝纤维化4项指标透明质酸(hyaluronic acid, HA)、层黏蛋白(laminin, LN)、Ⅳ型前胶原(Ⅳ-procollagen, Ⅳ-C)、Ⅲ型前胶原肽(procollagen peptide Ⅲ, PCⅢ)采用放射免疫分析仪(西安FJ-2008P型)测定. 血清结缔组织生长因子(connective tissue growth factor, CTGF)、血小板衍生生长因子-BB(platelet-derived growth factor-BB, PDGF-BB)、生物素-亲和素ELISA测定试剂盒购自Rapidbio Lab, Calfornia USA; 金属蛋白酶抑制剂-1(inhibitor of metalloproteinase-1, TIMP-1)、转化生长因子-β1(transforming growth factor-β1, TGF-β1)ELISA试剂盒购自Invitrogen公司. Bio-RadModel680酶联仪, 购自美国Bio-Rad公司. 彩超所用仪器为PHLIPS HD3型彩色多普勒超声诊断仪, 探头频率为C5-2 MHz. 天然β胡萝卜素10 mg/粒(广州佛山海力土药业公司产).
1.2.1 入选标准: 参照2002年中华医学会肝脏病学分会脂肪肝和酒精性肝病学组南京的诊断标准和日本的诊断标准制定. (1)有长期饮酒史, 一般超过5年, 折合酒精量>40 g/d, 女性略低; 或2 wk内有暴饮史; (2)过度饮酒出现肝损伤的临床表现, 影像学诊断为ALF者; (3)肝活体组织检查符合ALF组织学改变者, 病变的主体: a. 中央静脉周围纤维化; b. 肝细胞周围纤维化; c. 从肝细胞囊开始的星芒状纤维化. 出现其中1项或全部; (4)未见明显炎细胞浸润和肝细胞坏死者; (5)血清HBsAg阳性但HBV-DNA阴性者; (6)年龄范围为25-70岁; (7)合并脂肪肝的纤维化(即脂肪肝加肝纤维化)病例亦归入此类. 注: 肝纤维化的定性诊断: a. 据临床和实验室检查很难诊断ALF在未作肝活检情况下, 应结合临床影像学检查结果. 测定门静脉、脾静脉内径, 可间接了解肝纤维化的有无, 门静脉主干内径>13 mm, 脾静脉内径>8 mm时, 排除测量时的影响因素, 提示有门脉高压的形成, 肯定已有肝纤维化的存在; b. 肝和/或脾大; (8)没有采用任何措施抗纤维化治疗.
1.2.2 病例排除标准: (1)年龄在25岁以下或70岁以上者; (2)妊娠或准备妊娠妇女, 哺乳期妇女; (3)血清HBsAg阳性, HBV-DNA阳性者; (4)血清学检测证实有HCV感染、自身免疫性肝炎、淤胆性肝炎或隐源型肝炎者; (5)合并肝癌、肝性脑病、水电解质及酸碱平衡紊乱、消化道出血、感染等严重并发症者; (6)肝功能失代偿期患者; (7)原发性和/或继发性心脑血管、肺、肾、内分泌、神经和血液系统疾病者; (8)精神异常不能表达自身感受者.
1.2.3 组织样本取材: 外科医生在腹腔镜下, 使用电刀取得肝组织(直径1-2 cm), 由病理医师作出肝组织病理学诊断. 纤维化分期按文献[6]报道, 分为纤维化程度高(S2-S4)和纤维化程度低(S0-S1).
1.2.4 血清指标检测: 肝取组织后第2天, 受试者空腹从肘静脉采血5 mL, 1 500 r/min, 离心15 min, 取血清置4 ℃冰箱保存.
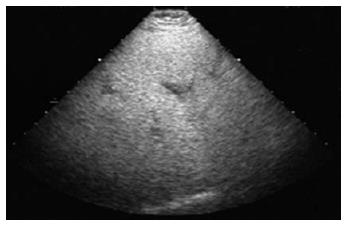
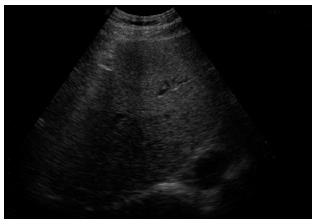
1.2.5 彩超检查: 受检者空腹8 h以上. 由固定的1位检查医师操作. 对肝脏内部回声的观察, 尽量选择最易观察的右肋缘下扫查. 采用以下4种超声附加方法: (1)二次谐波频率为5.0 MHz; (2)放大局部图像; (3)降低增益使肝实质降至低回声水平; (4)采用患者吸气后屏气状态下连续扫查. 综合采用上述方法观察肝实质回声评价标准分为3级: (1)肝回声均匀, 比脾、肾回声增高; (2)肝回声不均匀, 前段增高, 远场衰减, 整个肝区透声性差, 似有一层"薄雾"; (3)肝回声不均匀, 光点增粗, 肝呈小结节样改变.
1.2.6 治疗方法: 天然β胡萝卜素10 mg/粒, 每日2次, 每次1粒, 空腹口服. 每3 mo一疗程, 一疗程后停服7 d, 再服一疗程, 共计6 mo. ALF患者戒酒后行以上治疗.
统计学处理 采用SPSS12.0软件包计算, 数据用mean±SD表示, 组内(健康体检者、ALF、非ALF、慢性肝炎肝纤维化同时比较)比较用单因素方差分析, 组间比较(健康体检者、ALF、非ALF、慢性肝炎肝纤维化分别两两比较)用q检验, α = 0.05, α = 0.01.
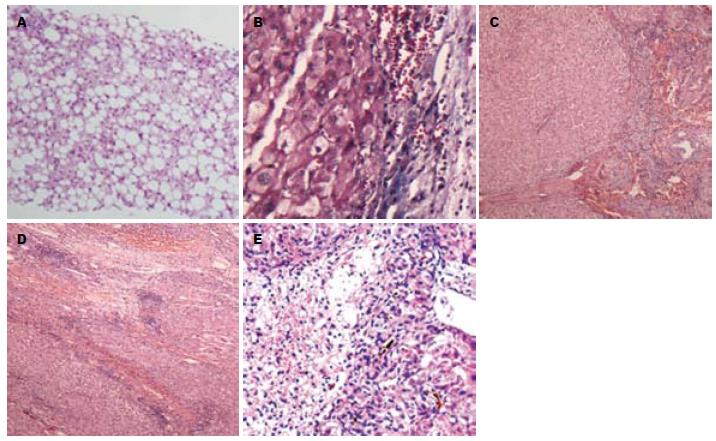
S0: 无肝纤维化; S1: 无汇管区扩大纤维化及局限窦周纤维化; S2: 汇管区周围纤维化或纤维间隔形成, 小叶结构保留; S3: 大量纤维间隔形成伴小叶结构紊乱, 无肝硬化; S4: 可能的或肯定伴有肝硬化形成(图1).
HA、LN、Ⅳ-C、PCⅢ肝纤S0-S1、S2-S4期患者治疗前组内、组间(各型与健康体检者比)均有显著性差异. 治疗后, 除Ⅳ-C S2-S4期患组内、组间(各型与健康体检者比)有统计学差异外, 其他均无差异(表1).
| n | HA(μg/L) | LN(kU/L) | Ⅳ-C(μg/L) | PCⅢ(ng/L) | |
| 健康体检者 | 60 | 20.79±10.26 | 0.91±0.28 | 84.05±24.16 | 0.47±0.29 |
| S0-S1 | |||||
| 酒精性肝纤维化治疗前 | 39 | 37.10±8.95b | 1.05±0.20b | 132.60±53.51b | 0.80±0.24b |
| 酒精性肝纤维化治疗后 | 20.53±7.65 | 0.92±0.26 | 83.79±23.84 | 0.49±0.27 | |
| 非酒精性肝纤维化治疗前 | 43 | 36.29±8.13b | 1.02±0.19b | 130.12±49.87b | 0.76±0.23b |
| 非酒精性肝纤维化治疗后 | 20.47±8.42 | 0.89±0.26 | 85.40±26.17 | 0.46±0.28 | |
| 慢性肝炎肝纤维化治疗前 | 36 | 37.94±9.02b | 1.07±0.23b | 136.25±63.04b | 0.84±0.26b |
| 慢性肝炎肝纤维化治疗后 | 20.19±7.53 | 0.90±0.28 | 84.62±25.36 | 0.47±0.27 | |
| S2-S4 | |||||
| 酒精性肝纤维化治疗前 | 28 | 51.69±13.41b | 1.41±0.21b | 156.74±53.74b | 1.09±0.32b |
| 酒精性肝纤维化治疗后 | 23.43±6.11 | 0.96±0.14 | 95.57±15.47a | 0.51±0.14 | |
| 非酒精性肝纤维化治疗前 | 31 | 49.80±12.35b | 1.42±0.22b | 157.19±53.27b | 1.13±0.34b |
| 非酒精性肝纤维化治疗后 | 22.52±6.71 | 0.88±0.19 | 100.16±13.70b | 0.51±0.15 | |
| 慢性肝炎肝纤维化治疗前 | 26 | 55.64±14.27b | 1.37±0.23b | 157.27±52.75b | 1.01±0.36b |
| 慢性肝炎肝纤维化治疗后 | 21.11±6.25 | 0.96±0.22 | 96.89±16.41b | 0.54±0.15 |
CTGF、PDGF-BB、TIMP-1、TGF-β1肝纤维化S0-S1、S2-S4期患者治疗前组内、组间(各型与健康体检者比)均有统计学差异. 治疗后, 除CTGF、PDGF-BB S2-S4期患者组内、组间(各型与健康体检者比)有统计学差异外, 其他均无差异(表2).
| n | CTGF(μg/L) | PDGF-BB(μg/L) | TIMP-1(μg/L) | TGF-β1(ng/L) | |
| 健康体检者 | 60 | 4.53±1.21 | 2.81±0.57 | 136.86±56.24 | 15.40±5.22 |
| S0-S1 | |||||
| 酒精性肝纤维化治疗前 | 39 | 6.01±1.10b | 3.26±0.51b | 163.01±28.41b | 18.89±5.31b |
| 酒精性肝纤维化治疗后 | 4.51±0.62 | 2.84±0.32 | 128.49±33.31 | 15.63±3.5 | |
| 非酒精性肝纤维化治疗前 | 43 | 6.28±1.12b | 3.36±0.45b | 161.53±27.09ab | 19.38±4.12b |
| 非酒精性肝纤维化治疗后 | 4.47±0.71 | 2.83±0.31 | 138.42±37.82 | 14.51±2.61 | |
| 慢性肝炎肝纤维化治疗前 | 36 | 5.84±1.06b | 3.34±0.51b | 166.12±23.80ab | 19.51±4.04b |
| 慢性肝炎肝纤维化治疗后 | 4.40±0.64 | 2.85±0.29 | 143.57±32.52 | 15.26±2.95 | |
| S2-S4 | |||||
| 酒精性肝纤维化治疗前 | 28 | 13.43±3.46b | 7.57±1.19b | 211.67±61.03b | 21.52±6.06b |
| 酒精性肝纤维化治疗后 | 7.74±1.87b | 3.51±0.66 | 147.66±31.24 | 16.84±3.53 | |
| 非酒精性肝纤维化治疗前 | 31 | 11.71±3.66b | 7.36±1.85b | 196.51±50.98b | 20.65±5.83b |
| 非酒精性肝纤维化治疗后 | 7.68±1.72b | 3.30±0.65 | 150.17±30.08 | 17.13±3.48 | |
| 慢性肝炎肝纤维化治疗前 | 26 | 11.39±3.70b | 6.63±1.37b | 204.41±44.06b | 21.06±5.53b |
| 慢性肝炎肝纤维化治疗后 | 7.65±1.84b | 3.38±0.58 | 149.37±28.10 | 16.72±3.62 |
肝脏是乙醇代谢的主要器官, 摄入人体内的乙醇80%-90%由肝脏代谢, 乙醇氧化过程中产生的乙醛及其乙醛-蛋白质加合物等能降低肝细胞内谷胱甘肽的浓度, 使其清除氧自由基的作用减弱. 使库普弗细胞在大量的氧自由基及产生的脂质过氧化物的作用下活化并释放大量细胞因子刺激肝星状细胞(hepatic stellate cell, HSC)合成胶原; 此外, 乙醇还可通过低氧刺激HSC活化并分泌胶原. HSC增殖、活化导致ECM在Disse间隙中沉积, 使肝内皮细胞窗孔直径减小, 导致肝毛细血管化, 加重肝中央小静脉缺氧并加速肝纤维化的形成. 阿拓莫兰在人体内通过抗氧化、缓解氧应激、中和氧自由基、激活SH酶的作用而广泛应用于酒精性肝炎的治疗[7,8].
ALF是酒精性肝病的一种, 发病机制较为复杂, 目前尚不清楚, 可能与酒精及其代谢产物对肝脏的毒性作用、氧化应激、内毒素、免疫异常等多种因素有关[9], 是酒精性脂肪肝、酒精性肝炎进一步恶化导致的以胶原为代表的ECM成分过度增生、沉积的纤维增生性疾病[10]. ALF是酒精性肝硬化的早期阶段, 是酒精性肝病发展为酒精性肝硬化的中间阶段和必经之路. 肝纤维化的可逆性已经得到共识, ALF是酒精性肝病的研究热点之一.
目前西药对肝纤维化的治疗主要针对纤维化过程的某些重要环节用药物进行干预, 获得了一定的疗效, 但目前大多数化学药物仍处在动物实验或临床试验阶段, 尚缺乏理想的药物和方法. 近年研究较多的肝纤维化基因治疗主要是以肝纤维化发病的相关基因和抑制炎症反应发展作为治疗的靶位, 通过各种分子生物学手段影响TGF-β1、干扰素(interferon, IFN)、肝细胞生长因子(hepatic growth factor, HGF)等在肝纤维化发病中发挥作用的基因的表达以减缓或阻断肝纤维化进程; 此外, 增加黑色素刺激素α(melanin-stimulating hormone α, MSH-α)炎症抑制因子的表达或减少尿激酶型纤溶酶原的激活物(urokinase-type plasminogen activator, uPA)-HGF成熟刺激因子的表达也可以抑制肝纤维化进程[11]. 但是这些研究还处于分子生物学阶段, 其临床应用价值有待进一步验证.
近年来, 中医药治疗慢性乙型肝炎肝纤维化的临床观察研究的报道逐渐增多, 进一步从临床角度验证中医药抗纤维化的有效性. 大黄座虫丸是东汉名医张仲景《金匮要略》中的著名方剂, 主治"五劳虚极赢瘦, 腹胀不能食, 食伤、忧伤、饮伤、房劳伤、饥伤、经络营血伤, 内有干血, 肌肤甲错, 两目黯黑"的"干血痨". 虽然该方并非专为治疗肝硬化而设.但其遣方用药与中医认为肝纤维化的本质是肝血淤阻、湿热未尽, 治疗应活血化瘀、清泻湿热、解毒的观点十分吻合. 另外, 研究发现, 酒精性肝病预后和戒酒密切相关, 戒酒在脂肪变性、急性肝炎、脂质过氧化、炎症和胶原沉积中都发挥着作用, 具有代表性的对酒精性肝病的治疗都是以完全戒酒作为治疗的起点[12]. 针对ALF, 长期彻底的戒酒是治疗的首要措施, 是决定预后的关键性因素, 戒酒数周至数月后, 临床和病理表现有明显改善[13], 戒酒可明显提高患者的生存质量[14].
目前, 准确判断肝纤维化程度主要依靠肝组织病理学检测, 肝穿刺活检从理论上说虽然是诊断肝纤维化、肝硬化的金标准, 但在实际临床操作时往往由于患者的依从性和可重复性差, 执行起来有相当大的难度, 而且肝穿刺活检也同样存在诸如容易出现取材误差等同题, 因此人们一直致力于寻找血清学指标来联合监测肝纤维化的发展进程. 研究表明, 血清中HA、LN、PC-Ⅲ、Ⅳ-C从不同侧面反映了肝纤维化及肝细胞实质性损伤程度, 有利于全面反映肝纤维化的发展变化, 联合检测上述指标, 可明显提高肝纤维化诊断的准确性与可靠性, 能反映肝内炎症活动及肝细胞变性坏死情况, 对临床诊断、治疗有重要实用价值[15].
肝纤维化时, 肝内及HSC内VitA的含量及视黄酸受体一类维生素AX受体-a mRNA水平降低, 缺乏维生素A(vitamin A, VitA)可促进肝纤维化, 同时VitA可阻止肝纤维化的形成[16-19]. 其阻止肝纤维化形成的机制可能有: (1)调节HSC的增殖和分化[20]; (2)影响胶原等ECM的合成; (3)影响ECM的降解[21]. 由此可以推论, VitA阻止肝纤维化的作用是通过调节ECM而产生的. ECM一项重要的生理作用是贮存VitA脂滴, ECM在向肌成纤维细胞转化的过程中, 脂质中的VitA脂滴逐渐丢失, 可见VitA对ECM的转化有抑制作用[22]. 采用VitA逆转肝纤维化国外已有大量的报道, 但由于VitA中起主要作用的物质是视黄醇[23], 这种物质过量产生毒性, 因此我们采用VitA前体物质β胡萝卜素逆转肝纤维化.
本研究采用β胡萝卜素胶囊治疗不同分期的ALF患者与健康体检者、肝炎肝纤维化患者、非ALF患者比较, 通过血清HA[24]、LN、Ⅳ-C、PCⅢ、CTGF、PDGF-BB、TIMP-1、TGF-β1与彩超检查来判断β胡萝卜素逆转肝纤维化的效果. HA、LN、Ⅳ-C、PCⅢ为肝纤维化诊断指标已被国内外许多学者的研究结果证实[25-28], 由于他的非创伤性特点, 现已广泛用于临床. 我们的研究结果表明, HA、LN、Ⅳ-C 、PCⅢ肝纤S0-S1、S2-S4期患者治疗前组内、组间(各型与健康体检者比)均有显著性差异. 治疗后, 除Ⅳ-C S2-S4期患组内、组间(各型与健康体检者比)有统计学差异外, 其他均无差异. 研究显示, β胡萝卜素胶囊治疗不同分期的ALF患者的肝纤4项指标的结果相似, 除S2-S4期患者Ⅳ-C指标治疗后有所改善但未恢复正常外, 其他指标均恢复了正常.
一些研究显示, 某些细胞因子在HSC活化以及ECM生成中起着非常关键的作用, 其中TGF-β1是肝纤维化进展中重要的细胞因子, 在肝纤维化组织中TGF-β1明显增加[29], TGF-β1诱导的ECM产生等功能是通过下游效应元件CTGF的基因起作用的[30]. 使用免疫组织化学和Northern blot以及分子探针技术已证实, 肝纤维化组织中CTGF表达水平明显高于正常肝组织[31]. 王念跃等[32]用ELISA法检测慢性肝炎患者血清中的CTGF, 发现其和肝纤维化程度明显相关. 本项研究表明CTGF、PDGF-BB、TIMP-1、TGF-β1在肝纤维化S0-S1、S2-S4期患者治疗前组内、组间(各型与健康体检者比)均有统计学差异. 治疗后, 除CTGF、PDGF-BB S2-S4期患者组内、组间(各型与健康体检者比)有统计学差异外, 其他均无差异. 这说明β-胡萝卜素防治ALF的作用与防治慢性肝炎肝纤维化、非ALF的效果相近. 除CTGF、PDGF-BB在S2-S4期患者组内、组间(各型与健康体检者比)不能恢复正常外, 其他指标均可恢复正常.
本研究通过彩超评价ALF患者的效果, 观察结果显示1例S0-S1期ALF患者治疗后肝回声较均匀, 未见"薄雾"样改变, 进一步证明了β胡萝卜素防治ALF有一定的效果.
本研究从血清HA、LN、Ⅳ-C、PCⅢ、CTGF、PDGF-BB、TIMP-1、TGF-β1与彩超检查结果证明了β胡萝卜素对S0-S1、S2-S4期ALF患者均有逆转肝纤维化的作用. 且β胡萝卜素的治疗效果在ALF、肝炎肝纤维化、非ALF的患者中没有统计学差异. 由于肝纤维化存在难逆转和难治疗的现状, 因此在肝损伤早期即阻断其进展将有更重要的意义[33].
酒精性肝纤维化是以胶原为主的细胞外基质合成和降解的失衡, 导致其在肝内过度沉积的结果. 肝星状细胞激活在肝纤维化期间是引起胶原过度沉澱的主要原因, 并具有贮存维生素A脂滴的生理作用. 慢性酒精摄入可减少肝脏视黄酸的浓度, 减弱视黄醛的信号传递, 肝星状细胞在向肌成纤维细胞的转化过程中, 胞质中的维生素A脂滴逐渐丢失, 而视黄酸与视黄醛是维生素A类在人体的中间代谢产物, 由此推论维生素A类可抑制肝星状细胞的活化.
吴俊华, 副主任医师, 南京大学医学院功能评价中心
研发前沿 ALF是酒精性肝硬化的早期阶段, 是酒精性肝病发展为酒精性肝硬化的中间阶段和必经之路. 肝纤维化的可逆性已经得到共识, ALF是酒精性肝病的研究热点之一.
王念跃等用ELISA法检测慢性肝炎患者血清中的CTGF, 发现其和肝纤维化程度明显相关.
β胡萝卜素对酒精性肝纤维化患者有防治的效果, 并与β胡萝卜素防治慢性肝炎肝纤维化患者、非酒精性肝纤维化患者的效果基本一致.
本文具有较高的学术价值和应用价值, 但创新性一般.
编辑: 李薇 电编:李薇
| 2. | 刘 晨第, 邹 金海, 李 春英, 宋 慧, 魏 思忱, 陈 霞. 大黄(糜)虫丸联合戒酒治疗酒精性肝纤维化的临床研究. 现代中西医结 合杂志. 2009;18:1359-1360. |
| 16. | Floreani A, Baragiotta A, Martines D, Naccarato R, D'odorico A. Plasma antioxidant levels in chronic cholestatic liver diseases. Aliment Pharmacol Ther. 2000;14:353-358. [PubMed] |
| 18. | Vitaglione P, Morisco F, Caporaso N, Fogliano V. Dietary antioxidant compounds and liver health. Crit Rev Food Sci Nutr. 2004;44:575-586. [PubMed] |
| 20. | Naves MM, Silveira ER, Dagli ML, Moreno FS. Effects of beta-carotene and vitamin A on oval cell proliferation and connexin 43 expression during hepatic differentiation in the rat(1). J Nutr Biochem. 2001;12:685-692. [PubMed] |
| 22. | Dooley S, Delvoux B, Lahme B, Mangasser-Stephan K, Gressner AM. Modulation of transforming growth factor beta response and signaling during transdifferentiation of rat hepatic stellate cells to myofibroblasts. Hepatology. 2000;31:1094-1106. [PubMed] |
| 23. | Knook DL, Bosma A, Seifert WF. Role of vitamin A in liver fibrosis. J Gastroenterol Hepatol. 1995;10 Suppl 1:S47-S49. [PubMed] |
| 24. | Eboumbou C, Steghens JP, Abdallahi OM, Mirghani A, Gallian P, van Kappel A, Qurashi A, Gharib B, De Reggi M. Circulating markers of oxidative stress and liver fibrosis in Sudanese subjects at risk of schistosomiasis and hepatitis. Acta Trop. 2005;94:99-106. [PubMed] |
| 25. | 李 保森, 辛 绍杰, 张 双福, 邹 正升, 毛 远丽. 对几种肝纤维化诊断指标的评价. 中华实验和临床病毒学杂志. 2000;14:289. |
| 31. | Paradis V, Dargere D, Vidaud M, De Gouville AC, Huet S, Martinez V, Gauthier JM, Ba N, Sobesky R, Ratziu V. Expression of connective tissue growth factor in experimental rat and human liver fibrosis. Hepatology. 1999;30:968-976. [PubMed] |