修回日期: 2010-12-13
接受日期: 2010-12-21
在线出版日期: 2011-03-18
目的: 探讨尿激酶型纤溶酶原激活物(uPA)基因修饰骨髓源性肝干细胞(BDLSC)移植对CCl4诱导的大鼠肝组织转化生长因子-β-Smads(TGF-β-Smads)信号通路的影响.
方法: 采用皮下注射CCl4建立大鼠肝纤维化模型. 将纯系Fisher大鼠随机分为正常组、模型组、BDLSC组(尾静脉注入2×106 BDLSC)和BDLSC-uPA组(尾静脉注入2×106 AduPA转染的BDLSC), 每组9只. 观察各组大鼠肝功能和病理组织学变化; 采用免疫组织化学法或Western blot法分别检测大鼠肝组织TGF-β1、Smad3及Smad7蛋白表达变化.
结果: 与模型组和BDLSC组相比, BDLSC-uPA组大鼠肝脏结缔组织增生程度减轻, 假小叶形成不明显, 肝功能明显改善; 肝组织TGF-β1蛋白表达明显低于模型组和BDLSC组(0.1849±0.0456 vs 0.8202±0.0636, 0.2936±0.0548, 均P<0.05), 而Smad3和Smad7蛋白表达无明显变化.
结论: uPA基因修饰BDLSC移植可能部分通过抑制TGF-β1蛋白表达, 从而发挥抗肝纤维化的作用.
引文著录: 孙超, 李定国, 陈源文, 陈颖伟, 汪保灿. uPA基因修饰骨髓源性肝干细胞移植对肝纤维化大鼠TGF-β-Smads信号通路的影响. 世界华人消化杂志 2011; 19(8): 789-793
Revised: December 13, 2010
Accepted: December 21, 2010
Published online: March 18, 2011
AIM: To explore the effect of transplantation of urokinase-type plasminogen activator (uPA) gene-modified bone marrow-derived liver stem cells (BDLSC) on the transforming growth factor-β (TGF-β)/Smad signal pathway in rats with CCl4-induced liver fibrosis.
METHODS: Liver fibrosis was induced in rats by subcutaneous injection of CCl4. The rats were randomly divided into control group, model group, BDLSC group (injected with 2×106 BDLSC via the tail vein), and BDLSC-uPA group(injected with 2×106 uPA-transfected BDLSC via the tail vein). Liver function and hepatic pathohistological changes were detected, and the expression of TGF-β1, Smad3 and Smad7 proteins was determined by immunohistochemistry or Western blot.
RESULTS: In the BDLSC-uPA group, the extent of liver fibrosis was much milder, the formation of pseudolobules was less obvious, liver function was better, and the expression of TGF-β1 protein in the liver (0.1849 ± 0.0456 vs 0.8202 ± 0.0636, 0.2936 ± 0.0548, both P < 0.05) was significantly lower compared with the control group and BDLSC group. No significant difference was observed in the expression of Smad3 and Smad7 proteins among all the groups.
CONCLUSION: Transplantation of uPA gene-modified BDLSC exerts an anti-fibrosis effect partly by inhibiting the expression of TGF-β1 protein.
- Citation: Sun C, Li DG, Chen YW, Chen YW, Wang BC. Effect of transplantation of uPA gene-modified bone marrow-derived liver stem cells on the TGF-β/Smad signal pathway in rats with liver fibrosis. Shijie Huaren Xiaohua Zazhi 2011; 19(8): 789-793
- URL: https://www.wjgnet.com/1009-3079/full/v19/i8/789.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i8.789
骨髓源性肝干细胞(bone marrow-derived liver stem cell, BDLSC)来源充足, 增殖能力强, 具有很强的向肝系细胞分化的能力, 成为基因治疗肝脏疾病理想的靶细胞[1,2]. 尿激酶型纤溶酶原激活物(urokinase type plasminogen activator, uPA)在降解纤维、逆转肝纤维化中具有重要作用[3,4]. 我们设想肝干细胞与uPA基因治疗联合应用时, uPA参与清除坏死组织及降解纤维间隔, 促进BDLSC种植、增殖和分化、重建正常的肝组织结构, 将有利于肝组织形态和功能恢复. 转化生长因子-β1(transforming growth factor-β1, TGF-β1)是公认的最重要的促肝纤维化细胞因子之一, Smad3和Smad7蛋白为TGF-β1受体后下游的信号转导因子. 本研究将携带人uPA基因的腺病毒(adenoviral vector expressing human uPA, AduPA)体外转染BDLSC, 移植入肝纤维化大鼠体内, 评价转基因BDLSC对肝纤维化大鼠疗效和TGF-β-Smads信号通路的影响.
纯系Fisher 344♂大鼠10只, ♀大鼠36只, 体质量150-180 g, 购自中科院上海斯莱克实验动物有限责任公司. 其中♂大鼠仅用于提取骨髓干细胞, 是供体大鼠, 而♀大鼠是受体大鼠. TRIzol购自美国Invitrogen公司, M-MLV逆转录酶购自美国Promega公司. Taq DNA聚合酶购自大连TaKaRa宝生物有限公司. TGF-β1、Smad7兔多克隆抗体和Smad3羊多克隆抗体均购自美国Santa Cruz公司.
1.2.1 重组复制缺陷型腺病毒AduPA的包装及扩增: 人pAduPA重组腺病毒质粒由第二军医大学附属长征医院林勇博士惠赠. 利用脂质体转染法在293细胞中包装和扩增, 用氯化铯梯度离心纯化, AduPA最终病毒滴度可达3×1012 µfu/L.
1.2.2 BDLSC筛选、扩增和鉴定: 采用淋巴分离液进行密度梯度离心法分离胆总管结扎后10 d大鼠骨髓单个核细胞, 使用含5%的大鼠淤胆血清的病理条件培养液筛选培养BDLSC. 应用RT-PCR方法检测肝干细胞标志表达[5].
1.2.3 造模与分组: 将♀大鼠随机分为4组, 每组9只. (1)正常组: 皮下注射等量橄榄油; (2)模型组: 予40% CCl4(CCl4:橄榄油 = 2:3, 3 mL/kg)皮下注射, 3 d注射1次, 首剂加倍, 共注射18 次, 并经尾静脉注射等量生理盐水; (3)BDLSC组: 造模方法与模型组相同, 于实验第4周经尾静脉输入2×106 BDLSC; (4)BDLSC-uPA组: 造模方法与模型组相同. AduPA以感染复数(multiplicity of infection, MOI)500转染BDLSC, 72 h后收集BDLSC溶于生理盐水, 于实验第4周经尾静脉导入2×106转基因BDLSC. 细胞移植后应用免疫抑制剂他克莫司灌胃, 0.1 mg/(kg•d). 各组大鼠于第8周处死, 留取血清及肝组织.
1.2.4 病理组织学检测: 以甲醛固定矢状肝组织切片, 常规石蜡包埋. 制备5 μm厚肝组织切片用于HE染色.
1.2.5 血清学检测: 取各组大鼠血清1.5 mL, 使用自动生化分析仪检测肝功能指标丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBIL)和白蛋白(albumin, ALB).
1.2.6 Western blot分析: 提取各组肝组织总蛋白分别标准定量后, 各取20 μg于10% SDS-PAGE电泳分离蛋白, 转蛋白至PVDF膜. 使用5% BSA/TBST封闭1 h, 加入一抗(TGF-β1 1:200、Smad3 1:200、Smad7 1:1 000、β-actin 1:1 000稀释), 于4 ℃中孵育过夜. 次日用TBST洗涤后, 与辣根过氧化物酶标记的二抗(1:5 000稀释)在室温下孵育2 h, TBST洗涤. 用SuperSignal® west Pic化学发光试剂检测, 胶片曝光, 经显影、定影后结果扫描入计算机.
1.2.7 免疫组织化学分析: 将石蜡切片脱蜡至水, 微波抗原修复10 min, 加3% H2O2后于室温下孵育20 min; 加正常封闭羊血清, 室温下孵育20 min; 弃去羊血清, 加入一抗(TGF-β1: 1:200), 于4 ℃中过夜; 次日加对应二抗, 37 ℃中孵育45 min; DAB显色, 显微镜下观察适时终止反应, 苏木素复染, 脱水封片. 每个动物随机选取3张石蜡切片重复实验, 每张切片随机选取10个视野, 应用Image-Pro plus 5.1图像分析软件计算每个视野的阳性染色百分比进行统计.
统计学处理 计量资料以mean±SD表示, 采用SPSS12.0统计软件包进行单因素ANOVA或Kruskal-Wallis检验分析. P<0.05为显著性界值.
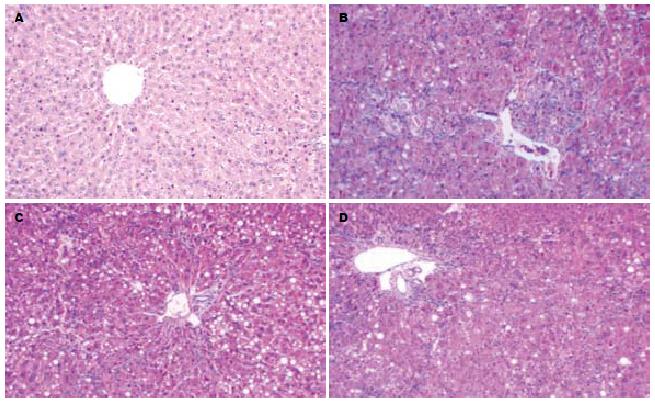
各组大鼠肝组织切片HE染色结果显示: 模型组肝组织呈广泛而严重的肝细胞脂肪变性坏死, 门脉及中央静脉周围炎症细胞浸润, 汇管区扩大, 大量纤维组织增生, 假小叶形成, 而BDLSC-uPA组肝细胞变性坏死、炎症细胞浸润及纤维组织增生明显减轻(图1).
大鼠血清肝功能检测结果显示: 与正常组相比, 肝纤维化模型组血清ALT、AST和TBIL水平均显著升高, ALB水平显著下降(P<0.05); 与模型组相比, BDLSC-uPA组大鼠血清ALT、AST和TBIL水平均有不同程度的降低, ALB水平升高(P<0.05, 表1).
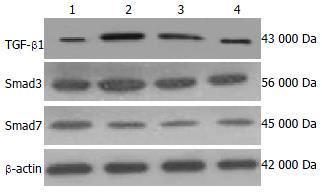
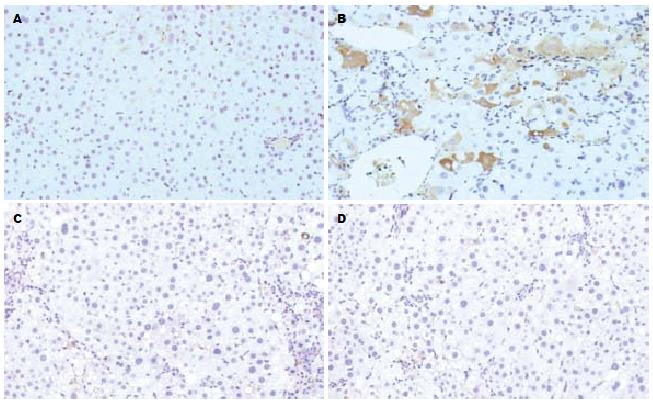
Western blot结果经计算机灰度扫描并与内参照(β-actin)比较分析显示: 与模型组(0.8202±0.0636)和BDLSC组(0.2936±0.0548)相比, BDLSC-uPA组的肝组织TGF-β1蛋白表达量(0.1849±0.0456)均明显减低(P<0.05, 图2). 免疫组织化学分析显示TGF-β1蛋白表达与Western blot结果一致, BDLSC-uPA组的TGF-β1染色阳性细胞数量(9%±3%)较模型组(51%±6%)和BDLSC组(19%±5%)明显减少(P<0.05, 图3). 而大鼠肝组织Smad3、7蛋白表达量在各实验组均无明显差异(P>0.05, 图2). 结果表明转基因移植BDLSC能明显抑制CCl4诱导的大鼠肝TGF-β1基因表达升高, 但对Smad3、Smad7蛋白表达无明显影响.
肝纤维化是肝脏对慢性损伤的一种修复反应, 以细胞外基质(extracellular matrix, ECM)在肝内过多沉积为主要特征. 由uPA、纤溶酶及基质金属蛋白酶(matrix metallo proteinases, MMPs)构成的级联激活反应是调节ECM沉积的主要途径[4]. 我们将肝干细胞与uPA基因治疗联合应用时, uPA参与清除坏死组织及降解纤维间隔, 促进BDLSC种植、重建正常的肝组织结构. 同时BDLSC作为uPA的载体细胞, 避免了单纯uPA基因治疗的免疫原性和毒性. 本研究中, 我们采用CCl4建立大鼠肝纤维化模型, 一方面由于CCl4诱导的肝纤维化在病理上与人相似[6], 另一方面, CCl4造成一定程度的肝损伤和肝纤维化, 有利于BDLSC在肝脏的种植. Terai等[7]将绿色荧光蛋白转基因小鼠的骨髓细胞经尾静脉导入CCl4肝纤维化小鼠模型中, 4 wk后发现受体肝脏中有26%供体来源细胞, 种植率远高于其他肝损伤动物模型.
我们组织学染色发现, 模型组大鼠肝组织中可见大量肝细胞变性坏死, 炎症细胞浸润, 汇管区扩大; BDLSC-uPA组的大鼠肝组织结缔组织增生程度减轻, 纤维间隔变细, 假小叶形成不明显. 同时, BDLSC-uPA组大鼠的血清ALT、AST和TBIL水平均有不同程度的降低, ALB水平升高, 上述结果均提示转基因BDLSC移植能明显减轻大鼠肝纤维化的程度, 在一定程度上改善了纤维化大鼠肝功能, 抑制了肝纤维化的发生发展. 某些学者发现, 输入体内的干细胞发挥上述作用并非通过直接地替代受损细胞, 而是启动了内源性的肝再生, 从而修复肝组织[8,9].
TGF-β1是最重要的促肝纤维化因子之一. 他促进肝星状细胞(hepatic stellate cell, HSC)活化和ECM合成, 抑制肝细胞再生, 并以自分泌和旁分泌的方式上调TGF-β1表达, 加速肝纤维化的发展[10]. TGF-β1对HSC的作用信号主要通过其受体和下游信号分子Smads蛋白转导. Smads是TGF-β生长因子超家族细胞内信号通路的基本组成成分, 成员有Smad1-Smad8. TGFβ与受体结合后诱导Smad2和Smad3磷酸化, 并与Smad4形成异寡聚体复合物, 转运到细胞核而调节转录反应. Smad7能通过阻断Smad2、Smad3和Smad4的结合, 对Smad的信号转导通路发挥负调控作用[11]. 基于此, 我们检测了各组大鼠肝组织中TGF-β1和Smad3、Smad7基因表达. Western blot检测和免疫组织化学分析均显示, BDLSC-uPA组的TGF-β1基因表达较模型组明显降低, 但对Smad3、Smad7表达的影响却不明显. 这与国内外研究结果相似[8,9]. Zhao等[9]研究推测骨髓干细胞可能分泌一些细胞因子, 如神经生长因子, 诱导HSC的凋亡, 下调TGF-β1的表达. 我们的结果提示转基因BDLSC抗肝纤维化机制也可能部分与BDLSC抑制TGF-β1的表达有关.
总之, 我们的研究证实uPA基因修饰BDLSC移植可能部分通过抑制TGF-β1蛋白表达, 从而发挥抗肝纤维化的作用.
近年发现骨髓中某些干细胞具有向肝系细胞分化的潜能, 分离骨髓源性肝干细胞(BDLSC), 用于肝病的治疗研究受到广泛重视. 尿激酶型纤溶酶原激活物(uPA)在降解纤维、逆转肝纤维化中起重要作用.
单云峰, 副主任医师, 温州医学院附属第一医院肝胆外科
基因治疗与细胞治疗的结合是目前研究的热点.
Zhao等研究推测骨髓干细胞可能分泌一些细胞因子, 如神经生长因子, 诱导HSC的凋亡, 下调TGF-β1的表达.
本研究发现BDLSC-uPA组大鼠肝脏结缔组织增生程度减轻, 肝功能明显改善; 肝组织TGF-β1蛋白表达明显低于模型组和BDLSC组, 而Smad3和Smad7蛋白表达无明显变化.
本研究发现转基因BDLSC可抑制肝纤维化的发展, 且其抗肝纤维化机制也可能部分与BDLSC抑制TGF-β1的表达有关. 此研究为其临床应用治疗肝纤维化提供理论依据.
本文深入研究了尿激酶型纤溶酶原激活物(uPA)修饰BDLSC移植抑制大鼠肝纤维化的机制, 为临床应用提供更多的理论依据.
编辑: 李薇 电编:李薇
| 1. | Lan L, Chen Y, Sun C, Sun Q, Hu J, Li D. Transplantation of bone marrow-derived hepatocyte stem cells transduced with adenovirus-mediated IL-10 gene reverses liver fibrosis in rats. Transpl Int. 2008;21:581-592. [PubMed] [DOI] |
| 2. | Dai LJ, Li HY, Guan LX, Ritchie G, Zhou JX. The therapeutic potential of bone marrow-derived mesenchymal stem cells on hepatic cirrhosis. Stem Cell Res. 2009;2:16-25. [PubMed] [DOI] |
| 3. | Martínez-Rizo A, Bueno-Topete M, González-Cuevas J, Armendáriz-Borunda J. Plasmin plays a key role in the regulation of profibrogenic molecules in hepatic stellate cells. Liver Int. 2010;30:298-310. [PubMed] [DOI] |
| 4. | González-Cuevas J, Bueno-Topete M, Armendariz-Borunda J. Urokinase plasminogen activator stimulates function of active forms of stromelysin and gelatinases (MMP-2 and MMP-9) in cirrhotic tissue. J Gastroenterol Hepatol. 2006;21:1544-1554. [PubMed] [DOI] |
| 5. | 孙 超, 李 定国, 陈 源文, 陈 颖伟, 孙 巧玲, 汪 保灿. 腺病毒介导的人uPA体外转染大鼠骨髓源性肝干细胞的研究. 胃肠病学 和肝病学杂志. 2006;15:46-49. |
| 6. | Sindhu ER, Firdous AP, Preethi KC, Kuttan R. Carotenoid lutein protects rats from paracetamol-, carbon tetrachloride- and ethanol-induced hepatic damage. J Pharm Pharmacol. 2010;62:1054-1060. [PubMed] [DOI] |
| 7. | Terai S, Sakaida I, Yamamoto N, Omori K, Watanabe T, Ohata S, Katada T, Miyamoto K, Shinoda K, Nishina H. An in vivo model for monitoring trans-differentiation of bone marrow cells into functional hepatocytes. J Biochem. 2003;134:551-558. [PubMed] [DOI] |
| 8. | Fang B, Shi M, Liao L, Yang S, Liu Y, Zhao RC. Systemic infusion of FLK1(+) mesenchymal stem cells ameliorate carbon tetrachloride-induced liver fibrosis in mice. Transplantation. 2004;78:83-88. [PubMed] [DOI] |
| 9. | Zhao DC, Lei JX, Chen R, Yu WH, Zhang XM, Li SN, Xiang P. Bone marrow-derived mesenchymal stem cells protect against experimental liver fibrosis in rats. World J Gastroenterol. 2005;11:3431-3440. [PubMed] |
| 10. | Kisseleva T, Brenner DA. Role of hepatic stellate cells in fibrogenesis and the reversal of fibrosis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S73-S78. [PubMed] [DOI] |
| 11. | Breitkopf K, Godoy P, Ciuclan L, Singer MV, Dooley S. TGF-beta/Smad signaling in the injured liver. Z Gastroenterol. 2006;44:57-66. [PubMed] [DOI] |