修回日期: 2011-02-09
接受日期: 2011-02-15
在线出版日期: 2011-03-18
目的: 探讨磷脂酰肌醇3-激酶(PI-3K)通路及其相关蛋白二酰甘油酰基转移酶2(DGAT2)、蛋白激酶C(protein kinase C, PKC)的亚型PKC-ε在大鼠非酒精性脂肪性肝病(NAFLD)发病中的作用.
方法: 48只大鼠随机分为6组: 正常对照组(N1组普通饮食喂养4 wk, N2组普通饮食喂养8 wk, N3组普通饮食喂养12 wk); NAFLD模型组(H1组高脂喂养4 wk、H2组高脂喂养8 wk、H3组高脂喂养12 wk); 评价各组大鼠肝脂肪变程度、炎症活动和纤维化程度; 免疫组织化学法观测各组PKC-ε蛋白表达量; RT-PCR法检测PI-3K(p85a) mRNA和DGAT2 mRNA的表达.
结果: NAFLD模型组脂肪变性明显, 纤维化和炎症活动度记分均显著高于正常对照组; H2、H3组脂肪变性分度及纤维化分期比H1组明显增高, 气球样变也有显著的差异; H2、H3组PKC-ε蛋白表达量与正常对照组比较明显增多(7.68±1.32 vs 6.68±2.16, 8.46±1.19 vs 5.52±1.05, P<0.05或0.01); PI-3K mRNA(ΔCt)与正常对照组相比明显升高, 且H2、H3组与H1组比较明显升高, PI-3K mRNA表达量在模型组中随脂肪肝程度的加重呈进行性降低. DGAT2 mRNA(ΔCt)与正常对照组比较显著降低, 且H2、H3组与H1组比较明显降低, DGAT2 mRNA表达量在NAFLD模型组中随脂肪肝程度的加重呈进行性升高.
结论: PI-3K通路及其相关蛋白PKC-ε和DGAT2可能与NAFLD发病机制有关.
引文著录: 李光艳, 李昌平, 钟晓琳, 康敏. PI-3K、DGAT2、PKC-ε在大鼠非酒精性脂肪性肝病发病机制中的作用. 世界华人消化杂志 2011; 19(8): 782-788
Revised: February 9, 2011
Accepted: February 15, 2011
Published online: March 18, 2011
AIM: To investigate the role of phosphatidylinositol 3-kinase (PI-3K), acyl-CoA: diacylgycerol acyltransferase 2 (DGAT2) and protein kinase C-ε (PKC-ε) in the pathogenesis of non-alcoholic fatty liver disease (NAFLD) in rats.
METHODS: Forty-eight Sprague-Dawley rats were randomly divided into normal control group and high-fat diet group. Rats of the high-fat diet group were fed a high-fat diet for 4, 8 or 12 weeks, while the normal control group was fed a normal diet. Liver slices were prepared to grade the degree of fatty change, inflammation and fibrosis. The expression of PKC-ε protein was determined by immunohistochemistry (IHC), while the mRNA levels of PI-3K (p85) and DGAT2 were measured by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Feeding a high-fat diet caused the development of NAFLD in rats. The degree of fatty change and inflammation was significantly more severe in the high-fat die group than in the normal control group. The degree of inflammation, fibrosis and ballooning degeneration was significantly more severe in rats fed a high-fat diet for 8 and 12 wk than for 4 wk. The expression of PKC-ε in rats feeding a high-fat diet for 8 and 12 wk was significantly higher than that in the normal control group (7.68 ± 1.32 vs 6.68 ± 2.16, 8.46 ± 1.19 vs 5.52 ± 1.05, P < 0.05 or 0.01). The expression of PI-3K (p85a) was significantly lower in the high-fat diet group than in the normal control group and in rats fed a high-fat diet for 8 and 12 wk than for 4 wk. In contrast, the expression of DGAT2 was significantly higher in the high-fat diet group than in the normal control group and in rats fed a high-fat diet for 8 and 12 wk than for 4 wk.
CONCLUSION: PI-3K and its associated proteins DGAT2 and PKC-ε may be critically involved in the pathogenesis of NAFLD.
- Citation: Li GY, Li CP, Zhong XL, Kang M. Role of PI-3K, DGAT2 and PKC-ε in pathogenesis of non-alcoholic fatty liver disease in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(8): 782-788
- URL: https://www.wjgnet.com/1009-3079/full/v19/i8/782.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i8.782
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)发病机制复杂, 其发病机制与胰岛素抵抗(insulin resistance, IR)等有关[1]. IR是机体对胰岛素的反应减退, 正常剂量的胰岛素产生低于正常生物学效应的一种状态即胰岛素敏感细胞(主要为肝细胞、肌细胞、脂肪细胞)对胰岛素介导的葡萄糖摄取及代谢的抵抗, 而胰岛素信号传递受阻或减弱是导致IR的主要原因[2,3]. 肝脏IR是NAFLD发生的中心环节, 通过增加肝脏的氧化应激及脂质过氧化水平促进疾病发展, 此外, 高胰岛素血症可能还通过刺激星状细胞合成和分泌结缔组织生长因子(connective tissue growth factor, CTGF), 促进肝纤维化发生发展[4]. 磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI-3K)通路是肝脏胰岛素信号传导中的主要通路, PI-3K通路任何一个环节出现异常都有可能导致葡萄糖代谢或转运障碍, 导致IR发生, 而PI-3K作为胰岛素信号转导中的关键酶, 在IR的发生发展中起重要用[3,5]; 本实验中通过改良高脂饮食建立NAFLD大鼠模型, 检测蛋白激酶ε(protein kinase ε, PKC-ε)在肝组织中的表达情况及检测肝脏PI-3K mRNA以及二酰甘油酰基转移酶(acyl-CoA: diacylgycerol acyltransferase 2, DGAT2)mRNA的表达, 从而揭示他们在NAFLD中的发病作用.
健康成年清洁级♂Spague-Dawlay(SD)大鼠48只, 体质量150-180 g, 购于重庆腾鑫生物技术有限公司. 适应性喂养1 wk. 兔抗大鼠PKC-ε多克隆抗体、二抗羊抗兔IgG、SP免疫组织化学染色试剂盒(武汉博士德生物技术有限公司), DEPC(北京赛百盛基因技术有限公司), 溴化乙锭(EB, 美国Promega公司), 溴酚蓝(美国Sigma公司), 引物合成及探针修饰(上海生物工程有限公司), Taq DNA PCR反应试剂盒(TaKaRa大连宝生 批号ck3501AA), TRIzol(购自美国Invitrogen, 批号50563209), dNTP[购自美国普洛麦格(Promega)公司, 批号251230]. FTC2000实时荧光定量基因扩增仪(加拿大枫岭公司), 微型台式离心机(日本Sanyo公司), 水平电泳仪(美国BIO-RAD公司), 水平离心机LD5-2A(北京医用离心机厂), Gel Doc 1000凝胶成像系统(美国BIO-RAD公司), Maxi-MixⅡ试管震荡器(Barnstead/ThermolyneUSA).
1.2.1 分组及造模: 48只大鼠随机分为6组: 正常对照组(N1组普通饮食喂养4 wk, N2组普通饮食喂养8 wk, N3组普通饮食喂养12 wk); NAFLD模型组[H1组高脂饲料[6](即: 胆固醇2%+胆酸钠0.5%+丙硫氧嘧啶0.2%+蔗糖5%+猪油10%+基础饲料82.3%)喂养4 wk、H2组高脂饲料喂养8 wk、H3组高脂饲料喂养12 wk). 均提供自来水, 自由饮用, 并于每天傍晚给予适当饲料, 供其食用; 饲养温度控制在(25±2) ℃.
1.2.2 病理组织学检查: 大鼠处死前1 d禁食12 h, 自由饮水, 于第2天称质量后以20 g/L戊巴妥钠溶液1 mL/kg腹腔内注射麻醉, 进行心脏采血, 然后迅速取下肝脏测量肝湿质量, 以备计算肝指数(肝湿质量/体质量×100%); 在肝右叶部分距边缘5 mm处取1.0 cm×0.5 cm×0.5 cm大小肝组织, 浸泡于4%多聚甲醛中固定, 切片行苏木紫-伊红染色后, 在显微镜下观察肝组织的脂肪变、炎症活动以及纤维化情况.
1.2.3 各组大鼠心脏采血后进行血脂及肝功能检测: 测定各组大鼠血清总胆固醇(total cholesterol, TC)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST).
1.2.4 观测指标的检测: (1)免疫组织化学法检测PKC-ε在脂肪肝组织中的表达, 一抗选用兔抗大鼠PKC-ε多克隆抗体, 按照SP免疫组织化学染色试剂盒说明书按步骤进行操作. 采用双盲法在光镜下随机选择20个肝细胞/片, 记数肝细胞的阳性细胞及细胞总数, PKC-ε在肝细胞中的标记值为阳性细胞数/细胞总数×100%; (2)实时荧光定量PCR检测肝脏PI-3K(p85a) mRNA及DGAT2 mRNA的表达按TRIzol说明书方法提取组织总RNA, 对获得的RNA产物进行电泳检测可见RNA提取完整无降解, 将提取的总mRNA逆转录为cDNA, 收集数据, 确定每个样品管中荧光强度增加到某一特定阈值时的扩增循环数(Ct值), 进行分析绘制每一反应管的扩增动力学曲线, 根据Ct值与标准模板初始拷贝的对数值作图, 得到该样品的标准曲线. GADPH引物: F: TGACATCAAGAAGGTGGTGA, R:TCATACCAGGAAATGAGCTT产物长度为177 bp; PI-3K引物为: F: TTCTCTGATCCATTAACCTT, R:TCTTTGACAACTTGATCCTG, 产物长度为: 143 bp; DGAT2引物: F: GAGACTACTTTCCCATCCAG, R: GGTATCCAAAGATATAGTTCCT, 产物长度为: 72 bp. 以上基因扩增参数为: (2)94 ℃ 2 min; (2)94 ℃ 20 s, 55 ℃, 30 s, 60 ℃ 40 s, 45循环.
统计学处理 所有数据均使用SPSS15.0软件进行统计学分析. 计量资料用mean±SD表示, H组与N组比较采用两样本均数比较的t检验; H组与N组间比较采用方差分析, P<0.05为差异有统计学意义.
随造模时间延长, H组大鼠血脂及肝功能各组指标呈进行性升高, 各时间点H组ALT值与N组比较, 及H组间比较均有明显差异(P<0.05), H3组与H1组有明显的差异(P<0.05); 各时间点H组TC值与N组比较, 及H组间比较均有明显差异(均P<0.05); AST水平H组与N组间差异显著(P<0.01).
H组脂肪变性分度、气球样变、小叶内炎症分级及纤维化分期均高于N组(P<0.05); H2组脂肪变性分度及纤维化分期与H1组有显著的差异(P<0.01), 气球样变也有显著的差异(P<0.05); H3纤维化分期与H1也有显著的统计学意义(P<0.01).
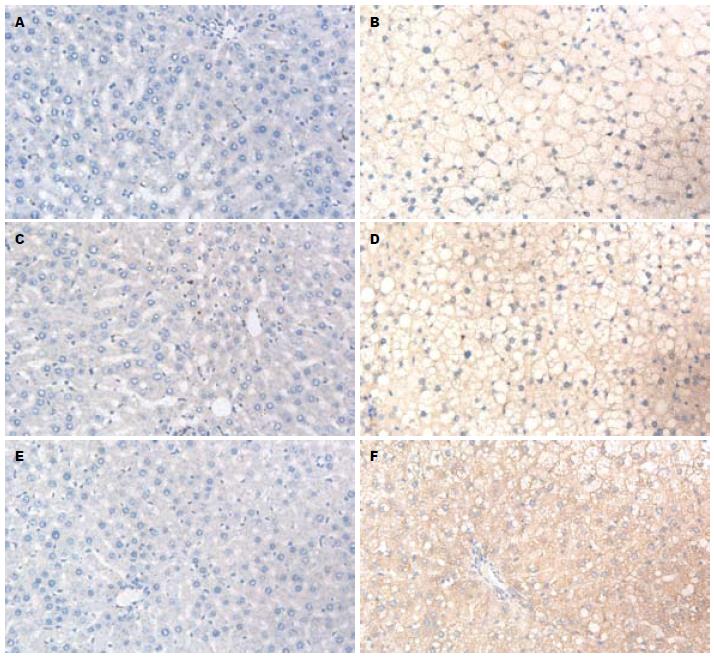
H组与N组大鼠比较, 肝组织内表达明显增强, H2、H3组与N组有显著差异(7.68±1.32 vs 6.68±2.16; 8.46±1.19 vs 5.52±1.05, 均P<0.05, 图1)
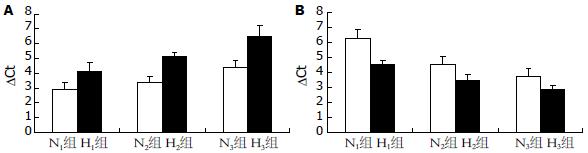
PI-3K(p85a) mRNA表达量在H组中随脂肪肝程度的加重呈进行性降低, H1、H2、H3组PI-3K(p85a) mRNA相对表达量均显著低于N组(均P<0.05), 且H组间之间比较也存在明显差异(均P<0.05). DGAT2 mRNA表达量在H组中随脂肪肝程度的加重呈进行性升高, 且H组间比较也存在明显差异(P<0.05, 图2-4).
肝脏IR是NAFLD发生的中心环节, IR不仅通过增加脂质分解及游离脂肪酸(free fatty acid, FFA)运至肝脏的增加导致脂肪变性的发生, 还通过"第二次打击"涉及氧化应激. 血清FFA增多及线粒体功能不全导致脂质过氧化增强, 氧自由基增多, 肝脏氧化-抗氧化平衡失调, 促进NAFLD进一步发展. 最近的实验研究表明微电流(mild electrical stimulation, MES)和热休克(heat shock, HS)影响信号传导并且激活PI-3K/AKT传导通路, 通过增加AKT磷酸化, 进而改善IR并且促进脂肪代谢, 可以缓解NAFLD, 进一步证明了胰岛素信号传导通路PI-3K-AKT是一种由胰岛素作用的瀑布式信号传导通路, 并且在肝脏内葡萄糖的平衡和三酰甘油的代谢起着非常重要的作用[7-9]. 据近年研究表明肝细胞凋亡与非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)直接相关, 并且肝细胞凋亡的程度与疾病的严重性有密切的关系. 实验证明, 胰岛素和其他一些相关的增长因素阻止细胞凋亡并且通过PI-3K/AKT机制加速了细胞的增殖, 从而说明PI-3K的激活从机能上可能阻止了细胞死亡信号, 并且进一步可以改善NAFLD[10]. 本研究通过检测大鼠NAFLD模型PI-3K蛋白表达量及其mRNA的表达水平, 观察PI-3K在NAFLD发病中的作用. 有研究显示在肥胖的大鼠肌肉和肝脏中, 胰岛素刺激胰岛素受体底物1、2(insulin-stimulated insulin receptor substrate 1, IRS-1、IRS-2)含量和活性显著降低, 与PI-3K的结合减少, 引起PI-3K活性降低; 且PI-3K中p85a亚单位的表达明显减少. 本实验用高脂饮食造模, 在形成单纯性脂肪肝的基础上继续高脂饮食喂养, 病理形态上在单纯脂肪肝时, 实行荧光定量PCR分别检测各组肝脏中PI-3K(p85a) mRNA的表达活性, 结果显示H1组与N组PI-3K(p85a) mRNA表达水平无显著差异; 随着造模时间延长、肝脏脂肪变程度加重, PI-3K蛋白表达量出现下降, 实验中H1、H2、H3与N相比, PI-3K(p85a) mRNA表达水平明显降低(P<0.05), H3组PI-3K(p85a) mRNA表达与H2组相比, 表达水平有所降低(P<0.05). 可见PI-3K(p85a) mRNA表达随着NAFLD的病情加重, 其表达量逐渐降低, PI-3K(p85a) mRNA表达与NAFLD的发病程度呈负相关.
PKC-ε归为新型PKC亚家族, 其特点为非钙依赖而对二酰甘油敏感的Ser/Thr蛋白激酶. PKC-ε在细胞内的区域化定位取决于第二信使和一些信号蛋白因子, 这类蛋白因子能对G-蛋白偶联受体、酪氨酸激酶受体和酪氨酸激酶偶联受体做出应答. 成熟PKC-ε是由几种不同的第二信使如DAG、三磷酸肌醇和脂肪酸激活的, 脂肪酸是由血小板衍生生长因子和缓激肽生理激活产生的.
PKC-ε导致NAFLD的机制为胰岛素受体的下调和脂肪累积, 其结果导致糖原合成受损、IR[11], 他可能干扰了IRS-1和IRS-2的酪氨酸磷酸化并且损害了胰岛素激活糖原合酶的能力[12]. 其分子机制可能为: PKC-ε能使胰岛素受体激酶失活, 从而导致了胰岛素刺激IRS1和IRS2的酪氨酸磷酸化的减少. 接着, 这会导致胰岛素激活PI-3K/AKT-2的减少. 减弱的AKT-2的激活导致了糖原激酶合酶激酶3和FOXO的磷酰化的降低, 然后会降低肝糖原合成和减弱肝糖异生的抑制作用[13]. 在本实验中通过运用免疫组织化学法检测NAFLD模型各组肝脏组织内的PKC-ε蛋白在不同时间点的阳性表达量进一步来探讨NAFLD的发病机制. 在本实验中H组大鼠肝组织内PKC-ε阳性表达量, 较N组有明显差异. 并且随着NAFLD脂肪变程度的加重, PKC-ε阳性表达量也明显增加. 在H1、H2、H3组中的各个时间点上阳性表达逐渐向黄色、棕黄色、褐色表达. 目前研究表明PKC-ε在NAFLD的发病过程中的作用是通过PKC-ε活化和表达提高, 进一步导致了肝脏IR, 而PKC-ε活化和表达提高导致肝IR的中心环节是由于导致胰岛素激活PI-3K/AKT-2的减少. 在实验中, 随着H组脂肪肝程度的加重, PKC-ε阳性表达量也明显增加, PI-3K的表达量相应降低, PKC-ε的表达与PI-3K的表达呈负相关, 与肝脂肪变程度呈正相关. 可见PKC-ε表达和活性提高在NAFLD的发病过程中间起到了重要作用.
DGAT2是一种完整的内质网细胞微粒体酶, 是催化三酰甘油合成的最后一步反应的酶, 也是三酰甘油合成过程中唯一的关键酶和限速酶. 此酶是机体中一种非常重要的酶, 其主要作用机制是使DAG加上脂肪酸酰基辅酶A以共价键结合形成三酰甘油, 成为三酰甘油合成的最后一个步骤. DGAT2在脂质代谢旺盛的组织中的表达水平最高(如肝脏、肾脏、白色脂肪组织), 这意味着他在脂质代谢中扮演着十分重要的角色, 这种表达主要是胰岛素应答[14-16]. 被敲除DGAT1的老鼠在组织中减少了将近50%的三酰甘油, 通过人工喂养和通过涉及不断增长的能量消耗, 他们很幸运的活了下来, 而DGAT2敲除的老鼠由于严重的脂肪减少和受损的皮肤屏障功能在不久就死亡了[17-19]. 目前, 反义技术已能在特殊处理的老鼠体内阻止DGAT2的表达: 反义寡核苷酸类(antisense oligonucleotides, ASOs)作用于肝脏和脂肪组织, 但不作用于体内的肌肉里. 经过高脂饮食的肥胖小鼠和肥胖的ob/ob小鼠给予DGAT2 ASOs干预后, 结果发现在肝脏里的三酰甘油和三酰甘油脂蛋白明显减少了, 说明了在肝脏里有一条肝脏脂肪的下行调节通路(包括SREBP-1C, SCD1, ACC, ATP柠檬酸裂合酶, glycerol lcinase and HMG-CoA还原酶)和一条上调FFA氧化的通路; 如果体质量, 肥胖, 代谢速率, 胰岛素敏感性都不变, 主要是由于体内肝脏阻断DGAT2[20]. DGAT2 ASOs逆转了由饮食因素引起的肝脏脂肪沉积和IR, 后者的影响与PKC的复位膜电位相偶联的. 研究表明, 经过DGAT2 ASOs治疗后, DAG明显减少, 从而使肝脏的IR有所改进, 很可能是由于固醇调节元件结合蛋-1C的反馈, 进而调整了脂肪生成通路和由肝脏LCCoAs对线粒体氧化的激活, 这是在DGAT2 ASO干预以后改变的[13,21-24]. 以上这些发现和DAG激活PKCa的能力, 使得DAG成为肝脏脂质引起的IR最佳的中间介质[13,21-24]. DGAT2的表达与IR有明显关系, 而IR是NAFLD发病的中心环节. 本实验通过制作NAFLD动物模型, 应用RT-PCR分别来检测N组和H组各个时间点的DGAT2 mRNA的表达, 进一步探讨DGAT2与NAFLD发病的关系, 从结果可以看出DGAT2 mRNA表达量在H组中随脂肪肝程度的加重呈进行性升高, 且H组间比较也存在明显差异(P<0.05).
总之, PI-3K(p85a) mRNA表达随着NAFLD的肝脂肪变程度加重, 其表达量逐渐降低, PI-3K(p85a) mRNA表达与NAFLD的肝脂肪变程度呈负相关. 随着H组脂肪肝程度的加重PKC-ε、DGAT2表达量也明显增加, PI-3K的表达量相应降低, PKC-ε、DGAT2的表达与PI-3K的表达呈负相关, 与肝脂肪变程度呈正相关.
非酒精性脂肪性肝病(NAFLD)发病机制复杂, 其发病机制与胰岛素抵抗(IR)等有关. IR是机体对胰岛素的反应减退, 正常剂量的胰岛素产生低于正常生物学效应的一种状态, 即胰岛素敏感细胞(主要为肝细胞、肌细胞、脂肪细胞)对胰岛素介导的葡萄糖摄取及代谢的抵抗, 而胰岛素信号传递受阻或减弱是导致IR的主要原因.
高泽立, 主任医师, 上海交通大学医学院附属第九人民医院周浦分院消化科
最近的实验研究表明微电流(MES)和热休克(HS)影响信号传导, 并且激活PI-3K/AKT传导通路, 通过增加AKT磷酸化, 进而改善IR并且促进脂肪代谢, 可以缓解NAFLD.
本实验通过改良高脂饮食建立NAFLD大鼠模型, 检测蛋白激酶ε(PKC-ε)在肝组织中的表达情况, 及检测肝脏PI-3K mRNA以及二酰甘油酰基转移酶(DGAT2)mRNA的表达, 从而揭示他们在NAFLD中的发病作用.
PI-3K通路及其相关蛋白PKC-ε和DGAT2可能与NAFLD发病机制有关.
本文选题新颖, 实验设计合理, 具有较好的参考价值.
编辑: 李薇 电编:何基才
| 1. | Fan JG, Farrell GC. VAT fat is bad for the liver, SAT fat is not! J Gastroenterol Hepatol. 2008;23:829-832. [PubMed] [DOI] |
| 2. | Pessin JE, Saltiel AR. Signaling pathways in insulin action: molecular targets of insulin resistance. J Clin Invest. 2000;106:165-169. [PubMed] |
| 8. | Morino S, Kondo T, Sasaki K, Adachi H, Suico MA, Sekimoto E, Matsuda T, Shuto T, Araki E, Kai H. Mild electrical stimulation with heat shock ameliorates insulin resistance via enhanced insulin signaling. PLoS One. 2008;3:e4068. [PubMed] [DOI] |
| 9. | Robinson KR. The responses of cells to electrical fields: a review. J Cell Biol. 1985;101:2023-2027. [PubMed] [DOI] |
| 10. | Pagliassotti MJ, Wei Y, Wang D. Insulin protects liver cells from saturated fatty acid-induced apoptosis via inhibition of c-Jun NH2 terminal kinase activity. Endocrinology. 2007;148:3338-3345. [PubMed] [DOI] |
| 11. | 王 芳, 曹 西南. 蛋白激酶Cε的结构特点和生理、病理作用. 国外医学•临床生物化学与检验学分册. 2005;5:307-309. |
| 12. | Samuel VT, Liu ZX, Qu X, Elder BD, Bilz S, Befroy D, Romanelli AJ, Shulman GI. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease. J Biol Chem. 2004;279:32345-32353. [PubMed] [DOI] |
| 13. | Choi CS, Savage DB, Kulkarni A, Yu XX, Liu ZX, Morino K, Kim S, Distefano A, Samuel VT, Neschen S. Suppression of diacylglycerol acyltransferase-2 (DGAT2), but not DGAT1, with antisense oligonucleotides reverses diet-induced hepatic steatosis and insulin resistance. J Biol Chem. 2007;282:22678-22688. [PubMed] |
| 14. | Musso G, Gambino R, Cassader M. Recent insights into hepatic lipid metabolism in non-alcoholic fatty liver disease (NAFLD). Prog Lipid Res. 2009;48:1-26. [PubMed] [DOI] |
| 15. | Cases S, Stone SJ, Zhou P, Yen E, Tow B, Lardizabal KD, Voelker T, Farese RV Jr. Cloning of DGAT2, a second mammalian diacylglycerol acyltransferase, and related family members. J Biol Chem. 2001;276:38870-38876. [PubMed] [DOI] |
| 16. | Cases S, Smith SJ, Zheng YW, Myers HM, Lear SR, Sande E, Novak S, Collins C, Welch CB, Lusis AJ. Identification of a gene encoding an acyl CoA:diacylglycerol acyltransferase, a key enzyme in triacylglycerol synthesis. Proc Natl Acad Sci U S A. 1998;95:13018-13023. [PubMed] [DOI] |
| 17. | Chen HC, Smith SJ, Ladha Z, Jensen DR, Ferreira LD, Pulawa LK, McGuire JG, Pitas RE, Eckel RH, Farese RV Jr. Increased insulin and leptin sensitivity in mice lacking acyl CoA:diacylglycerol acyltransferase 1. J Clin Invest. 2002;109:1049-1055. [PubMed] |
| 18. | Smith SJ, Cases S, Jensen DR, Chen HC, Sande E, Tow B, Sanan DA, Raber J, Eckel RH, Farese RV Jr. Obesity resistance and multiple mechanisms of triglyceride synthesis in mice lacking Dgat. Nat Genet. 2000;25:87-90. [PubMed] [DOI] |
| 19. | Stone SJ, Myers HM, Watkins SM, Brown BE, Feingold KR, Elias PM, Farese RV Jr. Lipopenia and skin barrier abnormalities in DGAT2-deficient mice. J Biol Chem. 2004;279:11767-11776. [PubMed] [DOI] |
| 20. | Yu XX, Murray SF, Pandey SK, Booten SL, Bao D, Song XZ, Kelly S, Chen S, McKay R, Monia BP. Antisense oligonucleotide reduction of DGAT2 expression improves hepatic steatosis and hyperlipidemia in obese mice. Hepatology. 2005;42:362-371. [PubMed] [DOI] |
| 21. | Neschen S, Morino K, Hammond LE, Zhang D, Liu ZX, Romanelli AJ, Cline GW, Pongratz RL, Zhang XM, Choi CS. Prevention of hepatic steatosis and hepatic insulin resistance in mitochondrial acyl- CoA:glycerol-sn-3-phosphate acyltransferase 1 knockout mice. Cell Metab. 2005;2:55-65. [PubMed] [DOI] |
| 22. | Considine RV, Nyce MR, Allen LE, Morales LM, Triester S, Serrano J, Colberg J, Lanza-Jacoby S, Caro JF. Protein kinase C is increased in the liver of humans and rats with non-insulin-dependent diabetes mellitus: an alteration not due to hyperglycemia. J Clin Invest. 1995;95:2938-2944. [PubMed] [DOI] |
| 23. | Yu C, Chen Y, Cline GW, Zhang D, Zong H, Wang Y, Bergeron R, Kim JK, Cushman SW, Cooney GJ. Mechanism by which fatty acids inhibit insulin activation of insulin receptor substrate-1 (IRS-1)- associated phosphatidylinositol 3-kinase activity in muscle. J Biol Chem. 2002;277:50230-50236. [PubMed] [DOI] |
| 24. | Shmueli E, Alberti KG, Record CO. Diacylglycerol/protein kinase C signalling: a mechanism for insulin resistance? J Intern Med. 1993;234:397-400. [PubMed] [DOI] |