修回日期: 2010-12-27
接受日期: 2011-01-06
在线出版日期: 2011-03-08
目的: 研究Akt在胃癌及癌旁正常组织中的表达、活化状况及其与胃癌血管新生的关系.
方法: 收集手术切除的胃癌及相应的癌旁正常组织标本48例. 采用Western blot法检测20例新鲜胃癌及癌旁组织Akt和磷酸化Akt(pAkt)蛋白的表达. 以免疫组织化学法检测pAkt蛋白在48例胃癌和癌旁正常组织的表达以及血管内皮生长因子(VEGF)在48例胃癌组织中的表达水平. 采用CD34抗原为血管内皮标记检测其在胃癌组织的免疫染色状况以确定肿瘤组织的微血管密度(MVD).
结果: Western blot显示20例胃癌组织(20/20)和19例癌旁正常组织(19/20)中存在Akt蛋白的表达, Akt蛋白在胃癌组织中的表达水平为正常组织的2.7倍(0.186±0.013 vs 0.069±0.009, P<0.001); 在20例胃癌配对组织中皆可检测到pAkt蛋白的表达, 但癌组织的水平为癌旁正常组织4.1倍(0.164±0.025 vs 0.040±0.006, P<0.01). pAkt蛋白在胃癌和癌旁正常组织中表达的阳性率分别为66.7%(32/48)和58.3%(28/48), pAkt较高表达于组织分化较差(χ2 = 8.280, P<0.05)和TNM分期较晚(χ2 = 8.526, P<0.05)的胃癌组织中. 48例胃癌组织的平均MVD为40.6±15.1, 在32例pAkt表达阳性胃癌组织中, MVD均值为45.5±20.3, 而16例pAkt表达阴性的胃癌组织中, MVD均值为30.6±12.1, 统计分析表明两组之间具有显著性差异(P<0.01). VEGF在48例胃癌组织中的阳性表达率为52.1%(25/48), χ2检验分析表明pAkt与VEGF在胃癌组织中的表达水平密切相关(χ2 = 12.89, P = 0.012).
结论: Akt及pAkt蛋白特异性过表达于胃癌组织. pAkt蛋白可能促进胃癌的血管新生, 上调表达VEGF可能在其中发挥重要的介导作用.
引文著录: 周晓东, 陈红霞, 关润年, 吕农华. Akt的活化对胃癌血管新生的促进作用. 世界华人消化杂志 2011; 19(7): 744-748
Revised: December 27, 2010
Accepted: January 6, 2011
Published online: March 8, 2011
AIM: To determine the expression and activation of Akt in gastric cancer and to investigate the role of Akt activation in tumor angiogenesis in gastric cancer.
METHODS: Forty-eight fresh gastric adenocarcinoma tissue samples and matched normal gastric mucosal samples were collected surgically from patients with gastric cancer and immediately frozen in liquid nitrogen. The expression levels of Akt and phosphorylated Akt (pAkt) in the above tissue samples were measured by Western blot. Immunohistochemistry was conducted to evaluate the expression levels of pAkt and vascular endothelial growth factor (VEGF) and microvessel density (MVD) in gastric adenocarcinoma .
RESULTS: Western blot analysis demonstrated that Akt protein was expressed in 20 cancer tissue samples (20/20) and 19 normal tissue samples (19/20). The mean expression level of Akt protein in gastric adenocarcinoma was 2.7-fold higher than that in normal gastric mucosal tissue (0.186 ± 0.013 vs 0.069 ± 0.009, P < 0.001). The expression level of pAkt protein in gastric adenocarcinoma was 4.1-fold higher than that in tumor-adjacent gastric mucosal tissue (0.164 ± 0.025 vs 0.040 ± 0.006, P < 0.01). Immunohistochemically, pAkt was found to be expressed in 67.7% (32/48) of gastric cancer tissue samples and 58.3% (28/48) of normal tissue samples. The abundance of pAkt was significantly associated with tumor differentiation (χ2 = 8.280, P < 0.05) and TNM stage (χ2 = 8.526, P < 0.05). The mean MVD was 40.6 ± 15.1 in 48 gastric cancer tissue samples. The mean MVD in pAKT-positive cancer tissue samples was significantly higher than that in pAkt-negative ones (45.5 ± 20.3 vs 30.6 ± 12.1, P < 0.01). The mean MVD in VEGF-positive cancer tissue samples was significantly higher than that in VEGF-negative ones. In addition, pAkt abundance was significantly associated with VEGF expression (χ2 = 12.89, P = 0.012).
CONCLUSION: Overexpression of Akt and pAkt occurs in gastric adenocarcinoma and may promote tumor angiogenesis by up-regulating VEGF expression.
- Citation: Zhou XD, Chen HX, Guan RN, Lv NH. Akt activation promotes angiogenesis in gastric cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(7): 744-748
- URL: https://www.wjgnet.com/1009-3079/full/v19/i7/744.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i7.744
胃癌的发病率和死亡率居我国恶性肿瘤之首, 占胃恶性肿瘤的95%. 目前研究发现, 细胞凋亡的抑制及肿瘤血管的新生在胃癌的发生和发展中可能有重要的地位, 但尚未找到有效靶点. 近年来, 蛋白激酶B(protein kinase B, PKB/Akt)的激活已被认为在肿瘤生长中起重要作用[1,2]. 有多项研究表明, 肿瘤细胞可经Akt信号通路的激活上调表达血管内皮生长因子(vascular endothelial growth factor, VEGF), 在培养的细胞系及实验动物模型中加入Akt活化信号通路的特异性抑制剂可以阻断VEGF的促血管生成作用[3,4]. 然而, 胃癌组织中是否存在Akt/VEGF信号通路参与胃癌的血管新生还不得而知. 本研究拟初步探讨胃癌中Akt的表达和活化与胃癌血管新生的关系.
收集手术切除的胃癌及相应的癌旁正常组织新鲜标本48例置液氮中保存. 每例另切取部分经40 g/L中性甲醛固定, 石蜡包埋. 所有包埋组织切成4 μm厚连续切片以备免疫组织化学和病理分析用. 主要试剂: 兔抗人Akt和鼠抗人磷酸化Akt(phosphorylated Akt, pAkt)单克隆抗体购自Cell Signaling公司, 兔抗人VEGF单克隆抗体购自Santa Cruz公司; 增强化学发光显色试剂盒及预染色的蛋白Marker购自Cell Signaling公司.
1.2.1 免疫组织化学检测pAkt和VEGF蛋白表达: 采用免疫组织化学SP法对48例胃癌及癌旁正常组织进行染色, 操作按SP试剂盒说明书进行. PBS缓冲液代替一抗作为阴性对照. 经DAB显色, 苏木素复染后封片. 于48 h内光镜下阅片, 在400倍视野下随机选取5个区域计算阳性细胞百分率判定染色结果划分如下: (1)-, <5%; (2)+, 5%-50 %; (3)++, >50%.
1.2.2 Western blot检测Akt和pAkt蛋白的表达水平: 提取胃癌组织总蛋白, 以β-actin的水平作为等量蛋白质上样对照, 每个样本至少重复3遍, 取50 μg蛋白质样品进行SDS-PAGE电泳, 并转至硝酸纤维膜上; 室温封闭2 h后, 用TBST缓冲液漂洗3次, 分别加入兔抗人Akt或鼠抗人pAkt单克隆抗体(1:1 000)4 ℃孵育过夜, TBST漂洗3次后加入辣根过氧化物酶标记的羊抗兔或羊抗鼠二抗(1:2 000), 室温摇床孵育2 h, 增强化学发光显色系统显色, 暗室内X光底片感光成像.
1.2.3 胃癌组织中微血管密度的检测: 以兔抗人CD34单克隆抗体检测血管内皮细胞标志物抗原CD34, 采用免疫组织化学SP法染色. CD34抗体稀释度为1:100, 阴性对照采用PBS代替CD34抗体稀释液, 染色结束后封片. 胃癌组织微血管密度(microvessel density, MVD)计数采用Weidner等[5]方法进行计数, 血管内皮以细胞内有棕黄色颗粒沉着为阳性染色标准. 先用×40低倍镜扫视整个切片, 寻找血管密度最高的区域, 即"热点"(hot spot), 然后在高倍镜(×200)视野下计数被染色的血管数目, 共记数5个高倍视野, 但应尽量避免分化良好的腺体区域, 取平均值来表示肿瘤的MVD. 染色的内皮细胞或内皮细胞簇只要与附近的微血管、肿瘤细胞或其他结缔组织分开, 即视为一个微血管, 不考虑血管腔的有无, 也不用红细胞出现与否作为判断血管的标准.
1.2.4 免疫组织化学检测胃癌组织中VEGF的表达: 具体操作步骤同pAkt的免疫组织化学检测, 所用一抗为鼠抗人VEGF单克隆抗体, 稀释度为1:50. VEGF染色判断标准: 以胞质内出现棕黄色颗粒视为阳性细胞, 以阳性细胞数所占比例(5个高倍视野的均数)分为-: 阳性细胞<5%; +: 阳性细胞5%-50%; ++: 阳性细胞>50%.
1.2.5 图像分析: 采用美国Image PC alpha 9图像分析系统对Western blot结果进行图像分析, 计算条带的积分吸光度.
统计学处理 实验数据由SPSS统计软件处理, 计量资料用mean±SD表示. 应用Student's t检验、方差分析(ANOVA)、χ2检验对实验结果进行统计分析.
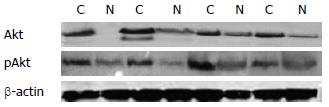
Western blot检测20例新鲜胃癌及癌旁正常组织中Akt及pAkt蛋白的表达水平显示, 20例胃癌组织(20/20)和19例癌旁正常组织(19/20)中存在Akt蛋白的表达, 经图像分析系统分析表明, Akt蛋白在癌组织中的平均表达水平为正常组织的2.7倍(表1), 差异显著(P<0.001, 图1); 20例新鲜胃癌及癌旁正常组织中pAkt蛋白的表达水平见表1, 癌组织中pAkt蛋白的平均表达水平为正常组织的4.1倍(P<0.001, 图1).
| Akt蛋白 | P值 | pAkt蛋白 | P值 | |
| 正常组织 | 0.069±0.009 | <0.001 | 0.040±0.006 | <0.001 |
| 胃癌组织 | 0.186±0.013 | 0.164±0.025 |
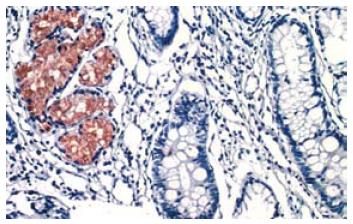
免疫组织化学染色显示pAkt主要表达于癌旁正常胃黏膜腺上皮细胞及胃癌细胞的胞质中, 在某些切片上可观察到早期癌变的腺体呈强阳性染色, 而临近的相对正常腺体则呈阴性表达(图2). 值得一提的是, 正常组织中pAkt的阳性表达仅限于增生区域的腺上皮. pAkt蛋白在胃癌和癌旁正常组织中表达的阳性率分别为66.7%(32/48)和58.3%(28/48), 统计分析发现, pAkt较高表达于组织分化较差(χ2 = 8.280, P<0.05)和TNM分期较晚(χ2 = 8.526, P<0.05)的胃癌组织中(表2).
| 临床病理参数 | n | pAkt(n) | χ2值 | P值 | ||
| - | + | ++ | ||||
| 性别 | ||||||
| 男 | 28 | 10 | 12 | 6 | 0.480 | 0.787 |
| 女 | 20 | 6 | 8 | 6 | ||
| 年龄(岁) | ||||||
| <50 | 23 | 7 | 9 | 7 | 0.701 | 0.704 |
| ≥50 | 25 | 9 | 11 | 5 | ||
| 组织分化 | ||||||
| 高, 中 | 34 | 11 | 7 | 2 | 8.280 | 0.016 |
| 低, 未 | 14 | 5 | 13 | 10 | ||
| Lauren分型 | ||||||
| 肠型 | 34 | 10 | 14 | 10 | 1.452 | 0.484 |
| 弥漫型 | 14 | 6 | 6 | 2 | ||
| 肿瘤大小(cm) | ||||||
| <5 | 26 | 8 | 13 | 5 | 1.813 | 0.404 |
| ≥5 | 22 | 8 | 7 | 7 | ||
| TNM分期 | ||||||
| Ⅰ-Ⅱ | 22 | 12 | 7 | 3 | 8.526 | 0.014 |
| Ⅲ-Ⅳ | 26 | 4 | 13 | 9 | ||
| 淋巴结转移 | ||||||
| 0 | 19 | 9 | 5 | 5 | 3.659 | 0.061 |
| ≥1 | 29 | 7 | 15 | 7 | ||
48例胃癌组织的平均MVD为40.6±15.1, 范围为14-115. 在不同组织类型、浸润深度及淋巴转移的胃癌组中未见MVD有明显差异(P>0.05). 然而, 在32例pAkt免疫组织化学表达阳性胃癌组织中, MVD均值为45.5±20.3, 而16例pAkt表达阴性的胃癌组织中, MVD均值为30.6±12.1, 统计分析表明两组之间具有显著性差异(P<0.01).
目前已发现Akt过表达于多种肿瘤组织中, 如: 乳腺、结肠、卵巢、胰腺、前列腺及胆道的肿瘤[6-8]. 另外, 采用针对Ser473位点磷酸化的Akt抗体经免疫组织化学检测证实黑素瘤、头颈部肿瘤、乳腺癌、结肠癌、食管鳞状上皮细胞癌、卵巢癌、胰腺癌、胆道癌和前列腺癌中都存在Akt的过度活化[9-11]. 尤其令人感兴趣的是, Akt的活化与多种肿瘤患者较差的预后密切相关[12]. 尽管多项体外和在体实验显示了Akt在人类肿瘤中的重要性, 但胃癌组织中Akt的表达状况及其扮演的角色还不明了.
在本研究中, 我们采用Western blot实验结果显示Akt蛋白在胃癌组织中的表达水平明显增高. 既往研究表明, 非磷酸化Akt蛋白不具备生物学活性, 然而Akt经PI3K/Akt信号途径形成pAkt而激活后能够通过两种不同的机制促进细胞转化: (1)促进细胞增殖, 使肿瘤细胞通过正常的细胞周期阻滞; (2)抑制细胞凋亡, 使肿瘤细胞免于机体自身所诱导的死亡, 延长其生存时间. 因此, 我们进一步比较了pAkt蛋白在胃癌及癌旁组织中的表达水平. Western blot法检测结果表明癌组织中pAkt蛋白的表达水平显著高于正常组织. 免疫组织化学结果显示正常组织中pAkt蛋白表达区域仅限于增生区腺上皮, 提示活化的Akt蛋白可能通过促进细胞周期的进程而促进细胞的增殖. 我们发现, pAkt较高表达于分化较差的癌组织和TNM分期较晚的癌组织中, 该结果与Schlieman等[13]的研究结果相似: 在胰腺癌组织中pAkt的阳性率为59%, 且其表达水平与肿瘤的分期密切相关. 有研究发现, 卵巢癌和食管癌中Akt信号通路的活化可促进肿瘤的生长和转移[14,15]. 尽管本研究中, pAkt的表达水平在有淋巴结转移的胃癌组织中有增高的趋势, 但尚未达到统计学意义.
最近, 有研究显示, Akt在VEGF诱导的促血管生成作用中也起着重要的调节作用[16-18]. 为了初步探讨Akt在胃癌血管新生中的作用, 本研究检测了胃癌组织中VEGF表达状况, 以进一步分析其表达水平与Akt活化的关系. 实验结果表明VEGF表达的阳性率为52.1%, 并且其表达水平与MVD显著正相关, 这与前人的研究结果一致. 另外, VEGF的表达水平与胃癌组织中pAkt的表达水平密切相关(χ2 = 12.89, P = 0.012), 进一步统计分析显示pAkt与VEGF均阳性的胃癌组织MVD明显高于两者均阴性者(P = 0.0007), 提示胃癌组织中pAkt可能通过诱导VEGF的表达而促进血管生成. 综合以上分析, 我们推测原位胃癌组织中亦可能存在pAkt/VEGF信号调节通路促进胃癌的血管新生. 当然, 这还有待于进一步的体外实验及在体实验验证.
蛋白激酶B(Akt)的激活已被认为在肿瘤生长中起重要作用, 他在消化系恶性肿瘤发生发展中的作用日益受到关注.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
目前国内外少有研究报道Akt在原位胃癌组织的表达与血管内皮生长因子及微血管密度的相关性. 本研究采用免疫组织化学及蛋白免疫印迹的方法探讨了胃癌组织中Akt与血管内皮生长因子的关系, 为Akt促进胃癌血管新生提供了原位组织学证据.
Akt可能通过促进血管内皮生长因子的表达促进胃癌血管新生, 深入的体外干预实验将进一步验证这一结果.
本文学术性较好, 对胃癌的靶向治疗及进一步研究具有重要的参考价值.
编辑: 李薇 电编:何基才
| 1. | Carnero A. The PKB/AKT pathway in cancer. Curr Pharm Des. 2010;16:34-44. [PubMed] [DOI] |
| 3. | Poulaki V, Mitsiades CS, McMullan C, Sykoutri D, Fanourakis G, Kotoula V, Tseleni-Balafouta S, Koutras DA, Mitsiades N. Regulation of vascular endothelial growth factor expression by insulin-like growth factor I in thyroid carcinomas. J Clin Endocrinol Metab. 2003;88:5392-5398. [PubMed] [DOI] |
| 4. | Akagi M, Kawaguchi M, Liu W, McCarty MF, Takeda A, Fan F, Stoeltzing O, Parikh AA, Jung YD, Bucana CD. Induction of neuropilin-1 and vascular endothelial growth factor by epidermal growth factor in human gastric cancer cells. Br J Cancer. 2003;88:796-802. [PubMed] [DOI] |
| 5. | Weidner N, Folkman J, Pozza F, Bevilacqua P, Allred EN, Moore DH, Meli S, Gasparini G. Tumor angiogenesis: a new significant and independent prognostic indicator in early-stage breast carcinoma. J Natl Cancer Inst. 1992;84:1875-1887. [PubMed] [DOI] |
| 6. | Zinda MJ, Johnson MA, Paul JD, Horn C, Konicek BW, Lu ZH, Sandusky G, Thomas JE, Neubauer BL, Lai MT. AKT-1, -2, and -3 are expressed in both normal and tumor tissues of the lung, breast, prostate, and colon. Clin Cancer Res. 2001;7:2475-2479. [PubMed] |
| 7. | Castaneda CA, Cortes-Funes H, Gomez HL, Ciruelos EM. The phosphatidyl inositol 3-kinase/AKT signaling pathway in breast cancer. Cancer Metastasis Rev. 2010;29:751-759. [PubMed] [DOI] |
| 8. | Wegiel B, Bjartell A, Culig Z, Persson JL. Interleukin-6 activates PI3K/Akt pathway and regulates cyclin A1 to promote prostate cancer cell survival. Int J Cancer. 2008;122:1521-1529. [PubMed] [DOI] |
| 9. | Tanno S, Yanagawa N, Habiro A, Koizumi K, Nakano Y, Osanai M, Mizukami Y, Okumura T, Testa JR, Kohgo Y. Serine/threonine kinase AKT is frequently activated in human bile duct cancer and is associated with increased radioresistance. Cancer Res. 2004;64:3486-3490. [PubMed] [DOI] |
| 10. | Alkan S, Izban KF. Immunohistochemical localization of phosphorylated AKT in multiple myeloma. Blood. 2002;99:2278-2279. [PubMed] [DOI] |
| 11. | Semba S, Moriya T, Kimura W, Yamakawa M. Phosphorylated Akt/PKB controls cell growth and apoptosis in intraductal papillary-mucinous tumor and invasive ductal adenocarcinoma of the pancreas. Pancreas. 2003;26:250-257. [PubMed] [DOI] |
| 12. | LoPiccolo J, Granville CA, Gills JJ, Dennis PA. Targeting Akt in cancer therapy. Anticancer Drugs. 2007;18:861-874. [PubMed] |
| 13. | Schlieman MG, Fahy BN, Ramsamooj R, Beckett L, Bold RJ. Incidence, mechanism and prognostic value of activated AKT in pancreas cancer. Br J Cancer. 2003;89:2110-2115. [PubMed] [DOI] |
| 14. | Li B, Tsao SW, Li YY, Wang X, Ling MT, Wong YC, He QY, Cheung AL. Id-1 promotes tumorigenicity and metastasis of human esophageal cancer cells through activation of PI3K/AKT signaling pathway. Int J Cancer. 2009;125:2576-2585. [PubMed] [DOI] |
| 15. | Hua K, Feng W, Cao Q, Zhou X, Lu X, Feng Y. Estrogen and progestin regulate metastasis through the PI3K/AKT pathway in human ovarian cancer. Int J Oncol. 2008;33:959-967. [PubMed] |
| 16. | Ma J, Sawai H, Ochi N, Matsuo Y, Xu D, Yasuda A, Takahashi H, Wakasugi T, Takeyama H. PTEN regulates angiogenesis through PI3K/Akt/VEGF signaling pathway in human pancreatic cancer cells. Mol Cell Biochem. 2009;331:161-171. [PubMed] [DOI] |
| 17. | Pang X, Yi Z, Zhang J, Lu B, Sung B, Qu W, Aggarwal BB, Liu M. Celastrol suppresses angiogenesis-mediated tumor growth through inhibition of AKT/mammalian target of rapamycin pathway. Cancer Res. 2010;70:1951-1959. [PubMed] [DOI] |