修回日期: 2011-01-14
接受日期: 2011-01-23
在线出版日期: 2011-02-28
目的: 研究表没食子儿茶素没食子酸酯(EGCG)是否具有增强5-氟尿嘧啶(5-FU)抑制肝癌BEL-7402细胞生长的作用, 并探讨其中的机制.
方法: 应用MTT法观察肝癌细胞的生存率; Western blot进行蛋白分析; 应用小RNA干扰(siRNA)法来沉默BEL-7402细胞中COX-2蛋白的表达; ELISA定量测定细胞培养上清液中前列腺素E2(PGE2)的含量.
结果: 与对照组(0.1% DMSO)相比, 工作浓度为5、10、25、50 mmol/L的EGCG显著抑制BEL-7402细胞的生长(P<0.05), 分别下降至为76.55%±1.98%、52.88%±4.28%、18.54%±2.88%和7.95%±0.90%(q = 0.86, 1.31, 1.33, 1.17). 当与10 mmol/L 5-FU联合用药时, 细胞生存率下降更为显著, 即浓度为5 mmol/L EGCG与5-FU联合用药表现出两药相加作用; 10、25、50 mmol/L EGCG浓度为与5-FU联合用药表现出协同作用. 进一步研究发现, EGCG下调BEL-7402细胞中COX-2蛋白表达, 降低PGE2的释放, 这一系列分子活动参与5-FU协同抗肝癌细胞生长作用.
结论: EGCG具有协同增强5-FU抑制BEL-7402细胞生长作用.
引文著录: 林少芒, 曹良启, 张智辉, 萧剑彬, 李强. EGCG对氟尿嘧啶抑制肝癌细胞生长的增强作用. 世界华人消化杂志 2011; 19(6): 619-623
Revised: January 14, 2011
Accepted: January 23, 2011
Published online: February 28, 2011
AIM: To investigate whether epigallocatechin-3-gallate (EGCG) enhances 5-fluorouracil (5-FU)-induced cell growth inhibition in human hepatocellular carcinoma cell line BEL-7402 and to explore potential mechanisms involved.
METHODS: MTT assay was used to evaluate cell viability. Western blotting analysis was performed to detect protein expression, and small interfering RNA was used to suppress COX-2 expression. ELISA assay was applied to test the release of prostaglandin E2 (PGE2).
RESULTS: Treatment with different concentrations of EGCG (5, 10, 25, or 50 mmol/L) significantly inhibited the growth of BEL-7402 cells compared with control cells (treated with 0.1% DMSO, all P < 0.05). When cells were treated with 10 mmol/L 5-FU in combination with either 5, 10, 25, or 50 mmol/L EGCG, the percentages of viable cell significantly decreased when compared with cells treated with each drug alone, suggesting a synergistic effect between the two drugs. Moreover, EGCG down-regulated the expression of COX-2 and reduced the release of PGE2 in BEL-7402 cells.
CONCLUSION: EGCG enhances 5-FU-induced cell growth inhibition in human hepatocellular carcinoma cell line BEL-7402 possibly by down-regulating COX-2 expression and inhibiting PGE2 release.
- Citation: Lin SM, Cao LQ, Zhang ZH, Xiao JB, Li Q. EGCG enhances 5-fluorouracil-induced cell growth inhibition in human hepatocellular carcinoma cell line BEL-7402. Shijie Huaren Xiaohua Zazhi 2011; 19(6): 619-623
- URL: https://www.wjgnet.com/1009-3079/full/v19/i6/619.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i6.619
原发性肝癌(primary liver cancer, PLC)是我国常见的恶性肿瘤之一, 年死亡率占肿瘤死亡率的第2位, 就世界范围内而言, 其发病率呈上升趋势, 严重危害人类的健康和生命. 表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)是从绿茶提取的儿茶素单体成分. 先前的研究已经证实EGCG能够防治肝硬化和诱导肝癌细胞凋亡的作用, 其机制尚在探索之中[1-3]. 5-氟尿嘧啶(5-fluorouracil, 5-FU)是肝癌化疗中常用药物, 也是各种联合化疗方案中必不可少的化疗药物之一. 由于肿瘤细胞对药物产生耐药性则严重影响了肝癌的疗效, 成为晚期肝癌化疗的障碍[4,5]. 因此, 临床和科研工作者正努力寻找更好的化疗药物或新的联合化疗方案从肝癌发生发展的基因调控机制中寻找新的药物靶点, 以求提高对肝癌的治疗效果. 本文通过体外实验观察EGCG联合5-FU对肝癌细胞生长的影响, 并探讨其中的机制.
EGCG, 5-FU和Celecoxib购于美国Cayman公司, 这些化学药品溶于DMSO(终浓度为0.1%). 兔多克隆抗人COX-2(72 000 Da)和辣根过氧化物酶耦联的羊抗兔二抗均为美国Santa Cruz公司产品, PGE2-ELISA试剂盒购于深圳晶美生物有限公司. 人肝癌细胞系BEL-7402细胞由中山大学第一附属医院肝胆外科汪谦教授惠赠. 细胞培养在含100 mL/L胎牛血清, 青霉素100 kU/L和链霉素100 mg/L的DMEM高糖(由Gibco公司提供)培养基中, 于37 ℃、50 mL/L CO2培养箱中静置培养. 待细胞融合至80%-90%时常规消化传代, 每2-3 d传代1次, 取对数生长期的细胞进行实验.
1.2.1 MTT法测定细胞生存率: 取对数生长期细胞, 以含100 mL/L胎牛血清的DMEM培养基调整细胞浓度为1×105/mL, 按200 μL/孔接种于96孔板, 37 ℃、50 mL/L CO2孵箱中培养8 h; 观察细胞贴壁后弃去培养液, 每孔重新加入含不同工作浓度的EGCG或/和5-FU培养液200 μL, 每一浓度设置5个复孔, 对照组仅加含0.1% DMSO等体积的培养液, 并设无细胞培养液的空白对照; 常规培养48 h后取出培养板, 每孔加入MTT(5 g/L)20 μL并继续孵育4 h后弃培养液, 每孔加入DMSO 200 μL, 微量振荡器振荡10 min至结晶溶解, 空白对照调零, 酶标仪上测定570 nm波长处吸光度值(A), 计算细胞存活率及抑制率. 细胞存活率 = 实验孔A值/对照孔A值×100%, 细胞抑制率 = 1-细胞生存率. 药物相互作用的结果根据金正均法[6-8]进行判断, 即在量效曲线区间内根据两药合并用药的抑制率及两单药的抑制率计算q值: q = 两药合用的抑制率/两单药预计抑制率 = EA+B/(EA+EB-EA×EB). 当0.85≤q≤1.15时, 两药有相加作用; 当q>1.15时, 两药有协同作用; 当q<0.85时, 两药有拮抗作用.
1.2.2 细胞总蛋白提取和Western blot分析: BEL-7402细胞经各处理因素处理24 h后, 预冷PBS漂洗3次后, 每孔加入冰冷的蛋白裂解液200 μL, 放置于4 ℃, 30 min, 15 000 g离心10 min收集裂解物总蛋白, 取50 μg总蛋白行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)并原位电转印至PVDF膜; 膜经封闭液[含20 mmol/L Tris-HCl(pH7.6)、150 mmol/L NaCl、0.1%吐温-20和5%脱脂奶粉]处理1 h后, 与目的蛋白一抗或内参照β-actin分别4 ℃孵育过夜. 膜经漂洗后再与辣根过氧化物酶耦联的二抗常温孵育1 h, 应用增强化学发光法(ECL)发光试剂曝光、显影并成像.
1.2.3 小RNA干扰: 人COX-2基因的小RNA干扰(small interfering RNA, siRNA)序列由广州锐博生物科技公司设计并合成. 干扰的靶序列为GGAACGTTGTGAATAACAT, 正义链(5'-3'): GGAACGUUGUGAAUA ACAU dTdT反义链(3'-5'): dTdT CCUUGCAACACUUAUUGUA. 将BEL-7402细胞接种至6孔板, 用无抗生素的培养基培养24 h至细胞完全贴壁, 保证细胞密度达到50%融合, 弃去旧的培养基, 重新加入无抗生素的培养液1 500 μL. 取转染试剂(Lipofectamine2000)10 μL, 用250 μL的Opti-MEMI培养基(不含血清, 不含抗生素)进行稀释, 轻晃, 室温静置5 min. 再用250 μL的Opti-MEMI培养基稀释10 μL的siRNA或control siRNA(两种siRNA终浓度均为100 nmol/L)溶液加入上述混合液共同室温孵育20 min. 然后, 将含有转染试剂和siRNA或control siRNA混合液加入上述6孔板中于培养箱中培养48 h后处理.
1.2.4 PGE2的定量检测: 调整BEL-7402细胞浓度为1×105/mL, 按200 μL/孔接种于96孔板, 37 ℃、50 mL/L CO2孵箱中培养8 h; 观察细胞贴壁后弃去培养液, 每孔重新加入含不同工作浓度的EGCG或/和5-FU培养液200 μL, 每一浓度设置3个复孔, 无药对照组仅加含0.1% DMSO等体积的培养液, 并设无细胞培养液的空白对照. 培养24 h后收集上清, 按PGE2-ELISA试剂盒说明进行测定.
统计学处理 实验数据用mean±SD表示, 采用SPSS11.0统计软件进行完全随机设计的单因素方差分析, 多个样本均数间的两两比较采用Student-Newman-Keuls q检验, 以P<0.05表示差异有显著性.
工作浓度为 5、10、25、50 mmol/L的EGCG处理BEL-7402细胞48 h后的生存率分别是92.94%±3.19%、81.62%±3.59%、49.32%±2.27%、27.07%±3.46%, 各组生存率之间两两比较有显著性差异(P<0.05). 10 mmol/L 5-FU作用于该细胞48 h后, 细胞生存率为78.30%±4.78%; 当与EGCG联合用药时, 细胞生存率明显降低, 分别下降至为76.55%±1.98%、52.88%±4.28%、18.54%±2.88%和7.95%±0.90%(q = 0.86、1.31、1.33、1.17), 即浓度为5 mmol/L EGCG与5-FU联合用药表现出两药相加作用, 而浓度为10、25、50 mmol/L EGCG与5-FU联合用药表现出两药之间存在协同效应.
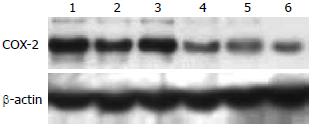
如图1所示, 与对照组相比, EGCG明显下调了BEL-7402细胞COX-2蛋白表达; 单药10 mmol/L 5-FU处理细胞后, COX-2蛋白表达未见明显变化, 与EGCG联合后显著下调COX-2蛋白表达.
BEL-7402细胞经各处理因素处理24 h后, 上清液PGE2的测定值如下: 单药10 μmol/L 5-FU组: 66.76 μg/L±2.60 μg/L; 25 μmol/L EGCG组: 26.22 μg/L±2.29 μg/L; 联合用药组(25 μmol/L EGCG+10 μmol/L 5-FU): 9.08 μg/L±1.10 μg/L; 阳性(50 μmol/L Celecoxib)对照组: 31.62 μg/L±3.72 μg/L; 对照组(0.1% DMSO): 72.64 μg/L±3.72 μg/L; 这些处理组均显著低于对照组. 根据各处理组对BEL-7402细胞PGE2释放的抑制率(q = 1.30), 这表明联合用药有协同作用.
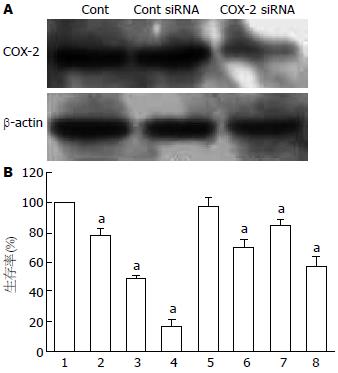
如图2A所示, 我们利用特异性COX-2 siRNA敲出COX-2的高表达状态, 而非特异性Cont siRNA对COX-2的表达与对照组相比未见明显改变. 敲出COX-2蛋白后的细胞生存率为70.50%±5.62%, 与5-FU联合后的细胞生存率为47.01%±6.75%(q = 1.18). 这些数据表明特异性敲出COX-2蛋白的表达参与了联合用药(5-FU+COX-2 siRNA组)对BEL-7402细胞的生长抑制作用, 并显示出协同效应(图2B). 这些数据表明EGCG下调BEL-7402细胞COX-2的表达参与了联合用药的协同效应.
EGCG是茶叶中所提取的儿茶素单体成分, 具有抗氧化、抗炎、抗病毒、清除自由基以及抗肿瘤等生物学作用. 化疗是肿瘤综合治疗的有效手段之一, 对于晚期肝癌, 尤其是伴有门脉癌栓者, 被证明是有效的. 然而, 化疗最大的障碍是肿瘤细胞的耐药. 业已证实, 当前临床上使用的化疗药物是通过抑制肿瘤细胞增殖, 诱导细胞凋亡以达到杀死肿瘤细胞为目的. 然而, 当恶性肿瘤细胞接触一种抗癌药物后, 肿瘤细胞本身可获得抗增殖、抗凋亡的抗药性, 甚至产生了对多种结构不同、作用机制不同的其他抗癌药的抗药性, 这些就成为肿瘤耐药的主要原因之一[9,10]. 5-FU是临床上常用的化疗药, 也是肝癌化学治疗不可缺少的药物之一. 5-FU在体内必须转化为相应的核苷酸才能发挥其抑制肿瘤生长的作用. 他在体内首先转变成5-氟-2-脱氧尿嘧啶核苷酸, 抑制胸腺嘧啶核苷酸合成酶, 阻断脱氧尿嘧啶核苷酸转变为脱氧胸腺嘧啶核苷酸, 从而抑制DNA的生物合成; 此外, 还能渗入RNA, 阻止尿嘧啶渗入RNA以抑制RNA的合成. 5-FU代谢后主要生成两种活性物质: 一个为尿氟三磷(FUTP), 结合到RNA上, 干扰其功能; 另一个是通过尿苷激酶的作用, 生成氟去氧尿一磷(FdUMP), 他抑制胸苷酸合成酶而阻止DNA的合成, 后者是其抗肿瘤的主要原因[11,12]. 由于5-FU的耐药导致化疗效果较差, 因此有必要寻找一个能够增强5-FU抗肿瘤作用的药物. 我们实验结果结果显示: EGCG联合5-FU具有显著地抑制肝癌细胞生长作用, 并具有协同效应, 这在国内外未见报道.
COX是花生四烯酸代谢途径中的关键限速酶, 也是前列腺素合成过程中主要限速酶. 包括两种亚型: COX-1和COX-2. COX-1在正常组织中表达, 维持正常前列腺素的合成, 发挥正常的生理功能. COX-2在组织正常的生理状态下一般检测不到, 但在细胞因子、炎性介质、促癌剂等作用下, 表达迅速上调. PGE2作为COX-2的主要代谢产物, 具有促进细胞生长增殖作用, COX-2表达上调, PGE2产生增加, 形成一种COX-2/PGE2生物轴, 调节细胞的生长, 其中也包括肿瘤细胞[13,14]. 李刚等[15]报道EGCG诱导肝癌SMMC-7721细胞早期凋亡, 涉及多种基因和蛋白的表达变化. 陈锡林等[2]报道, EGCG能够抑制肝癌HepG2和SMMC-7721细胞生长, 并能下调COX-2和Bcl-2蛋白的表达, 这一点与我们的结果相似. 此外研究结果还发现, EGCG下调COX-2的表达具有剂量依赖性. 同时, 应用25 μmol/L EGCG与10 μmol/L 5-FU联合显著抑制PGE2的释放, 并具有协同效应. 特异性地敲出COX-2蛋白的表达参与了联合用药(5-FU+COX-2 siRNA组)对BEL-7402细胞的生长抑制作用, 并显示出协同效应. 进一步说明EGCG下调BEL-7402细胞COX-2的表达参与了联合用药(EGCG+5-FU)的协同效应. 近来的研究也报道[16,17], 抑制COX-2的表达, 提高肿瘤化疗或放疗的疗效.
总之, EGCG通过下降肝癌细胞中COX-2蛋白的表达, 抑制PGE2分泌, 增强5-FU抗肝癌作用, 产生协同效应, 为晚期肝癌的化疗提供新的治疗靶点, 也为EGCG抗肝癌治疗提供理论依据.
原发性肝癌恶性程度高, 死亡率高. 5-FU是肝癌化疗中常用药物, 表没食子儿茶素没食子酸酯(EGCG)为儿茶素单体成分, 已经证实他能够防治肝硬化和诱导肝癌细胞凋亡的作用. 利用联合用药, 克服化疗药物耐药, 产生协同作用成为当今晚期肝癌治疗的突破口.
王悦华, 副主任医师, 首都医科大学宣武医院普外科
原发性肝癌是我国常见的恶性肿瘤之一, 发病率和死亡率高, 对于失去手术机会的肝癌患者, 常规化疗效果差, 并容易产生耐药. 因此, 寻找高效的化疗药物或新的联合化疗方案, 探索药物间相互作用的机制, 以求提高对肝癌的治疗效果成为当今研究的热点.
本研究发现, EGCG能够下调人肝癌细胞系BEL-7402细胞中COX-2蛋白的表达, 减少PGE2分泌, 增强5-FU抗肝癌作用, 产生协同效应. 从而揭示了EGCG协同5-FU抑制肝癌细胞生长的机制.
本研究通过体外实验证实了EGCG增强5-FU抑制肝癌细胞生长的作用, 揭示了EGCG可能成为晚期肝癌可供选择的化疗药物之一, 也为EGCG抗肝癌治疗提供理论依据. 其临床疗效仍需要进一步验证.
本文选题较好, 具有较好的创新性和实用性.
编辑: 曹丽鸥 电编:何基才
| 1. | Zhen MC, Wang Q, Huang XH, Cao LQ, Chen XL, Sun K, Liu YJ, Li W, Zhang LJ. Green tea polyphenol epigallocatechin-3-gallate inhibits oxidative damage and preventive effects on carbon tetrachloride-induced hepatic fibrosis. J Nutr Biochem. 2007;18:795-805. [PubMed] [DOI] |
| 3. | Zhen MC, Huang XH, Wang Q, Sun K, Liu YJ, Li W, Zhang LJ, Cao LQ, Chen XL. Green tea polyphenol epigallocatechin-3-gallate suppresses rat hepatic stellate cell invasion by inhibition of MMP-2 expression and its activation. Acta Pharmacol Sin. 2006;27:1600-1607. [PubMed] [DOI] |
| 4. | Vitale FV, Romeo P, Vasta F, Panebianco V, Calì S, Rotondo S, Ferraù F, La Greca M. Hepatic intra-arterial interferon alpha 2b-based immunotherapy combined with 5-fluorouracil (5-FU)-based systemic chemotherapy for patients with hepatocellular carcinoma (HCC) not responsive and/or not eligible for conventional treatments: a pilot study. Anticancer Res. 2007;27:4077-4081. [PubMed] |
| 5. | Zhang YQ, Tang XQ, Sun L, Dong L, Qin Y, Liu HQ, Xia H, Cao JG. Rosiglitazone enhances fluorouracil-induced apoptosis of HT-29 cells by activating peroxisome proliferator-activated receptor gamma. World J Gastroenterol. 2007;13:1534-1540. [PubMed] |
| 7. | 俞 谦, 孙 为豪, 刘 顺英, 欧 希龙, 曹 大中, 苏 菡, 江 洁, 俞 婷. 奥曲肽联合特异性COX-2抑制剂对肝癌细胞的抑制作用. 东南大学学报(医学版). 2005;24:363-367. |
| 8. | Cao LQ, Shao ZL, Peng HP, Xiao JB, Xia T. Rosiglitazone enhances 5-fluorouracil-induced cell growth inhibition in hepatocellular carcinoma cell line Hep3B. Chin J Cancer. 2010;29:741-746. [PubMed] |
| 9. | Huang G, Zhong X, Cao Y, Chen Y. Antiproliferative effects of conjugated linoleic acid on human colon adenocarcinoma cell line Caco-2. Asia Pac J Clin Nutr. 2007;16 Suppl 1:432-436. [PubMed] |
| 11. | Al-Batran SE, Hartmann JT, Probst S, Schmalenberg H, Hollerbach S, Hofheinz R, Rethwisch V, Seipelt G, Homann N, Wilhelm G. Phase III trial in metastatic gastroesophageal adenocarcinoma with fluorouracil, leucovorin plus either oxaliplatin or cisplatin: a study of the Arbeitsgemeinschaft Internistische Onkologie. J Clin Oncol. 2008;26:1435-1442. [PubMed] [DOI] |
| 12. | Takeda K, Suyama H, Igishi T, Shigeoka Y, Matsumoto S, Yamasaki A, Hashimoto K, Sumikawa T, Morita M, Ueda Y. Sequential treatment with SN-38 followed by 5-fluorouracil shows synergistic cytotoxic activity in small cell lung cancer cells. Oncol Rep. 2008;19:945-951. [PubMed] |
| 14. | 梁 熹, 胡 雅楠, 和 水祥, 邓 元, 李 晓峰, 张 雅欣, 侯 和磊, 朱 占芳. COX-2与C/EBP β在人肝细胞肝癌中的表达及其临床意义. 世界华人消化杂志. 2010;18:3040-3044. [DOI] |
| 15. | 李 刚, 容 敏华, 钟 艳平, 丁 兰芳, 覃 健, 廖 明, 萧 浩, 何 敏. EGCG诱导人肝癌SMMC-7721细胞早期凋亡以及基因和蛋白谱的变化研究. 中国药理学通报. 2009;25:1482-1486. |
| 16. | Xia W, Zhao T, Lv J, Xu S, Shi J, Wang S, Han X, Sun Y. Celecoxib enhanced the sensitivity of cancer cells to anticancer drugs by inhibition of the expression of P-glycoprotein through a COX-2-independent manner. J Cell Biochem. 2009;108:181-194. [PubMed] [DOI] |
| 17. | Kim BM, Won J, Maeng KA, Han YS, Yun YS, Hong SH. Nimesulide, a selective COX-2 inhibitor, acts synergistically with ionizing radiation against A549 human lung cancer cells through the activation of caspase-8 and caspase-3. Int J Oncol. 2009;34:1467-1473. [PubMed] |