修回日期: 2011-01-09
接受日期: 2011-01-11
在线出版日期: 2011-02-28
目的: 研究肝细胞癌相关基因表达, 建立肝癌分子诊断指数, 以期能更准确的诊断肝癌.
方法: 采用实时荧光定量PCR检测40例肝细胞癌患者癌组织和配对的癌旁2 cm及手术切缘组织、10例肝硬化组织、10例正常肝脏组织中11个基因的表达, 以管家基因G3PDH为对照, 2-ΔΔCT法计算目的基因相对表达量, 挑选出特异性好且与正常肝、肝硬化组织表达差异大的肝癌相关基因, 依据这些基因在组织中表达异常的个数建立分子诊断指数.
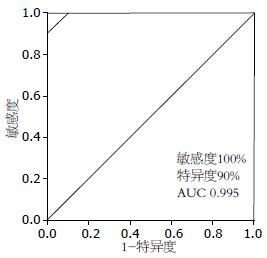
结果: 在40例癌组织中, 抑癌基因PRDM2、IGFBP3、DLC-1分别有65.0%、75.0%、67.5%的标本表达<3倍正常肝组织, 癌基因GPC3、STMN、CCNA2、BIRC5、AFP分别有87.5%、77.5%、82.5%、85.0%、67.5%的标本表达>3倍正常肝组织, 并且与肝硬化组织表达差异显著(0.45±0.69 vs 0.50±0.20; 0.17±0.20 vs 0.67±0.47; 0.29±0.48 vs 0.58±0.60; 677.57±999.30 vs 4.41±3.99; 17.56±28.28 vs 1.17±1.08; 53.17±103.64 vs 2.09±1.50; 16.53±16.39 vs 1.82±1.39; 4 445.70±1 1642.87 vs 0.86±0.43, 均P<0.05). 以此8个基因建立分子诊断指数, 其在肝硬化、手术切缘、癌旁2 cm、癌组织中分别为2.2±1.5、3.0±1.6、2.9±1.5、6.3±1.2, 癌组与肝硬化组、切缘组、癌旁2 cm组差异显著. 以肝硬化组作为对照组, 当分子诊断指数≥4诊断为肝癌时, ROC曲线的敏感性为100%, 特异性为90%, AUC = 0.995.
结论: 利用荧光定量PCR检测肝癌相关基因表达, 成功建立分子诊断指数, 提高了肝癌诊断的敏感性及特异性.
引文著录: 余俊, 王毅军, 高英堂, 石文霞, 王瞿辉, 刘彤, 许彦杰, 杨斌, 杜智. 肝癌相关基因表达的荧光定量PCR检测及分子诊断指数的建立. 世界华人消化杂志 2011; 19(6): 588-595
Revised: January 9, 2011
Accepted: January 11, 2011
Published online: February 28, 2011
AIM: To develop a molecular diagnostic index for hepatocellular carcinoma (HCC).
METHODS: The expression of 11 genes was assessed by real-time fluorescent quantitative polymerase chain reaction (QRT-PCR) in 40 HCC specimens and matched tumor-adjacent specimens and surgical margin specimens, 10 cirrhotic tissue specimens, and 10 normal liver tissue specimens. Using G3PDH as a control, the 2-ΔΔCT method was used to calculate the relative gene expression levels. HCC-associated genes were then selected to establish a molecular diagnostic model for HCC.
RESULTS: Compared with normal liver tissue specimens, approximately 65.0%, 75.0%, and 67.5% of HCC specimens showed a >3-fold increase in the expression levels of tumor suppressor genes PRDM2, IGFBP3, and DLC-1, and approximately 87.5%, 77.5%, 82.5%, 85.0%, and 67.5% of HCC specimens showed a >3-fold decrease in the expression levels of oncogenes GPC3, STMN, CCNA2, BIRC5, and AFP, respectively. The expression levels of these eight genes differed significantly between HCC and cirrhotic tissue (0.45 ± 0.69 vs 0.50 ± 0.20; 0.17 ± 0.20 vs 0.67 ± 0.47; 0.29 ± 0.48 vs 0.58 ± 0.60; 677.57 ± 999.30 vs 4.41 ± 3.99; 17.56 ± 28.28 vs 1.17 ± 1.08; 53.17 ± 103.64 vs 2.09 ± 1.50; 16.53 ± 16.39 vs 1.82 ± 1.39; 4445.70 ± 11642.87 vs 0.86 ± 0.43, all P < 0.05). Molecular diagnostic index was estimated based on these eight genes, which was 2.2 ± 1.5, 3.0 ± 1.6, 2.9 ± 1.5, 6.3 ± 1.2 for liver cirrhosis, surgical margin, tumor-adjacent tissue, and cancer tissue, respectively. The molecular diagnostic index for cancer tissue was significantly different from those for liver cirrhosis, surgical margin, and tumor-adjacent tissue. When a molecular diagnostic index of 4 or greater was adopted to diagnose liver cancer using liver cirrhosis as a control, the sensitivity, specificity, and the area under the receiving operative curve (ROC) were 100%, 90%, and 0.995, respectively.
CONCLUSION: A molecular diagnostic index for HCC was successfully established using fluorescence quantitative PCR to detect HCC-associated genes.
- Citation: Yu J, Wang YJ, Gao YT, Shi WX, Wang QH, Liu T, Xu YJ, Yang B, Du Z. Detection of HCC-associated gene expression by real-time fluorescence quantitative PCR to establish a molecular diagnostic index for HCC. Shijie Huaren Xiaohua Zazhi 2011; 19(6): 588-595
- URL: https://www.wjgnet.com/1009-3079/full/v19/i6/588.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i6.588
血清标志物甲胎蛋白(alpha fetoprotein, AFP)作为诊断肝细胞癌(hepatocellular carcinoma, HCC)的"金标准"已逐渐被人们质疑, 其敏感性之低在临床上易造成大量患者漏诊[1]. Capurro等[2]联合检测血清GPC3、AFP用以诊断肝癌, 结果提高了敏感性而未降低特异性. 多基因联合检测已逐渐应用于肝癌的早期诊断及预后评估. 肝癌的发生涉及到细胞功能的许多方面, 是一个多因素、多步骤、多基因参与的复杂过程. 基因表达异常明显早于组织学改变, 基因标志物的检测有助于早期发现肝癌[3]. 实时荧光定量RT-PCR(real-time fluorescent quantitative polymerase chain reaction, QRT-PCR)是一种简便、快速且高敏感性的基因表达检测方法, 能准确分析基因表达水平的改变. 本研究应用QRT-PCR法检测11个与肝癌相关的基因, 筛选出8个表达特异的基因建立分子诊断指数, 以提高诊断及鉴别诊断肝癌的能力, 更早、更准确的诊断肝癌.
收集2006-09/2009-12天津市第三中心医院肝胆外科手术组织标本60例, 包括40例HCC患者的癌组织(T)、癌旁2 cm(N2)和手术切缘(M)组织. 其中男32例, 女8例; 年龄38-75(平均56±9)岁; AFP<20 ng/mL或肿瘤直径<3 cm共15例; 高、中、低分化肝癌分别为14、19、7例; 标本均经病理证实. 另有10例肝硬化组织; 10例正常肝组织(取自手术治疗的肝血管瘤旁组织)作为对照. 标本切取后立即投入液氮中, 于-80 ℃保存. 所有标本取材均通过院伦理委员会审核, 家属知情签字同意.
1.2.1 RNA提取和逆转录: 参照Promega公司RNAgents试剂盒提取总RNA, 每50 mg组织的总RNA溶于50 μL DEPC水中, 琼脂糖凝胶电泳检测RNA完整性, 紫外分光光度计检测A值, 计算其浓度. 逆转录参照Promega公司的ImRrom-ⅡTM使用说明书, 反应体系为2 μg RNA、3 μL随机引物, 补DEPC水至24 μL; 70 ℃热变性15 min, 迅速冰浴3 min; 再依次加入4.8 μL 25 mmol/L MgCl2、8 μL 5×逆转录缓冲液、2 μL 10 mmol/L dNTP Mix、1.5 μL逆转录酶, 至终体积为40 μL; 离心后置于PCR仪中, 37 ℃, 90 min.
1.2.2 引物设计: 依据GenBank中癌基因GPC3、STMN、CCNA2、UBD、CD133、BIRC5、AFP, 抑癌基因PRDM2、IGFBP3、DLC-1、WWOX和管家基因G3PDH的mRNA序列设计引物, 采用Primer Express 2.0软件设计, 由上海生物工程技术服务有限公司负责合成, 序列见表1.
| 引物 | 序列5'→3'片段 | 大小(bp) | 退火温度(℃) |
| G3PDH | CTCATGACCACAGTCCATGCCATCACTG | 140 | 62.5 |
| CATGAGGTCCACCACCCTGTTGCTGTA | |||
| PRDM2 | GGGATGGATGTGCATTGATG | 350 | 60.0 |
| GCAGAGGTGAAATCTGGCTCA | |||
| IGFBP3 | GGGCTCTGCGTCAACGCTAGTG | 445 | 62.5 |
| CCCGCTTCCTGCCTTTGGAAGG | |||
| DLC-1 | TTTACCACCTGCTGAATTACTCACGCC | 300 | 63.0 |
| ACGTCTGTGTAGTGCACAGGAAAGCC | |||
| WWOX | AGGGCGAGTGAAGCAGTGTCACGC | 601 | 62.5 |
| CGGTGGTGGCAGCTCCCTGTTG | |||
| STMN | TATCCAGGTGAAAGAACTGGAGAAG | 381 | 60.0 |
| TCTTCAATGTGCTTATCCTTCTCTC | |||
| GPC3 | TGACCTGAAAGTATTTGGGAATTTCC | 427 | 63.0 |
| CAATAGTGGTGGTCAGCTTTCCTG | |||
| CCNA2 | ATGTCACCGTTCCTCCTTGG | 401 | 60.0 |
| CCAGTCCACGAGGATAGCTCTC | |||
| BIRC5 | CCATTAACCGCCAGATTTGAA | 249 | 65.0 |
| TTCCAGCTCCTTGAAGCAGAA | |||
| AFP | TCAGTGAGGACAAACTATTGG | 395 | 62.5 |
| CTCTTCAGCAAAGCAGACTTC | |||
| CD133 | GACCCATTGGCATTCTCTTTGA | 251 | 63.0 |
| ACACATACAAAAGAAATACCCCACC | |||
| UBD | AGAGATGGCTCCCAATGCTTCCT | 250 | 60.0 |
| CTTCACCACTTTCAGGGTAAGGTG |
1.2.3 实时荧光定量PCR检测12个基因的表达水平: 优化反应条件, 如引物浓度、退火温度和延伸时间等, 使目的基因和管家基因的扩增效率保持一致. 按照TaKaRa公司的QRT-PCR反应体系, 组成如下: cDNA模板2 μL、上下游引物各0.4 μL、1 μL Taq聚合酶、2 μL 2.5 mmol/L dNTP和2.5 μL 10×PCR缓冲液, 加超纯水至总体积25 μL. 采用两步PCR法, 扩增条件为: 95 ℃预变性2 min, 94 ℃变性45 s, 各基因退火温度见表1. 根据各基因的实时扩增曲线和熔解曲线进行分析, 取CT值, 按2-ΔΔCT法[4]计算待测目的基因相对表达量, 其前提是目的基因和G3PDH扩增效率相似且均接近于100%. 计算各样本平均CT值和ΔCT值(ΔCT = CT目的基因-CTG3PDH), 计算2-ΔΔCT(ΔΔCT = ΔCT目的样本-ΔCT参照样本), 其数值用于表示目的样本相对于参照样本目的基因的相对倍数. 2-ΔΔCT值相差3倍认为有表达差异.
统计学处理 采用SPSS16.0统计软件包进行数据分析, 计量资料以mean±SD表示, 如数据不呈正态分布或方差不齐采用秩和检验, 两组间均数比较采用t检验, P<0.05为差异有统计学意义. 生存分析应用Kaplan-Meier法, 生存率比较采用Log-rank检验.
提取的总RNA纯度及完整性较好, 逆转录为cDNA. 随机混合5份cDNA样品模板按2的倍数连续梯度稀释, QRT-PCR检测11个基因与G3PDH的实时荧光曲线, 通过cDNA浓度梯度的log值对ΔCT值(ΔCT = CT目的基因-CT内参基因)作图比较两基因扩增效率. 所得直线斜率绝对值<0.1, 说明目的基因和内参基因扩增效率一致, 实验结果可以应用2-ΔΔCT法进行相对定量分析.
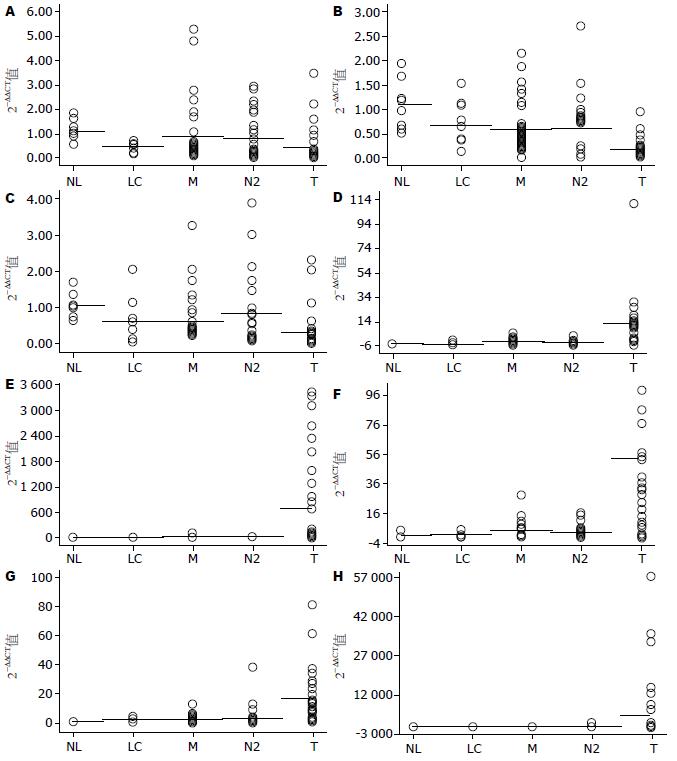
在40例癌组织中, 抑癌基因PRDM2、IGFBP3、DLC-1分别有65.0%、75.0%、67.5%的标本表达呈3倍量下调; 癌基因GPC3、STMN、CCNA2、BIRC5、AFP分别有87.5%、77.5%、82.5%、85.0%、67.5%的标本表达呈3倍量上调; 而WWOX只有30.0%的标本呈3倍量下调, CD133只有10.0%的标本呈3倍量上调; UBD有90.0%的标本呈3倍量上调, 但亦有70.0%的肝硬化标本呈3倍量上调, 特异性差; 最终选取PRDM2、IGFBP3、DLC-1、GPC3、STMN、CCNA2、BIRC5、AFP作为肝癌高度相关基因.
GPC3等8个基因在正常肝(NL)、肝硬化(LC)、手术切缘(M)、癌旁2 cm(N2)、癌(T)组的两组或多组间表达存在差异(均P<0.01, 表2). 其中抑癌基因PRDM2、IGFBP3、DLC-1从正常肝、肝硬化到癌组表达呈明显递减趋势, 癌基因GPC3、STMN、CCNA2、BIRC5、AFP从正常肝、肝硬化到癌组表达呈明显递增趋势; 在肝癌标本中, 癌组的抑癌基因表达明显低于癌旁2 cm组及切缘组, 而癌基因正相反; 8个基因在癌旁2 cm组及切缘组中的表达差异不明显(表2). 进一步以8个基因在NL, LC, M, N2, T组的表达量做散点图, 从散点图可以看出各基因在个体中的差异表达(图1).
| NL | LC | M | N2 | T | P值 | |
| n | 10 | 10 | 38 | 40 | 40 | |
| PRDM2 | 1.08±0.43 | 0.50±0.20 | 0.91±1.19 | 0.82±0.88 | 0.45±0.69 | 0.000 |
| IGFBP3 | 1.11±0.52 | 0.67±0.47 | 0.59±0.53 | 0.61±0.49 | 0.17±0.20 | 0.000 |
| DLC-1 | 1.04±0.30 | 0.58±0.60 | 0.57±0.63 | 0.66±0.74 | 0.29±0.48 | 0.000 |
| STMN | 1.02±0.22 | 1.17±1.08 | 2.37±2.27 | 2.13±1.76 | 17.56±28.28 | 0.000 |
| GPC3 | 1.05±0.33 | 4.41±3.99 | 8.18±16.12 | 6.55±10.58 | 677.57±999.30 | 0.000 |
| CCNA2 | 1.04±0.31 | 2.09±1.50 | 4.77±5.77 | 3.65±4.32 | 53.17±103.64 | 0.000 |
| BIRC5 | 1.04±0.31 | 1.82±1.39 | 2.51±2.31 | 3.48±6.50 | 16.53±16.39 | 0.000 |
| AFP | 1.10±0.50 | 0.86±0.43 | 10.76±26.71 | 54.44±249.26 | 4 445.70±11 642.87 | 0.000 |
依据这8个基因在组织中3倍量上调或下调的个数建立分子诊断指数, 即标本中每有一个基因表达量与正常组相差3倍则分子诊断指数增加1, 因此分子诊断指数从0到8. 结果在正常肝、肝硬化、切缘、癌旁2 cm、癌组中诊断指数分别为0、2.2±1.5、3.0±1.6、2.9±1.5、6.3±1.2, 显示癌组>癌旁2 cm组、切缘组>肝硬化组>正常组, 癌组明显高于其他4组, 平均值是肝硬化组的2.9倍, 是癌旁2 cm及切缘组的2.1倍, 均P<0.01; 癌旁2 cm及切缘组略高于肝硬化组, 但无统计学意义(P>0.05). 结果还显示在10例肝硬化标本中诊断指数0-4; 38例切缘标本中除246指数为6, 其余均≤5; 40例癌旁2 cm标本中除348指数为6, 其余均≤5(此2例标本肿瘤直径均>10 cm, TNM分期为Ⅲ期、Ⅳ期, 病理均为低分化); 40例癌组织中除217、262、369、374标本指数为4, 其余的36例均≥5(此4例标本肿瘤直径为8 cm, 2 cm, 3 cm, 4 cm, TNM分期均为Ⅱ期, 病理为中、高、高、高分化).
通过成对比较40例HCC患者切缘、癌旁2 cm与癌组织的分子诊断指数, 有50%的切缘组织诊断指数大于癌旁2 cm组织, 且除1例标本外(标本374在切缘、癌旁2 cm、癌中指数分别为1、5、4)切缘及癌旁2 cm组指数均小于配对的癌组, 癌组与癌旁2 cm及切缘组差异明显(P<0.01); 切缘组与癌旁2 cm组之间无统计学差异(P>0.05, 表3). 当分子诊断指数取≥4诊断为恶性组织时, 能鉴别出100%的肝癌和90%的肝硬化组织.
| 样本 | M | N2 | T | 样本 | M | N2 | T |
| 215 | 3 | 2 | 5 | 320 | 3 | 5 | 7 |
| 217 | 1 | 2 | 4 | 339 | 4 | 5 | 7 |
| 220 | 3 | 2 | 6 | 348 | 5 | 6 | 7 |
| 221 | 4 | 3 | 6 | 349 | 4 | 4 | 5 |
| 222 | 3 | 3 | 7 | 358 | 5 | 5 | 8 |
| 233 | 3 | 4 | 6 | 359 | 5 | 4 | 6 |
| 245 | 5 | 5 | 7 | 363 | 2 | 0 | 5 |
| 246 | 6 | 5 | 7 | 365 | 3 | 2 | 6 |
| 262 | 3 | 1 | 4 | 369 | 3 | 3 | 4 |
| 265 | 5 | 3 | 8 | 374 | 1 | 5 | 4 |
| 267 | 5 | 3 | 8 | 376 | 4 | 2 | 7 |
| 269 | 3 | 1 | 8 | 381 | 1 | 2 | 6 |
| 270 | 2 | 1 | 6 | 386 | 1 | 1 | 5 |
| 273 | 3 | 1 | 5 | 398 | 0 | 1 | 6 |
| 291 | 1 | 4 | 8 | 399 | 0 | 3 | 7 |
| 296 | 4 | 3 | 7 | 402 | 3 | 5 | |
| 301 | 1 | 2 | 8 | 407 | 2 | 6 | |
| 302 | 5 | 3 | 7 | 409 | 4 | 3 | 6 |
| 306 | 1 | 4 | 7 | 410 | 4 | 2 | 5 |
| 310 | 2 | 2 | 7 | 411 | 3 | 2 | 7 |
所有肝癌标本病理回报手术切缘未见癌侵及, 但切缘组织诊断指数明显高于正常组织. 分子诊断指数与肿瘤大小、血清AFP高低、分化程度没有明显联系: 40例肝癌标本中AFP阴性或肿瘤直径<3 cm的共有15例, 其癌组中分子诊断指数从4到8, 平均5.8±1.4, 其余25例肝癌诊断指数从4到8, 平均6.5±1.1, 两者无统计学差异(P>0.05); 14例高分化肝癌、19例中分化肝癌与7例低分化肝癌诊断指数分别为5.9±1.4、6.3±1.1、6.7±1.1, 三者无统计学差异(P>0.05).
近30年来, 随着分子生物学的飞速发展, 人们逐步在分子水平上认识了肝癌的本质. 肝癌发生的分子机制复杂, 根本原因在于肝炎病毒的慢性感染, 癌基因、癌相关基因的激活及抑癌基因的失活, 引起细胞生长失控, 肝细胞出现持续增殖, 最后导致癌变[5]. 分子诊断技术及基因标志物在肝癌早期发现、术后复发和转移监测中的应用, 正向高度灵敏、特异诊断方向发展[6]. 单基因研究很难说明肝癌变化的本质, 单凭单个基因诊断早期肝癌易造成漏诊与误诊. 以本研究中在癌中表达差异最大的GPC3为例, 在40例癌标本中有35例表达量上调, 造成了5例标本漏诊; 而10例肝硬化标本有6例标本上调, 又会造成肝癌的误诊. 因而寻找新型肝癌诊断标志物并采用多个标志物联合检测可望提高肝癌诊断率.
Paradis等[7]用筛选的13个基因做分子诊断指数研究, 结果显示25例正常肝和22例肝硬化标本分子诊断指数0-4, HCC标本中除2例标本分子诊断指数为2和3外, 其余的34例标本分子诊断指数均>5. 王伟丽等[8]报道了用6个基因建立分子诊断指数, 同时检测了正常肝、肝炎、肝硬化、肝癌组织, 结果正常组和肝炎组分子诊断指数接近于0; 肝硬化组中除1例标本外分子诊断指数介于0-2, 平均值为1.58; 肝癌组中除1例标本外都≥3, 分子诊断指数平均值为5.24, 与肝硬化等组差异显著. 以上结果表明分子诊断指数所具有的可行性和优越性.
Jia等[6]用GPC3等5个基因对58例HCC标本、36例肝硬化非癌标本进行检测, 结果表明5个基因组合评分能检测出100%的非癌组织, 71%的癌组织, 说明相对于单个基因检测, 5个基因组合诊断能改善预测的精确性, 包括AFP阴性肝癌及小肝癌. Llovet等[9]用荧光定量PCR法检测55个基因, 从中筛选出12个肝癌表达特异基因, 进一步应用Logistic回归分析确定了3个基因组合, 包括GPC3、LYVE1、survivin, 用此3基因联合检测早期小肝癌与异型增生结节, 结果分辨精确率达94%. 本研究从以往文献和实验基础上选择肝癌中表达水平较正常组织差异大、特异性好的多个基因进行分子诊断指数的初步研究. 选择抑癌基因PRDM2[10,11]、IGFBP3[12,13]、DLC1[14,15]、WWOX[16,17]、癌基因STMN[18]、CCNA2[19]、GPC3[20-22]、BIRC5[23]、AFP[24-26]、CD133[27,28]、UBD[29]作为分子诊断指数的候选基因, 包括了细胞增殖相关基因、黏附功能相关基因、坏死凋亡相关基因等. 本次实时荧光定量PCR结果表明, 抑癌基因PRDM2、IGFBP3、DLC1、WWOX, 癌基因STMN、CCNA2、GPC3、BIRC5、AFP、CD133、UBD的表达与文献相符. 筛选其中8个基因建立分子诊断指数. 本研究采用分子诊断指数的方法诊断肝癌, 其相对于单基因诊断具有高灵敏性及特异性. 以肝硬化组作为对照组, 肝癌组为实验组, 当分子诊断指数≥4诊断为肝癌时, ROC曲线的敏感性为100%, 特异性为90%, AUC为0.995, 阳性结果预示值PPV = 97.6%, 阴性结果预示值NPV = 100%, 准确度 = 98%. 分子诊断指数明显优于单个基因的诊断, 提高了肝癌诊断的准确性, 包括AFP阴性及肿瘤直径<3 cm的肝癌(分子诊断指数均≥4), 可以更早期的发现肿瘤.
从分子诊断指数中还可以看出: 高分化肝癌共有14例, 平均诊断指数为5.9, 是肝硬化组(平均诊断指数为2.2)的2.7倍, 可以有效地对临床上组织病理学难以鉴别的高分化癌结节与肝硬化结节进行诊断; 手术虽然可以将肿瘤完整切除, 病理回报手术切缘亦未见癌侵及, 但在手术切缘仍存在许多分子变异, 并且在肝硬化、癌旁2 cm的硬化组织中亦存在分子变异, 这些分子变异在肝硬化组织、癌旁硬化组织中即已出现, 他们参与了从细胞变性、癌前病变到癌的整个过程. GPC3、AFP、STMN等基因在细胞生长、分化及迁移中起重要作用, 他们在癌旁及肝硬化组织中的变异表达提示着某些组织具有恶性潜能, 将来有可能恶变, 正如Hoshida等[30]研究发现癌旁组织比癌组织基因差异表达能更可靠的预测肝癌复发.
在本研究数据中, 可以发现个别基因在个别样本中的异常表达, 比如癌基因STMN在374癌组织中、CCNA2在386癌组织中、AFP在270、301、381、399癌组织中却呈现低表达, 而抑癌基因PRDM2在349癌组织中呈现高表达, 这可能是分子异质性的结果. 从分子诊断指数上看, 246、348标本在切缘或癌旁2 cm组织中指数偏高(值为6), 而217、262、369、374在癌组中偏低(值为4), 这可能与肿瘤生长特性有关, 从临床资料中可以看出前2例标本肿瘤直径大, 分化差, 恶性度高, 癌向周围广泛浸润, 而后4例肿瘤直径较小, 分化好, 基因变异表达少. 标本374的癌组诊断指数低于癌旁组, 可能与肿瘤组织坏死影响血供从而基因表达减少有关.
本研究通过定量检测肝癌相关基因表达, 成功建立了分子诊断指数. 初步结果表明: 由多基因组成的分子诊断指数比单一基因能更准确的诊断肝癌; 分子诊断指数能有效鉴别肝硬化结节、肝癌结节; 分子诊断指数在AFP阴性及小肝癌中有较高灵敏度, 可以更早诊断肝癌. 由于从组织中获取基因操作复杂、费用昂贵, 不易在临床开展. 下一步的工作是在外周血中筛选更多、更能反应肝癌生物行为的基因, 优化组合, 并增加癌前病变和早期肝癌的临床样本量, 建立费用低廉、结果可靠、操作简便、可用于临床的分子诊断指数.
Capurro等联合检测血清GPC3、AFP用以诊断肝癌, 结果提高了敏感性而未降低特异性. 多基因联合检测已逐渐应用于肝癌的早期诊断及预后评估. 基因标志物的检测有助于早期发现肝癌.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
Llovet等用荧光定量PCR法检测55个基因, 从中筛选出12个肝癌表达特异基因, 进一步应用Logistic回归分析确定了3个基因组合, 包括GPC3, LYVE1, survivin, 用此3基因联合检测早期小肝癌与异型增生结节, 结果分辨精确率达94%.
本研究应用实时荧光定量PCR法检测11个与肝癌相关的基因, 筛选出8个表达特异的基因建立分子诊断指数, 对40例肝癌(包括15例AFP阴性及肿瘤直径<3 cm肝癌)及10例肝硬化进行诊断, 结果诊断精确度达98%.
分子诊断指数可以有效地诊断AFP阴性肝癌及小肝癌, 提示多基因联合诊断肝癌有望提高肝癌诊断的准确度, 以更早的发现肝癌.
本文学术性较高, 对原发性肝癌的早期诊断有重要的理论指导价值.
编辑: 李薇 电编:何基才
| 1. | Stefaniuk P, Cianciara J, Wiercinska-Drapalo A. Present and future possibilities for early diagnosis of hepatocellular carcinoma. World J Gastroenterol. 2010;16:418-424. [PubMed] [DOI] |
| 2. | Capurro M, Wanless IR, Sherman M, Deboer G, Shi W, Miyoshi E, Filmus J. Glypican-3: a novel serum and histochemical marker for hepatocellular carcinoma. Gastroenterology. 2003;125:89-97. [PubMed] [DOI] |
| 3. | Kojiro M, Roskams T. Early hepatocellular carcinoma and dysplastic nodules. Semin Liver Dis. 2005;25:133-142. [PubMed] [DOI] |
| 4. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] |
| 5. | Thorgeirsson SS, Lee JS, Grisham JW. Molecular prognostication of liver cancer: end of the beginning. J Hepatol. 2006;44:798-805. [PubMed] [DOI] |
| 6. | Jia HL, Ye QH, Qin LX, Budhu A, Forgues M, Chen Y, Liu YK, Sun HC, Wang L, Lu HZ. Gene expression profiling reveals potential biomarkers of human hepatocellular carcinoma. Clin Cancer Res. 2007;13:1133-1139. [PubMed] [DOI] |
| 7. | Paradis V, Bièche I, Dargère D, Laurendeau I, Laurent C, Bioulac Sage P, Degott C, Belghiti J, Vidaud M, Bedossa P. Molecular profiling of hepatocellular carcinomas (HCC) using a large-scale real-time RT-PCR approach: determination of a molecular diagnostic index. Am J Pathol. 2003;163:733-741. [PubMed] [DOI] |
| 8. | 王 伟丽, 高 英堂, 杜 智, 王 毅军, 景 丽, 郭 华, 杨 斌, 白 同. 应用实时荧光定量RT-PCR法建立肝癌分子诊断指数. 世界华人消化杂志. 2009;17:985-991. [DOI] |
| 9. | Llovet JM, Chen Y, Wurmbach E, Roayaie S, Fiel MI, Schwartz M, Thung SN, Khitrov G, Zhang W, Villanueva A. A molecular signature to discriminate dysplastic nodules from early hepatocellular carcinoma in HCV cirrhosis. Gastroenterology. 2006;131:1758-1767. [PubMed] [DOI] |
| 10. | Fang W, Piao Z, Buyse IM, Simon D, Sheu JC, Perucho M, Huang S. Preferential loss of a polymorphic RIZ allele in human hepatocellular carcinoma. Br J Cancer. 2001;84:743-747. [PubMed] [DOI] |
| 11. | Fang W, Piao Z, Simon D, Sheu JC, Huang S. Mapping of a minimal deleted region in human hepatocellular carcinoma to 1p36.13-p36.23 and mutational analysis of the RIZ (PRDM2) gene localized to the region. Genes Chromosomes Cancer. 2000;28:269-275. [PubMed] [DOI] |
| 12. | Luo SM, Tan WM, Deng WX, Zhuang SM, Luo JW. Expression of albumin, IGF-1, IGFBP-3 in tumor tissues and adjacent non-tumor tissues of hepatocellular carcinoma patients with cirrhosis. World J Gastroenterol. 2005;11:4272-4276. [PubMed] |
| 13. | Subramaniam K, Ooi LL, Hui KM. Transcriptional down-regulation of IGFBP-3 in human hepatocellular carcinoma cells is mediated by the binding of TIA-1 to its AT-rich element in the 3'-untranslated region. Cancer Lett. 2010;297:259-268. [PubMed] [DOI] |
| 14. | Wong CM, Lee JM, Ching YP, Jin DY, Ng IO. Genetic and epigenetic alterations of DLC-1 gene in hepatocellular carcinoma. Cancer Res. 2003;63:7646-7651. [PubMed] |
| 15. | Song LJ, Ye SL, Wang KF, Weng YQ, Liang CM, Sun RX, Zhao Y, Liu YK, Tang ZY. [Relationship between DLC-1 expressions and metastasis in hepatocellular carcinoma]. Zhonghua Ganzangbing Zazhi. 2005;13:428-431. [PubMed] |
| 16. | Park SW, Ludes-Meyers J, Zimonjic DB, Durkin ME, Popescu NC, Aldaz CM. Frequent downregulation and loss of WWOX gene expression in human hepatocellular carcinoma. Br J Cancer. 2004;91:753-759. [PubMed] |
| 17. | Yakicier MC, Legoix P, Vaury C, Gressin L, Tubacher E, Capron F, Bayer J, Degott C, Balabaud C, Zucman-Rossi J. Identification of homozygous deletions at chromosome 16q23 in aflatoxin B1 exposed hepatocellular carcinoma. Oncogene. 2001;20:5232-5238. [PubMed] [DOI] |
| 18. | Lee HS, Lee DC, Park MH, Yang SJ, Lee JJ, Kim DM, Jang Y, Lee JH, Choi JY, Kang YK. STMN2 is a novel target of beta-catenin/TCF-mediated transcription in human hepatoma cells. Biochem Biophys Res Commun. 2006;345:1059-1067. [PubMed] [DOI] |
| 19. | Jain S, Singhal S, Lee P, Xu R. Molecular genetics of hepatocellular neoplasia. Am J Transl Res. 2010;2:105-118. [PubMed] |
| 20. | Liu H, Li P, Zhai Y, Qu CF, Zhang LJ, Tan YF, Li N, Ding HG. Diagnostic value of glypican-3 in serum and liver for primary hepatocellular carcinoma. World J Gastroenterol. 2010;16:4410-4415. [PubMed] [DOI] |
| 22. | Suzuki M, Sugimoto K, Tanaka J, Tameda M, Inagaki Y, Kusagawa S, Nojiri K, Beppu T, Yoneda K, Yamamoto N. Up-regulation of glypican-3 in human hepatocellular carcinoma. Anticancer Res. 2010;30:5055-5061. [PubMed] |
| 23. | Matsunaga Y, Koda M, Murawaki Y. Expression of matrix metalloproiteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs) in hepatocellular carcinoma tissue, compared with the surrounding non-tumor tissue. Res Commun Mol Pathol Pharmacol. 2004;115-116:143-150. [PubMed] |
| 24. | Debruyne EN, Delanghe JR. Diagnosing and monitoring hepatocellular carcinoma with alpha-fetoprotein: new aspects and applications. Clin Chim Acta. 2008;395:19-26. [PubMed] [DOI] |
| 26. | Yamamoto K, Imamura H, Matsuyama Y, Kume Y, Ikeda H, Norman GL, Shums Z, Aoki T, Hasegawa K, Beck Y. AFP, AFP-L3, DCP, and GP73 as markers for monitoring treatment response and recurrence and as surrogate markers of clinicopathological variables of HCC. J Gastroenterol. 2010;45:1272-1282. [PubMed] [DOI] |
| 27. | Sasaki A, Kamiyama T, Yokoo H, Nakanishi K, Kubota K, Haga H, Matsushita M, Ozaki M, Matsuno Y, Todo S. Cytoplasmic expression of CD133 is an important risk factor for overall survival in hepatocellular carcinoma. Oncol Rep. 2010;24:537-546. [PubMed] [DOI] |
| 29. | Oliva J, Bardag-Gorce F, Lin A, French BA, French SW. The role of cytokines in UbD promoter regulation and Mallory-Denk body-like aggresomes. Exp Mol Pathol. 2010;89:1-8. [PubMed] [DOI] |
| 30. | Hoshida Y, Villanueva A, Kobayashi M, Peix J, Chiang DY, Camargo A, Gupta S, Moore J, Wrobel MJ, Lerner J. Gene expression in fixed tissues and outcome in hepatocellular carcinoma. N Engl J Med. 2008;359:1995-2004. [PubMed] [DOI] |