修回日期: 2010-12-09
接受日期: 2010-12-21
在线出版日期: 2011-02-28
目的: 研究健脾为基础的中药复方辨证治疗对胃癌根治术后患者无病生存期(DFS)的影响.
方法: 采用非随机同期对照研究的方法, 将胃癌根治术后病例分别纳入中药组(中药+化疗)和对照组(单纯化疗), 采用Kaplan-Meier法和Cox比例风险模型对影响胃癌根治术后DFS的相关影响因素进行单因素和多因素分析, 并根据临床病理分期进行进一步分层分析.
结果: 共入组病例474例, 中药组196例, 对照组278例. Cox分析显示临床病理分期(P = 0.000)和中药治疗(P = 0.000)是胃癌根治术后DFS的独立影响因素. 对Ⅰ-Ⅳ(M0)期进行分层研究显示, 中药治疗是Ⅳ期胃癌根治术后DFS的独立影响因素(P = 0.034), 中药组的DFS较对照组长(39.78 mo vs 18.38 mo, P = 0.023); 中药治疗是Ⅲ期胃癌根治术后DFS的独立影响因素(P = 0.000), 中药组1、3、5年无病生存率分别为: 94%、76%、67%, 对照组分别为: 82%、47%、39%.
结论: 以健脾为基础的中药复方辨证治疗能延长Ⅳ(M0)期胃癌根治术后中位DFS. 健脾为基础的中药复方辨证治疗可延长Ⅲ期胃癌根治术后患者DFS.
引文著录: 孙姗姗, 赵爱光, 杨金坤, 赵刚, 蔡泳, 李朝燕. 健脾为基础的复方辨证治疗对胃癌根治术后无病生存期的影响. 世界华人消化杂志 2011; 19(6): 581-587
Revised: December 9, 2010
Accepted: December 21, 2010
Published online: February 28, 2011
AIM: To investigate the effect of treatment with a Jianpi herbal formula on disease-free survival (DFS) in patients with gastric cancer after radical gastrectomy.
METHODS: A total of 474 gastric cancer patients after radical gastrectomy were assigned to treatment group (n = 196; undergoing treatment with the Jianpi herbal formula and chemotherapy) and control group (n = 278; undergoing chemotherapy only). Independent factors influencing DFS in gastric cancer patients after radical gastrectomy were analyzed using the Kaplan-Meier method and Cox proportional hazards model. A stratified analysis was performed by clinicopathologic stage.
RESULTS: Cox analysis showed that clinicopathologic stage (P = 0.000) and treatment with the Jianpi herbal formula (P = 0.000) were independent factors influencing DFS in gastric cancer patients after radical gastrectomy. Stratified analysis indicated that treatment with the Jianpi herbal formula was an independent factor influencing DFS in patients with stage IV (M0) gastric cancer after radical gastrectomy (P = 0.034). Patients of the treatment group had a significantly longer DFS than those of the control group (39.78 mo vs 18.38 mo, P = 0.023). Treatment with the Jianpi herbal formula was also an independent factor influencing DFS in patients with stage III gastric cancer after radical gastrectomy (P = 0.000). The 1-, 3-, and 5-year DFS rates were significantly higher in the treatment group than in the control group (94% vs 82%, 76% vs 47%, 67% vs 39%).
CONCLUSION: Treatment with the Jianpi herbal formula can prolong DFS in stages III and IV (M0) gastric cancer patients after radical gastrectomy.
- Citation: Sun SS, Zhao AG, Yang JK, Zhao G, Cai Y, Li ZY. Effect of treatment with a Jianpi herbal formula on disease-free survival in patients with gastric cancer after radical gastrectomy. Shijie Huaren Xiaohua Zazhi 2011; 19(6): 581-587
- URL: https://www.wjgnet.com/1009-3079/full/v19/i6/581.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i6.581
近年来, 胃癌发病率及死亡率呈上升趋势[1,2], 目前外科根治性手术被认为是唯一有可能获得治愈胃癌的方法. 但日本的统计数据表明, 术后复发率仍高达20%, 美国根治术后仍有60%患者会出现局部复发或远处转移[3]. 国外文献对根治术后治疗方案延长无病生存期(disease-free survival, DFS)的报道不甚明确[4-9], 我们的前期研究[10-12]显示, 中医药在延长无病生存期, 改善生存质量等方面具有一定的作用. 本文将采用非随机同期对照研究的设计[13-15], 以DFS为主要疗效指标, 采用Log-rank单因素、Cox多因素回归方法, 评价健脾为基础的复方对胃癌患者DFS影响作用.
2001-01-01/2008-12-31在上海中医药大学附属龙华医院肿瘤一科、上海交通大学附属瑞金医院消化外科、上海交通大学附属仁济医院普外科等诊治的胃癌根治术后病例, 符合以下各项要求者. 诊断标准: 依据卫生部《中国常见恶性肿瘤诊治规范》的诊断, 依据手术病理组织学诊断明确; 依据国际抗癌联盟(UICC第六版)胃癌TNM分期法进行临床病理分期. 纳入标准: (1)有明确胃癌病理组织学诊断为腺癌者; (2)有明确TNM分期患者, TNM分期Ⅰb-Ⅳ期(M0), 接受根治术(R0)后病例; (3)根治术前未针对胃癌进行治疗, 如新辅助放化疗; (4)年龄≥18岁, 男女均可; (5)Karnofsky评分≥60分; (6)预计生存期6 mo以上; (7)根治术后8 wk内开始化疗, 且化疗周期≥3个周期; (8)骨髓、肝肾、心等功能正常; (9)患者知情同意, 并接受长期随访. 排除标准: (1)二重或多重癌患者; (2)接受靶向药物治疗患者; (3)孕妇、哺乳期妇女和精神病患者.
1.2.1 分组及治疗: 采用非随机同期对照研究, 分别依据患者自愿的原则, 分为中药组(中药+化疗)和对照组(单纯化疗). 对照组: 化疗≥3个周期, 且未在我科接受辨证分型中医药治疗. 中药组: 化疗≥3个周期, 依据自愿的原则, 在上海中医药大学附属龙华医院肿瘤一科接受辨证分型中药治疗持续6 mo及以上. 中医治疗方案: 基本处方由太子参15 g, 炒白术12 g, 茯苓30 g, 红藤30 g, 生牡蛎30 g, 夏枯草9 g等组成, 采用水煎剂, 每日1剂, 分2-4次服. 1-2 wk辨证1次, 修正中药处方, 记录服药持续的时间. 未服上述中药则纳入非中药治疗组. 化疗方案: 氟尿嘧啶类化疗药物为基础的单药或二药、三药联合化疗, 依据手术方式、病理组织学类型、临床病理分期、体能状况等情况选择, 21-28 d为1个周期.
1.2.2 观察项目: 一般体检项目(身高、体质量、血压、心率、呼吸及体温等); 安全性指标(血常规、尿常规、粪常规+粪便隐血试验、肝肾功能、电解质、心电图等); 疗效性指标(CEA、CA-199等肿瘤标志物). 门诊患者术后两年内每3 mo复查1次, 第3年每半年复查1次, 之后每年复查1次, 住院患者每月复查; 腹部CT/MRI(或腹部及盆腔B超)及胸片: 术后两年内每3 mo复查1次, 第3年每半年复查1次, 之后每年复查1次; 胃镜: 术后每年复查1次. DFS以及相应的1、3、5年无病生存率: 记录患者手术日直到首次出现肿瘤复发/转移或各种原因导致死亡(或失访)的时间.
1.2.3 随访: 收集住院病史及门诊记录, 采用门诊随访、电话随访、信访等方式, 直至出现转移复发(复发转移是以影像学明确病灶或再次手术时病理为诊断依据)或死亡或观察截止日期2010-01-01. 失访患者观察截止日期为最后1次随访到的时间.
1.2.4 数据收集及转换: 根据病例报告表(case report form, CRF)的项目采用Microsoft Excel数据库管理软件建立数据库, 并对有关信息编码赋值[16-18].
统计学处理 统计学处理使用SPSS16.0软件. 单因素分析: 应用Kaplan-meier法估算中位总生存期(overall survival, OS)、DFS, 各因素组间生存分布差异采用Log-rank进行显著性检验. 多因素分析: 应用Cox模型进行预后因素分析. 基线均衡性分析采用构成比的χ2检验或Fisher检验. 所有统计分析的显著性水准为α = 0.05. 预设分层: 本研究以临床病理分期分层, 并根据研究结束后多因素分析结果以影响研究终点的因素分层.
依据纳入排除标准共获得475例可进行相关统计的胃癌根治术后病例资料, 其中中药组196例, 没有剔除或退出研究, 最终纳入统计分析的中药组196例; 对照组279例, 因发现二重癌(原发肺癌)1例(胃癌术后82 mo)剔除, 最终纳入统计分析的对照组278例. 随访时间最长为107.3 mo, 最短6.0 mo, 失访32例, 失访率6.75%(表1).
| 变量 | n |
| 性别 | |
| 男 | 308 |
| 女 | 166 |
| 年龄(岁) | |
| ≤45 | 68 |
| 46-60 | 224 |
| 61-75 | 168 |
| >75 | 14 |
| 原发部位 | |
| 上区 | 53 |
| 中、下区残胃 | 415 |
| 皮革胃 | 6 |
| 病理类型 | |
| 高-中分化(腺癌、管状或乳头状腺癌) | 93 |
| 低分化腺癌(黏液腺癌、印戒细胞癌或 未分化癌) | 381 |
| 临床病理分期 | |
| Ⅰb | 41 |
| Ⅱ期 | 87 |
| Ⅲ期 | 253 |
| Ⅳ期 | 93 |
| 化疗周期 | |
| <6 | 102 |
| 6 | 301 |
| >6 | 71 |
| 化疗方案 | |
| 单药方案 | 17 |
| 两药方案 | 259 |
| 三药方案 | 118 |
| 其他方案 | 80 |
| 服用中药治疗 | |
| 未用及服用<6 mo | 278 |
| 服用≥6 mo | 196 |
| 转移复发或死亡事件(DFS终点) | |
| 未出现或失访 | 303 |
| 出现(终点事件) | 171(36.1%) |
| 死于胃癌 | |
| 未出现或失访 | 344 |
| 出现(终点事件) | 130(27.4%) |
2.2.1 单因素分析: 病理类型、临床病理分期、服用中药治疗及化疗周期4个因素是胃癌根治术后DFS的影响因素. 其他4个不是影响因素(表2).
| 变量 | χ2值 | P值 |
| 病理类型 | 8.529 | 0.003 |
| 临床病理分期 | 71.260 | 0.000 |
| 化疗周期 | 9.528 | 0.009 |
| 服用中药治疗 | 35.662 | 0.000 |
| 性别 | 0.004 | 0.947 |
| 年龄 | 1.297 | 0.255 |
| 原发部位 | 3.344 | 0.188 |
| 化疗方案 | 4.405 | 0.221 |
2.2.2 多因素分析: Cox多因素回归分析表明: 胃癌根治术后DFS的独立影响因素为临床病理分期(P = 0.000)、服用中药治疗(P = 0.000). 临床病理分期中以Ⅳ期为参照, Ⅰb期、Ⅱ期、Ⅲ期的相对危险度分别为0.113、0.143及0.578; 服用中药治疗的相对危险度为0.424; 而性别、年龄、原发部位、病理类型、化疗方案、化疗周期均不是独立影响因素(P>0.05, 表3).
| 因子 | 回归系数 | 标准误 | 统计量 | P值 | 相对危险度(95%CI) |
| 临床病理分期 | 47.847 | 0.000 | |||
| Ⅰb期 vs Ⅳ期 | -2.183 | 0.522 | 17.471 | 0.000 | 0.113(0.041-0.314) |
| Ⅱ期 vs Ⅳ期 | -1.944 | 0.330 | 34.619 | 0.000 | 0.143(0.075-0.274) |
| Ⅲ期 vs Ⅳ期 | -0.548 | 0.167 | 10.741 | 0.001 | 0.578(0.417-0.802) |
| 服用中药治疗 | -0.859 | 0.175 | 24.060 | 0.000 | 0.424(0.301-0.597) |
多因素分析结果显示临床病理分期和服用中药治疗是胃癌根治术后DFS的独立影响因素, 使用卡方检验进行构成比比较, 但结果显示, 两组之间构成比有统计学意义, 基线不平衡, 不能直接比较(表4). 按照预设分层根据临床病理分期进行分层研究.
| Ⅰb期 | Ⅱ期 | Ⅲ期 | Ⅳ期 | |
| 中药组 | 28(14.3) | 41(20.9) | 100(51.0) | 27(13.8) |
| 对照组 | 13(4.7) | 46(16.5) | 153(55.0) | 66(23.7) |
2.3.1 中药治疗对Ⅰb-Ⅱ期胃癌根治术后DFS的影响: 由于Ⅰb期的患者过少, 未达到多因素分析所需样本量, 故将其与Ⅱ期合并分析. Ⅰb-Ⅱ期患者共128例. 终点事件发生率低(11.7%), 统计分析结果可信度较低, 故暂未进行统计分析, 未对两组进行比较.
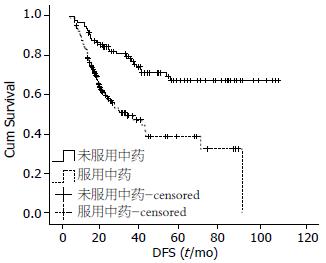
2.3.2 中药治疗对Ⅲ期胃癌根治术后DFS的影响: Ⅲ期患者共253例, 中药组100例, 对照组153例; 出现终点事件98例, 发生率为38.7%%. 基本资料见表5. 单因素分析结果显示: 服用中药治疗(P = 0.000)是本组病例中Ⅲ期胃癌根治术后DFS的影响因素; 而其他因素均不是. 多因素分析结果显示: 本组病例中Ⅲ期胃癌根治术后DFS的独立影响因素为服用中药治疗(P = 0.000), 中药治疗的相对危险度为0.344, 95.0%CI(0.218-0.544). Ⅲ期胃癌根治术后两组患者的DFS及1、3、5年无病生存率结果(表6, 图1), 显示中药组中位DFS未达到, 但中药组累积无病生存率较化疗组显著提高. 由于中药组中位DFS未达到, 对两组四分位DFS进行比较, 结果显示: 对照组四分位DFS为14.1 mo, 中药组四分位DFS为36.6 mo, 中药组较对照组延长22.5 mo(P = 0.000).
| 变量 | n |
| 性别 | |
| 男 | 170 |
| 女 | 83 |
| 年龄(岁) | |
| ≤45 | 42 |
| 46-60 | 108 |
| 61-75 | 93 |
| >75 | 10 |
| 原发部位 | |
| 上区 | 32 |
| 中、下区残胃 | 219 |
| 皮革胃 | 2 |
| 病理类型 | |
| 高-中分化(腺癌、管状或乳头状腺癌) | 44 |
| 低分化腺癌(黏液腺癌、印戒细胞癌或 未分化癌) | 209 |
| 化疗周期(个) | |
| 3-5 | 53 |
| 6 | 158 |
| >6 | 42 |
| 化疗方案 | |
| 单药方案 | 9 |
| 两药方案 | 139 |
| 三药方案 | 69 |
| 其他方案 | 36 |
| 服用中药治疗 | |
| 未用及服用<6 mo | 153 |
| 服用≥6 mo | 100 |
| 转移复发或死亡事件(DFS终点) | |
| 未出现或失访 | 155 |
| 出现(终点事件) | 98(38.7%) |
| 死于胃癌 | |
| 未出现或失访 | 182 |
| 出现(终点事件) | 71(28.1%) |
| 分组 | n | 中位DFS(mo) | 无病生存率(%) | ||
| 1年 | 3年 | 5年 | |||
| 中药组 | 100 | 未达到 | 94 | 76 | 67 |
| 对照组 | 153 | 31.30 | 82 | 47 | 39 |
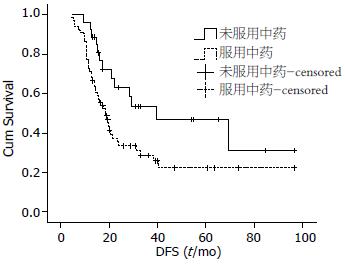
2.3.3 中药治疗对Ⅳ期胃癌根治术后DFS的影响: Ⅳ期患者共93例, 中药组27例, 对照组66例; 出现终点事件58例, 发生率为62.4%, 基本资料见表7. 单因素分析结果显示: 中药(P = 0.023)和化疗周期(P = 0.015)是本组病例中Ⅳ期胃癌根治术后DFS的影响因素; 而其他因素均不是. 多因素分析结果显示: Ⅳ期胃癌根治术后DFS的独立影响因素为服用中药治疗(P = 0.034)和化疗周期(P = 0.027). 而性别、年龄、原发部位、病理类型、化疗方案均不是独立影响因素(P>0.05). 服用中药治疗的相对危险度为0.509(95%CI: 0.272-0.951); 化疗周期是影响因素, 对其中3个变量两两比较, 结果显示: 化疗3-5周期与化疗6个周期之间比较有统计学意义(P = 0.008), 以化疗6个周期为参照, 化疗3-5个周期相对危险度为2.274(95%CI: 1.241-4.169), 而化疗大于6个周期与化疗6个周期之间和化疗>6个周期与化疗3-5个周期之间比较无统计学意义(表8). 多因素分析结果显示化疗周期和服用中药治疗是Ⅳ期根治术后DFS的独立影响因素, 使用卡方检验进行构成比比较, 结果显示, 两组之间构成比无统计学意义, 基线平衡, 可以直接比较(表9). Ⅳ期胃癌根治术后两组患者的中位DFS及1、3、5年无病生存率结果(表10, 图2)显示中药组较对照组延长21.4 mo(P = 0.023).
| 变量 | n |
| 性别 | |
| 男 | 59 |
| 女 | 34 |
| 年龄(岁) | |
| ≤45 | 15 |
| 46-60 | 40 |
| 61-75 | 36 |
| >75 | 2 |
| 原发部位 | |
| 上区 | 13 |
| 中、下区 | 77 |
| 皮革胃 | 3 |
| 病理类型 | |
| 高-中分化(腺癌、管状或乳头状腺癌) | 11 |
| 低分化腺癌(黏液腺癌、印戒细胞癌或 未分化癌) | 82 |
| 化疗周期(个) | |
| 3-5 | 24 |
| 6 | 53 |
| >6 | 16 |
| 化疗方案 | |
| 单药方案 | 2 |
| 两药方案 | 42 |
| 三药方案 | 31 |
| 其他方案 | 18 |
| 服用中药治疗 | |
| 未用及服用<6 mo | 66 |
| 服用≥6 mo | 27 |
| 转移复发或死于胃癌(DFS终点) | |
| 未出现或失访 | 35 |
| 出现(终点事件) | 58(62.4%) |
| 死于胃癌 | |
| 未出现或失访 | 44 |
| 出现(终点事件) | 49(52.7%) |
| 因子 | 回归系数 | 标准误 | 统计量 | P值 | 相对危险度(95%CI) |
| 化疗周期 | 7.209 | 0.027 | |||
| 3-5 vs >6 | 0.380 | 0.370 | 1.052 | 0.305 | 1.462(0.708-3.019) |
| 6 vs >6 | -0.442 | 0.340 | 1.688 | 0.194 | 0.643(0.330-1.252) |
| 3-5 vs 6 | 0.882 | 0.309 | 7.061 | 0.008 | 2.274(1.241-4.169) |
| 服用中药治疗 | -0.676 | 0.319 | 4.489 | 0.034 | 0.509(0.272-0.951) |
| 3-5个周期 | 6个周期 | >6个周期 | |
| 中药组 | 5(18.5) | 17(63.0) | 5(18.5) |
| 对照组 | 19(28.8) | 36(54.5) | 11(16.7) |
| 分组 | n | 中位DFS(mo) | 无病生存率(%) | ||
| 1年 | 3年 | 5年 | |||
| 中药组 | 27 | 39.78 | 96 | 52 | 46 |
| 对照组 | 66 | 18.38 | 71 | 30 | 23 |
按照研究规定定期进行血象、肝肾功能等检测, 未发现与中药治疗相关的不良反应.
本研究多因素分析结果显示胃癌根治术后DFS的独立影响因素有临床病理分期和服用中药治疗, 健脾为基础的中药复方辨证治疗是胃癌根治术后DFS的独立保护性因素. Ⅳ(M0)期胃癌患者服用中药治疗能够延长DFS. 目前Ⅲ期患者中药组中位DFS未达到, 但由中药组1、3、5年无病生存率较化疗组显著提高可以看出, 服用中药治疗可以延长Ⅲ期患者的DFS.
近年来, 本科室根据多年治疗经验及实验室研究总结出健胃为基础, 结合清热解毒, 软坚化痰等作为胃癌的治法. 先贤张景岳《景岳全书》中已指出: "治反胃之法......必宜以扶助正气, 健脾养胃为主". 本科室主张"脾"为胃癌的"病本", 病因病机与"虚"、"痰"、"瘀"、"毒"有关, 其中尤以脾胃虚弱为胃癌发生与发展的一个基本因素. 文献报道[19]及我们多年的临床和实验研究[12,20-21]健脾表明为基础的中药对胃癌术后患者的复发转移有防治作用.
中医在中国古代对胃癌及其转移就有一定的认识. 胃癌属于中医"胃脘痛"、"噎膈"、"痞满"、"呃逆"、"反胃"、"伏梁"、"积聚"等范畴. 并将肿瘤的转移称为"传舍". 其后宋•杨士瀛《仁斋直指附遗方论》曰: "癌者, 上高下深, 岩穴之状, 颗颗累垂. 毒根深藏, 穿孔透里". 其中"穿孔透里"的性质, 是对癌症易于浸润转移这一特点的形象描述. 中医认为癌毒传舍是胃癌根治术后转移复发的基本病理过程, 而正气亏虚、余毒未尽、伏邪流注经络脏腑则是其病因病机[22].
胃癌根治术后患者服用中药预防复发转移, 改善生活质量的思路, 来源于中医"未病先防"的思想[23]. 胃癌经过根治术治疗后, 体内仍有可能存在微小的肿瘤病灶, 即中医谓之"伏邪"、"余毒"、"余邪", 是肿瘤复发转移的根源所在, 即癌毒传舍[24]. "未病先防"是指胃部的原发病灶已经被切除, 但余毒仍可留于经络, 如遇正虚, 正不胜邪, 余毒蔓延而造成复发转移, 于是需要提前用药防止其复发转移.
从本研究Ⅲ期和Ⅳ(M0)期患者的1、3、5年累积无病生存率可以看出胃癌根治术后患者复发转移多发生在根治术后3年内, 3年后这种趋势逐渐减缓, 与其他文献报道相符[25,26], 因此胃癌根治术后3年内的治疗应该受到特别重视. 对于Ⅲ, Ⅳ(M0)期胃癌辅助化疗一般认为术后8 wk内开始, 行6个疗程, 化疗结束后多为术后半年, 西医认为此时全面复查, 如无复发转移无需其他治疗, 即可进入观察. 但从本研究和其他文献来看, 术后1-3年复发转移率最高, 证明很多病期较晚的患者化疗后仍有癌细胞残存体内, 此时中药治疗就能够很好地发挥作用, 以其不良反应小, 患者依从性好的优势成为预防胃癌根治术后复发转移的重要治疗手段. 所以胃癌术后1-3年内可以选择中药治疗预防复发转移, 如有条件可延长服用时间至5年或更久, 以弥补手术和辅助化疗的不足之处.
此外, 本研究结果显示化疗周期是Ⅳ(M0)期胃癌根治术后DFS的独立影响因素, 化疗6个周期患者较化疗<6个周期患者DFS长, 而化疗>6个周期与化疗6个周期之间以及化疗>6个周期与化疗<6个周期之间差异无统计学意义. 这与大多数辅助化疗方案都以化疗6个周期为标准相符合, 因此在临床工作中如患者身体状况允许, 提倡胃癌根治术后尤其是Ⅳ期患者[27,28], 应积极完成6个周期辅助化疗. 但化疗药物具有明显的不良反应[29,30], 对人体损伤较大, 中医认为治疗疾病应中病即止, 过度用药反而会耗伤正气, 本研究表明化疗>6个周期较化疗6个周期及<6个周期未显示出生存优势, 故认为, 辅助化疗6个周期即可, 无需延长化疗时间.
近年来, 胃癌发病率及死亡率呈上升趋势, 目前外科根治性手术被认为是唯一有可能获得治愈胃癌的方法. 但日本的统计数据表明, 术后复发率仍高达20%, 美国根治术后仍有60%患者会出现局部复发或远处转移.
魏睦新, 教授, 南京医科大学第一附属医院中西医结合科
文献报道及本课题组多年的临床和实验研究健脾表明, 基础中药对胃癌术后患者的复发转移有防治作用.
以健脾为基础的中药复方辨证治疗能延长Ⅳ(M0)期胃癌根治术后中位DFS. 健脾为基础的中药复方辨证治疗可延长Ⅲ期胃癌根治术后患者DFS.
本文设计合理, 具有一定的临床实用价值.
编辑: 李薇 电编:何基才
| 1. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化情况分析及其发展趋势预测. 中华肿瘤杂志. 2004;26:4-9. |
| 2. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 3. | Ajani JA. Evolving chemotherapy for advanced gastric cancer. Oncologist. 2005;10 Suppl 3:49-58. [PubMed] [DOI] |
| 4. | Macdonald JS, Smalley SR, Benedetti J, Hundahl SA, Estes NC, Stemmermann GN, Haller DG, Ajani JA, Gunderson LL, Jessup JM. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med. 2001;345:725-730. [PubMed] [DOI] |
| 5. | Sakuramoto S, Sasako M, Yamaguchi T, Kinoshita T, Fujii M, Nashimoto A, Furukawa H, Nakajima T, Ohashi Y, Imamura H. Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine. N Engl J Med. 2007;357:1810-1820. [PubMed] [DOI] |
| 6. | Janunger KG, Hafström L, Glimelius B. Chemotherapy in gastric cancer: a review and updated meta-analysis. Eur J Surg. 2002;168:597-608. [PubMed] [DOI] |
| 8. | Cunningham D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJ, Nicolson M, Scarffe JH, Lofts FJ, Falk SJ, Iveson TJ. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006;355:11-20. [PubMed] [DOI] |
| 9. | Oba K. Efficacy of adjuvant chemotherapy using tegafur-based regimen for curatively resected gastric cancer: update of a meta-analysis. Int J Clin Oncol. 2009;14:85-89. [PubMed] [DOI] |
| 10. | Zhao AG, Cao W, Xu Y, Zhao G, Liu BY, Cai Y, Yang JZ, Gu Y, Yuan W, Zhu YJ. [Survival benefit of an herbal formula for invigorating spleen for elderly patients with gastric cancer]. Zhongxiyi Jiehe Xuebao. 2010;8:224-230. [PubMed] |
| 11. | Cao ND, Zhao AG, Yang JK. [Survival time of advanced gastric cancer patients treated with integrated traditional Chinese and Western medicine therapy]. Zhongxiyi Jiehe Xuebao. 2010;8:116-120. [PubMed] |
| 12. | Yang JK, Zhen J, Shen KP. [Clinical study on post-operative metastasis prevention of progressive stage of gastric cancer by weichang'an]. Zhongguo Zhongxiyi Jiehe Xuebao. 2003;23:580-582. [PubMed] |
| 16. | 赵 爱光, 曹 雯, 徐 燕, 赵 刚, 刘 炳亚, 蔡 泳, 杨 金祖, 顾 缨, 苑 伟, 朱 莹杰. 以健脾为基础的复方辨证治疗对老年胃癌患者生存期的影响. 中西医结合学报. 2010;8:224-230. |
| 17. | Wanebo HJ, Kennedy BJ, Chmiel J, Steele G Jr, Winchester D, Osteen R. Cancer of the stomach. A patient care study by the American College of Surgeons. Ann Surg. 1993;218:583-592. [PubMed] [DOI] |
| 18. | 陈 映霞, 秦 叔逵, 何 泽明, 王 琳, 钱 军, 邵 志坚, 刘 秀峰, 廖 峰, 龚 新雷. 胃差分化腺癌根治术后辅助化疗的临床研究. 临床肿瘤学杂志. 2007;12:651-654. |
| 19. | Cao W, Zhao AG. [Prescription rules of Chinese herbal medicines in treatment of gastric cancer]. Zhongxiyi Jiehe Xuebao. 2009;7:1-8. [PubMed] |
| 29. | Biancosino C, Albert M, Linder A. Acute toxicity of irinotecan in the ex-vivo isolated perfused human lung model--high-dose therapy during isolated perfusion without acute toxic lung edema. Interact Cardiovasc Thorac Surg. 2007;6:583-587. [PubMed] [DOI] |
| 30. | Leblond J, Le Pessot F, Hubert-Buron A, Duclos C, Vuichoud J, Faure M, Breuillé D, Déchelotte P, Coëffier M. Chemotherapy-induced mucositis is associated with changes in proteolytic pathways. Exp Biol Med (Maywood). 2008;233:219-228. [PubMed] [DOI] |