修回日期: 2011-01-06
接受日期: 2011-01-11
在线出版日期: 2011-02-28
目的: 探讨外源性亮菌抗顺铂(DDP)化疗过程中并发胃平滑肌电活动改变及5-羟色胺(5-HT)在此过程中的调控作用.
方法: 90只♂SD大鼠随机分为6组: 空白对照组、模型组、亮菌低、中、高剂量组及昂丹司琼组, 参照De Jonghe法以6 mg/kg体质量腹腔注射DDP制造化疗性大鼠异食癖恶心呕吐模型, 采用Biopac专用胃肠电记录分析系统检测胃窦部平滑肌电活动, 运用ELISA方法检测大鼠胃窦5-HT含量, 观察亮菌对DDP复制模型后不同时间段的胃电活动的影响及其与5-HT的关系.
结果: 造模后24-72 h, 模型组大鼠胃窦慢波每分钟频率(CPM)与平均振幅(AV)均显著高于空白对照组(P<0.05)与亮菌中、高剂量组(P<0.01), 以造模后24 h模型组(CPM: 7.33±2.92, AV: 249.75±79.09)与空白对照组(CPM: 3.00±1.55, AV: 148.04±63.51)、亮菌高剂量(CPM: 4.13±1.14, AV: 163.46±26.14)的差异最明显. 与空白对照组相比较, 其他各组大鼠胃窦组织5-HT含量(μg/L)均明显升高(24 h: 389.7±25.5, 354.5±34.9, 314.5±31.5, 282.2±19.6, 271.0±21.1 vs 244.6±27.3, P<0.05或0.01). 胃窦CMP及AV总体趋势随着5-HT含量增加而上升, 尤以造模后24 h趋势最为明显.
结论: 亮菌可有效抑制DDP化疗所诱发的胃节律性运动紊乱, 其对化疗过程中诱发的胃节律性运动紊乱的抑制作用机制可能与5-HT的调控作用有关.
引文著录: 杜静, 李平, 汪克明, 蔡荣林, 张梅, 孙鑫. 5-HT在亮菌防治顺铂化疗诱发胃肌电变化中的调控作用. 世界华人消化杂志 2011; 19(6): 562-567
Revised: January 6, 2011
Accepted: January 11, 2011
Published online: February 28, 2011
AIM: To investigate the preventive effect of Armillariella tabescens against cisplatin-induced changes in gastric electromyographic activity in rats and to explore the role of 5-hydroxytryptamine (5-HT) in this process.
METHODS: Ninety male Sprague-Dawley rats were randomized into control group, model group, ondansetron group, low-, medium-, and high-dose Armillariella tabescens groups. Rats were injected intraperitoneally with cisplatin (6 mg/kg) to induce pica. The electrical activity of gastric antral smooth muscle was recorded and analyzed using the Biopac MP100-CE acquisition system. The concentration of 5-HT in gastric antrum tissue was assayed by ELISA. The effect of Armillariella tabescens on gastric electromyographic activity and its relationship with 5-HT were then examined.
RESULTS: During 24-72 h after cisplatin administration, the cycles per minute (CPM) and amplitude of vibration (AV) of slow-wave in the gastric antrum were significantly higher in the model group than in the control group (all P < 0.05), medium-, and high-dose Armillariella tabescens groups (all P < 0.01), and the differences were most significant between the model group (CPM: 7.33 ± 2.92, AV: 249.75 ± 79.09) and the control group (CPM: 3.00 ± 1.55, AV: 148.04 ± 63.51) and high-dose Armillariella tabescens group (CPM: 4.13 ± 1.14, AV: 163.46 ± 26.14) at 24 h after cisplatin administration. Compared with the control group, the concentrations of 5-HT (μg/L) in the other groups were dramatically increased (24 h: 389.7 ± 25.5, 354.5 ± 34.9, 314.5 ± 31.5, 282.2 ± 19.6, 271.0 ± 21.1 vs 244.6 ± 27.3, all P < 0.05 or 0.01). CMP and AV increased with the increase in the concentrations of 5-HT.
CONCLUSION: Armillariella tabescens could effectively inhibit cisplatin-induced changes in gastric electromyographic activity in rats possibly via mechanisms involving 5-HT.
- Citation: Du J, Li P, Wang KM, Cai RL, Zhang M, Sun X. Involvement of 5-hydroxytryptamine in the preventive effect of Armillariella tabescens against cisplatin-induced changes in gastric electromyographic activity in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(6): 562-567
- URL: https://www.wjgnet.com/1009-3079/full/v19/i6/562.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i6.562
化疗诱发恶心呕吐等胃肠道发应是胃肠节律性运动紊乱的反映[1-3]. 近20年的研究显示, 5-羟色胺(5-hydroxytryptamine, 5-HT)受体拮抗剂不但在化疗药所致的恶心呕吐等胃肠道反应中扮演关键的抗呕吐作用[4-6], 且5-HT受体在胃起搏过程中对胃慢波活动起着一定的调控作用[7-9]. 本研究通过腹腔注射顺铂的方法制造化疗性大鼠异食癖恶心呕吐模型, 探讨亮菌通过改变胃肌电活动而防治顺铂化疗所诱发的恶心呕吐等胃肠道反应的机制, 初步了解5-HT在亮菌防治顺铂化疗诱发胃肌电变化中的调控作用.
健康♂SD大鼠, 体质量200-250 g(安徽医科大学实验动物中心). 实验前适应性喂养1 wk, 饲养期间, 保持实验室清洁安静, 采光及通风良好, 室温在20 ℃左右, 饲以普通颗粒饲料(安徽医科大学实验动物中心), 自由饮水. 亮菌口服液(安徽立方药业, 批号H34020002); 顺铂(南京制药厂, 批号H20030675); 大鼠5-HT ELISA试剂盒(上海朗顿生物技术有限公司, 批号BPE10493R); 昂丹司琼(江苏奥赛康药业有限公司, 批号H20060195); 高岭土(金岩高岭土开发有限责任公司); 甲酸、丙酮、庚烷、氯仿(安徽医科大学设备科).
1.2.1 分组: 健康♂SD大鼠90只, 随机分为6组: 第1组空白对照组, 第2组模型组, 第3组亮菌口服液低剂量组, 第4组亮菌口服液中剂量组, 第5组亮菌口服液高剂量组, 第6组昂丹司琼组, 每组24、48及72 h各5只.
1.2.2 造模: 实验前第3天, 放置50 g高岭土于另一个标准食物槽内. 实验第1天下午20:00, 第3、4、5组分别按成人每千克体质量用量的3倍、7倍和14倍给予亮菌口服液3、7和14 mL/kg灌胃, 第6组每隔12 h给予昂丹司琼2 mg/kg腹腔注射[10], 第2组以生理盐水灌胃. 如上法处理4 d. 参照De Jonghe等[11]法腹腔注射顺铂制造化疗性大鼠异食癖恶心呕吐模型, 于实验第2天, 对第2、3、4、5、6组分别按6 mg/kg体质量腹腔注射顺铂. 第1组均不给试剂.
1.2.3 观测指标: (1)高岭土: SD大鼠单笼饲养, 每日下午19:00记录大鼠高岭土摄入量(撒落的高岭土碎屑收集干燥后称重, 精确到0.01 g); (2)胃肌电图: 大鼠禁食12 h后, 按70 mL/L的水合氯醛5 mL/kg体质量腹腔注射麻醉后, 仰卧位固定, 腹正中线切口开腹, 暴露全胃, 于胃窦部浆膜下埋植单极Φ0.2 mm铂金丝圆环电极(部分埋植1对电极). 胃肌电活动记录及分析采用Biopac生物信号采集系统(MP100-CE, Santa Barbara, CA, USA). 放大器参数: LF 0.005 Hz, HF 0.5 Hz. 连续描记60 min; (3)5-HT: 胃肌电图描记结束后, 将大鼠颈椎脱臼处死. 取距幽门1 cm内胃窦部全层组织0.5 g, 均置-80 ℃冰箱中待测. 取胃窦组织0.1 g并加入2 mL甲酸/丙酮(V/V: 15/85)匀浆[12]. 用甲酸/丙酮对沉淀物进行离心和萃取后, 混合的上清用庚烷/氯仿(V/V: 8/1, 其中每1 mL的甲酸/丙酮加3 mL庚烷/氯仿)振荡清洗10 min. 离心10 min后(500 g)将有机相和脂质相被抽吸弃除, 并将水相在37 ℃环境下干燥. 样品用ELISA洗涤液进行重建. 最后按说明书用ELISA法测定分析5-HT含量. 采用酶联免疫分析仪(Model550, Biorad, USA)在λ = 450 nm处测读A值.
统计学处理 采用SPSS13.0统计软件进行分析. 各项指标均以mean±SD表示, 多组间比较方差齐用LSD检验, 方差不齐用Dunnett's C检验.
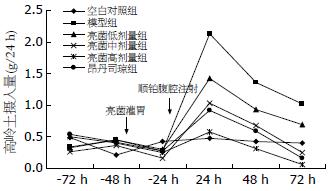
造模前72 h高岭土摄入量各组间差异均无统计学意义(P>0.05); 造模后24 h, 模型组大鼠高岭土摄入量显著上升, 与空白对照组比较差异具有统计学意义(2.13±0.96 vs 0.48±0.10, P<0.01), 造模后48-72 h模型组大鼠高岭土摄入量逐渐下降, 但均显著高于空白对照组(P<0.05); 造模后24-72 h, 亮菌高、中剂量组及昂丹司琼组大鼠高岭土摄入量均显著低于模型组(P<0.05), 其中以造模后24 h亮菌高剂量组大鼠高岭土摄入量与模型组比较差异最明显(0.58±0.23 vs 2.13±0.96, 图1).
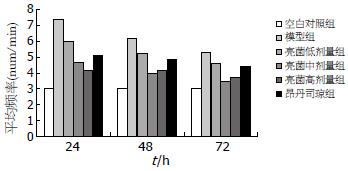
造模后24-72 h, 胃窦慢波每分钟频率均为模型组显著高于空白对照组(P<0.01), 其中以24 h模型组(7.33±2.92)与空白对照组(3.00±1.55)胃窦慢波频率差异最显著. 造模后24-72 h, 亮菌低、中、高剂量组及昂丹司琼组与模型组的慢波频率比较显示, 亮菌低、中、高剂量组及昂丹司琼组的慢波频率均显著低于模型组(P<0.01), 其中, 以造模后24 h亮菌高剂量(4.13±1.14)与模型组(7.33±2.92)胃窦慢波频率差异最明显, 而昂丹司琼组对慢波频率的抑制效果不及亮菌中、高剂量组, 尤以造模后48-72 h更为显著(图2).
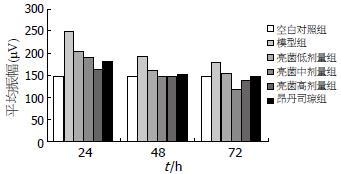
造模后24、48、72 h, 胃窦慢波平均振幅均为模型组显著高于空白对照组(P<0.05), 以24 h模型组(249.75±79.09)与空白对照组(148.04±63.51)胃窦慢波平均振幅差异最显著; 造模后24-72 h, 亮菌低、中、高剂量组及昂丹司琼组的慢波平均振幅均显著低于模型组(P<0.01)(除外24 h亮菌低剂量组), 其中以造模后24 h亮菌高剂量(163.46±26.14)与模型组(249.75±79.09)胃窦慢波平均振幅差异最明显, 而昂丹司琼组对慢波平均振幅的抑制效果不及亮菌中、高剂量组, 尤以与造模后72 h亮菌中剂量组比较更为明显(图3).
造模后24-72 h, 各组大鼠胃窦组织中5-HT含量均显著高于空白对照组(P<0.05); 造模后24-72 h, 亮菌低、中、高剂量组及昂丹司琼组与模型组的胃窦5-HT含量比较发现, 造模后24 h亮菌中剂量组、造模后24-72 h亮菌高剂量组及昂丹司琼组的胃窦5-HT含量显著低于模型组(P<0.05), 其余各组胃窦5-HT含量均低于模型组, 但差异均无统计学意义(P>0.05, 表1).
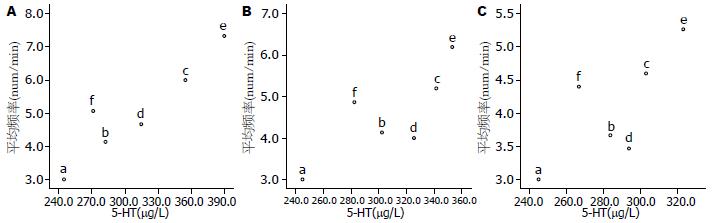
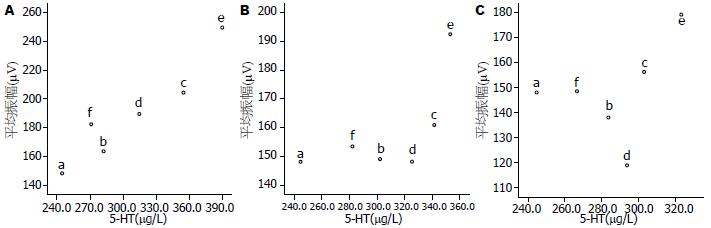
对大鼠胃窦慢波频率与胃窦5-HT含量作散点图分析显示, 腹腔注射顺铂后24-72 h, 胃窦慢波频率总体趋势随着5-HT含量增加而上升, 以腹腔注射顺铂后24 h变化最为明显; 其中, 腹腔注射顺铂后24-72 h, 亮菌中、高剂量组的5-HT含量均高于昂丹司琼组, 但其对胃窦慢波频率的抑制作用均强于昂丹司琼组, 尤以腹腔注射顺铂后48 h和72 h更为明显(图4).
对大鼠胃窦慢波振幅与胃窦5-HT含量作散点图分析显示, 腹腔注射顺铂后24-72h, 胃窦慢波振幅总体趋势基本呈现随5-HT含量增加而上升, 尤以腹腔注射顺铂后24 h变化最为明显; 其中, 腹腔注射顺铂后24-72 h, 亮菌中、高剂量组的5-HT含量均高于昂丹司琼组, 但其对胃窦慢波振幅的抑制作用均强于昂丹司琼组, 尤以腹腔注射顺铂后48 h和72 h更为明显(图5).
恶心呕吐是肿瘤化疗常见的胃肠道反应, 其中顺铂所致的恶心呕吐等消化道反应发生率高达90%以上, 严重影响肿瘤患者的生存质量与治疗效果[13-17]. 近20年, 5-HT受体阻滞剂的广泛应用使得约70%的急性呕吐可被有效控制, 但仍有约30%的急性呕吐和50%的迟发性呕吐尚未得到有效的控制[18-20]. 因此, 如何更有效地防治化疗所致的恶心、呕吐等胃肠道反应的发生, 对改善患者生活质量并保证化疗的顺利进行有重要意义.
已有研究证实, 大鼠异食癖行为可以用作有呕吐反射动物的呕吐模型[11,21-24]. 本研究即参照De Jonghe等[11]法腹腔注射顺铂制造化疗性大鼠异食癖恶心呕吐模型, 研究结果显示, 造模后24 h模型组高岭土摄入量显著上升, 与空白对照组比较差异具有显著性, 表明化疗后异食癖恶心呕吐模型复制成功; 同时, 在造模前24 h对亮菌高、中、低剂量组与空白对照组大鼠高岭土摄入量比较发现, 亮菌三剂量组与空白对照组大鼠高岭土摄入量差异无统计学意义, 说明亮菌不影响大鼠高岭土摄入量. 亮菌对顺铂化疗诱发胃肠道反应的防治效果研究显示, 造模后24、48及72 h, 亮菌高、中、低剂量组高岭土摄入量均低于模型组, 其中以造模后24 h亮菌高剂量组高岭土摄入量的抑制作用最为显著, 由此可见, 亮菌对顺铂化疗诱发大鼠异食癖反应有显著的抑制作用.
国外研究[1-3]表明, 化疗诱发恶心呕吐等胃肠道发应是胃肠节律性运动紊乱的反映. 呕吐在很大程度上取决于其内在的电活动, 慢波是胃肠道肌电活动的起步电位, 慢波调控胃肠平滑肌收缩的节律、时间、地点、频率和方向, 是胃动力的基础. 国内谭万初等[25]研究发现, 顺铂化疗致吐会加快家鸽胃肌电慢波频率, 导致节律异常, 而予以抗止呕药则能显著减慢慢波频率, 降低异常节律指数; 此外, 余晓云等[26]应用顺铂诱发犬呕吐的胃肌电研究发现, 顺铂化疗致吐会显著增加犬胃肌电慢波频率, 且胃肌电过速和过缓发生的百分比明显增加. 本研究结果表明, 腹腔注射顺铂后24-72 h, 与空白对照组比较, 模型组大鼠胃窦慢波每分钟频率明显增加、平均振幅显著增高, 其中尤以造模后24 h变化最为明显, 此外, 在本次试验过程中, 还同步记录了3例模型组大鼠胃体和胃窦部平滑肌电活动, 发现外源性顺铂复制模型后, 胃体与胃窦部平滑肌电活动同步性较差, 常见胃窦部慢波节律启动时间早于胃体部, 这可能是顺铂诱发其异位节律所致; 由此可见, 顺铂化疗过程中可诱发大鼠胃节律性运动紊乱. 而给予亮菌灌胃后结果显示, 造模后24-72 h亮菌中、高剂量组的慢波频率与平均振幅均显著低于模型组, 同步观察的5例亮菌组大鼠胃体和胃窦部平滑肌电活动经分析发现, 亮菌组胃体与胃窦部平滑肌电活动同步性较好, 仅1例出现常见胃窦部慢波节律启动时间早于胃体部, 结果提示亮菌对顺铂化疗诱发的大鼠胃节律性运动紊乱有明显的抑制作用.
目前, 化疗导致胃肠节律性运动紊乱的具体机制仍不十分清楚, 现有研究认为, 胃肠节律性运动紊乱与神经系统、脑肠肽及免疫因素等有密切关系. 余跃等研究[8]显示, 5-HT4受体拮抗剂GR113808能引起胃电紊乱, 提示胃起搏可能是通过5-HT4受体的介导而对胃慢波进行调控; 而5-HT在化疗药所致恶心呕吐等胃肠道不良反应的机制中扮演关键角色[4-6]. 本研究结果表明, 造模后24-72 h亮菌组胃窦组织5-HT含量显著低于模型组, 而对大鼠胃窦慢波频率及振幅与5-HT含量的关系分析表明, 腹腔注射顺铂后24-72 h, 胃窦慢波频率及振幅总体趋势随着5-HT含量增加而上升, 提示亮菌可能通过抑制化疗后大鼠胃肠道组织5-HT的释放, 从而起到对大鼠胃慢波的调控作用, 其中以腹腔注射顺铂后24 h调控作用最为明显, 该结果可能与顺铂化疗所诱发的急性期恶心呕吐等胃肠道反应的主要机制为5-HT有关[4-6]. 本研究采用组间比较设计的方法, 故不能验证5-HT含量与胃窦节律性运动紊乱的因果关系, 因此, 在探讨5-HT在亮菌防治顺铂化疗诱发胃肌电变化中的调控作用时尚需考虑时间因素的影响.
此外, 对大鼠胃窦慢波频率及振幅与5-HT含量的关系分析还发现, 腹腔注射顺铂后24-72 h, 亮菌中、高剂量组的5-HT含量均高于昂丹司琼组, 但其对胃窦慢波振幅及频率的抑制作用均强于昂丹司琼组, 尤以腹腔注射顺铂后48 h和72 h更为明显, 该结果提示, 亮菌对顺铂化疗诱发胃窦节律性运动紊乱的抑制作用除5-HT机制外(与昂丹司琼机制相似), 可能还存在其他途径, 如亮菌通过提高化疗后大鼠体内NO水平而起到对大鼠胃慢波的调控作用[27-30]. 有关亮菌与5-HT受体抑制剂对胃肠节律性运动紊乱的抑制作用的比较, 提示亮菌可能存在其他途径的观点, 在亮菌能有效治疗慢性胃炎、溃疡性结肠炎和小儿腹泻等研究结果中亦得到进一步佐证[31], 但该结论尚需进一步研究.
总之, 亮菌可有效抑制顺铂化疗所诱发的胃节律性运动紊乱, 其对大鼠顺铂化疗过程中诱发的胃节律性运动紊乱的抑制作用机制可能与5-HT的调控作用有关, 二者均以造模后24 h效果最为明显.
亮菌(Armillariella tabescens)是我国最初发现并拥有自主知识产权的一种真菌, 不仅具有提取简单方便、价格便宜及不良反应小的优点, 且能提高肿瘤患者机体免疫力、改善化疗患者的胃肠道不良反应.
任超世, 研究员, 中国医学科学院生物医学工程研究所
有关胃电快波、慢波与胃平滑肌收缩运动的同步性为学术界关注的主要问题之一, 一般认为快波较慢波能更好地反映胃平滑肌收缩运动情况, 但目前实验中常采用的单通道记录胃平滑肌快慢波电活动, 易引起快波电位的严重失真, 因此如何有效的采用分离双通道法同步记录胃电快波、慢波与胃平滑肌收缩运动亟待进一步研究.
余跃等研究显示, 5-HT4受体拮抗剂GR113808能引起胃电紊乱, 而胃起搏以较小的刺激能量就能纠正之, 提示胃起搏可能是通过5-HT4受体的介导而对胃慢波进行调控的.
本研究以大鼠胃平滑肌电活动节律变化为依据, 探讨顺铂化疗过程中诱发的胃平滑肌电活动改变及5-HT在此过程中的调控作用. 探讨亮菌对大鼠顺铂化疗过程中诱发的胃节律性运动紊乱的抑制作用, 机制可能与5-HT的调控作用有关.
本研究提示, 亮菌可有效抑制顺铂化疗所诱发的胃节律性运动紊乱, 其对化疗过程中诱发的胃节律性运动紊乱的抑制作用机制可能与5-HT的调控作用有关. 该结论对亮菌防治化疗诱发胃肠道反应的机制深入研究具有一定的理论指导意义.
本文设计合理, 结果可靠, 对于化疗诱发恶心呕吐等胃肠道反应方面的研究有一定的参考意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Yu X, Yang J, Hou X, Zhang K, Qian W, Chen JD. Cisplatin-induced gastric dysrhythmia and emesis in dogs and possible role of gastric electrical stimulation. Dig Dis Sci. 2009;54:922-927. [PubMed] [DOI] |
| 2. | Riezzo G, Clemente C, Leo S, Russo F. The role of electrogastrography and gastrointestinal hormones in chemotherapy-related dyspeptic symptoms. J Gastroenterol. 2005;40:1107-1115. [PubMed] [DOI] |
| 3. | Lo LH, Tai YS, Jou SJ. [A pilot study: gastric motility and nausea/vomiting in two leukemia children receiving chemotherapy]. Huli Zazhi. 2006;53:46-53. [PubMed] |
| 4. | Hesketh PJ. Chemotherapy-induced nausea and vomiting. N Engl J Med. 2008;358:2482-2494. [PubMed] [DOI] |
| 5. | Zhang WD, Wang XW, Chen ZD, Qin FZ, Shu YQ, Pan LX, Zhang MH. [Tropisetron hydrochloride in preventing and treating chemotherapy-induced nausea and vomiting: a phase II, randomized, multicenter, double-blinded, comparative clinical trial]. Ai Zheng. 2007;26:870-873. [PubMed] |
| 6. | Abenhardt W, Bosse D, Böning L, Bojko P, Hitz H, Völkl S, Fromm M, Mittermüller J, Göldel N, Schick HD. [Treatment of chemotherapy-induced nausea and vomiting with 5-hydroxytryptamine type 3 receptor antagonists]. Dtsch Med Wochenschr. 2006;131:2707-2712. [PubMed] [DOI] |
| 7. | Hoyer D, Hannon JP, Martin GR. Molecular, pharmacological and functional diversity of 5-HT receptors. Pharmacol Biochem Behav. 2002;71:533-554. [PubMed] [DOI] |
| 10. | Rudd JA, Yamamoto K, Yamatodani A, Takeda N. Differential action of ondansetron and dexamethasone to modify cisplatin-induced acute and delayed kaolin consumption ("pica") in rats. Eur J Pharmacol. 2002;454:47-52. [PubMed] [DOI] |
| 11. | De Jonghe BC, Horn CC. Chemotherapy-induced pica and anorexia are reduced by common hepatic branch vagotomy in the rat. Am J Physiol Regul Integr Comp Physiol. 2008;294:R756-R765. [PubMed] [DOI] |
| 12. | Smith JE, Lane JD, Shea PA, McBride WJ, Aprison MH. A method for concurrent measurement of picomole quantities of acetylcholine, choline, dopamine, norepinephrine, serotonin, 5-hydroxytryptophan, 5-hydroxyindoleacetic acid, tryptophan, tyrosine, glycine, aspartate, glutamate, alanine, and gamma-aminobutyric acid in single tissue samples from different areas of rat central nervous system. Anal Biochem. 1975;64:149-169. [PubMed] [DOI] |
| 13. | Ballatori E, Roila F, Ruggeri B, Betti M, Sarti S, Soru G, Cruciani G, Di Maio M, Andrea B, Deuson RR. The impact of chemotherapy-induced nausea and vomiting on health-related quality of life. Support Care Cancer. 2007;15:179-185. [PubMed] [DOI] |
| 14. | Hesketh PJ, Aapro M, Street JC, Carides AD. Evaluation of risk factors predictive of nausea and vomiting with current standard-of-care antiemetic treatment: analysis of two phase III trials of aprepitant in patients receiving cisplatin-based chemotherapy. Support Care Cancer. 2010;18:1171-1177. [PubMed] [DOI] |
| 15. | De Jonghe BC, Horn CC. Chemotherapy agent cisplatin induces 48-h Fos expression in the brain of a vomiting species, the house musk shrew (Suncus murinus). Am J Physiol Regul Integr Comp Physiol. 2009;296:R902-R911. [PubMed] [DOI] |
| 16. | Cohen L, de Moor CA, Eisenberg P, Ming EE, Hu H. Chemotherapy-induced nausea and vomiting: incidence and impact on patient quality of life at community oncology settings. Support Care Cancer. 2007;15:497-503. [PubMed] [DOI] |
| 18. | Eisenberg P, Figueroa-Vadillo J, Zamora R, Charu V, Hajdenberg J, Cartmell A, Macciocchi A, Grunberg S. Improved prevention of moderately emetogenic chemotherapy-induced nausea and vomiting with palonosetron, a pharmacologically novel 5-HT3 receptor antagonist: results of a phase III, single-dose trial versus dolasetron. Cancer. 2003;98:2473-2482. [PubMed] [DOI] |
| 19. | Hickok JT, Roscoe JA, Morrow GR, King DK, Atkins JN, Fitch TR. Nausea and emesis remain significant problems of chemotherapy despite prophylaxis with 5-hydroxytryptamine-3 antiemetics: a University of Rochester James P. Wilmot Cancer Center Community Clinical Oncology Program Study of 360 cancer patients treated in the community. Cancer. 2003;97:2880-2886. [PubMed] [DOI] |
| 20. | Geling O, Eichler HG. Should 5-hydroxytryptamine-3 receptor antagonists be administered beyond 24 hours after chemotherapy to prevent delayed emesis? Systematic re-evaluation of clinical evidence and drug cost implications. J Clin Oncol. 2005;23:1289-1294. [PubMed] [DOI] |
| 21. | Yuan CS, Wang CZ, Mehendale SR, Aung HH, Foo A, Israel RJ. Protease inhibitor-induced nausea and vomiting is attenuated by a peripherally acting, opioid-receptor antagonist in a rat model. AIDS Res Ther. 2009;6:19. [PubMed] [DOI] |
| 22. | Cabezos PA, Vera G, Castillo M, Fernández-Pujol R, Martín MI, Abalo R. Radiological study of gastrointestinal motor activity after acute cisplatin in the rat. Temporal relationship with pica. Auton Neurosci. 2008;141:54-65. [PubMed] [DOI] |
| 23. | Mehendale S, Aung H, Wang A, Yin JJ, Wang CZ, Xie JT, Yuan CS. American ginseng berry extract and ginsenoside Re attenuate cisplatin-induced kaolin intake in rats. Cancer Chemother Pharmacol. 2005;56:63-69. [PubMed] [DOI] |
| 24. | Aung HH, Mehendale SR, Xie JT, Moss J, Yuan CS. Methylnaltrexone prevents morphine-induced kaolin intake in the rat. Life Sci. 2004;74:2685-2691. [PubMed] [DOI] |
| 26. | 余 晓云, 侯 晓华. 胃电刺激对药物诱导的犬呕吐症状和胃肌电活动的影响及其中枢机制研究. 武汉: 华中科技大学博士学位论文 2009; 1-79. |
| 27. | 余 跃, 殷 光甫, 钱 伟, 侯 晓华. NO参与了胃起搏调控胃慢波活动. 胃肠病学和肝病学杂志. 2007;16:247-249. |
| 29. | 沈 业寿, 马 金宝. 亮菌研究的现状与展望. 安徽大学学报(自然科学版). 2007;31:82-86. |