修回日期: 2010-12-28
接受日期: 2011-01-06
在线出版日期: 2011-02-28
目的: 研究胃癌细胞来源的外泌体(exosome)对肿瘤细胞增殖的影响, 初步探讨Src蛋白激酶在此过程中的作用.
方法: 采用离心超滤和蔗糖密度梯度超速离心的方法从胃癌SGC7901细胞的上清液中分离出胃癌细胞来源的exosome. 透射电子显微镜下观察exosome形态, MTT法检测细胞增殖能力, Western blot检测蛋白的表达.
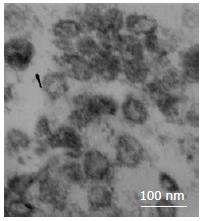
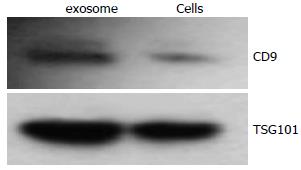
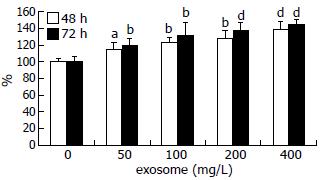
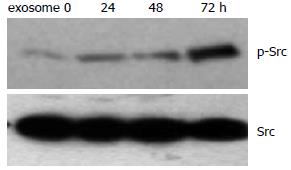
结果: 透射电子显微镜下观察胃癌SGC7901细胞来源的exosome具有特征性的盘状结构, 由双层膜构成, 他们的直径30-100 nm. Western blot结果显示exosome表面富含CD9和TSG101分子. MTT结果显示exosome能以时间和剂量依赖性的方式促进SGC7901细胞的增殖, 200 mg/L和400 mg/L的exosome处理SGC7901细胞72 h, 细胞的增殖比率分别是对照组的138%(P<0.001)和144%(P<0.001), 在此过程中伴随有p-Src表达的上调.
结论: 胃癌细胞来源的exosome能促进肿瘤细胞的增殖, 其机制可能与激活Src蛋白激酶有关.
引文著录: 曲晶磊, 曲秀娟, 刘云鹏, 赵明芳, 侯科佐, 姜又红, 杨向红. Src激酶在胃癌细胞来源的exosome促进肿瘤细胞增殖中的作用. 世界华人消化杂志 2011; 19(6): 557-561
Revised: December 28, 2010
Accepted: January 6, 2011
Published online: February 28, 2011
AIM: To investigate the effect of gastric cancer exosomes on tumor cell proliferation and to evaluate the role of tyrosine kinase Src in this process.
METHODS: Exosomes were isolated and purified from gastric cancer SGC7901 cells by serial centrifugation and sucrose gradient ultracentrifugation and observed by electron microscopy. Cell proliferation was measured by MTT assay. Protein expression was assayed by Western blot.
RESULTS: Gastric cancer exosomes had a characteristic saucer-like shape that was limited by a lipid bilayer, and their diameter ranged from 30 to 100 nm. CD9 and TSG101 were abundant on the surface of exosomes. Gastric cancer exosomes significantly increased SGC7901 cell proliferation in a time- and dose-dependent manner. Compared with control cells, the proliferation of cells treated with 200 and 400 mg/L exosomes for 72 h were increased to 138% and 144%, respectively (both P < 0.01). The expression of phosphorylated Src in SGC7901 cells was up-regulated in a time- and dose-dependent manner after treatment with exosomes.
CONCLUSION: Gastric cancer exosomes promote tumor cell proliferation possibly by activating tyrosine kinase Src.
- Citation: Qu JL, Qu XJ, Liu YP, Zhao MF, Hou KZ, Jiang YH, Yang XH. Role of tyrosine kinase Src in gastric cancer exosome-mediated promotion of tumor cell proliferation. Shijie Huaren Xiaohua Zazhi 2011; 19(6): 557-561
- URL: https://www.wjgnet.com/1009-3079/full/v19/i6/557.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i6.557
我国是世界上胃癌发病最高的国家之一, 每年新发病例近40万, 约占全世界的42%, 并且多数患者在诊断时已属晚期[1,2]. 尽管手术和放化疗在一定水平改善了患者的生存, 但5年生存率仍低于15%[3], 其预后不良的重要原因是肿瘤复发和转移. 因此深入探讨胃癌细胞自我调控的增殖机制, 对提高胃癌疗效具有重要意义. 目前研究发现, 肿瘤细胞能释放大量的外泌体(exosome), 作为细胞功能的使者, 参与多种病理生理过程[4-6]. exosome是由细胞分泌至胞外的膜性小囊泡, 起源于内吞途径中的多泡体, 通过多泡体与质膜融合释放至细胞外[7]. exosome含有大量与其来源和功能密切相关的蛋白质和脂质成分[8,9]. 由于exosome的膜性结构能阻止血清中的蛋白酶对其携带的蛋白分子的降解, 所以exosome可作为体内细胞之间信息传递的重要载体, 可通过自分泌或旁分泌的方式作用于自身或远隔的靶细胞并调节其功能[10,11]. 我们之前的研究发现肿瘤来源的exosome能通过激活PI3K/Akt和MAPK/ERK信号转导通路促进肿瘤细胞的增殖[12,13], 但Src蛋白激酶在此过程中的作用不清楚. 本研究分离纯化了胃癌SGC7901细胞来源的exosome, 评价了Src蛋白激酶在胃癌细胞来源的exosome促进胃癌细胞增殖中的作用, 为进一步理解胃癌的恶性增殖机制提供了理论依据.
RPMI 1640培养基购自Gibco公司, 胎牛血清购自天津血液病研究所. 100 000 Da MWCO Amicon超滤管购自美国Millipore公司, 重水购自美国Sigma公司. 鼠抗人CD9抗体和TSG101抗体购自Santa Cruz公司, 鼠抗人Src和p-Src抗体购自Cell Signaling公司. 辣根过氧化物酶标记的羊抗鼠二抗购自北京中杉金桥生物技术有限公司, ECL试剂盒购自PIERCE公司.
1.2.1 细胞培养: 人低分化胃腺癌细胞株SGC 7901细胞为本实验室常规传代培养, 生长于含有100 mL/L灭活胎牛血清、12 kU/L庆大霉素的RPMI 1640培养液中, 于37 ℃、50 mL/L CO2、饱和湿度的培养箱内培养, 2.5 g/L胰酶消化液消化传代, 2-3 d传代1次. 所有实验均采用对数生长期细胞. 血清来源的exosome的去除采用两步法分离, 即10 000 g×30 min, 100 000 g×1 h.
1.2.2 exosome的制备: 胃癌SGC7901细胞培养48 h后收集细胞上清液用于exosome的制备. 首先, 收集的上清液通过一系列离心去除细胞及碎片: 4 ℃, 300 g×10 min、1 200 g×30 min、10 000 g×30 min. 然后将上清液移入100 000 Da MWCO Amicon 50 mL超滤离心管中, 4 ℃离心, 1 000 g×30 min, 取浓缩液. 将超滤后液体移至含有30%蔗糖/重水垫的15 mL超速离心管中, 4 ℃ 100 000 g超速离心1 h. 收集底部含有exosome的缓冲垫, 用至少5倍体积的PBS稀释后, 置于100 000 Da MWCO Amicon超滤离心管中, 4 ℃ 1 000 g离心30 min, 重复3次. 得到的浓缩液即为exosome, 0.22 μm滤膜过滤除菌, Bardford法检测蛋白浓度, 分装备用, -80 ℃保存.
1.2.3 电镜: 将exosome超速离心成沉淀后, 经固定液(2%多聚甲醛, 0.25%戊二醛)4 ℃固定1 h, PBS洗涤3次(15 min/次), 1%锇酸固定1.5 h, PBS洗涤3次(15 min/次), 梯度酒精脱水, 环氧树脂浸透过夜、包埋, 于35 ℃、45 ℃、60 ℃聚合24 h, 经超薄切片、铅铀染色后透射电镜下观察摄片.
1.2.4 MTT法检测细胞活力: 取对数生长期的SGC7901细胞, 常规胰酶消化制成单细胞悬液, 将细胞浓度调至2.5×107/L接种于96孔板, 每孔180 μL, 培养12 h后分别加入终浓度为50、100、200和400 mg/L的exosome. 设置空白、正常对照组(空白组除不加细胞外, 正常对照组除不加exosome外, 其余均与exosome实验组同样处理), 每组设4个复孔, 每孔终体积为200 μL. 分别培养48和72 h后每孔加入MTT溶液(5 g/L)20 μL, 继续孵育4 h后吸弃上清, 每孔加入200 μL DMSO, 振荡摇匀. 用酶标仪于570 nm波长条件下测定吸光度(A)值. 按下列公式计算细胞增殖率: 增殖率(%) = (处理组平均A值-空白组平均A值)/(正常对照组平均A值-空白组平均A值)×100%.
1.2.5 Western blot检测蛋白表达: 分别收集对照组及处理组细胞, 将其裂解于200 μL含有蛋白酶抑制剂(100 mg/L PMSF, 2 mg/L Aprotitin)的裂解液中[1% Triton X-100, 50 mmol/L Tris-HCl(pH 7.4), 150 mmol/L NaCl, 10 mmol/L EDTA, 100 mmol/L NaF, 1 mmol/L Na3VO4], 4 ℃裂解40 min, 15 000 r/min离心20 min, 取上清, Bardford法进行蛋白定量. 与3×样品缓冲液混合后, 煮沸5 min. 将样品在10%的SDS-聚丙烯凝胶中进行电泳3 h, 然后转印至硝酸纤维素膜上. 用5%脱脂牛奶封闭1 h后, 分别加入一抗, 4 ℃过夜. TTBS洗4次后加入辣根过氧化物酶标记的二抗, 室温作用30 min, ECL法显色, GIS凝胶图像分析系统照相并分析处理.
统计学处理 所有数据均为3次独立实验结果, 以mean±SD表示. 采用SPSS13.0统计软件进行统计学分析. 两组之间比较采用t检验, P<0.05有统计学意义.
透射电子显微镜下观察exosome具有特征性的盘状结构, 由双层膜构成, 他们的直径为30-100 nm(图1).
Western blot结果显示与等量的SGC7901细胞裂解物相比, exosome表面富含四次跨膜分子CD9和多泡体标志物TSG101分子(图2).
MTT结果显示exosome以时间和剂量依赖性的方式促进SGC7901细胞增殖, 200 mg/L和400 mg/L的exosome处理SGC7901细胞72 h, 细胞的增殖比率分别是正常对照组的138%(P<0.001)和144%(P<0.001, 图3).
肿瘤能在人体内发生并长期生存, 一方面是肿瘤细胞获得了一定水平的自主性生长信号, 使其不受体内生长调节系统的控制而持续增殖[14]; 另一方面是由于肿瘤细胞在生长过程中形成了多重免疫逃逸机制, 使机体的免疫系统无法对肿瘤细胞进行识别和杀伤[15]. 目前越来越多的证据表明肿瘤来源的exosome在肿瘤细胞的恶性增殖和免疫逃逸等方面发挥着重要的作用[16-18]. Skog等[19]报道原代培养的恶性胶质瘤细胞释放的exosome能促进人胶质瘤细胞系的增殖. Koga等[20]报道人乳腺癌BT-474细胞分泌的exosome和BT-474细胞共同培养时, exosome能附着在细胞表面并能促进BT-474细胞的增殖. 也有体内研究证实小鼠乳腺癌细胞来源的exosome能通过抑制NK细胞的功能而促进肿瘤的生长[21].
基于上述研究结果, 我们以胃癌SGC7901细胞为模型, 采用离心超滤和蔗糖密度梯度离心的方法分离中肿瘤细胞来源的exosome, 并从形态学和分子表达两方面进行了鉴定. Exosome携带的蛋白质根据其分布大致分为两大类[22,23], 一类是普通蛋白质(如四次跨膜蛋白家族成员), 在所有的exosome上都有分布; 一类是细胞特异性蛋白质, 只存在于特定细胞来源的exosome. 本研究显示SGC7901细胞来源的exosome表面富含四次跨膜蛋白CD9和多泡体标志TSG101分子, 这些蛋白质的表达可能与exosome的生物起源有关, 进一步证实了SGC7901细胞培养液经离心超滤和蔗糖密度梯度离心得到的微囊小体即为exosome. 进一步的研究发现SGC7901来源的exosome能以时间和剂量依赖性的方式促进SGC7901细胞的增殖. 国外最新研究显示[24], 表达EGFRvⅢ的神经胶质瘤细胞能通过分泌的exosome把自身携带的EGFRvⅢ转运给不表达EGFRvⅢ的胶质瘤细胞并促进其恶性增殖. 这些结果提示exosome可能是肿瘤细胞之间传递恶性增殖信号的重要载体.
本研究发现SGC7901来源的exosome在促进胃癌细胞增殖过程中存在Src激酶的持续活化. Src基因是第1个被发现的有内在酪氨酸激酶活性的人类癌基因[25]. 在人类许多肿瘤中, 如胃癌、结肠癌、乳腺癌和胰腺癌都存在Src蛋白的过度表达和活化[26-29]. 于虹等[30]报道胃癌SGC7901细胞中Src激酶处于高活性状态, 抑制Src激酶的活性能抑制SGC7901细胞的增殖、迁移、基质侵袭和体外诱导血管形成的能力. 研究提示Src激酶可能在胃癌细胞的恶性增殖和转移过程中起到促进作用. 但目前尚没有肿瘤来源的exosome对Src活性的影响的报道. 本研究首次报道了肿瘤来源的exosome在促进肿瘤细胞增殖过程中激活了Src蛋白激酶, 提示Src激酶的活化可能是exosome促进肿瘤细胞增殖的机制之一.
尽管肿瘤细胞来源的exosome的生理作用还不十分清楚, 但可以肯定的是exosomes在体内细胞之间的信息传递方面发挥着重要的作用. 本研究结果显示胃癌细胞来源的exosome体外能促进肿瘤细胞的增殖, 其机制可能与Src激酶的活化有关. 进一步研究胃癌细胞来源的exosome促进肿瘤细胞增殖的机制, 对深入理解胃癌的生物学行为和寻找治疗胃癌的新的靶分子具有重要的科学意义和实际价值.
目前研究发现, 肿瘤细胞能释放大量的外泌体(exosome), 作为细胞功能的使者, 参与多种病理生理过程. exosome是由细胞分泌至胞外的膜性小囊泡, 起源于内吞途径中的多泡体, 通过多泡体与质膜融合释放至细胞外. exosome含有大量与其来源和功能密切相关的蛋白质和脂质成分.
刘连新, 教授, 哈尔滨医科大学第一临床医学院普通外科三病房
Skog等报道原代培养的恶性胶质瘤细胞释放的exosome能促进人胶质瘤细胞系的增殖.
胃癌细胞来源的exosome能促进肿瘤细胞的增殖, 其机制可能与激活Src蛋白激酶有关.
本文选题合理, 结果可靠, 具有较好的科学性和创新性.
编辑: 曹丽鸥 电编:何基才
| 2. | 吴 春晓, 郑 莹, 鲍 萍萍, 顾 凯, 王 春芳, 向 泳梅, 彭 鹏, 邱 永莉, 龚 杨明, 卢 伟. 上海市胃癌发病流行现况与时间趋势分析. 外科理论与实践. 2008;13:24-29. |
| 3. | Cunningham D, Starling N, Rao S, Iveson T, Nicolson M, Coxon F, Middleton G, Daniel F, Oates J, Norman AR. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med. 2008;358:36-46. [PubMed] [DOI] |
| 4. | Nazarenko I, Rana S, Baumann A, McAlear J, Hellwig A, Trendelenburg M, Lochnit G, Preissner KT, Zöller M. Cell surface tetraspanin Tspan8 contributes to molecular pathways of exosome-induced endothelial cell activation. Cancer Res. 2010;70:1668-1678. [PubMed] [DOI] |
| 5. | Ashiru O, Boutet P, Fernández-Messina L, Agüera-González S, Skepper JN, Valés-Gómez M, Reyburn HT. Natural killer cell cytotoxicity is suppressed by exposure to the human NKG2D ligand MICA*008 that is shed by tumor cells in exosomes. Cancer Res. 2010;70:481-489. [PubMed] [DOI] |
| 6. | 曲 晶磊, 赵 明芳, 曲 秀娟, 侯 科佐, 姜 又红, 杨 向红, 刘 云鹏. MAPK/ERK信号通路在胃癌细胞来源的外来体诱导Jurkat T细胞凋亡中的作用. 世界华人消化杂志. 2010;18:1969-1973. [DOI] |
| 7. | Lykke-Andersen S, Brodersen DE, Jensen TH. Origins and activities of the eukaryotic exosome. J Cell Sci. 2009;122:1487-1494. [PubMed] [DOI] |
| 8. | Théry C, Zitvogel L, Amigorena S. Exosomes: composition, biogenesis and function. Nat Rev Immunol. 2002;2:569-579. [PubMed] |
| 9. | Simpson RJ, Lim JW, Moritz RL, Mathivanan S. Exosomes: proteomic insights and diagnostic potential. Expert Rev Proteomics. 2009;6:267-283. [PubMed] [DOI] |
| 10. | Eldh M, Ekström K, Valadi H, Sjöstrand M, Olsson B, Jernås M, Lötvall J. Exosomes communicate protective messages during oxidative stress; possible role of exosomal shuttle RNA. PLoS One. 2010;5:e15353. [PubMed] [DOI] |
| 11. | Meckes DG Jr, Shair KH, Marquitz AR, Kung CP, Edwards RH, Raab-Traub N. Human tumor virus utilizes exosomes for intercellular communication. Proc Natl Acad Sci U S A. 2010;107:20370-20375. [PubMed] [DOI] |
| 13. | Qu JL, Qu XJ, Zhao MF, Teng YE, Zhang Y, Hou KZ, Jiang YH, Yang XH, Liu YP. Gastric cancer exosomes promote tumour cell proliferation through PI3K/Akt and MAPK/ERK activation. Dig Liver Dis. 2009;41:875-880. [PubMed] [DOI] |
| 14. | Taby R, Issa JP. Cancer epigenetics. CA Cancer J Clin. 2010;60:376-392. [PubMed] [DOI] |
| 15. | Han W, Pan H, Jiang L, Wei K, Zou D, Zhang Z. A novel approach to rescue immune escape in oral squamous cell carcinoma: Combined use of interferon-γ and LY294002. Oncol Rep. 2011;25:181-187. [PubMed] |
| 16. | Hendrix A, Westbroek W, Bracke M, De Wever O. An ex(o)citing machinery for invasive tumor growth. Cancer Res. 2010;70:9533-9537. [PubMed] [DOI] |
| 17. | Hong BS, Cho JH, Kim H, Choi EJ, Rho S, Kim J, Kim JH, Choi DS, Kim YK, Hwang D. Colorectal cancer cell-derived microvesicles are enriched in cell cycle-related mRNAs that promote proliferation of endothelial cells. BMC Genomics. 2009;10:556. [PubMed] [DOI] |
| 18. | Valenti R, Huber V, Iero M, Filipazzi P, Parmiani G, Rivoltini L. Tumor-released microvesicles as vehicles of immunosuppression. Cancer Res. 2007;67:2912-2915. [PubMed] [DOI] |
| 19. | Skog J, Würdinger T, van Rijn S, Meijer DH, Gainche L, Sena-Esteves M, Curry WT Jr, Carter BS, Krichevsky AM, Breakefield XO. Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers. Nat. Cell Biol. 2008;10:1470-1476. [PubMed] [DOI] |
| 20. | Koga K, Matsumoto K, Akiyoshi T, Kubo M, Yamanaka N, Tasaki A, Nakashima H, Nakamura M, Kuroki S, Tanaka M. Purification, characterization and biological significance of tumor-derived exosomes. Anticancer Res. 2005;25:3703-3707. [PubMed] |
| 21. | Liu C, Yu S, Zinn K, Wang J, Zhang L, Jia Y, Kappes JC, Barnes S, Kimberly RP, Grizzle WE. Murine mammary carcinoma exosomes promote tumor growth by suppression of NK cell function. J Immunol. 2006;176:1375-1385. [PubMed] |
| 23. | Graner MW, Alzate O, Dechkovskaia AM, Keene JD, Sampson JH, Mitchell DA, Bigner DD. Proteomic and immunologic analyses of brain tumor exosomes. FASEB J. 2009;23:1541-1557. [PubMed] [DOI] |
| 24. | Al-Nedawi K, Meehan B, Micallef J, Lhotak V, May L, Guha A, Rak J. Intercellular transfer of the oncogenic receptor EGFRvIII by microvesicles derived from tumour cells. Nat Cell Biol. 2008;10:619-624. [PubMed] [DOI] |
| 25. | Aleshin A, Finn RS. SRC: a century of science brought to the clinic. Neoplasia. 2010;12:599-607. [PubMed] |
| 26. | Okamoto W, Okamoto I, Yoshida T, Okamoto K, Takezawa K, Hatashita E, Yamada Y, Kuwata K, Arao T, Yanagihara K. Identification of c-Src as a potential therapeutic target for gastric cancer and of MET activation as a cause of resistance to c-Src inhibition. Mol Cancer Ther. 2010;9:1188-1197. [PubMed] [DOI] |
| 27. | Sirvent A, Bénistant C, Pannequin J, Veracini L, Simon V, Bourgaux JF, Hollande F, Cruzalegui F, Roche S. Src family tyrosine kinases-driven colon cancer cell invasion is induced by Csk membrane delocalization. Oncogene. 2010;29:1303-1315. [PubMed] [DOI] |
| 28. | Mayer EL, Krop IE. Advances in targeting SRC in the treatment of breast cancer and other solid malignancies. Clin Cancer Res. 2010;16:3526-3532. [PubMed] [DOI] |
| 29. | Ischenko I, Guba M, Yezhelyev M, Papyan A, Schmid G, Green T, Fennell M, Jauch KW, Bruns CJ. Effect of Src kinase inhibition on metastasis and tumor angiogenesis in human pancreatic cancer. Angiogenesis. 2007;10:167-182. [PubMed] [DOI] |