修回日期: 2011-01-07
接受日期: 2011-01-11
在线出版日期: 2011-02-18
目的: 比较自身免疫性肝炎(AIH)、原发性胆汁性肝硬化(PBC)及慢性乙型肝炎(CHB)的组织学特征, 并探讨雌激素受体α(ERα)及转化生长因子β1(TGF-β1)在各组肝活检中的表达及意义.
方法: 应用HE染色对29例I型AIH、18例PBC、15例CHB肝穿标本进行组织学特征分析, 应用免疫组织化学方法检测各组ERα及TGF-β1的表达情况, 设8例正常肝组织(非肝病患者尸检来源的肝组织)为对照.
结果: 各组肝活检组织学特征中羽毛状变性、胆栓、胆管增生的发生率的差异具有统计学意义(33.33% vs 3.45%, 6.67%; 44.44% vs 6.92%, 6.67%; 61.11% vs 34.48%, 13.33%, 均P<0.05). TGF-β1在PBC组汇管区的阳性细胞数高于肝小叶(31.80±15.92 vs 16.00±6.28, P<0.05), 各组间汇管区阳性细胞数PBC组高于其他3组(31.80±15.92 vs 10.00±12.15, 13.44±13.51, 3.20±3.20, 均P<0.01), 在正常组肝小叶内阳性细胞数高于汇管区(16.85±3.48 vs 3.20±3.20, P<0.01). ERα在各组的表达AIH和PBC组高于正常组(94.78±48.36, 110.40±36.66 vs 28.98±24.60, 均P<0.01).
结论: 不同类型的自身免疫性肝病的组织学特征有所不同, AIH以肝小叶界板的损伤为主要改变, 而PBC以胆管上皮损伤为主要特征. ERα及TGF-β1可能介导和促进了自身免疫性肝病的发生发展.
引文著录: 李麟, 章明放, 王邦茂, 白雪, 张玉洁, 乌日丽其. 不同类型自身免疫性肝病的组织学特征及ERα、TGF-β1表达的意义. 世界华人消化杂志 2011; 19(5): 519-523
Revised: January 7, 2011
Accepted: January 11, 2011
Published online: February 18, 2011
AIM: To summarize the histological features of autoimmune hepatitis (AIH), primary biliary cirrhosis (PBC) and chronic virus hepatitis of type B (CHB), and to investigate the significance of ERα and TGF-β1 expression in the above liver diseases.
METHODS: Histological examination was performed using liver biopsy specimens from 29 patients with AIH, 18 patients with PBC, and 15 patients with CHB. Immunohistochemistry was used to detect the expression of ERα and TGF-β1 in the above specimens and 8 normal liver tissue specimens.
RESULTS: The incidences of feathery degeneration, bile thrombus, and bile duct hyperplasia were significantly different among AIH, PBC, and CHB (33.33% vs 3.45%, 6.67%; 44.44% vs 6.92%, 6.67%; 61.11% vs 34.48%, 13.33%; all P < 0.05). In patients with PBC, the expression of TGF-β1 was significantly higher in the portal area than in the hepatic lobule (31.80 ± 15.92 vs 16.00 ± 6.28, P < 0.05). The expression of TGF-β1 in the portal area was significantly higher in PBC than in the other three groups (31.80 ± 15.92 vs 10.00 ± 12.15, 13.44 ± 13.51, 3.20 ± 3.20, all P < 0.01). In normal controls, the expression of TGF-β1 was significantly higher in the hepatic lobule than in the portal area (16.85 ± 3.48 vs 3.20 ± 3.20, P < 0.01). The expression of ERα was significantly different among the four groups. The expression of ERα was significantly higher in AIH and PBC than in normal controls (94.78 ± 48.36, 110.40 ± 36.66 vs 28.98 ± 24.60, both P < 0.01).
CONCLUSION: Different autoimmune liver diseases have different histological features. AIH is characterized by interface hepatitis, and PBC by destructive cholangitis. ERα and TGF-β1 may mediate and promote the development and progression of autoimmune liver diseases.
- Citation: Li L, Zhang MF, Wang BM, Bai X, Zhang YJ, Wuriliqi. Histological features and significance of ERα and TGF-β1 expression among different types of autoimmune liver diseases. Shijie Huaren Xiaohua Zazhi 2011; 19(5): 519-523
- URL: https://www.wjgnet.com/1009-3079/full/v19/i5/519.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i5.519
自身免疫性肝病的病因及发病机制仍未阐明. 该病多见于女性[1], 本实验检测雌激素受体α(estrogen receptor, ERα)在该病的表达情况来探讨是否ERα与该病发病机制存在关联. 转化生长因子(transforming growth-β1, TGF-β1)与肝纤维化密切相关, 本实验检测其在各组肝组织中表达情况来比较其是否有所不同并初步探讨其在自身免疫性肝病发病中的作用. 自身免疫性肝病包括自身免疫性肝炎(autoimmune hepatitis, AIH), 原发性胆汁性肝硬化(primary biliary cirrhosis, PBC), 原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)及重叠综合征(overlap syndrome, OS), 由于后两者发病率低, 本文主要比较AIH、PBC与CHB的组织学特征.
收集天津医科大学总医院病理科2007- 2009年的肝穿刺蜡块标本, 其中AIH 29例, 男4例, 女25例, 年龄35-74岁; PBC 18例, 男2例, 女16例, 年龄33-76岁; CHB 15例, 男11例, 女4例, 年龄16-62岁; 正常肝组织8例(非肝病患者尸检来源的肝组织)为对照组, 男5例, 女3例, 年龄38-53岁. 自身免疫性肝病的诊断参照1999年国际AIH小组(IAIHG)修正的AIH临床评分标准[2], 慢性乙型肝炎诊断按照2000年中华医学会传染病与寄生虫病分会及肝病学分会联合修订的慢性乙型肝炎诊断标准.
每例标本均经10%中性甲醛固定, 常规石蜡包埋. 4 μm连续切片分别进行HE染色和免疫组织化学染色(操作按照试剂盒说明进行). 兔抗TGF-β1多克隆抗体、兔抗ERα单克隆抗体及SP试剂盒均购自北京中山生物技术有限公司. 免疫组织化学结果判定, 选取5个高倍视野计数阳性细胞数取其平均值.
统计学处理 计量资料以mean±SD表示, 采用SPSS13.0软件进行组间资料的单因素方差分析及SNK法进行两两比较, 组内资料进行配对t检验, 并对分类变量资料进行χ2检验, P<0.05具有统计学意义.
AIH、PBC、CHB 3组中羽毛状变性发生率分别为3.45%、33.33%、6.67%, PBC组明显高于AIH组(P<0.05); 桥接坏死发生率分别为27.59%、50.00%、13.33%, PBC组明显高于乙肝组(P<0.05); 胆栓发生率分别为6.92%、44.44%、6.67%, PBC组明显高于AIH和CHB组(P<0.01, P<0.05); 胆管增生发生率分别为34.48%、61.11%、13.33%, PBC组明显高于AIH和CHB组(P<0.05, 表1).
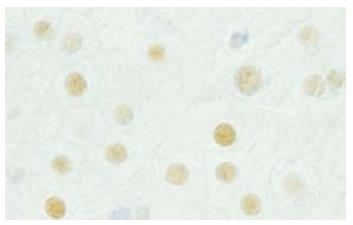
ERα表达在肝细胞核为棕黄色颗粒(图1), AIH组高于正常组(P<0.01), PBC组高于正常组(P<0.01, 表2).
AIH和PBC是两种不同的自身免疫性肝病, 已知AIH因抑制性T淋巴细胞的缺陷而导致免疫调节的紊乱和自身抗体的产生而致, PBC是自身抗体和T淋巴细胞介导的细胞毒效应所导致的胆管上皮破坏, 但其详细发病机制尚未阐明[3,4]. CHB是由乙型肝炎病毒引起的肝损伤. 不同类型肝炎的鉴别诊断是临床迫切需要解决的难题. 尽管已有多种组织学改变的表述, 但多为病变发展到相当程度时的表现, 且各种病变欠缺绝对特异性, 各型病变异同点在早、中期难以界定. 本文尝试从不同的组织学变化梳理诊断的思路. 已知羽毛状变性和胆管增生在PBC中常见, 本实验PBC组的羽毛状变性、桥接坏死、胆栓和胆管增生显著高于其他组. 花环结构和浆细胞浸润及界面炎是AIH的特征[5], 本研究也显示, 浆细胞浸润、界面炎、肝细胞嗜酸性变、纤维化及假小叶在AIH和PBC组较CHB组尽管没有显著性差异但呈增高趋势, 可能由于各组例数所限或病变程度差异难以反映出病变的全貌, 有必要收集更多的例数, 探究不同阶段病变的特性和动态性变化, 为明确诊断提供更有力的证据.
雌激素能够调节人和动物的免疫系统, 影响T淋巴细胞和B淋巴细胞的增殖和活性, 引起相应的免疫状态变化. 雌激素的作用部分或全部依赖于 ER, ER影响T淋巴细胞的分化成熟, 且是B淋巴细胞形成所必需. 已证实雌激素与自身免疫性疾病有关, 如雌激素缺乏所致T淋巴细胞功能缺陷是形成干燥综合征自身免疫性组织缺损的重要原因, 此外, 给遗传性易患自身免疫性疾病的小鼠注射雌激素, 可加速小鼠表达自身抗体, 最后发展成淋巴腺病、关节炎、免疫复合物性肾小球肾炎而死亡. 女性占系统性红斑狼疮绝大多数, 服用含雌激素避孕药的妇女常致病情恶化, 提示雌激素在促进自身免疫性反应和引起该病发生时起重要作用. 但雌激素与ER是否和自身免疫性肝病有关, 报道尚少. 有研究表明, 在女性PBC患者ERα基因多态性影响T淋巴细胞亚群的转换及细胞因子的表达[6]. Alvaro等[7]研究ERα表达在胆管细胞, 与本实验ERα在肝细胞表达不同, 但与其较正常肝组织中表达显著增高的结论一致, 提示ERα在自身免疫性肝病的发病中起到促进作用, 但详细机制有待深入探讨.
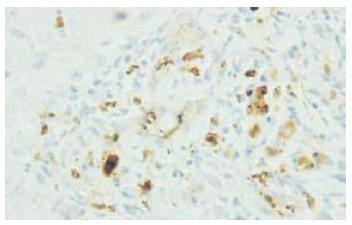
TGF-β是肝纤维化发生中的重要因子, 见于肝星状细胞(hepatic stellate cell, HSC), 还见于角质细胞(keratinocyte, KC)、肝窦内皮细胞和肝纤维化区域的炎细胞. 其还可由辅助性T淋巴细胞的另一个亚群-Th3细胞(也称为调节性T淋巴细胞)分泌[8]. 近年来发现TGF-β对细胞的生长、分化和免疫功能都有重要的调节作用, 是一类极强的免疫调节剂, 可抑制免疫活性细胞如T、B淋巴细胞、胸腺细胞、NK细胞、淋巴因子激活的杀伤细胞(LAK细胞)的增殖及细胞毒性T淋巴细胞(cytotoxic T lymphocyte)的产生, 调节细胞表型, 抑制淋巴细胞的分化, 抑制一些因子产生. TGF-β1可抑制自身免疫性疾病进展, 如类风湿性关节炎[9]和自身免疫性胰腺炎[10]. 相反, 对自身抗体起主要作用的重症肌无力症[11], TGF-β1可使其加重. 在免疫球蛋白E(immunoglobulin E)抗体引起的哮喘病患者中, TGF-β1可增加疾病的严重程度[12]. 有研究表明TGF-β1在自身免疫及肝纤维化方面发挥重要的作用, 但其在自身免疫性肝病中的作用研究不多, 有学者建议把敲出TGF-β1基因的小鼠作为PBC的模型[13], 可见TGF-β1在自身免疫性肝病的发病机制中起到了一定作用. 王国辉等[14]研究表明在大鼠胆管损伤狭窄模型中损伤狭窄组TGF-β1表达高于正常组, 本研究发现在汇管区内TGF-β1的表达PBC组高于其他3组, 而PBC主要是以胆管损伤为特点, 所以此结论与上述研究一致. 本研究还发现在PBC组汇管区的TGF-β1表达高于肝小叶内, 可能是因为汇管区的炎症较重、HSC增生显著并且常伴纤维化所致. 在正常组却相反, 肝小叶内表达高于汇管区, 可能因为正常肝组织汇管区内炎症轻微且没有纤维化, 所以大部分表达在肝小叶内. 另外还有学者研究其在PBC Ⅲ-Ⅳ期患者血清中的含量是降低的[15], 又有学者检测其在AIH患者血清中含量是增高的[16], 本研究只检测其在肝组织中的表达, 是否与血中其含量存在相关性还有待于进一步探讨.
雌激素、ER、TGF-β1与T淋巴细胞及B淋巴细胞之间的关联近年来受到关注, 雌激素减少导致TGF-β1的下降, 而TGF-β1的下降导致T淋巴细胞的数量和活性明显增加, 而T淋巴细胞活化后产生的肿瘤坏死因子α和白细胞介素等细胞因子有可能在肝细胞的损伤过程发挥重要作用. 其详细机制有待本课题组深入研究.
自身免疫性肝病的详细发病机制未明, 不同类型的自身免疫性肝病各自的组织学特征是明确诊断的重要依据. 有研究表明ERα在自身免疫性肝病中起重要作用, 而与其密切关联的TGF-β等细胞因子在肝细胞损伤过程中的作用日益受到关注.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院病理实验科
王国辉等研究表明, 在大鼠胆管损伤狭窄模型中损伤狭窄组TGF-β1表达高于正常组.
本文将组织学改变与ERα及TGF-β1表达差异作为探索思路, 阐明组织学特征与相应标记物的关系将为临床诊治开辟新的思路.
本文对自身免疫性肝病的治疗有一定的参考价值, 但可读性一般.
编辑: 李薇 电编:李薇
| 2. | Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL, Chapman RW, Cooksley WG, Czaja AJ, Desmet VJ. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol. 1999;31:929-938. [PubMed] [DOI] |
| 6. | Zhang Y, Chen WZ, Shi JM. [Effect of estrogen receptor alpha gene polymorphism on the variations of T lymphocyte subsets and its related cell factors in female patients with primary cholestasis cirrhosis]. Zhonghua Ganzangbing Zazhi. 2010;18:740-744. [PubMed] |
| 7. | Alvaro D, Invernizzi P, Onori P, Franchitto A, De Santis A, Crosignani A, Sferra R, Ginanni-Corradini S, Mancino MG, Maggioni M. Estrogen receptors in cholangiocytes and the progression of primary biliary cirrhosis. J Hepatol. 2004;41:905-912. [PubMed] [DOI] |
| 8. | Kitani A, Chua K, Nakamura K, Strober W. Activated self-MHC-reactive T cells have the cytokine phenotype of Th3/T regulatory cell 1 T cells. J Immunol. 2000;165:691-702. [PubMed] |
| 9. | Thorbecke GJ, Shah R, Leu CH, Kuruvilla AP, Hardison AM, Palladino MA. Involvement of endogenous tumor necrosis factor alpha and transforming growth factor beta during induction of collagen type II arthritis in mice. Proc Natl Acad Sci U S A. 1992;89:7375-7379. [PubMed] [DOI] |
| 10. | Peng Y, Laouar Y, Li MO, Green EA, Flavell RA. TGF-beta regulates in vivo expansion of Foxp3-expressing CD4+CD25+ regulatory T cells responsible for protection against diabetes. Proc Natl Acad Sci U S A. 2004;101:4572-4577. [PubMed] [DOI] |
| 11. | Shi FD, Bai XF, Xiao BG, van der Meide PH, Link H. Nasal administration of multiple antigens suppresses experimental autoimmune myasthenia gravis, encephalomyelitis and neuritis. J Neurol Sci. 1998;155:1-12. [PubMed] [DOI] |
| 12. | Duvernelle C, Freund V, Frossard N. Transforming growth factor-beta and its role in asthma. Pulm Pharmacol Ther. 2003;16:181-196. [PubMed] [DOI] |
| 13. | Kikuchi K, Tanaka A, Matsushita M, Kitazawa E, Hosoya N, Kawashima Y, Selmi C, Gershwin ME, Miyakawa H. Genetic polymorphisms of transforming growth factor beta-1 promoter and primary biliary cirrhosis in Japanese patients. Ann N Y Acad Sci. 2007;1110:15-22. [PubMed] [DOI] |
| 15. | Voumvouraki A, Koulentaki M, Tzardi M, Sfakianaki O, Manousou P, Notas G, Kouroumalis E. Increased ΤGF-β3 in primary biliary cirrhosis: an abnormality related to pathogenesis. World J Gastroenterol. 2010;16:5057-5064. [PubMed] [DOI] |
| 16. | Sakaguchi K, Kitano M, Nishimura M, Senoh T, Ohta T, Terao M, Shinji N, Koide N, Tsuji T. Serum level of transforming growth factor-beta1 (TGF-beta1) and the expression of TGF-beta receptor type II in peripheral blood mononuclear cells in patients with autoimmune hepatitis. Hepatogastroenterology. 2004;51:1780-1783. [PubMed] |