修回日期: 2011-01-19
接受日期: 2011-01-27
在线出版日期: 2011-02-18
目的: 探讨氧化苦参碱(OM)在重症急性胰腺炎(SAP)肠黏膜屏障损害中的作用及其机制.
方法: 采用L-精氨酸(1 750 mg/kg)腹腔注射制备SAP大鼠模型. 将80只Wistar大鼠随机分为Control组、OM对照组、SAP对照组、OM治疗组1、12、24、36、48 h 5个亚组, 每组10只. 分时取材, 测定血浆内毒素、D-乳酸, 用荧光定量PCR方法检测结肠黏膜组织跨膜蛋白Claudin-1 mRNA表达, 用Western blot检测结肠黏膜组织Claudin-1蛋白水平.
结果: Control组与OM对照组相比较, 提示OM干预对正常大鼠血浆内毒素含量、D-乳酸水平和结肠黏膜组织Claudin-1 mRNA、蛋白表达没有统计学的差异. SAP对照组与Control组相对比, 大鼠血浆内毒素含量、D-乳酸浓度均显著升高(0.61 EU/mL±0.01 EU/mL vs 0.05 EU/mL±0.02 EU/mL; 8.38 mg/L±0.38 mg/L vs 2.87 mg/L±0.50 mg/L, 均P<0.01), 结肠黏膜组织Claudin-1 mRNA、蛋白表达显著降低. 与SAP对照组比较, OM干预可显著上调结肠黏膜组织Claudin-1 mRNA、蛋白表达, 降低血浆内毒素、D-乳酸浓度(0.09 EU/mL±0.02 EU/mL vs 0.61 EU/mL±0.01 EU/mL; 2.94 mg/L±0.42 mg/L vs 8.38 mg/L±0.38 mg/L, 均P<0.01).
结论: SAP损伤导致血浆内毒素、D-乳酸浓度升高, 结肠黏膜组织Claudin-1 mRNA、蛋白表达降低, OM干预可明显减少血浆内毒素、D-乳酸的产生, 上调结肠黏膜组织Claudin-1表达, 改善肠黏膜屏障功能, 阻止细菌移位.
引文著录: 张志强, 王燕庆, 董明, 崔建春, 荣大庆, 董齐. 氧化苦参碱诱导跨膜蛋白Claudin-1表达在重症急性胰腺炎大鼠肠黏膜损害中的作用. 世界华人消化杂志 2011; 19(5): 510-514
Revised: January 19, 2011
Accepted: January 27, 2011
Published online: February 18, 2011
AIM: To investigate the effect of oxymatrine (OM) on intestinal mucosal barrier dysfunction in rats with severe acute pancreatitis (SAP) and to analyze possible mechanisms involved.
METHODS: A rat model of SAP was established by peritoneal injection of 175 mg/100 g L-arginine. Eighty healthy male Wistar rats were divided randomly into four groups: control group, OM control group, SAP control group, OM treatment group (1-, 12-, 24-, 36-, and 48-h subgroups). After treatment, plasma endotoxin and D-lactic acid levels were determined, the expression of claudin-1 mRNA in the tunica mucosa coli was detected by real-time polymerase chain reaction (real time-PCR), and the activity of claudin-1 was determined by Western blotting.
RESULTS: There were no significant differences in plasma levels of endotoxin and D-lactic acid and expression levels of claudin-1 mRNA and protein in the tunica mucosa coli between the control group and OM control group. Compared with the control group, plasma endotoxin and D-lactic acid levels were markedly increased, and the expression levels of claudin-1 mRNA and protein in the tunica mucosa coli were significantly decreased in the SAP control group (0.61 EU/mL ± 0.01 EU/mL vs 0.05 EU/mL ± 0.02 EU/mL; 8.38 mg/L ± 0.38 mg/L vs 2.87 mg/L ± 0.50 mg/L, both P < 0.01). Compared with the SAP control group, the expression levels of claudin-1 mRNA and protein in the tunica mucosa coli were significantly increased and plasma levels of endotoxin and D-lactic acid were markedly decreased in the OM treatment group (0.09 EU/mL ± 0.02 EU/mL vs 0.61 EU/mL ± 0.01 EU/mL; 2.94 mg/L ± 0.42 mg/L vs 8.38 mg/L ± 0.38 mg/L, both P < 0.01).
CONCLUSION: Plasma levels of endotoxin and D-lactic acid were markedly increased and expression levels of claudin-1 mRNA and protein in tunica mucosa coli were significantly decreased in SAP rats. OM intervention can markedly decrease plasma levels of endotoxin and D-lactic acid, increase claudin-1 mRNA and protein expression levels, and improve mucosal barrier dysfunction to prevent bacterial translocation in SAP rats.
- Citation: Zhang ZQ, Wang YQ, Dong M, Cui JC, Rong DQ, Dong Q. Oxymatrine induces the expression of transmembrane protein claudin-1 in the intestinal mucosa of rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2011; 19(5): 510-514
- URL: https://www.wjgnet.com/1009-3079/full/v19/i5/510.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i5.510
重症急性胰腺炎(severe acute pancreatitis, SAP)常涉及多器官衰竭、败血症, 是临床极其棘手的疾病之一. 如何有效地防治急性胰腺炎时肠黏膜屏障损伤, 肠黏膜通透性增强引起的细菌移位是目前还没有解决的难题.
肠黏膜上皮细胞间的紧密连接, 形成了机体防止肠道内细菌发生移位的机械屏障[1,2]. 最近报道, 在炎性肠病、肠道感染时, 由于紧密连接崩解导致肠黏膜屏障断裂破坏, 引起肠上皮细胞旁通透性增加[3-5]. 紧密连接包含众多蛋白复合体, 可以调节细胞旁的通透性, 其中跨膜蛋白Claudin-1最具代表性[6,7].
本研究通过检测结肠黏膜组织Claudin-1的动态变化, 探讨氧化苦参碱(oxymatrine, OM)对SAP肠道黏膜的保护作用及作用机制.
OM购自西安冠宇生物技术有限公司, L-精氨酸购自张家港市思普生化有限公司, D-乳酸检测试剂盒购自Megazyme, Rabbit Anti-CLDN1购自北京博奥森生物技术有限公司, 显色基质鲎试剂盒购自厦门市鲎试剂实验厂有限公司; 健康成年♂Wistar大鼠80只(体质量250-280 g)购自中国医科大学实验动物部; 电泳系统DYY-10C、凝胶成像系统WD-9413B型购自北京六一, PCR仪Life Express购自杭州BIOER, 紫外分光光度计NANO 2000、超微量分光光度计NANO DROP 2000购自美国Thermo, 酶标仪Elx-800购自美国BioTek.
将80只大鼠随机分为Control组(n = 10), OM对照组(n = 10), SAP对照组(n = 10), OM治疗组(n = 50), OM治疗组又分为建模治疗后1、12、24、36、48 h, 5个亚组(每亚组10只).
1.2.1 动物实验: 在室温20 ℃-28 ℃、相对湿度40%-70%的动物房内适应性喂养1 wk后开始实验, 实验前12 h起禁食, 不控制饮水. Control组: 10只大鼠分2次腹腔注射生理盐水(与L-精氨酸溶液等量、间隔1 h); 48 h后处死; OM对照组: 10只大鼠, 给予OM(50 mg/kg)直肠保留灌肠(灌肠后把大鼠吊起, 头向下, 治疗8 min, 每24 h 1次); 48 h后处死. SAP对照组: 10只大鼠分2次腹腔注射L-精氨酸溶液(各175 mg/100 g、间隔1 h)[8-10], 48 h后处死; OM治疗组: 分为建模治疗后1、12、24、36、48 h 5个亚组(每亚组10只), 50只大鼠分2次腹腔注射L-精氨酸溶液(各175 mg/100 g、间隔1 h), 第2次注射L-精氨酸后1 h开始给予OM(50 mg/kg)直肠保留灌肠治疗(灌肠后把大鼠吊起, 头向下, 治疗8 min, 每24 h 1次), 治疗后1、12、24、36, 48 h处死相应亚组大鼠; 上述各组处死后的大鼠, 取门静脉血及结肠黏膜组织固定保存.
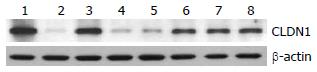
1.2.2 D-乳酸、血浆内毒素水平及Claudin-1 mRNA表达水平的检测: 取结肠黏膜组织2 cm×2 cm, 采用TIANGEN公司总RNA提取试剂盒提取样本总RNA, 利用紫外分光光度计对提取的RNA浓度进行测定, 利用TIANScript cDNA第一链合成试剂盒对上步实验所得的RNA样本进行反转录以得到对应的cDNA; 建立PCR反应体系(引物信息见表1), 设计PCR反应程序, 利用韩国BIONEER公司生产的ExicyclerTM 96荧光定量仪进行荧光定量分析, 应用2-ΔΔCT方法分析数据, 根据数据表得到各样本中基因的相对表达量. 用Western blot检测结肠黏膜组织Claudin-1水平: 取结肠黏膜组织3 cm×3 cm, 4 ℃匀浆, 加入蛋白提取液12 000 r/min离心10 min, 取上清液, 以考马斯亮蓝法进行蛋白定量. 再将提取的蛋白等量加样, 经SDS-PAGE电泳分离样品后, 转膜封闭, 然后加入一抗(Rabbit Anti-Occludin, 浓度1:500)37 ℃孵育1.5 h, 加入标记二抗(羊抗兔酶标二抗, 浓度1:10 000)37 ℃孵育40 min. ECL浸膜显色, 暗室中, 取胶片于暗盒中曝光, 将胶片于成像系统中拍照, 保存图片. 通过计算目的条带及内参条带的灰度比确定各个样本目的蛋白的表达量.
| 引物名称 | 序列(5'-3') | 引物长度(bp) | 退火温度(℃) |
| CLDN1-F | GTGCATGAGGTGCTTAGAAG | 20 | 57.8 |
| CLDN1-R | CACGTAGTCTTTCCCAGTAG | 20 | 57.8 |
统计学处理 所有数据均以mean±SD表示, 采用单因素方差分析, 经SPSS11.0统计分析软件对数据进行处理.
Control组与OM对照组对比提示OM干预对正常大鼠血浆内毒素含量和D-乳酸水平没有统计学的改变. SAP对照组与Control组对比提示大鼠血浆中内毒素含量、D-乳酸浓度均较Control组显著升高.
与SAP对照组比较OM治疗48 h后血浆内毒素含量、D-乳酸浓度显著降低(内毒素: 0.61 EU/mL±0.01 EU/mL vs 0.09 EU/mL±0.02 EU/mL, P<0.01; D-乳酸浓度: 8.38 mg/L±0.38 mg/L vs 2.94 mg/L±0.42 mg/L, P<0.01, 表2).
Control组与OM对照组对比提示OM对正常大鼠结肠黏膜Claudin-1 mRNA表达没有统计学的改变. SAP对照组与Control组对比提示大鼠结肠黏膜Claudin-1 mRNA表达较Control组显著降低.
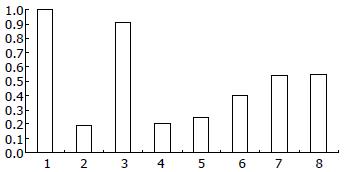
与SAP对照组比较OM治疗12 h后可显著提高结肠黏膜组织Claudin-1 mRNA表达, 并依时间顺序逐步增强(图1).
Control组与OM对照组对比提示OM对正常大鼠结肠黏膜Claudin-1蛋白表达没有统计学的改变. SAP对照组与Control组对比提示大鼠结肠黏膜Claudin-1蛋白表达较Control组显著降低.
与SAP对照组比较OM治疗后1、12、24 h结肠黏膜组织Claudin-1蛋白表达逐步增强, 之后达到均衡状态(图2).
SAP发病凶险, 并发症多, 近年来其救治成功率有所提高, 但病死率仍为12%-15%. SAP患者第一死亡高峰是在发病1 wk内, 原因主要是全身炎症反应综合征导致的多器官衰竭; 第二死亡高峰是在患病1 wk后, 由于继发感染引发败血症所致. SAP的继发感染主要因素是结肠内常驻细菌移位[11,12], 统计资料显示继发感染导致患者死亡占SAP总死亡率的80%[13].
肠道黏膜屏障由机械屏障、免疫屏障、化学屏障、生物屏障组成, SAP时上述4种屏障均会受到不同程度地损伤. 肠道黏膜机械屏障是肠黏膜4种屏障最重要的一道屏障, 肠黏膜上皮细胞层的完整性及上皮细胞间的紧密连接, 形成了机体防止肠道内细菌发生移位的机械屏障[1,2]. 正常情况下肠上皮细胞旁间隙是由蛋白复合体封闭, 而由蛋白复合体构成的紧密连接位于细胞侧膜的表层近顶端. 最近报道, 在炎性肠病、肠道感染时, 由于紧密连接崩解导致肠黏膜屏障断裂破坏, 引起肠上皮细胞旁通透性增加[3-5]. 紧密连接包含众多蛋白复合体, 其主要有跨膜蛋白Occludin、Claudins、连接黏附分子(junctional adhesion molucule, JAM)和胞质附着蛋白Zos、AF6、7H6等蛋白紧密连接所组成[14,15]. Claudin-1最具代表性, 这些蛋白复合体被认为可以调节细胞旁的通透性[6,7].
OM是从我国传统中药苦豆子中提取的一种生物碱, 具有抗乙型和丙型肝炎病毒、改善肝细胞功能、抗肝纤维化、免疫调节、抗炎、抗肿瘤、抗过敏反应、抗心律失常、强心、降压、平喘等多种生物活性[16-19], 目前临床上主要用于慢性乙型和丙型肝炎的治疗. 近年来, 有研究显示静脉应用OM联合应用善得定在SAP治疗上有协同作用, 疗效优于单一的西药治疗[20]; OM还能够抑制中性粒细胞趋化因子和单核细胞趋化蛋白在SAP大鼠胰腺组织中的表达, 对SAP有一定的治疗作用[21,22].
本研究结果显示, OM治疗对正常结肠黏膜无损伤, 而能阻碍SAP诱发的血浆内毒素、D-乳酸浓度升高, 上调结肠黏膜组织Claudin-1 mRNA、蛋白表达.
SAP对照组与Control组对比大鼠血浆内毒素含量、D-乳酸浓度均较Control组显著升高, 提示存在肠黏膜屏障损伤, 肠黏膜通透性增加; 结肠黏膜组织Claudin-1 mRNA、蛋白表达显著降低, 提示结肠组织黏膜组织损伤, 紧密连接遭到破坏. 给予OM灌肠治疗后, OM治疗组5个亚组血浆内毒素含量、D-乳酸浓度逐步降低, 结肠黏膜组织Claudin-1基因和蛋白表达逐步提高. 这说明OM有助于肠黏膜屏障损伤的修复, 改善肠黏膜通透性, 抑制肠道细菌移位.
重症急性胰腺炎继发感染导致患者死亡占重症急性胰腺炎总死亡率的80%, 继发感染的主要因素是结肠内常驻细菌移位, 但细菌移位的途径及发生因素还不十分清楚, 通常认为是由于肠黏膜屏障损伤, 肠黏膜通透性增强引起. 如何有效地保护肠道黏膜屏障, 抑制肠道细菌移位是目前还没有解决的难题.
孙诚谊, 教授, 贵阳医学院附属医院院长办
通过研究氧化苦参碱对重症急性胰腺炎动物模型进行灌肠干预, 解析了氧化苦参碱阻止细菌移位的作用机制, 揭示了氧化苦参碱通过靶向调控蛋白Claudin-1限制大肠上皮细胞旁间隙通透性的机制. 为预防和治疗重症急性胰腺炎继发肠黏膜屏障损害提供了新途径.
SAP损伤导致血浆内毒素、D-乳酸浓度升高, 结肠黏膜组织Claudin-1 mRNA、蛋白表达降低, OM干预可明显减少血浆内毒素、D-乳酸的产生, 上调结肠黏膜组织Claudin-1表达, 改善肠黏膜屏障功能, 阻止细菌移位.
本文新颖性较好, 具有一定的科学价值.
编辑: 李薇 电编:何基才
| 3. | Ukena SN, Singh A, Dringenberg U, Engelhardt R, Seidler U, Hansen W, Bleich A, Bruder D, Franzke A, Rogler G. Probiotic Escherichia coli Nissle 1917 inhibits leaky gut by enhancing mucosal integrity. PLoS One. 2007;2:e1308. [PubMed] [DOI] |
| 4. | Rees LE, Cogan TA, Dodson AL, Birchall MA, Bailey M, Humphrey TJ. Campylobacter and IFNgamma interact to cause a rapid loss of epithelial barrier integrity. Inflamm Bowel Dis. 2008;14:303-309. [PubMed] [DOI] |
| 5. | Oshima T, Sasaki M, Kataoka H, Miwa H, Takeuchi T, Joh T. Wip1 protects hydrogen peroxide-induced colonic epithelial barrier dysfunction. Cell Mol Life Sci. 2007;64:3139-3147. [PubMed] [DOI] |
| 6. | Bücker R, Troeger H, Kleer J, Fromm M, Schulzke JD. Arcobacter butzleri induces barrier dysfunction in intestinal HT-29/B6 cells. J Infect Dis. 2009;200:756-764. [PubMed] [DOI] |
| 7. | Li Q, Zhang Q, Wang C, Liu X, Li N, Li J. Disruption of tight junctions during polymicrobial sepsis in vivo. J Pathol. 2009;218:210-221. [PubMed] [DOI] |
| 8. | Dawra R, Sharif R, Phillips P, Dudeja V, Dhaulakhandi D, Saluja AK. Development of a new mouse model of acute pancreatitis induced by administration of L-arginine. Am J Physiol Gastrointest Liver Physiol. 2007;292:G1009-G1018. [PubMed] [DOI] |
| 9. | 满 晓华, 赵 航, 徐 克群, 龚 燕芳, 高 军, 杜 奕奇, 许 爱芳, 李 兆申. L-精氨酸诱导实验性慢性胰腺炎大鼠模型的可行性分析. 中华胰腺病杂志. 2009;9:109-111. |
| 11. | Sakorafas GH, Lappas C, Mastoraki A, Delis SG, Safioleas M. Current trends in the management of infected necrotizing pancreatitis. Infect Disord Drug Targets. 2010;10:9-14. [PubMed] |
| 12. | Balzan S, de Almeida Quadros C, de Cleva R, Zilberstein B, Cecconello I. Bacterial translocation: overview of mechanisms and clinical impact. J Gastroenterol Hepatol. 2007;22:464-471. [PubMed] [DOI] |
| 13. | Al Mofleh IA. Severe acute pancreatitis: pathogenetic aspects and prognostic factors. World J Gastroenterol. 2008;14:675-684. [PubMed] [DOI] |
| 14. | Qin H, Zhang Z, Hang X, Jiang Y. L. plantarum prevents enteroinvasive Escherichia coli-induced tight junction proteins changes in intestinal epithelial cells. BMC Microbiol. 2009;9:63. [PubMed] [DOI] |
| 15. | Severson EA, Kwon M, Hilgarth RS, Parkos CA, Nusrat A. Glycogen Synthase Kinase 3 (GSK-3) influences epithelial barrier function by regulating occludin, claudin-1 and E-cadherin expression. Biochem Biophys Res Commun. 2010;397:592-597. [PubMed] [DOI] |