修回日期: 2011-01-09
接受日期: 2011-01-21
在线出版日期: 2011-02-18
目的: 探讨Sonic hedgehog信号通路中Smo和Gli1蛋白在食管鳞状细胞癌(ESCC)组织中的表达及临床意义.
方法: 采用免疫组织化学二步法分别检测60例ESCC、45例癌旁异型增生及60例食管正常黏膜组织中Smo和Gli1蛋白的表达, 并分析两者的表达水平与临床病理因素的关系.
结果: Smo和Gli1蛋白在ESCC组织中表达强度显著高于癌旁异型增生和正常食管黏膜组织(53/60 vs 22/45, 9/60; 54/60 vs 18/45, 16/60, 均P<0.05), 而Smo和Gli1蛋白在癌旁异型增生及食管正常黏膜组中的表达差异无统计学意义. Smo和Gli1蛋白在ESCC组织中的表达强度与肿瘤的浸润深度和淋巴结转移有关(均P<0.05). 相关分析显示Smo和Gli1蛋白在ESCC组织中的表达呈正相关(r = 0.452, P<0.01).
结论: Sonic hedgehog信号通路异常激活与ESCC的发生发展密切相关, 在食管鳞状细胞癌中Sonic hedgehog信号通路的激活可能是高表达的Smo蛋白通过上调其下游的转录因子Gli1蛋白来发挥作用的, 联合检查两者对ESCC患者预后的判断有一定的临床意义.
引文著录: 孙波, 张蕾, 李颖霞, 符仲标, 卲惠杰, 温洪涛. Smo和Gli1蛋白在食管鳞状细胞癌组织中的表达及临床意义. 世界华人消化杂志 2011; 19(5): 483-487
Revised: January 9, 2011
Accepted: January 21, 2011
Published online: February 18, 2011
AIM: To investigate the expression of Smo and Gli1 proteins in esophageal squamous cell carcinoma (ESCC).
METHODS: The protein expression of Smo and Gli1 was detected by immunohistochemistry in 60 ESCC specimens, 45 tumor-adjacent atypical hyperplastic tissue specimens, and 60 normal esophageal mucosal specimens.
RESULTS: The expression of Smo and Gli1 protein was significantly higher in ESCC than in atypical hyperplastic tissue and normal esophageal mucosal tissue (53/60 vs 22/45, 19/60; 54/60 vs 18/45, 16/60; all P < 0.05). There was no significant difference in the expression of the two proteins between atypical hyperplasia tissue and normal esophageal mucosal tissue (both P > 0.05). Overexpression of Smo and Gli1 proteins was related with lymph node metastasis and the depth of tumor invasion in ESSC (both P < 0.05). The expression of Smo protein was significantly correlated with that of Gli1 protein in ESCC (r = 0.452, P < 0.01).
CONCLUSION: Abnormal sonic hedgehog signaling may play an important role in the development and evolution of ESCC, and this abnormality is associated with Smo protein overexpression, which can upregulate the expression of Gli1 protein, a downstream transcription factor in the sonic hedgehog signal transduction pathway. Combined detection of Smo and Gli1 proteins may be helpful to evaluate the prognosis of ESCC.
- Citation: Sun B, Zhang L, Li YX, Fu ZB, Shao HJ, Wen HT. Clinicopathological significance of expression of Smo and Gli1 in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(5): 483-487
- URL: https://www.wjgnet.com/1009-3079/full/v19/i5/483.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i5.483
Sonic hedgehog信号通路是人类胚胎发育过程中调控细胞增殖和组织分化的重要信号通路[1,2]. 大量研究表明该信号通路在人类多种肿瘤中异常激活, 并对这些肿瘤的生长起着促进作用[3-6]. Smo和Gli1蛋白是该信号通路中的两个关键蛋白, 目前有关联合检测这两个蛋白在ESCC中的表达及相关性研究鲜见报道. 本文采用免疫组织化学法检测Smo和Gli1蛋白在食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)、癌旁异型增生及食管正常黏膜组织中的表达水平, 探讨Sonic hedgehog信号通路中Smo和Gli1蛋白与ESCC发生发展的关系.
60例新鲜ESCC标本均收集于食管癌高发区河南省安阳市肿瘤医院2009-01/2009-11手术切除的标本, 其中男36例, 女24例; 患者年龄35-78岁, 其中≥60岁者33例, <60岁者27例, 平均年龄为60.6±9.5岁. 所有患者术前均未行放疗、化疗及免疫治疗. 所有标本分别在癌灶、癌旁3 cm以内及远端正常食管黏膜组织处取材, 经10%中性缓冲甲醛固定, 常规脱水, 石蜡包埋切片, 分别用于HE染色和免疫组织化学染色. 全部标本均经组织学证实: 癌灶组织均为ESCC, 其中组织学分级Ⅰ级11例, Ⅱ级25例, Ⅲ级24例; 浅层浸润组11例(黏膜固有层或黏膜下层), 深层浸润组49例(肌层或外膜层); 有淋巴结转移22例, 无淋巴结转移38例. 60例癌旁组织中45例组织学证实异型增生, 60例远端组织均证实为食管正常黏膜组织. 兔抗人Smo多克隆抗体购于Abcam公司. 兔抗人Gli1多克隆抗体购于北京博奥森、PV9000免疫组织化学试剂盒购自北京中杉金桥公司.
免疫组织化学PV9000二步法严格按说明书进行, Smo抗体稀释度为1:100, Gli1抗体稀释度为1:200, DAB显色, 苏木素复染, 透明封片. 用已知阳性的胰腺癌切片作为阳性对照, 以PBS代替一抗作阴性对照. 参考Yoshikawa等[7]判断方法并做适当修改, 按照细胞膜和(或)胞质内及细胞核和(或)胞质内出现黄色或棕黄色颗粒的细胞视为阳性细胞, 随机选取5个高倍视野, 计数阳性细胞数的百分比: <5%为(-), ≥5%且<35%为(+), ≥35%且<65%为(++), ≥65%为(+++).
统计学处理 采用SPSS16.0统计软件进行数据分析, 表达强度比较用等级资料非参数秩和检验, 相关性采用Spearman等级相关分析, 检验水准α = 0.05.
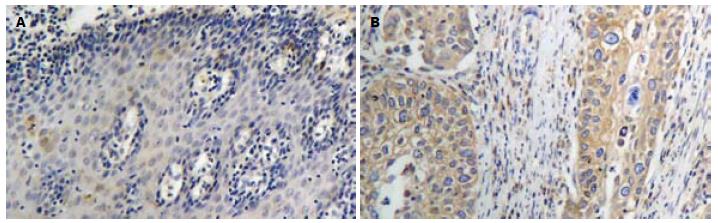
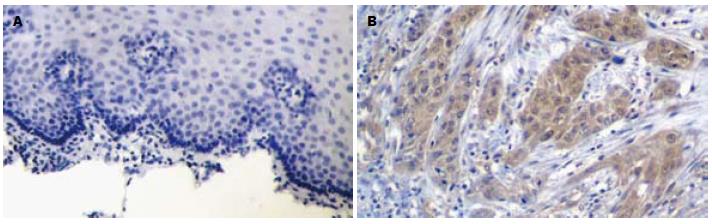
Smo蛋白在胞膜及胞质均可见表达, 以胞膜为主(图1). Smo蛋白在ESCC、癌旁异型增生及正常食管黏膜组织中的表达强度逐级降低, 在ESCC组织中的表达强度显著高于异型增生和正常黏膜组织(P<0.01, 表1), 而其在异型增生和正常组织中的表达差异无统计学意义(P>0.05, 表1). Smo蛋白在ESCC中的表达强度与患者的性别、年龄、肿瘤分化程度无关(P>0.05), 而与肿瘤的浸润深度及淋巴结转移有关(P<0.05, 表2).
| 因素 | n | Smo(n) | Mean mark | P值 | Gli1(n) | Mean mark | P值 | ||||||
| - | + | ++ | +++ | - | + | ++ | +++ | ||||||
| 性别 | |||||||||||||
| 男 | 36 | 4 | 9 | 11 | 12 | 32.81 | 4 | 7 | 12 | 13 | 32.99 | ||
| 女 | 24 | 3 | 8 | 10 | 3 | 27.04 | 0.191 | 2 | 9 | 9 | 4 | 26.77 | 0.158 |
| 年龄(岁) | |||||||||||||
| ≥60 | 33 | 5 | 10 | 9 | 9 | 29.45 | 3 | 9 | 11 | 10 | 31.03 | ||
| <60 | 27 | 2 | 7 | 12 | 6 | 31.78 | 0.286 | 3 | 7 | 10 | 7 | 29.85 | 0.786 |
| 分化程度 | |||||||||||||
| Ⅰ | 11 | 1 | 3 | 6 | 1 | 28.64 | 1 | 3 | 1 | 6 | 35.64 | ||
| Ⅱ | 25 | 3 | 8 | 9 | 5 | 29.80 | 3 | 4 | 9 | 9 | 33.34 | ||
| Ⅲ | 24 | 3 | 6 | 6 | 9 | 33.12 | 0.611 | 2 | 9 | 11 | 2 | 25.19 | 0.123 |
| 浸润深度 | |||||||||||||
| 浅层 | 11 | 4 | 4 | 1 | 2 | 20.09 | 4 | 4 | 2 | 1 | 17.27 | ||
| 深层 | 49 | 3 | 13 | 20 | 13 | 32.84 | 0.022 | 2 | 12 | 19 | 16 | 33.47 | 0.004 |
| 淋巴结转移 | |||||||||||||
| 有 | 22 | 0 | 6 | 8 | 8 | 36.36 | 0 | 4 | 9 | 9 | 37.41 | ||
| 无 | 38 | 7 | 11 | 13 | 7 | 27.11 | 0.039 | 6 | 12 | 12 | 8 | 26.50 | 0.015 |
Gli1蛋白主要在胞核及胞质中表达(图2). Gli1蛋白在ESCC、癌旁异型增生及食管正常黏膜组织中的表达强度逐级降低, 其在ESCC组织中的表达强度显著均高于异型增生和正常黏膜组织(均P<0.01, 表1), 而其在异型增生和正常黏膜组织中的表达差异无统计学意义(P>0.05, 表1). Gli1蛋白在ESCC中的表达与患者的性别、年龄、肿瘤分化程度无关(P>0.05), 而与肿瘤的浸润深度及淋巴结转移有关(P<0.05, 表2).
Spearman等级相关分析显示: Smo和Gli1蛋白在ESCC组织表达呈正相关(r = 0.432, P<0.05).
食管癌是一种常见的消化系恶性的肿瘤, 严重危害人类的身心健康. 至今食管癌的确切发病机制尚未清楚, 但可以肯定其形成是一个多因素, 多步骤的过程. 他涉及到一系列原癌基因异常的激活以及抑癌基因突变导致的失活, 进而引起一些信号传导通路的异常. 因此找到参与食管癌发生发展的主要因子或信号通路, 对食管癌的防治及预后将具有重要的意义. Sonic hedgehog信号通路是一个进化保守的信号通路, 从低等动物(果蝇)到高等动物(人类)均普遍存在. 该信号通路主要由3部分组成: Hh配体蛋白(Shh、Ihh、Dhh)、跨膜受体蛋白(PTCH, Smo)、下游转录因子(Gli1、Gli2、Gli3)[8,9]. 其中Smo蛋白是sonic hedgehog信号通路中的信息转换器, 他能够把细胞外的Shh信号转换成细胞内的Gli1信号[8,10], 对Sonic hedgehog信号通路具有激活作用. 而Gli1蛋白是Sonic hedgehog信号通路中的转录因子, 可将SHh信号传导至核内后对靶基因起转录激活作用[11]. 研究认为Sonic hedgehog信号通路在胚胎的正常发育中起着重要作用, 并且在胚胎发育成熟后该信号通路就处于失活状态, 但近来研究发现在人类多种肿瘤中Sonic hedgehog信号通路存在异常激活[12-15]. 目前认为Sonic hedgehog信号通路激活方式有两种: 一是配体依赖性激活方式, 即因为Shh配体的过度表达而引起此信号通路中目的基因的转录, 导致肿瘤的发生和发展; 二是配体非依赖性激活方式: 即PTCH、Smo及Cli等基因发生功能获得性突变, 从而导致Sonic hedgehog信号通路的异常激活, 促进肿瘤的发生和发展[16-19]. 在基底细胞癌、髓母细胞瘤等恶性肿瘤的研究中发现PTCH基因的突变是Sonic hedgehog通路激活和肿瘤发生的关键[18-20]. 在胃癌、结直肠和胃肠间质瘤等消化系肿瘤的研究中发现PTCH1、Gli1及Smo基因有不同程度的表达上调[21-23]. Ma等[24]对食管癌中的研究也可见PTCH1和Gli1基因在癌组织中表达上调, 并且作者还发现用Smo拮抗剂环杷明(cyclopamine)处理后的食管癌细胞生长减慢, 凋亡增加. 还有学者把Clil转染至在正常胰腺导管上皮细胞株后, 可异常激活Sonic Hedgehog信号通路下游基因的转录, 促进细胞的癌变[25]. 这些都说明了Sonic hedgehog通路激活在肿瘤中是一种普遍现象, 并且与PTCH、Smo和Gli1异常表达有关. 本实验结果发现Smo和Gli1蛋白在食管正常黏膜及异型增生组织中不表达或弱表达, 但在ESCC组织中的表达强度明显增高, 均显著高于癌旁异型增生及正常食管黏膜膜组织, 说明了Smo和Gli1蛋白与ESCC的发生密切相关. 支持了Sonic hedgehog信号通路在ESCC中呈活化状态这一观点[26]. 与Ma等[24]研究结果基本一致. 在本研究中我们还发现癌旁异型增生和食管正常黏膜组织中Smo和Gli1蛋白的表达差异无统计学意义. 可见Smo和Gli1蛋白虽然参与了ESCC发生, 但Smo和Gli1蛋白高表达并不是食管癌变的早期事件, 而他们在促进食管异型增生向ESCC发展这一环节可能起着重要的作用. 但有报道, 在食管癌前病变的Barrett's食管组织中Sonic hedgehog通路存在异常激活, 认为该信号通路激活是食管癌发生的早期事件[27], 与本研究结果不一致, 这也许是鳞癌与腺癌之间不同, 这有待进一步探讨. 此外本研究还发现Smo和Gli1蛋白在ESCC中的表达均与肿瘤的浸润深度和淋巴结转移密切相关, 随着肿瘤的浸润深度和淋巴结转移的增加而增加, 与已有的研究结果基本一致[28]. 提示了Smo和Gli1蛋白在ESCC的浸润及转移中可能发挥着重要的作用. 也暗示了我们Smo和Gli1蛋白高表达的肿瘤可能具有更强的侵袭能力, 而严重影响患者的预后[7,28]. 使得通过联合检查Smo和Gli1蛋白来判断ESCC患者的预后有了依据.
另外我们还发现在ESCC组织中Smo和Gli1蛋白表达呈正相关(r = 0.432, P<0.05). 推测高表达的Smo蛋白可能通过上调其下游转录因子Gli1蛋白的表达, 而引起Sonic hedgehog信号通路异常激活, 共同促进ESCC的发生及发展.
Sonic hedgehog信号通路在胚胎时期组织分化发育调节中起巨大作用, 但近来越来越多的研究显示该信号通路在人类多种肿瘤呈异常激活, 并且该信号关键蛋白阻滞剂能显著减慢体外肿瘤细胞的生长.
欧希龙, 副教授, 东南大学中大医院消化科
阿片类药物依赖戒断机制及治疗的研究一直是医学界关注的热点. 海洛因是目前非法滥用范围最广、危害程度最为严重的阿片类物质, 海洛因依赖治疗中最难解决的问题是脱毒后的复吸. 美沙酮维持治疗已成为全球阿片类毒品依赖维持疗法中应用最为广泛的方法之一.
本文首次采用免疫组织化学法联合检查Smo和Gli1蛋白在食管鳞状细胞癌组织、癌旁异型增生组织及食管正常黏膜组织中的表达情况, 并分析他们两与食管鳞状细胞癌发生发展的关系.
Smo和Gli1蛋白的表达可能与食管鳞状细胞癌发生发展有关, 联合检查两蛋白可用于评价食管鳞状细胞的预后、指导治疗.
本文创新性较好, 设计合理, 具有一定的临床参考意义.
编辑: 李薇 电编:何基才
| 1. | Pasca di Magliano M, Hebrok M. Hedgehog signalling in cancer formation and maintenance. Nat Rev Cancer. 2003;3:903-911. [PubMed] [DOI] |
| 2. | 李 忠武, 刘 鲁英, 田 萌萌, 游 伟程, 李 吉友. 蒙古沙鼠幽门螺杆菌相关性胃炎Sonic hedgehog基因、IL-1β及TNF-α的表达. 世界华人消化杂志. 2007;15:7-13. [DOI] |
| 3. | Evangelista M, Tian H, de Sauvage FJ. The hedgehog signaling pathway in cancer. Clin Cancer Res. 2006;12:5924-5928. [PubMed] [DOI] |
| 4. | Kasper M, Regl G, Frischauf AM, Aberger F. GLI transcription factors: mediators of oncogenic Hedgehog signalling. Eur J Cancer. 2006;42:437-445. [PubMed] [DOI] |
| 5. | Feng YZ, Shiozawa T, Miyamoto T, Kashima H, Kurai M, Suzuki A, Ying-Song J, Konishi I. Overexpression of hedgehog signaling molecules and its involvement in the proliferation of endometrial carcinoma cells. Clin Cancer Res. 2007;13:1389-1398. [PubMed] [DOI] |
| 6. | Stecca B, Ruiz i Altaba A. The therapeutic potential of modulators of the Hedgehog-Gli signaling pathway. J Biol. 2002;1:9. [PubMed] [DOI] |
| 7. | Yoshikawa R, Nakano Y, Tao L, Koishi K, Matsumoto T, Sasako M, Tsujimura T, Hashimoto-Tamaoki T, Fujiwara Y. Hedgehog signal activation in oesophageal cancer patients undergoing neoadjuvant chemoradiotherapy. Br J Cancer. 2008;98:1670-1674. [PubMed] [DOI] |
| 8. | Ruiz i Altaba A, Sánchez P, Dahmane N. Gli and hedgehog in cancer: tumours, embryos and stem cells. Nat Rev Cancer. 2002;2:361-372. [PubMed] [DOI] |
| 9. | Sengupta A, Banerjee D, Chandra S, Banerji SK, Ghosh R, Roy R, Banerjee S. Deregulation and cross talk among Sonic hedgehog, Wnt, Hox and Notch signaling in chronic myeloid leukemia progression. Leukemia. 2007;21:949-955. [PubMed] |
| 10. | Murone M, Luoh SM, Stone D, Li W, Gurney A, Armanini M, Grey C, Rosenthal A, de Sauvage FJ. Gli regulation by the opposing activities of fused and suppressor of fused. Nat Cell Biol. 2000;2:310-312. [PubMed] [DOI] |
| 11. | Berman DM, Karhadkar SS, Hallahan AR, Pritchard JI, Eberhart CG, Watkins DN, Chen JK, Cooper MK, Taipale J, Olson JM. Medulloblastoma growth inhibition by hedgehog pathway blockade. Science. 2002;297:1559-1561. [PubMed] [DOI] |
| 12. | Beachy PA, Karhadkar SS, Berman DM. Tissue repair and stem cell renewal in carcinogenesis. Nature. 2004;432:324-331. [PubMed] [DOI] |
| 13. | Karhadkar SS, Bova GS, Abdallah N, Dhara S, Gardner D, Maitra A, Isaacs JT, Berman DM, Beachy PA. Hedgehog signalling in prostate regeneration, neoplasia and metastasis. Nature. 2004;431:707-712. [PubMed] [DOI] |
| 16. | 戎 祯祥, 方 驰华, 朱 达坚, 刘 胜军. Sonic hedgehog信号通路Smo蛋白及其下游转录因子Gli1蛋白在胃癌组织中的表达及其意义. 南方医科大学学报. 2006;26:1728-1730. |
| 17. | Agren M, Kogerman P, Kleman MI, Wessling M, Toftgård R. Expression of the PTCH1 tumor suppressor gene is regulated by alternative promoters and a single functional Gli-binding site. Gene. 2004;330:101-114. [PubMed] [DOI] |
| 18. | Berman DM, Karhadkar SS, Maitra A, Montes De Oca R, Gerstenblith MR, Briggs K, Parker AR, Shimada Y, Eshleman JR, Watkins DN. Widespread requirement for Hedgehog ligand stimulation in growth of digestive tract tumours. Nature. 2003;425:846-851. [PubMed] [DOI] |
| 19. | Rubin LL, de Sauvage FJ. Targeting the Hedgehog pathway in cancer. Nat Rev Drug Discov. 2006;5:1026-1033. [PubMed] [DOI] |
| 20. | Daya-Grosjean L, Couvé-Privat S. Sonic hedgehog signaling in basal cell carcinomas. Cancer Lett. 2005;225:181-192. [PubMed] [DOI] |
| 21. | Ma X, Chen K, Huang S, Zhang X, Adegboyega PA, Evers BM, Zhang H, Xie J. Frequent activation of the hedgehog pathway in advanced gastric adenocarcinomas. Carcinogenesis. 2005;26:1698-1705. [PubMed] [DOI] |
| 22. | Bian YH, Huang SH, Yang L, Ma XL, Xie JW, Zhang HW. Sonic hedgehog-Gli1 pathway in colorectal adenocarcinomas. World J Gastroenterol. 2007;13:1659-1665. [PubMed] |
| 23. | Yoshizaki A, Nakayama T, Naito S, Wen CY, Sekine I. Expressions of sonic hedgehog, patched, smoothened and Gli-1 in human intestinal stromal tumors and their correlation with prognosis. World J Gastroenterol. 2006;12:5687-5691. [PubMed] |
| 24. | Ma X, Sheng T, Zhang Y, Zhang X, He J, Huang S, Chen K, Sultz J, Adegboyega PA, Zhang H. Hedgehog signaling is activated in subsets of esophageal cancers. Int J Cancer. 2006;118:139-148. [PubMed] [DOI] |
| 26. | Sims-Mourtada J, Izzo JG, Apisarnthanarax S, Wu TT, Malhotra U, Luthra R, Liao Z, Komaki R, van der Kogel A, Ajani J. Hedgehog: an attribute to tumor regrowth after chemoradiotherapy and a target to improve radiation response. Clin Cancer Res. 2006;12:6565-6572. [PubMed] [DOI] |
| 27. | Wang DH, Clemons NJ, Miyashita T, Dupuy AJ, Zhang W, Szczepny A, Corcoran-Schwartz IM, Wilburn DL, Montgomery EA, Wang JS. Aberrant epithelial-mesenchymal Hedgehog signaling characterizes Barrett's metaplasia. Gastroenterology. 2010;138:1810-1822. [PubMed] [DOI] |