修回日期: 2011-01-04
接受日期: 2011-01-11
在线出版日期: 2011-02-18
目的: 探讨海洛因戒断、脱毒及复吸期间大鼠直肠内5-羟色胺(5-HT)、P物质(SP)表达的改变.
方法: 正常♂SD大鼠, 随机分为实验组、盐水对照组和正常对照组, 实验组分别建立海洛因依赖戒断模型, 美沙酮脱毒治疗模型和海洛因复吸模型. 取各组大鼠直肠组织, 采用免疫组织化学SABC法及图像分析方法进行研究.
结果: 与正常对照组及盐水对照组比较, 实验组大鼠直肠内的5-HT、SP细胞免疫染色加深; 图像分析5-HT、SP阳性细胞的细胞计数增多(5-HT: 10 d: 5.09±3.39 vs 3.16±2.05, 2.80±2.13; 24 d: 5.05±3.04 vs 3.16±2.05, 2.81±1.85; SP: 10 d: 2.55±1.35 vs 1.29±0.86, 1.37±0.93; 24 d: 2.57±1.27 vs 1.29±0.86, 1.39±0.79, 均P<0.05), 平均灰度值低于正常及盐水对照组(F = 36.642, 4.583, P<0.05). 实验组与正常及盐水对照组比较, 5-HT、SP阳性细胞免疫染色、细胞计数及平均灰度值变化差异均无统计学意义(均P>0.05).
结论: 5-HT、SP在大鼠直肠黏膜表达的改变, 提示二者参与海洛因戒断、脱毒和复吸期间消化系功能恢复的调节过程.
引文著录: 洪艳, 梁文妹, 夏白娟, 胡赟, 韩晶, 李一欣, 谢莉. 5-HT、SP在海洛因戒断、脱毒、复吸大鼠直肠组织中的表达. 世界华人消化杂志 2011; 19(5): 477-482
Revised: January 4, 2011
Accepted: January 11, 2011
Published online: February 18, 2011
AIM: To investigate the expression of 5-hydroxytryptamine (5-HT) and substance P (SP) in the rectum of rats during heroin abstinence, detoxication, and relapse.
METHODS: Male Sprague-Dawley rats were divided into normal control group (NCG), saline control group (SCG), and experiment group (EG). The EG group was further divided into heroin abstinence group (HAG), methadone detoxication group (MDG), and heroin relapse group (HRG). Rectum tissue samples were taken from each group to perform immunohistochemistry to detect the expression of 5-HT and SP.
RESULTS: Compared with the NCG and SCG groups, the immunostaining density of 5-HT- and SP-positive cells was greater, the numbers of 5-HT- and SP-positive cells increased (5-HT: 10 d: 5.09 ± 3.39 vs 3.16 ± 2.05, 2.80 ± 2.13; 24 d: 5.05 ± 3.04 vs 3.16 ± 2.05, 2.81 ± 1.85; SP: 10 d: 2.55 ± 1.35 vs 1.29 ± 0.86, 1.37 ± 0.93; 24 d: 2.57 ± 1.27 vs 1.29 ± 0.86, 1.39 ± 0.79, all P < 0.05), and the mean grey degree of 5-HT- and SP-positive cells decreased (F = 36.642, 4.583, P < 0.05) in the HAG and HRG groups. Compared with the NCG and SCG groups, there were no statistical significances in the immunostaining density, numbers, and mean grey degree of 5-HT- and SP- positive cells in the MDG group (all P > 0.05).
CONCLUSION: Altered expression of 5-HT and SP in the tunica mucosa recti of rats during heroin abstinence or relapse suggests that 5-HT and SP can regulate the recovery of digestive function during heroin abstinence, detoxification, and relapse.
- Citation: Hong Y, Liang WM, Xia BJ, Hu Y, Han J, Li YX, Xie L. Expression of 5-HT and SP in the rectum of rats during heroin abstinence, detoxification or relapse. Shijie Huaren Xiaohua Zazhi 2011; 19(5): 477-482
- URL: https://www.wjgnet.com/1009-3079/full/v19/i5/477.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i5.477
阿片类药物依赖戒断机制及治疗的研究一直是医学界关注的热点. 海洛因是目前非法滥用范围最广、危害程度最为严重的阿片类物质, 吸食大量海洛因后, 体内内源性阿片样物质因受到负反馈调节而减少, 从而引起机体神经-内分泌-免疫网络的功能紊乱[1]. 海洛因依赖治疗中最难解决的问题是脱毒后的复吸. 因此, 如何有效降低复吸率, 是当今脱毒治疗急需解决的首要问题[2]. 美沙酮维持治疗是针对海洛因等阿片类毒品依赖者采取的一种替代治疗方法, 目前已成为全球阿片类毒品依赖维持疗法中应用最为广泛的方式之一[3]. 近年来, 药物滥用对胃肠道功能的影响已引起国内外学者的广泛关注[4]. 已有研究证实药物滥用将导致直肠癌的发病率增加, 并成为溃疡性结肠炎的诊断依据之一[5]. 而直肠黏膜内分泌细胞数量及种类较多, 且胃肠激素的改变与消化道疾病的发生关系密切[6]. 5-羟色胺(5-hydroxytryptamine, 5-HT)是一种在人体内广泛存在的生物活性胺, 哺乳动物体内大约60%-90%的5-HT存在于胃肠道, 主要由肠嗜铬细胞合成. 5-HT作为一种神经递质, 对机体免疫系统和神经内分泌系统都有调节作用[7]. P物质(substance P, SP)是最早发现的一种神经肽, 属于哺乳动物速激肽家族; 在消化道主要分布于肠神经系统及黏膜内分泌细胞[8]. 本课题组曾对海洛因依赖大鼠结肠及直肠黏膜内5-HT和SP的表达进行研究[9,10]. 目前国内外有关海洛因脱毒、复吸时机体胃肠胰神经内分泌改变的形态学原位研究尚少, 尚未见到海洛因脱毒、复吸时直肠内激素定位及表达情况的系统报道. 本实验通过建立大鼠海洛因戒断、美沙酮脱毒及复吸模型, 应用免疫组织化学SABC法及图像分析, 对5-HT、SP在大鼠海洛因戒断、美沙酮脱毒及复吸期间直肠黏膜的定位和表达进行研究. 为探讨海洛因戒断和复吸的机制提供形态学资料, 并试图为临床通过调整胃肠激素治疗海洛因成瘾提供理论依据.
成年SD大鼠35只, ♂, 体质量180-220 g, 由贵阳医学院实验动物中心提供. 海洛因: 纯度为61.48%, 由贵州省公安厅提供. 美沙酮: 汉方制药厂提供.
1.2.1 分组: 按配对原则随机分为正常对照组(NCG)5只、盐水对照组(SCG)15只和实验组(EG)15只, EG又分为海洛因戒断组(heroin withdrawal group, HWG)、美沙酮脱毒治疗组(methadone detoxication group, MDG)和海洛因复吸组(heroin relapse group, HRG), 由贵阳医学院动物中心饲养员喂养.
1.2.2 造模: (1)海洛因戒断大鼠模型[11]: EG按体质量逐日注射海洛因药液. 首日剂量为3 mg/kg, 2次/d(上午8:00, 下午15:00), 每日递增剂量为3 mg/kg, 连续皮下注射海洛因9 d, 至第9天剂量为27 mg/kg, 第10天EG取5只大鼠腹腔注射0.8 mg纳洛酮催瘾, 观察并记录戒断症状30 min, 出现扭体、湿狗样抖、跳跃、站立、齿颤、清理皮毛、上睑下垂等戒断症状, 依照Maldonad等的戒断症状评分标准评定, 判定大鼠海洛因戒断模型成功建立. 戒断组大鼠1 h内处死; (2)美沙酮脱毒治疗模型[12]: 将已成瘾大鼠注射美沙酮脱毒治疗, 连续注射6 d, 每日剂量递减, 依次为5、4、3、2、1、0.5 mg/kg, 观察并记录, 脱毒治疗第7天(实验第17天)使用纳洛酮催瘾并观察, MDG大鼠与NCG和SCG比较, 无明显戒断症状, 将MDG大鼠处死; (3)海洛因复吸大鼠模型: 将剩余5只美沙酮脱毒6 d后的大鼠再次注射海洛因, 注射剂量9 mg/kg首日, 1次/d(上午8:00), 逐日递增剂量为3 mg/kg, 让大鼠再次染毒, 制作复吸模型. 复吸7 d(实验第24天)后将复吸组大鼠处死. SCG按体质量每日注射与EG相当剂量的生理盐水, 并与EG同时处死; NCG不予任何处理, 按时喂养, 同期处死.
1.2.3 取材及标本制备: 分别取NCG、SCG和EG(戒断、脱毒和复吸)大鼠直肠标本, 多聚甲醛液固定, 常规石蜡包埋, 制成4 μm厚的连续切片, 每例每个观察指标均观察切片3张以上, 切片间隔56 μm.
1.2.4 免疫组织化学SABC法: 按免疫组织化学SABC法进行染色, 分别显示5-HT和SP阳性细胞. 主要步骤为: 切片常规脱蜡至水, 室温10%甲醇-H2O2 10 min, 正常羊血清(1:50)室温下封闭20 min, 依次滴加兔5-HT(1:1 000, 中国人民解放军第四军医大学提供)、SP(1:100, 北京中杉金桥生物技术有限公司)抗血清4 ℃孵育过夜, 羊抗兔 IgG(1:100)37 ℃孵育20 min, SABC复合物(1:100, 武汉博士德生物工程公司提供)37 ℃孵育20 min, DAB-H2O2液显色, 苏木精轻度复染细胞核, 中性树胶封片. 方法对照: PBS缓冲液代替特异性抗血清, 余步骤同上.
1.2.5 图像分析: 随机选取NCG、SCG和实验各组直肠切片各5张, 在40倍物镜下, 每张切片随机选取5个视野, 分别计数每个视野内有核阳性5-HT、SP细胞数. 同样的方法选取视野, 用BioMias图像分析系统检测5-HT、SP阳性细胞的平均灰度值.
统计学处理 应用SPSS11.5软件包对实验数据进行单因素方差分析, 实验数据用mean±SD表示. P<0.05为具有显著性.
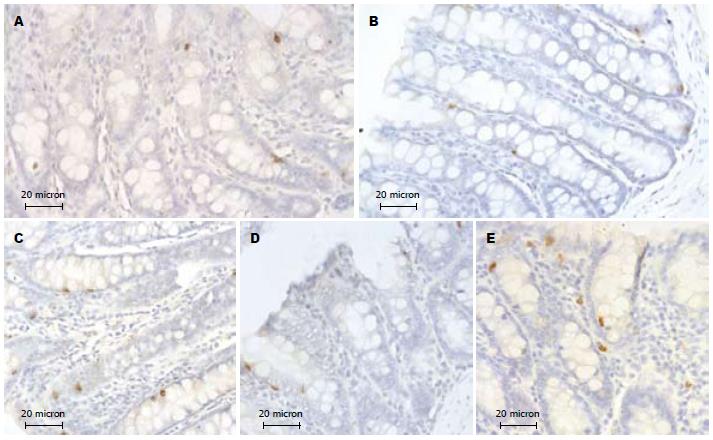
2.1.1 免疫组织化学观察: 光镜下, 正常组大鼠5-HT阳性细胞经DAB-H2O2液显色, 可见免疫反应产物呈棕黄色或棕黑色细颗粒状存在于细胞质内. 5-HT阳性细胞主要分布于黏膜上皮细胞间, 形态多样, 呈圆形、椭圆形、锥形、梭形等, 有的细胞顶端可见细长突起抵达肠腔或小肠腺腔(图1A). 方法对照切片未见阳性反应细胞. SCG和NCG相比, 5-HT阳性细胞的形态、数量、分布及免疫染色强度均未见明显变化(图1B). MDG与SCG和NCG比较, 大鼠直肠5-HT阳性细胞的数量、形态、分布和免疫染色强度未见明显变化(图1D). 与正常和SCG比较, HWG、HRG大鼠直肠5-HT阳性细胞的形态分布未见明显变化, 但免疫染色加深, 细胞数量增多(图1C, E).
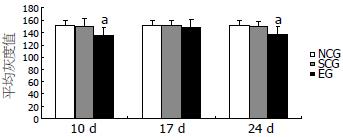
2.1.2 图像分析结果: NCG、SCG及MDG大鼠直肠5-HT阳性细胞计数及平均灰度值的差异无统计学意义(P>0.05), 与正常及SCG相比, HWG、HRG大鼠直肠5-HT阳性细胞计数增多, 平均灰度值降低, 差异有统计学意义(P<0.05, 表1, 图2).
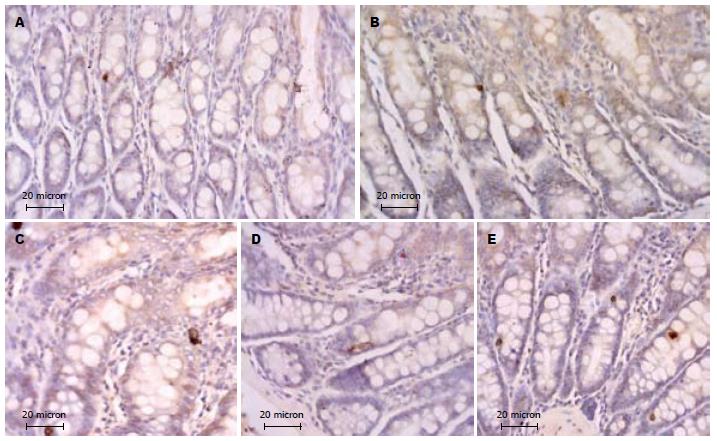
2.2.1免疫组织化学观察: 光镜下, 正常组大鼠直肠SP阳性细胞数量较少, 散在分布于肠腺上皮细胞之间, 多呈卵圆形或不规则形. 经DAB-H2O2液显色, 可见免疫反应产物位于细胞质内, 呈棕黄色细颗粒状(图3A). 方法对照切片未见阳性反应细胞. SCG与NCG比较, 大鼠SP阳性细胞的数量、形态、分布和免疫染色强度未见明显变化(图3B). 与SCG和NCG比较, HWG、HRG SP阳性细胞的免疫染色加深, 细胞数量增多(图3C, E); MDG则未见明显变化(图3D).
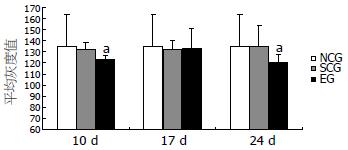
2.2.2 图像分析结果: NCG、SCG及MDG SP阳性细胞计数及平均灰度值的差异无统计学意义(P>0.05), 与正常和SCG比较, HWG、HRG SP阳性细胞计数增多, 平均灰度值降低, 差异有统计学意义(P<0.05, 表2, 图4).
海洛因依赖及戒断后, 由于外源性阿片类物质的作用及其对内源性阿片类物质的影响, 导致阿片受体、内源性阿片肽及受其调节的神经内分泌系统的改变, 表现出以迷走神经功能亢进为主的戒断症状. 海洛因成瘾者的戒断反应, 实质上是机体内部适应与暂时不适应相互转化的表现, 这一过程是建立在神经内分泌的变化、调节和失调基础上的[1]. 戒断症状的存在, 是造成海洛因依赖者脱毒治疗后复吸的重要因素. 在临床观察所见的戒断症状中, 消化道功能紊乱者尤其普遍存在, 如消化不良、食欲减退、腹胀、腹泻或便秘等[4]. 另有研究表明, 吗啡戒断大鼠易出现肠系膜局部微循环障碍[13].
5-HT是参与调节胃肠道运动和分泌功能的重要神经递质和旁分泌信号分子, 95%来源于肠道黏膜层的肠嗜铬细胞. 迷走神经刺激、胃肠内压对胃肠壁的作用等均可使肠嗜铬细胞释放5-HT[14]. 5-HT信号系统异常可导致胃肠道动力及分泌功能异常、内脏高敏感性, 与慢性便秘、肠易激综合征(irritable bowel syndrome, IBS)、腹泻及功能性消化不良等胃肠道功能性疾病密切相关[15-17]. Capasso研究显示5-HT受体阻断剂可明显减弱体外培养豚鼠回肠对吗啡戒断的反应, 表明血清素能和阿片系统之间存在功能上的密切联系[18]. 本实验通过建立海洛因依赖动物模型, 注射纳络酮诱发急性戒断症状, 结果显示戒断组大鼠直肠内5-HT阳性细胞的数量较NCG及SCG明显增多, 免疫染色增强, 推测肠黏膜5-HT的表达增高与海洛因戒断时消化系反应密切相关.
SP为含11个氨基酸残基的多肽, 在消化道主要分布于肠神经系统及黏膜内分泌细胞, 可与5-HT共存于肠嗜铬细胞[19]. SP可作为神经递质的调节因子, 可促进消化系平滑肌收缩, 加强结肠的集团推进运动, 刺激肠黏膜分泌水和电解质[20]. IBS发病过程中出现的肠道应激反应、肠道感染及内脏高敏感性均与SP密切相关[21,22]. Wang等[23]报道便秘型IBS大鼠肠神经系统及中枢神经系统内SP和c-fos蛋白的表达异常, 并推测SP的表达异常直接参与IBS的发病机制. 夏頔等观察IBS患者回盲部肠黏膜SP、SP受体及5-HT的改变及其相互关系, 实验结果表明认为SP、SP受体和5-HT共同作用, 在IBS的发病机制中起重要作用[24]. 研究证实大鼠脑室神经活性肽SP片段(SP1-7)在吗啡戒断期间明显增高[25]. 在大鼠阻断SP特异性NK1受体将减少纳洛酮给药后引起的戒断综合征的出现[26]. 本实验结果显示戒断组大鼠直肠黏膜表达SP增高, 提示SP与阿片肽之间存在复杂的作用机制, 二者共同参与海洛因戒断时消化系黏膜损伤的调节过程.
美沙酮系阿片受体激动剂, 由于其特有的药理学作用而被广泛地应用于阿片类成瘾的治疗. 具有与阿片受体亲和力大, 维持时间长, 成瘾潜力小等特点, 口服美沙酮可控制戒断症状[3]. 本实验采用美沙酮剂量逐日递减法建立美沙酮脱毒动物模型, 用免疫组织化学及图像分析法研究MDG大鼠直肠黏膜5-HT、SP的含量变化, 结果显示5-HT、SP含量较HWG大鼠显著降低, 与NCG及SCG比较无统计学意义. 国内外研究发现, 阿片类戒断后的焦虑情绪和5-HT系统功能有关, 5-HT含量的改变可能是稽延性戒断症状的主要机制之一[27]. 血清中5-HT的浓度改变可作为观测稽延性戒断症状程度的客观指标, 其降低的程度可作为疗效的评定参考[28]. 本实验观察到MDG大鼠戒断症状有所改善, 5-HT含量的降低可能提示美沙酮维持疗法有一定疗效. SP表达接近正常, 提示SP参与脱毒后消化系功能恢复的调节过程.
叶峻等[29]研究证实海洛因复吸大鼠脑内NA、DA、5-HT等神经递质的含量升高, 而且随复吸次数增多而升高. 本实验通过模拟海洛因依赖者脱毒后复吸的过程, 研究5-HT、SP在大鼠直肠含量的改变, 结果表明复吸后5-HT、SP的含量再次升高, 与叶峻等的结果相似. 这与本课题组前期对海洛因依赖期间大鼠结肠内分泌细胞的研究结果类似[10]. 5-HT(1A)拮抗剂可阻断口服大豆吗啡对小肠蠕动的抑制作用[30]. 本研究显示海洛因长期依赖引起5-HT改变可能是阿片肽再次作用引起消化系黏膜的损伤所致, 增多的5-HT也参与肠黏膜损伤的调节过程.
SP是直接调控吗啡等阿片类药物镇痛功能和耐受性的关键物质[31]. 国内外研究发现长期吗啡依赖后脑组织中SP含量升高[25]. Liang等[32]研究显示β2肾上腺素能受体对慢性吗啡依赖大鼠脊髓背根神经节内SP表达水平升高具有重要作用, 并证实其参与长期吗啡依赖时神经元适应的调节. Kojima等[33]研究表明阿片受体激动剂洛哌丁胺对NK3受体诱发的5-HT释放具有明显的抑制作用, 并推测该抑制作用是由位于神经元内的κ和δ受体所介导的. 本实验结果显示复吸组大鼠直肠黏膜表达SP增高, 提示脑肠肽与阿片肽之间存在复杂的作用机制, 可能是机体对抗海洛因依赖引起肠道功能紊乱的调节作用之一.
总之, 本研究结果显示在海洛因依赖戒断期间, 直肠黏膜5-HT、SP表达出现明显变化, 提示胃肠激素参与海洛因戒断、脱毒和复吸时消化功能紊乱的调节过程, 为进一步研究其具体机制提供形态学原位资料, 并为下一步临床通过调整胃肠激素治疗海洛因成瘾提供形态学资料.
近年来, 药物滥用对胃肠道功能的影响已引起国内外学者的广泛关注. 已有研究证实药物滥用将导致直肠癌的发病率增加. 胃肠激素的改变与消化系疾病的发生关系密切. 5-HT作为一种神经递质, 对机体免疫系统和神经内分泌系统都有调节作用. P物质作为神经递质的调节因子, 可促进消化系平滑肌收缩, 加强结肠的集团推进运动, 刺激肠黏膜分泌水和电解质. 目前国内外有关机体直肠神经内分泌的形态学和机能学的改变及其关系的研究尚少, 形态学方面的研究尤其少见.
赵春玲, 副教授, 潍坊医学院细胞生物学教研室
阿片类药物依赖戒断机制及治疗的研究一直是医学界关注的热点. 海洛因是目前非法滥用范围最广、危害程度最为严重的阿片类物质, 海洛因依赖治疗中最难解决的问题是脱毒后的复吸. 美沙酮维持治疗已成为全球阿片类毒品依赖维持疗法中应用最为广泛的方法之一.
Capasso研究显示5-HT受体阻断剂可明显减弱体外培养豚鼠回肠对吗啡戒断的反应, 表明血清素能和阿片系统之间存在功能上的密切联系. SP是直接调控吗啡等阿片类药物镇痛功能和耐受性的关键物质.
本实验观察到戒断及复吸组大鼠直肠5-HT的表达增高可能参与肠黏膜损伤的调节过程. 戒断及复吸组大鼠直肠黏膜表达SP增高, 提示SP与阿片肽之间存在复杂的作用机制, 可能是机体对抗海洛因依赖引起肠道功能紊乱的调节作用之一. 脱毒组大鼠戒断症状有所改善, 5-HT含量的降低可能提示美沙酮维持疗法有一定疗效. SP表达接近正常, 提示SP参与脱毒后消化系功能恢复的调节过程.
本文的相关工作将为深入理解阿片类毒品依赖性形成机制提供重要的形态学依据, 并为临床通过调整体内激素、细胞因子、神经肽的水平来治疗海洛因成瘾者奠定理论基础.
本文选题新颖, 设计合理, 为探讨海洛因戒断和复吸的机制提供形态学资料.
编辑: 曹丽鸥 电编:何基才
| 2. | 周 文华, 张 富强, 刘 惠芬, 唐 甩恩, 张 亚海, 刘 胜, 赖 苗军, 陈 为升, 顾 钧, 朱 华强. 海洛因复吸模型、机制和干预的研究进展. 中国药物依赖性杂志. 2006;15:206-209. |
| 3. | Tramullas M, Martínez-Cué C, Hurlé MA. Chronic methadone treatment and repeated withdrawal impair cognition and increase the expression of apoptosis-related proteins in mouse brain. Psychopharmacology (Berl). 2007;193:107-120. [PubMed] [DOI] |
| 4. | Banach T, Zurowski D, Gil K, Weisbrodt NW, Rosenfeld G, Thor PJ. Peripheral mechanisms of intestinal dysmotility in the morphine tolerant and dependent rats. J Physiol Pharmacol. 2006;57:73-82. [PubMed] |
| 5. | Dimitrijević I, Kalezić N, Ristić J, Bojović O, Dimitrijević N. Digestive system damage caused by substance abuse. Acta Chir Iugosl. 2008;55:133-138. [PubMed] [DOI] |
| 6. | Kilkens TO, Honig A, Fekkes D, Brummer RJ. The effects of an acute serotonergic challenge on brain-gut responses in irritable bowel syndrome patients and controls. Aliment Pharmacol Ther. 2005;22:865-874. [PubMed] [DOI] |
| 7. | Lesurtel M, Soll C, Graf R, Clavien PA. Role of serotonin in the hepato-gastroIntestinal tract: an old molecule for new perspectives. Cell Mol Life Sci. 2008;65:940-952. [PubMed] [DOI] |
| 8. | Brehmer A. Structure of enteric neurons. Adv Anat Embryol Cell Biol. 2006;186:1-91. [PubMed] |
| 14. | Hansen MB, Witte AB. The role of serotonin in intestinal luminal sensing and secretion. Acta Physiol (Oxf). 2008;193:311-323. [PubMed] [DOI] |
| 18. | Capasso A. Methisergide selective inhibition of opioid acute physical dependence in isolated tissues. Med Chem. 2008;4:309-312. [PubMed] [DOI] |
| 19. | Koon HW, Pothoulakis C. Immunomodulatory properties of substance P: the gastrointestinal system as a model. Ann N Y Acad Sci. 2006;1088:23-40. [PubMed] [DOI] |
| 21. | Chua AS, Keeling PW, Dinan TG. Role of cholecystokinin and central serotonergic receptors in functional dyspepsia. World J Gastroenterol. 2006;12:1329-1335. [PubMed] |
| 22. | Ma XP, Tan LY, Yang Y, Wu HG, Jiang B, Liu HR, Yang L. Effect of electro-acupuncture on substance P, its receptor and corticotropin-releasing hormone in rats with irritable bowel syndrome. World J Gastroenterol. 2009;15:5211-5217. [PubMed] [DOI] |
| 23. | Wang WF, Yang YS, Peng LH, Sun G. Alternation of substance P-containing neural pathways in a rat model of irritable bowel syndrome with rectal distension. Chin J Dig Dis. 2006;7:211-218. [PubMed] [DOI] |
| 25. | Zhou Q, Carlsson A, Botros M, Fransson R, Sandström A, Gordh T, Hallberg M, Nyberg F. The C-terminal amidated analogue of the substance P (SP) fragment SP(1-7) attenuates the expression of naloxone-precipitated withdrawal in morphine dependent rats. Peptides. 2009;30:2418-2422. [PubMed] [DOI] |
| 26. | Wang X, Douglas SD, Peng JS, Zhou DJ, Wan Q, Ho WZ. An in vitro model of morphine withdrawal manifests the enhancing effect on human immunodeficiency virus infection of human T lymphocytes through the induction of substance P. Am J Pathol. 2006;169:1663-1670. [PubMed] [DOI] |
| 30. | Kaneko K, Iwasaki M, Yoshikawa M, Ohinata K. Orally administered soymorphins, soy-derived opioid peptides, suppress feeding and intestinal transit via gut mu(1)-receptor coupled to 5-HT(1A), D(2), and GABA(B) systems. Am J Physiol Gastrointest Liver Physiol. 2010;299:G799-G805. [PubMed] [DOI] |
| 31. | Guan JS, Xu ZZ, Gao H, He SQ, Ma GQ, Sun T, Wang LH, Zhang ZN, Lena I, Kitchen I. Interaction with vesicle luminal protachykinin regulates surface expression of delta-opioid receptors and opioid analgesia. Cell. 2005;122:619-631. [PubMed] [DOI] |
| 32. | Liang DY, Shi X, Li X, Li J, Clark JD. The beta2 adrenergic receptor regulates morphine tolerance and physical dependence. Behav Brain Res. 2007;181:118-126. [PubMed] [DOI] |
| 33. | Kojima S, Ikeda M, Kamikawa Y. Loperamide inhibits tachykinin NK3-receptor-triggered serotonin release without affecting NK2-receptor-triggered serotonin release from guinea pig colonic mucosa. J Pharmacol Sci. 2005;98:175-180. [PubMed] [DOI] |