修回日期: 2010-12-09
接受日期: 2010-12-15
在线出版日期: 2011-02-08
目的: 探讨TSLC1和MPP3两种蛋白在胰腺癌中的表达和临床病理意义.
方法: 采用免疫组织化学S-P法检测37例胰腺癌组织、12例胰腺炎组织和10例正常胰腺组织中TSLC1和MPP3两种蛋白的表达.
结果: TSLC1、MPP3蛋白在胰腺癌组织中的阳性表达率均明显低于在正常胰腺组织和胰腺炎组织中的表达(21.62% vs 70.00%, 75.00%; 27.03% vs 80.00%, 66.67%, P<0.05或0.01). TSLC1和MPP3蛋白的异常表达均与胰腺癌的分化程度、淋巴结转移和TNM分期相关(均P<0.05), 而与患者的性别、年龄、部位和病理分型无关. 在37例胰腺癌中TSLC1与MPP3蛋白表达呈显著正相关(rs = 0.715, P<0.01).
结论: 胰腺癌中存在TSLC1和MPP3基因的失活和蛋白表达下调, 两者可能通过TSLC1- MPP3级联反应共同参与胰腺癌的发生、发展和转移.
引文著录: 刘志清, 刘修莉, 龚发良, 任习芳, 陈畅, 李玲, 潘志红, 袁玲莉, 陈蓉. TSLC1和MPP3在胰腺癌中的表达及其意义. 世界华人消化杂志 2011; 19(4): 379-383
Revised: December 9, 2010
Accepted: December 15, 2010
Published online: February 8, 2011
AIM: To investigate the clinical significance of the expression of TSLC1 (tumor suppressor in lung cancer 1) and MPP3 (membrane protein, palmitoylated 3) in pancreatic cancer.
METHODS: Immunohistochemistry was used to measure the expression of TSLC1 and MPP3 in 10 normal pancreatic tissue specimens, 12 pancreatitis specimens, and 37 pancreatic cancer specimens.
RESULTS: The positive rates of TSLC1 and MPP3 expression in pancreatic carcinoma were significantly lower than those in normal pancreatic tissue and pancreatitis (21.62% vs 70.00%, 75.00%; 27.03% vs 80.00%, 66.67%, all P < 0.05 or 0.01). The expression of TSLC1 and MPP3 was significantly correlated with tumor differentiation, lymph node metastasis, and TNM stage in pancreatic cancer (all P < 0.05), but not with gender, age, tumor location, and pathological type (all P > 0.05). A significant positive correlation was found between the expression of TSLC1 and MPP3 in pancreatic cancer (P < 0.01).
CONCLUSION: Down-regulated expression of TSLC1 and MPP3 may be involved the pathogenesis, progression, and metastasis of pancreatic carcinoma.
- Citation: Liu ZQ, Liu XL, Gong FL, Ren XF, Chen C, Li L, Pan ZH, Yuan LL, Chen R. Clinical significance of the expression of TSLC1 and MPP3 in pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(4): 379-383
- URL: https://www.wjgnet.com/1009-3079/full/v19/i4/379.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i4.379
肺癌抑制基因1(tumor suppressor in lung cancer-1, TSLC1)是2001年由Kuramochi等在人类非小细胞肺癌(non-small-cell lung cancer, NSCLC)中发现的一种抑癌基因, 定位于染色体11q23.2, 翻译生成442个氨基酸残基的跨膜糖蛋白. 该基因的突变与失活与人类多种肿瘤, 包括胰腺癌的发生发展密切相关[1,2]. 膜蛋白, 棕榈酰化3(membrane protein, palmitoylated 3, MPP3)蛋白是由585个氨基酸组成一种膜蛋白, 属于膜相关鸟苷酸激酶类似物(membranes-associated guanylate kinase, MAGUK)家族, 与果蝇肿瘤抑制基因discs large(dlg)高度同源[3]. Fukuhara等[4]用酵母双杂交筛选技术发现TSLC1与MPP3密切相关, 认为MPP3可能是NSCLC的一个抑癌基因. 国内迄今尚无关于TSLC1-MPP3信号通路的相关研究, 我们应用免疫组织化学方法检测TSLC1和MPP3蛋白在胰腺癌组织中的表达情况, 旨在探讨TSLC1和MPP3蛋白表达与胰腺癌的发生, 发展和临床病理学特征及预后的意义, 并进一步证实TSLC1与MPP3的相关性.
收集三峡大学人民医院2000-01/2009-06手术切除的胰腺癌标本37例, 其中男25例, 女12例, 年龄18-72岁. 淋巴结转移: 阳性者18例, 阴性者19例. TNM分期: Ⅰ-Ⅱ期20例, Ⅲ-Ⅳ期17例. 分化程度: 按WHO分类, 高分化腺癌10例, 中分化腺癌15例, 低分化腺癌12例. 取12例胰腺炎组织标本和10例正常胰腺组织标本作对照. 所有标本均经40 g/L缓冲中性甲醛固定, 常规石蜡包埋, 5 μm厚度连续切片, 1张行常规HE染色, 供组织学观察并行病理分型和诊断, 另3张制成涂胶白片作免疫组织化学染色用. 兔抗人多克隆抗体TSLC1购自Santa Cruz Biotechnology USA, 羊抗人多克隆抗体MPP3购自Abcam公司, 免疫组织化学SP试剂盒和DAB显色试剂盒均购自北京中杉生物技术有限公司.
1.2.1 SP法染色: (1)脱蜡和水化; (2)内源性过氧化物酶阻断溶液37 ℃孵育20 min; (3)高温高压抗原修复; (4)非免疫性动物血清37 ℃孵育30 min; (5)第一抗体4 ℃下孵育过夜, 一抗稀释比为: TSLC1(1:100)、MPP3(1:1 000); (6)生物素标记的第二抗体37 ℃孵育30 min; (7)链霉菌素抗生物素蛋白-过氧化物酶溶液37 ℃孵育30 min; (8)新配制的DAB溶液显色; (9)苏木素复染, 中性树胶封片. 以上步骤间均用0.01 mol/L PBS缓冲液(pH7.4)冲洗5 min×3次. 同时用已知阳性片作阳性对照, 用PBS代替一抗作阴性对照.
1.2.2 TSLC1染色结果的判断标准: 与阴性对照片相比, TSLC1蛋白以细胞膜或细胞质内出现棕黄色颗粒判断为阳性细胞, 采用双盲法, 高倍镜下随机选取10个视野, 每个视野计数200个细胞, 按照国外文献[5]方法计算阳性细胞数<30%为阴性(-), 阳性细胞数≥30%为阳性(+).
1.2.3 MPP3染色结果判断标准: MPP3蛋白以胞质和胞膜有棕黄色颗粒判断为阳性细胞. 染色结果判断标准方法: 先按染色强度计分: 0分为无色, 1分为浅黄色, 2分为棕黄色, 3分为棕褐色; 再在高倍镜下(×400倍)对每张切片随机选取5个高倍镜视野, 计数500个细胞/视野, 共计2 500个, 按阳性细胞所占的百分比计分: 0分为阴性, 1分为阳性细胞<10%, 2分为10%-50%, 3分为>50%, 染色强度与阳性细胞百分比的乘积≥2分为免疫组织化学阳性(+), 否则计为免疫组织化学阴性(-).
统计学处理 采用SPSS13.0 for Windows统计软件进行χ2检验和四格表的精确概率法判断TSLC1和MPP3蛋白表达与各病理指标的相互关系, 运用Spearman相关系数来判断TSLC1和MPP3蛋白表达之间的相关关系, 以P<0.05为差异有统计学意义.
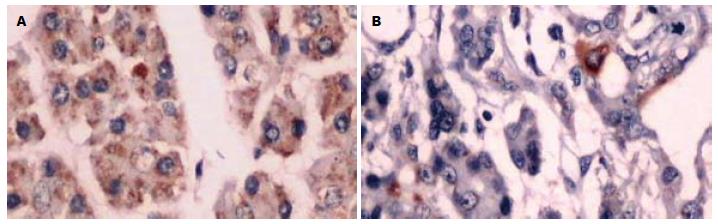
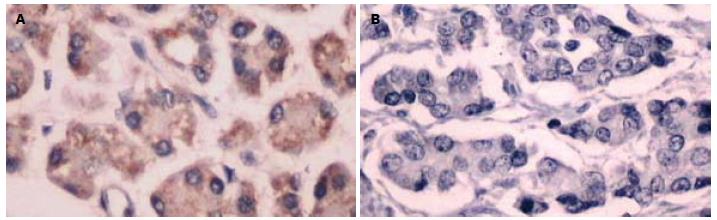
应用免疫组织化学SP法检测了TSLC1在37例胰腺癌、12例胰腺炎和10例正常胰腺组织中的定位及表达情况. 结果显示: TSLC1表达定位于细胞膜或细胞质内, 呈棕黄色颗粒(图1). 9例正常胰腺组织中有7例呈阳性表达, 阳性率为70.00%; 12例胰腺炎组织中有9例呈阳性表达, 阳性率为75.00%; 在37例胰腺癌中有例呈阳性表达, 阳性率为21.62%. TSLC1在胰腺癌与胰腺炎之间, 以及胰腺癌与正常胰腺组织中的表达存在显著性差异(P<0.05, 表1). 对TSLC1在胰腺癌组织中的表达与临床病理特征进行卡方检验, 结果发现其表达在肿瘤分化程度、淋巴结转移和TNM分期存在显著性差异(均P<0.05, 表2), 而与年龄、性别、部位和病理分型无关(均P>0.05, 表2).
| 临床病理特征 | n | TSLC1 | MPP3 | ||
| 阳性n(%) | P值 | 阳性n(%) | P值 | ||
| 性别 | |||||
| 男 | 25 | 5(20.00) | >0.05 | 7(28.00) | >0.05 |
| 女 | 12 | 3(25.00) | 3(25.00) | ||
| 年龄(岁) | |||||
| ≤45 | 9 | 2(22.22) | >0.05 | 1(11.11) | >0.05 |
| >45 | 28 | 6(21.43) | 9(32.14) | ||
| 肿瘤部位 | |||||
| 胰头癌 | 17 | 2(11.76) | >0.05 | 5(29.41) | >0.05 |
| 胰体癌 | 14 | 5(35.71) | 4(28.57) | ||
| 胰尾癌 | 6 | 1(16.67) | 1(16.67) | ||
| 分化程度 | |||||
| 高分化 | 10 | 5(50.00) | <0.01 | 7(70.00) | <0.01 |
| 中分化 | 15 | 3(20.00) | 3(20.00) | ||
| 低分化 | 12 | 0(0.00) | 0(0.00) | ||
| 淋巴结转移 | |||||
| 有 | 18 | 1(55.56) | <0.05 | 2(11.11) | <0.05 |
| 无 | 19 | 7(36.84) | 8(42.11) | ||
| 病理分型 | |||||
| 管状腺癌 | 35 | 6(17.14) | >0.05 | 8(22.86) | >0.05 |
| 其他 | 2 | 1(50.00) | 1(50.00) | ||
| TNM分期 | |||||
| Ⅰ-Ⅱ期 | 20 | 7(35.00) | <0.05 | 9(45.00) | <0.01 |
| Ⅲ-Ⅳ期 | 17 | 1(5.88) | 1(5.88) | ||
应用免疫组织化学SP法检测了37例人胰腺癌、12例胰腺炎和10例正常胰腺组织中MPP3的定位及表达情况. 结果显示: MPP3定位于细胞膜和细胞质内, 呈棕黄色颗粒(图2). 在10例正常胰腺组织中有8例呈阳性表达, 阳性率为80.00%; 12例胰腺炎组织中有8例呈阳性表达, 阳性率为66.67%; 在37例胰腺癌中有10例呈阳性表达, 阳性率为27.03%. MPP3在胰腺癌与胰腺炎之间, 以及胰腺癌与正常胰腺组织中的表达存在显著性差异(P<0.05, 表1). 对TSLC1在胰腺癌组织中的表达与临床病理特征进行卡方检验, 结果发现其表达在肿瘤分化程度、淋巴结转移和TNM分期存在显著性差异(均P<0.05, 表2), 而与年龄、性别、部位和病理分型无关(均P>0.05, 表2).
胰腺癌组织中TSLC1蛋白阳性率为18.92(7/37), 与MPP3蛋白的表达阳性率27.03(10/37), 相关性(rs = 0.715, P<0.01).
TSLC1蛋白属于免疫球蛋白超家族, 由胞外区、跨膜区和胞质区三部分组成. 其中胞质区域是TSLC1发挥作用所必需的, 其结构与血型糖蛋白C类似, 包括一个FERM(protein 4.1/ezrin/radixin/moesin)结合模体和一个PDZ(PSD-95/Dlg/ZO-1)结合模体, 并能与相应蛋白DAL-1/4.1B和(或)MAGUK结合发挥特殊功能[6]. Kuramochi等[1]报道在约17%的胰腺癌中检测到TSLC1的杂合子缺失(loss of heterozygosity, LOH), 72.7%的胰腺癌细胞系中有TSLC1表达缺失. 另外, Jansen等[7]研究发现在胰导管上皮癌, 胰腺上皮内瘤变(PinIN), 以及多种胰腺癌细胞株中如ASPC-1、Miapaca、PL-3内, 均可发生TSLC1较高频度的甲基化, 说明胰腺癌的发生与5'CpG岛的甲基化导致的TSLC1转录受抑, 进而表达缺失密切相关. TSLC1失活见于包括胰腺癌在内的多种肿瘤组织或细胞, 尤其多见于癌组织的浸润和转移部位[2]. 因此我们推测作为一种抑癌基因, TSLC1的失活在胰腺癌中发挥了重要作用. TSLC1可能与胰腺癌的生物学行为, 包括侵袭和转移有关. 本研究显示, TSLC1表达与胰腺癌分化程度, 淋巴结转移, TNM分期有关(均P<0.05), 而与患者的性别、年龄、肿瘤部位以及病理分型无关(均P>0.05), 研究结果与国外现有文献报道一致, 说明TSLC1可能影响胰腺癌的发生、发展、转移, TSLC1蛋白可以作为判断胰腺癌恶性程度的一个重要的生物学指标.
MPP3基因定位于17q21, MPP3蛋白由一对Lin/Lin7结构域(L27), 一个PDZ结构域、一个丝氨酸同源性结构域(SH3), 和一个鸟苷酸激酶同源结构域(GuK)组成, 该蛋白与果蝇抑癌蛋白Dlg高度同源. 研究表明DLG在控制果蝇上皮及神经细胞的细胞极性形成及细胞生长中发挥关键作用[9-11]; 与Dlg结果相似的含有PDZ结构域的蛋白在哺乳动物中称为MAGUK, 主要位于细胞连接处, 参与细胞构建和信号传导功能[8]. CASK, MPP3和Pals2和syntenin是MAGUK中目前认为与TSLC1结合的蛋白, 可调控细胞极性[4,12-14]. Fukuhara等[4]在NSCLC中用酵母双杂交筛选技术发现并通过体内及体外试验证实TSLC1与MPP3通过TSLC1的PDZ结构域相互作用, 参与相邻细胞间正常黏附结构, 当其中的一种蛋白表达缺失时, 就会影响正常细胞黏附而导致癌的转移. 迄今为止, 国内外没有MPP3和胰腺癌的相关报道, 本研究首次研究了MPP3在胰腺癌组织的表达情况. 结果显示MPP3表达与胰腺癌分化程度, 淋巴结转移, TNM分期有关(均P<0.05), 而与患者的性别、年龄、肿瘤部位以及病理分型无关(均P>0.05), 说明MPP3可能影响胰腺癌的发生、发展、转移, 进一步证实了MPP3是一种广泛存在的抑癌基因.
TSLC1、MPP3和DAL-1在细胞黏附位置相互作用, 值得注意的是一种红细胞抗原血型糖蛋白C与TSLC1胞质结构极度相似, 该蛋白与MPP1和蛋白4.1形成三元复合物参与红细胞的变形[15]; 另一种跨膜蛋白果蝇NeurexinⅣ基因与TSLC1胞质区结构相似, 与Dlg和蛋白4.1分子结构相似的Coracle相互作用[16]. 这些复合物参与分隔连接, 是果蝇中一种普遍存在的连接装置, 普遍存在于脊椎动物的紧密连接中, 因此我们推测TSLC1, DAL-1/4.1B和MPP3可能组成三元复合物, 共同参与与细胞黏附有关的上皮样细胞机构形成. 我们用免疫组织化学方法研究了胰腺癌中两种基因的表达及其相互关系, 结果显示TSLC1与MPP3在胰腺癌组织中表达呈正相关(P<0.01).
总之, TSLC1与MPP3在胰腺癌组织表达下调或缺失, 两者基因表达失活均与胰腺癌的分化程度、淋巴结转移及TNM分期有关, 并且两者具有相关性. TSLC1蛋白可能与MPP3蛋白共同参与胰腺癌的发生、发展和转移, 二者的作用机制有待进一步研究.
TSLC1作为一种新的抑癌基因参与细胞间黏附、细胞运动、信号转导及免疫调节, 在多种肿瘤中呈现异常表达, 并与肿瘤的多种生物学特性密切相关, 其作用的分子机制尚待进一步研究.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
Kuramochi等报道在约17%的胰腺癌中检测到TSLC1的杂合子缺失(LOH), 72.7%的胰腺癌细胞系中有TSLC1表达缺失.
本文检测了抑癌基因TSLC1在胰腺癌中的表达, 分析其与胰腺癌临床病理因素间的关系及与MPP3蛋白表达的相关性, 探讨TSLC1基因在胰腺癌发生发展中的作用及可能的分子机制.
本文对TSLC1和MPP3在胰腺癌中的相关性作出了初步探讨, 为深入了解TSLC1信号通路在肿瘤进展中的作用奠定了基础.
本文探讨TSLC1和MPP3在胰腺癌组织中的表达, 有重要的临床意义.
编辑: 李薇 电编:何基才
| 1. | Kuramochi M, Fukuhara H, Nobukuni T, Kanbe T, Maruyama T, Ghosh HP, Pletcher M, Isomura M, Onizuka M, Kitamura T. TSLC1 is a tumor-suppressor gene in human non-small-cell lung cancer. Nat Genet. 2001;27:427-430. [PubMed] [DOI] |
| 2. | Murakami Y. Involvement of a cell adhesion molecule, TSLC1/IGSF4, in human oncogenesis. Cancer Sci. 2005;96:543-552. [PubMed] [DOI] |
| 3. | Smith SA, Holik P, Stevens J, Mazoyer S, Melis R, Williams B, White R, Albertsen H. Isolation of a gene (DLG3) encoding a second member of the discs-large family on chromosome 17q12-q21. Genomics. 1996;31:145-150. [PubMed] [DOI] |
| 4. | Fukuhara H, Masuda M, Yageta M, Fukami T, Kuramochi M, Maruyama T, Kitamura T, Murakami Y. Association of a lung tumor suppressor TSLC1 with MPP3, a human homologue of Drosophila tumor suppressor Dlg. Oncogene. 2003;22:6160-6165. [PubMed] [DOI] |
| 5. | Goto A, Niki T, Chi-Pin L, Matsubara D, Murakami Y, Funata N, Fukayama M. Loss of TSLC1 expression in lung adenocarcinoma: relationships with histological subtypes, sex and prognostic significance. Cancer Sci. 2005;96:480-486. [PubMed] [DOI] |
| 6. | Mao X, Seidlitz E, Ghosh K, Murakami Y, Ghosh HP. The cytoplasmic domain is critical to the tumor suppressor activity of TSLC1 in non-small cell lung cancer. Cancer Res. 2003;63:7979-7985. [PubMed] |
| 7. | Jansen M, Fukushima N, Rosty C, Walter K, Altink R, Heek TV, Hruban R, Offerhaus JG, Goggins M. Aberrant methylation of the 5' CpG island of TSLC1 is common in pancreatic ductal adenocarcinoma and is first manifest in high-grade PanlNs. Cancer Biol Ther. 2002;1:293-296. [PubMed] |
| 8. | Harris BZ, Lim WA. Mechanism and role of PDZ domains in signaling complex assembly. J Cell Sci. 2001;114:3219-3231. [PubMed] |
| 9. | Ohshiro T, Yagami T, Zhang C, Matsuzaki F. Role of cortical tumour-suppressor proteins in asymmetric division of Drosophila neuroblast. Nature. 2000;408:593-596. [PubMed] [DOI] |
| 10. | Peng CY, Manning L, Albertson R, Doe CQ. The tumour-suppressor genes lgl and dlg regulate basal protein targeting in Drosophila neuroblasts. Nature. 2000;408:596-600. [PubMed] [DOI] |
| 11. | Bellaïche Y, Radovic A, Woods DF, Hough CD, Parmentier ML, O'Kane CJ, Bryant PJ, Schweisguth F. The Partner of Inscuteable/Discs-large complex is required to establish planar polarity during asymmetric cell division in Drosophila. Cell. 2001;106:355-366. [PubMed] [DOI] |
| 12. | Biederer T, Sara Y, Mozhayeva M, Atasoy D, Liu X, Kavalali ET, Südhof TC. SynCAM, a synaptic adhesion molecule that drives synapse assembly. Science. 2002;297:1525-1531. [PubMed] [DOI] |
| 13. | Shingai T, Ikeda W, Kakunaga S, Morimoto K, Takekuni K, Itoh S, Satoh K, Takeuchi M, Imai T, Monden M. Implications of nectin-like molecule-2/IGSF4/RA175/SgIGSF/TSLC1/SynCAM1 in cell-cell adhesion and transmembrane protein localization in epithelial cells. J Biol Chem. 2003;278:35421-35427. [PubMed] [DOI] |
| 14. | Bachmann A, Schneider M, Theilenberg E, Grawe F, Knust E. Drosophila Stardust is a partner of Crumbs in the control of epithelial cell polarity. Nature. 2001;414:638-643. [PubMed] [DOI] |
| 15. | Marfatia SM, Morais-Cabral JH, Kim AC, Byron O, Chishti AH. The PDZ domain of human erythrocyte p55 mediates its binding to the cytoplasmic carboxyl terminus of glycophorin C. Analysis of the binding interface by in vitro mutagenesis. J Biol Chem. 1997;272:24191-24197. [PubMed] [DOI] |
| 16. | Fehon RG, Dawson IA, Artavanis-Tsakonas S. A Drosophila homologue of membrane-skeleton protein 4.1 is associated with septate junctions and is encoded by the coracle gene. Development. 1994;120:545-557. [PubMed] |