修回日期: 2011-11-20
接受日期: 2011-12-18
在线出版日期: 2011-12-28
目的: 探讨盐酸戊乙奎醚对大鼠急性坏死性胰腺炎(acute necrotic pancreatitis, ANP)并发急性肺损伤(acute lung injury, ALI)血清巨噬细胞移动抑制因子(macrophage migration inhibitory factor, MIF)和肺泡灌洗液水通道蛋白-5(aquaporin-5, AQP-5)表达的影响.
方法: 采用经胰胆管内逆行注射4%牛磺胆酸钠构建大鼠ANP并发ALI模型, 100只SD大鼠以是否接受盐酸戊乙奎醚(penehyclidine hydrochloride, PHCD)腹腔注射干预治疗随机分为治疗组和非治疗组, 每组再以6 h、12 h、24 h、36 h、48 h五个取材时间点继续随机分组, 共10组, 每组10只动物. 采用ELISA法测定血清中MIF的浓度和肺泡灌洗液中AQP-5的浓度, 同时进行胰腺和肺组织病理形态学观察, 肺组织湿/干重比检测, 动脉血气分析.
结果: 相同时间点PHCD治疗组与非治疗组比较显示, 血清MIF浓度降低(χ2 = 20.52, P = 0.042), 肺泡灌洗液AQP-5浓度增高(χ2 = 17.22, P = 0.044), 胰腺和肺组织病理学损伤减轻, 肺组织湿/干质量比值减小(χ2 = 21.04, P = 0.000), 动脉血PaO2上升(χ2 = 503.48, P = 0.000)、PaCO2下降(χ2 = 82.83, P = 0.000).
结论: PHCD的适当干预对大鼠ANP并发ALI具有一定的治疗效果.
引文著录: 蔡丹磊. 盐酸戊乙奎醚对大鼠急性坏死性胰腺炎肺损伤MIF和AQP-5表达的影响. 世界华人消化杂志 2011; 19(36): 3672-3677
Revised: November 20, 2011
Accepted: December 18, 2011
Published online: December 28, 2011
AIM: To investigate the influence of treatment with penehyclidine hydrochloride (PHCD) on the levels of macrophage migration inhibitor factor (MIF) in serum and aquaporin-5 (AQP-5) in bronchoalveolar lavage fluid (BALF) in rats with acute necrotizing pancreatitis (ANP) and acute lung injury (ALI).
METHODS: ANP and ALI was induced in Sprague-Dawley rats by retrograde injection of 4% sodium taurocholate into the biliopancreatic duct. One hundred rats were randomly and equally divided into treatment group and non-treatment group. The treatment group received intraperitoneal injection of PHCD. Each group was further equally and randomly divided into five subgroups for testing at 6 h, 12 h, 24 h, 36 h, and 48 h. The concentrations of MIF in serum and AQP-5 in BALF were determined by enzyme-linked immunosorbent assay (ELISA). Pancreatic and pulmonary pathomorphology was recorded and compared between the two groups. The wet-to-dry weight ratio of the lung was measured and blood gas analysis was performed.
RESULTS: Compared to the non-treatment group, the treatment group had significantly decreased serum levels of MIF (χ2 = 20.52, P = 0.042), the wet-to-dry weight ratio of the lung (χ2 = 21.04, P = 0.000) and arterial PaCO2 (χ2 = 82.83, P = 0.000), significantly increased BALF levels of AQP-5 (χ2 = 17.22, P = 0.044) and arterial PaO2 (χ2 = 503.48, P = 0.000), and significantly mitigated pancreatic and lung histopathological changes.
CONCLUSION: PHCD intervention has an appreciable therapeutic effect on ANP and ALI in rats.
- Citation: Cai DL. Treatment with penehyclidine hydrochloride reduces the levels of MIF in serum and AQP-5 in bronchoalveolar lavage fluid in rats with acute necrotizing pancreatitis and acute lung injury. Shijie Huaren Xiaohua Zazhi 2011; 19(36): 3672-3677
- URL: https://www.wjgnet.com/1009-3079/full/v19/i36/3672.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i36.3672
重症急性胰腺炎(sever acute pancreatitis, SAP)是一种起病急、进展快、病情危重、并发症多、病死率高的急腹症[1]. 多种因素包括胆石、乙醇、缺血、高脂血症和高钙血症等均可激活胰腺细胞内的胰蛋白酶原和其他消化酶, 释放氧自由基; 激活的胰酶和氧自由基损伤腺泡细胞, 引起细胞因子和血管活性介质大量释放; 吸引炎症细胞, 活化血管内皮, 上调黏附分子表达, 引起胰腺微紊乱. 这种所谓的"第二次攻击"可使胰腺病理改变由水肿进展为坏死, 形成急性坏死性胰腺炎(acute necrosis pancreatitis, ANP), 并促使炎症从胰腺局部迅速扩展到全身, 发生全身炎症反应综合征和多器官衰竭[2], 其中急性肺损伤(acute lung injury, ALI)是SAP早期最常见的并发症. 急性胰腺炎相关性肺损伤(acute pancreatitis-associated lung injury, APALI)的具体机制尚未完全清楚. 近期有研究表明巨噬细胞移动抑制因子(macrophage migration inhibitory factor, MIF)高表达导致的过度炎症反应可能是大多数肺损伤的根本原因. 水通道蛋白-5(aquaporin-5, AQP-5)的表达和功能下降可能与高浓度氧肺损伤中肺水肿的形成及体液异常转运有关[3]. 盐酸戊乙奎醚(penehyclidine hydrochloride, PHCD)是一类新型选择性抗胆碱药, 主要选择作用于亚型M1和M3受体, 对大多存在于心脏的M2受体无明显作用或作用较弱, 而肺的通气道主要分布M3受体, 故该药具有持续作用时间长和心血管副作用小等特点. 目前PHCD已成功应用于临床救治有机磷农药中毒[4], 并推荐用于麻醉前给药, 近期有报道称其对创伤性和内毒性ALI有明显效果. 本课题拟通过研究PHCD干预治疗对大鼠ANP并发ALI后重要因子MIF和AQP-5表达的影响, 为寻找治疗APALI的可行性方案提供新思路和新策略.
牛磺胆酸钠(美国Sigma公司), 大鼠MIF和AQP-5 ELISA检测试剂盒(上海亚培生物科技有限公司), 长托宁PHCD(成都力思特制药股份有限公司), ELX800型酶标仪(美国BIO-TEK仪器公司), 血气分析仪(美国Roche公司), 全自动生化分析仪(美国Vitros公司), 光学显微镜(日本OLYMPUS公司), 石蜡切片机(德国LEICA公司), 全自动组织脱水机(德国LEICA公司), 组织包埋机(德国LEICA公司). 健康成年SPF级SD大鼠(180-240 g)100只, 雌雄各半, 由南通大学实验动物中心提供.
1.2.1 大鼠ANP并发ALI模型构建与PHCD药物处理: 参照Lankisch等的方法, 大鼠腹腔注射10%水合氯醛[300 mg/(kg•bw)]麻醉后固定于手术台, 以0.1 mL/min速度向胰胆管内逆向注入4%牛磺胆酸钠[1 mL/(kg•bw)], 构建大鼠ANP并发ALI模型. 按照是否采用PHCD药物干预随机分为治疗组和非治疗组, 治疗组大鼠在制模后30 min、12 h、24 h、36 h腹腔注射PHCD[0.2 mg/(kg•bw)], 非治疗组大鼠在各相应时间点注射等体积无菌生理盐水. 每组分别于制模成功并药物处理后6 h、12 h、24 h、36 h、48 h五个时间点取材, 继续随机分组, 共10组.
1.2.2 标本采集: 每组分别于制模成功并药物处理后6 h、12 h、24 h、36 h、48 h五个时间点, 将大鼠麻醉(方法同前)后抽取腹主动脉新鲜动脉血(肝素抗凝)0.5 mL, 密封后送检; 心脏穿刺抽取血液2-3 mL, 室温下以3 000 r/min离心20 min, 取血清置-80 ℃冰箱保存待检; 放血致死后取左肺, 生理盐水2 mL灌洗支气管肺泡2次, 取肺泡灌洗液2 mL, 室温下以2 500 r/min离心10 min, 取上清液置-80 ℃冰箱保存待检; 取右肺中叶组织, 滤纸吸干表面水分, 称质量待检; 同时快速切取胰腺和肺组织, 置40 g/L多聚甲醛中固定.
1.2.3 血气分析: 将抽取的新鲜动脉血0.5 mL立即用Roche OPTICCA 型血气分析仪测定PaO2和PaCO2, 具体方法按操作规程.
1.2.4 肺组织湿/干质量比测定: 用滤纸吸干右肺中叶组织的表面水分, 用电子分析天平称湿质量(W), 然后置80 ℃电热干燥箱内烘烤24 h左右, 待质量恒定后称干质量(D), 计算肺湿/干质量比値(W/D).
1.2.5 胰腺和肺组织病理学检测: 胰腺和肺组织经固定、脱水、石蜡包埋、切片, 进行苏木精-伊红(HE)染色, 显微镜下观察.
1.2.6 血清MIF和肺泡灌洗液AQP-5测定: 采用ELISA法分别检测血清MIF和肺泡灌洗液AQP-5的浓度, 严格按照试剂盒说明书规范操作.
统计学处理 使用SPSS15.0统计分析软件, 采用具有一个重复测量因素的两因素方差分析, 以P<0.05为有统计学意义.
非治疗组中6 h组大鼠活动减少; 12 h组大鼠开始呼吸急促, 同时有血性腹水; 24 h组可见大鼠耸毛, 口鼻周围紫绀, 睑缘和四肢肢端苍白, 喘息明显, 血性腹水增多, 腹围稍增加, 呼吸困难; 随着时间推移, 大鼠呈现越来越严重的呼吸窘迫表现; 36 h组出现1只大鼠死亡; 48 h组又有2只大鼠死亡. PHCD治疗组亦有厌食、竖毛、呼吸急促、活动减少等情况, 但与非治疗组各相应时间点比较明显轻微, 血性腹水明显减少, 且48 h组仅死亡1只大鼠.
PHCD治疗组与非治疗组各相应时间点比较, PaO2上升有统计学差异(χ2 = 503.48, P = 0.000), PaCO2下降有统计学差异(χ2 = 82.83, P = 0.000, 表1).
| PaO2 | PaCO2 | |||||||||
| 6 h | 12 h | 24 h | 36 h | 48 h | 6 h | 12 h | 24 h | 36 h | 48 h | |
| 非治 疗组 | 89.1±4.1 | 81.1±4.2 | 71.3±3.4 | 60.9±3.7 | 48.8±3.2 | 44.3±2.3 | 51.2±1.9 | 56.6±2.3 | 61.1±2.5 | 64.8±3.2 |
| PHCD 治疗组 | 94.1±2.2 | 85.9±2.9 | 80.4±1.6 | 73.0±2.7 | 66.8±4.7 | 42.5±2.6 | 49.5±2.5 | 50.2±1.1 | 53.7±2.9 | 60.0±1.5 |
| χ2值 | 102.64 | 101.69 | 102.49 | 36.55 | 72.45 | 72.83 | 61.75 | 52.22 | 51.41 | 41.07 |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0000 | 0.000 | 0.000 | 0.001 |
PHCD治疗组湿/干质量比值有逐渐增加趋势, 但与非治疗组各相应时间点比较明显下降, 有统计学差异(χ2 = 21.04, P = 0.000, 表2).
| 6 h | 12 h | 24 h | 36 h | 48 h | |
| 非治疗组 | 4.34±0.09 | 4.57±0.13 | 4.79±0.09 | 4.98±0.10 | 5.11±0.15 |
| PHCD治疗组 | 4.35±0.08 | 4.54±0.07 | 4.42±007 | 4.56±0.08 | 4.69±0.17 |
| χ2值 | 2.71 | 6.69 | 5.19 | 2.81 | 4.39 |
| P值 | 0.025 | 0.009 | 0.023 | 0.043 | 0.036 |
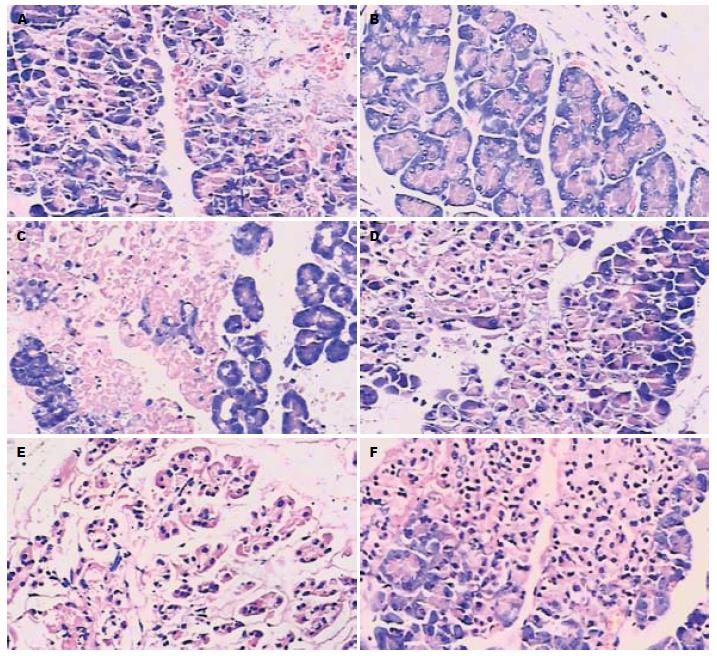
2.4.1 大体观察: 非治疗组注射完牛磺胆酸钠后胰腺组织随即出现明显的弥漫性出血, 6 h在穿刺点附近胰腺组织见明显的出血和肿胀, 局部有暗紫色斑, 腹腔内有少量血性腹水; 12 h胰腺组织出血、肿胀及坏死明显加重, 局部有皂化斑, 并见中等量血性腹水; 24-48 h点胰腺组织出血、肿胀及坏死进一步加重, 并可见多处皂化斑. PHCD治疗组胰腺组织出血和水肿均较非治疗组各相应时间点明显减轻.
2.4.2 镜下观察: 非治疗组6 h可见明显胰腺小叶间水肿, 片状出血, 炎性细胞浸润, 部分腺泡细胞变性; 12-48 h都可见大量炎性细胞浸润, 片状出血, 胰腺小叶结构破坏, 大量腺泡细胞坏死明显. PHCD治疗组6 h点虽可见胰腺部分细胞变性, 腺体呈空泡状, 但与相同时间点非治疗组比较明显减轻; 12-48 h虽可见胰腺小叶结构破坏、片状出血、炎症细胞浸润, 但与相同时间点非治疗组比较明显减轻(图1).
大体观察, 非治疗组6 h肉眼见肺水肿, 少量血性胸水; 12-48 h血性胸水逐渐增多, 肺水肿进行性加重; 暗红色肺表面12 h可见散在的出血点, 24-48 h出血点明显增多, 成大片状, 可见肺淤血. PHCD组各相应时间点肺水肿和淤血均明显较轻. 镜下观察, 非治疗组6 h可见肺间质水肿、充血、中性粒细胞浸润; 12-48 h肺病理组织学改变逐渐加重, 呈现不同程度的肺泡和间质水肿、出血、灶性或片状肺不张, 肺泡间隔增宽, 大量炎症细胞浸润, 肺组织结构紊乱等典型的ALI病理改变. PHCD治疗组肺间质水肿、出血、炎症细胞浸润均明显减轻.
各相同时间点PHCD治疗组血清MIF浓度明显低于非治疗组, 有统计学差异(χ2 = 20.52, P = 0.042, 表3).
| 6 h | 12 h | 24 h | 36 h | 48 h | |
| SAP组 | 158.9±7.9 | 208.0±7.4 | 191.2±7.5 | 177.6±6.5 | 160.8±2.7 |
| PHCD组 | 127.0±5.4 | 165.1±5.4 | 148.2±5.1 | 127.9±5.0 | 113.4±5.4 |
| χ2值 | 10.60 | 9.71 | 11.28 | 9.48 | 8.56 |
| P值 | 0.001 | 0.002 | 0.000 | 0.002 | 0.003 |
各相同时间点PHCD治疗组肺泡灌洗液AQP-5浓度明显高于非治疗组, 有统计学差异(χ2 = 17.22, P = 0.044, 表4).
| 6 h | 12 h | 24 h | 36 h | 48 h | |
| SAP组 | 0.223±0.032 | 0.187±0.017 | 0.143±0.013 | 0.117±0.017 | 0.099±0.014 |
| PHCD组 | 0.312±0.056 | 0.256±0.037 | 0.235±0.031 | 0.200±0.024 | 0.183±0.180 |
| χ2值 | 7.58 | 9.87 | 5.44 | 5.76 | 8.11 |
| P值 | 0.006 | 0.002 | 0.019 | 0.016 | 0.004 |
SAP是一种临床急重症, 病死率高, 预后较差[5], 并发症多, APALI是SAP早期最常见的并发症, 也是SAP早期最主要的死亡原因之一. 临床表现主要为肺内弥漫性炎症细胞浸润、肺血循环障碍、肺毛细血管通透性增加及低氧血症. 1980年Aho等[5]经胆管穿刺, 向胰胆管内注射牛磺胆酸钠, 首次成功诱导了ANP模型. 该模型出色地模拟了临床胰管梗阻、胆汁返流等导致的急性胰腺炎的发生和发展过程, 且操作比较方便, 现已被广泛接受与应用. 研究发现通过改变牛磺胆酸钠的药物浓度、注射速度及注射持续时间可以产生轻重不同的急性胰腺炎. 我们采用向大鼠胰胆管内逆行注射4%牛磺胆酸钠的方法出色的诱导了典型的ANP并发ALI, 病理学检查显示所有实验动物的胰腺组织均出现不同程度的水肿、炎症细胞浸润、灶性或片状出血, 胰腺及周围组织出现脂肪坏死及皂化斑, 同时还伴有血性腹水, 肺组织表现出弥漫性肺实质损伤和肺水肿, 符合APALI的病理改变. 因此, 该模型构建方法本模型制作方法操作简单, 重复性好, 病变产生迅速, 对研究胰腺炎的发生机制和防治效果具有一定的实用价值.
临床早期治疗APALI的重要手段之一就是药物干预, 但目前治疗药物均存在疗效不满意或不良反应较大等特点, 因此急需寻找更安全有效的APALI治疗药物. PHCD是一类中国原创的新型选择性长效抗胆碱药, 与其他抗胆碱药不同的是, 他具有选择性M1、M3和N1、N2受体拮抗作用, 无论在外周和中枢均可发挥作用, 且抗胆碱能作用更强. 肺的通气道主要分布M3受体, 故PHCD具有持续作用时间长、心血管不良反应小等特点. 近年来的研究表明PHCD可能对ALI具有治疗作用, 他能改善肺部微循环、降低毛细血管壁的通透性、促使溶酶体释放减少. 本次实验结果显示, PHCD可抑制分布于气道平滑肌上的M受体, 松弛平滑肌, 减少气管黏液分泌, 改善肺部通气.
伴随着人们对SAP认识的深入, APALI中炎症介质的作用逐渐受到人们的关注, 机体自身出现的多种炎症介质所形成的"瀑布效应"可使炎症反应扩大甚至失控, 最终导致以细胞自身破坏为特征的全身性炎症反应. TNF-α和IL-6等细胞因子会不断在胰腺局部产生并大量进入血液中, 形成强大的网络级联式反应, 继而导致远处器官内的单核细胞巨噬系统激活, 释放出毒性介质, 成为继发肺部严重炎性反应的始动因素. 新的研究发现要反映急性胰腺炎的病变和预后, 还有更加重要的细胞因子参与APALI的致死效应. 目前MIF的特殊生物学功能及其在多种疾病中的作用使得其日益受到人们的关注. MIF是一种可溶性细胞因子, 具有促炎性作用, 在APALI中发挥了重要作用. MIF由活化的T淋巴细胞分泌, 可抑制单核/巨噬细胞移动, 促进巨噬细胞在炎症局部浸润、增生、激活, 并分泌其他的促炎因子如 IL-1β、IL-6和TNF-α等, 从而加剧炎性反应. 我们通过实验发现PHCD治疗组与非治疗组比较血清MIF下降, 提示PHCD可抑制致炎因子MIF的产生, 减轻MIF引起的炎症"瀑布效应". 其机制可能是通过神经性胆碱能系统发挥作用, 使细胞对缺血缺氧的耐受性提高, 稳定细胞膜及溶酶体、线粒体等细胞器的膜结构, 减少溶酶体的释放[6], 从而抑制和减少致炎细胞因子MIF的产生和聚集, 抑制氧自由基生成、减轻肺泡上皮细胞损伤[7,8], 有效减轻肺泡的渗出, 有利于减轻肺间质和肺泡内水肿[9], 并阻滞了肺部胆碱能受体有效解除血管平滑肌痉挛, 降低肺血管阻力. 因此, PHCD可减轻大鼠ANP并发ALI的肺部炎症反应.
水通道蛋白是一组小分子跨膜蛋白, 负责渗透压驱动下水转运, 有时也转运甘油. 近年来的研究发现, 这一家族蛋白在肿瘤的生长和转移、细胞形态、细胞凋亡、黏液的分泌等方面具有重要作用[10,11]. 水通道蛋白有13种, 其中AQP-1、AQP-3、AQP-4和AQP-5这4种表达在肺及气道. 在AQP-1、AQP-3、AQP-4和AQP-5基因敲除小鼠中, 匹鲁卡品刺激后应用特殊显微镜直接观察小鼠上呼吸道, 只有AQP-5基因敲除小鼠气道黏膜下腺的液体分泌减低, 其他水通道蛋白基因敲除小鼠的液体分泌并无明显改变. 收集AQP-5基因敲除小鼠上呼吸道分泌的液体进行检测, 毛果芸香碱激发AQP-5缺失小鼠呼吸道黏液分泌较野生型小鼠降低2倍, 而黏液中蛋白和Cl-明显升高, 同时免疫组化显示黏膜下腺的形态和密度无改变, 说明腺体高分泌并非腺体数量和形态改变, 而是AQP-5功能缺失所致. 以上结果提示在肺组织4种水通道蛋白中, AQP-5在肺和气道的重要生理功能如肺泡液体吸收或气道表面液体调节中具有重要作用. 我们通过实验证实PHCD能增加ANP并发ALI大鼠肺泡灌洗液中AQP-5的含量, 降低肺湿/干质量比值, 并有效改善肺气体交换功能. 表明PHCD能保护肺泡上皮细胞, 维持其合成与分泌AQP-5的功能, 从而保持良好的肺表面张力, 防止肺泡萎陷, 维持肺功能作用. 主要原因可能是: PHCD可以降低胆碱能神经的张力, 避免胆碱能神经反射的加强, 从而使呼吸道静态张力降低, 松弛呼吸道平滑肌, 减少黏液分泌及血管渗出, 改善气道通气功能[12]; PHCD能够解除血管平滑肌痉挛, 调节微血管舒缩, 开放闭锁的微循环前后通路, 重新恢复灌流, 减轻对微血管内皮细胞骨架的影响, 调控胞浆内Ca2+的有效浓度等, 从而抑制肺微血管的通透性增加[13]; PHCD能够通过抗M胆碱作用抑制胆碱能促炎效应的发生等.
总之, PHCD不仅可以改善APALI的肺损伤程度, 甚至可能在一定程度上阻止ALI向ARDS进展, PHCD将有可能成为一种新的有效治疗APALI的可行性选择手段.
多种因素包括胆石、乙醇、缺血、高脂血症和高钙血症等均可形成急性坏死性胰腺炎(ANP), 并促使炎症从胰腺局部迅速扩展到全身, 发生全身炎症反应综合征和多器官衰竭, 其中急性肺损伤(ALI)是SAP早期最常见的并发症.
黄恒青, 主任医师, 福建省第二人民医院消化内科; 冯志杰, 主任医师, 河北医科大学第二医院消化内科
1980年Aho等经胆管穿刺, 向胰胆管内注射牛磺胆酸钠, 首次成功诱导了ANP模型. 该模型出色的模拟了临床胰管梗阻、胆汁返流等导致的急性胰腺炎的发生和发展过程, 且操作比较方便, 现已被广泛接受与应用.
盐酸戊乙奎醚(PHCD)不仅可以改善APALI的肺损伤程度, 甚至可能在一定程度上阻止ALI向ARDS进展, PHCD将有可能成为一种新的有效治疗APALI的可行性选择手段.
本文为动物基础研究, 立题有据, 采用的技术路线可行, 观察指标较全、较新, 对重症急性胰腺炎的防治具有一定的理论意义.
编辑: 李军亮 电编:闫晋利
| 2. | Lankisch PG, Ihse I. Bile-induced acute experimental pancreatitis. Scand J Gastroenterol. 1987;22:257-260. [PubMed] [DOI] |
| 5. | Pezzilli R, Mancini F. Assessment of severity of acute pancreatitis: a comparison between old and most recent modalities used to evaluate this perennial problem. World J Gastroenterol. 1999;5:283-285. [PubMed] |
| 10. | Blanc L, Liu J, Vidal M, Chasis JA, An X, Mohandas N. The water channel aquaporin-1 partitions into exosomes during reticulocyte maturation: implication for the regulation of cell volume. Blood. 2009;114:3928-3934. [PubMed] [DOI] |
| 11. | Verkman AS. Aquaporins: translating bench research to human disease. J Exp Biol. 2009;212:1707-1715. [PubMed] [DOI] |
| 12. | Bone RC. Sir Isaac Newton, sepsis, SIRS, and CARS. Crit Care Med. 1996;24:1125-1128. [PubMed] [DOI] |