修回日期: 2011-11-12
接受日期: 2011-12-07
在线出版日期: 2011-12-18
目的: 探讨胃癌组织中CHD5和KLF5的表达意义及其与预后的关系.
方法: 收集2000-01/2007-06在昆明医学院第二附属医院手术切除的208例胃癌组织标本, 采用免疫组织化学SP法检测胃腺癌组织、癌旁组织中CHD5和KLF5的表达; 采用χ2检验和Fisher精确概率法分析胃癌中CHD5和KLF5的表达与临床病理指标的相关性; 采用Cox比例风险模型方法进行多因素分析; 应用Kaplan-Meier生存分析法判断CHD5和KLF5表达与各临床病理参数及其预后的关系.
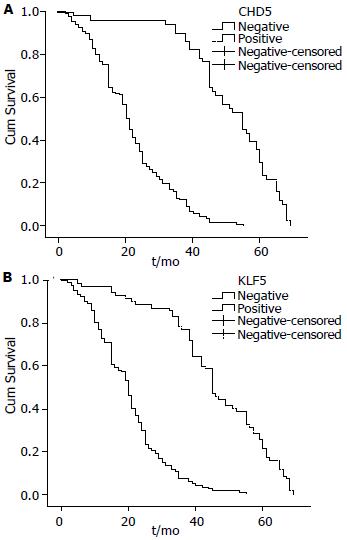
结果: 胃癌组织中CHD5和KLF5呈明显低表达特点. 其中, CHD5的表达与患者年龄、肿瘤分化程度、浸润深度、TNM分期、淋巴结和远处转移等有关, 差异有统计学意义(P<0.05); KLF5的表达与肿瘤分化程度、浸润深度、TNM分期、淋巴结和远处转移等有关, 差异有统计学意义(P<0.05). 多因素分析显示, 患者的生存时间主要受患者性别、肿瘤部位、组织分化程度、远处转移、TNM分期、CHD5和KLF5的异常表达等因素影响; Kaplan-Meier生存分析显示, CHD5、KLF5阴性组的中位生存期分别为(21.00 mo±1.36 mo)、(20.00 mo±1.54 mo), 而CHD5、KLF5阳性组的中位生存期分别为(55.00 mo±6.97 mo)、(45.00 mo±3.27 mo). CHD5和KLF5阴性表达组患者的1、3年生存率明显低于阳性表达患者, 差异均有统计学意义.
结论: 胃癌组织中CHD5和KLF5低表达与胃癌的侵袭转移及不良预后存在相关性. 提示CHD5和KLF5蛋白的异常表达可能参与胃黏膜恶性转变以及胃癌发生发展等生物学过程.
引文著录: 罗登, 赵公芳, 路明亮, 黄华, 常江, 郑梦瑶. CHD5与KLF5蛋白在胃癌组织中的表达及其与预后的关系. 世界华人消化杂志 2011; 19(35): 3603-3609
Revised: November 12, 2011
Accepted: December 7, 2011
Published online: December 18, 2011
AIM: To investigate the expression of chromodomain helicase DNA-binding protein 5 (CHD5) and Krüppel-like factor 5 (KLF5) in gastric cancer, and to evaluate whether CHD5 and KLF5 can be used as prognostic markers in gastric cancer.
METHODS: Immunohistochemistry staining was performed to detect the expression of CHD5 and KLF5 proteins in 208 surgical specimens of gastric cancer and 68 noncancerous gastric tissue specimens. The association of CHD5 and KLF5 expression in gastric cancer with the survival time of patients was retrospectively analyzed.
RESULTS: Reduced expression of CHD5 and KLF5 frequently occurred in gastric cancer. The positive rates of CHD5 and KLF5 expression in gastric cancer were 29.33% (61/208) and 38.46% (80/208), respectively. CHD5 expression was correlated with age, histologic differentiation, depth of invasion, regional lymph node metastasis, distant metastasis, and TNM stage (all P < 0.05). KLF5 expression was correlated with histologic differentiation, depth of invasion, lymph node metastasis, distant metastasis, and TNM stage (all P < 0.05). Further multivariate analysis revealed that patient's gender, tumor location, histologic differentiation, distant metastasis, TNM stage, and expression of CHD5 and KLF5 were independent prognostic factors in patients with gastric cancer. The Kaplan-Meier plot showed that the median survival was 21.00 ± 1.36 months in patients with negative expression of CHD5 and 20.00 ± 1.54 months in those with negative expression of KLF5. The median survival time was 55.00 ± 6.97 months in patients with positive CHD5 expression and 45.00±3.27 months in patients with positive KLF5 expression. The cumulative 1- and 3-year survival rates were significantly lower in patients with negative expression of CHD5 and KLF5 than in those with positive expression of these two proteins.
CONCLUSION: Reduced expression of CHD5 and KLF5 in gastric cancer is associated with tumor metastasis and poor survival. Ectopic expression of CHD5 and KLF5 proteins may play an important role in the tumorigenesis and progression of gastric carcinoma.
- Citation: Luo D, Zhao GF, Lu ML, Huang H, Chang J, Zheng MY, Gastroenterology DO, University TSAHOKM, 650101 K, Province Y, China. Association of CHD5 and KLF5 expression with prognosis in gastric carcinoma Deng Luo, Gong-Fang Zhao, Ming-Liang Lu, Hua Huang, Jiang Chang, Meng-Yao Zheng. Shijie Huaren Xiaohua Zazhi 2011; 19(35): 3603-3609
- URL: https://www.wjgnet.com/1009-3079/full/v19/i35/3603.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i35.3603
胃癌(Gastric cancer)是起源于胃黏膜上皮细胞的恶性肿瘤, 目前已成为全球继肺癌、乳腺癌、大肠癌之后发病率第4位的肿瘤, 也是导致肿瘤性死亡的第2位原因[1,2]. 因此, 探讨胃癌的发生发展及浸润转移等过程中的分子机制, 寻求诊断和治疗的有效分子靶标尤为重要. 近年来, Chromodomain helicase DNA-binding protein (CHD5)基因被认为是一种抑癌基因, 通过pl9Arf/p53通路调控细胞增殖、衰老和凋亡, 是抑癌调控系统的关键因子[3,4]. 在肿瘤形成过程中, CHD5基因有较高的甲基化发生率[5]. KLF5(Krüppel-like factor 5)是一种DNA结合转录调节因子, 属于KLF(Krüppel-like factors)家族, 广泛表达于人体骨骼肌、肺、乳腺、结肠、小肠、前列腺、胰腺、肾脏等多种组织. 其不仅在细胞增殖、分化及胚胎形成中发挥重要作用, 还在肿瘤病理过程中发挥着重要作用[6,7]. 现已证实, 结肠癌中KLF5 mRNA的表达下降, 提示KLF5的下调可能参与了结肠癌的发生发展过程. 本课题以临床胃癌患者作为研究对象, 采用免疫组织化学SP法检测CHD5和KLF5在胃癌及癌旁组织中的表达, 以期分析两者与肿瘤临床病理特征的相关性及在肿瘤发生发展中的作用, 并进一步了解两者与胃癌预后的关系.
收集2000-01/2007-06昆明医学院第二附属医院手术切除并经病理证实的208例患者的胃腺癌标本, 其均为原发性肿瘤, 同时选取68例正常胃组织(距胃癌原发灶>5 cm)作对照. 所选病例均有随访资料, 所有患者术前均未接受过化学治疗和放射治疗. 208例患者中, 男(n = 121), 女(n = 87), 男女比例1.39:1; 年龄29-84岁(平均55岁), <50岁(n = 70), ≥50岁(n = 138); 肿瘤部位: 胃近端14例, 胃体部86例, 胃远端108例; 切除肿瘤癌灶<5 cm (n = 102), ≥5cm (n = 106); 按美国癌症联合委员会(AJCC)胃癌TNM分期(2010年第7版)标准[8,9], T1(n = 17), T2(n = 43), T3(n = 120), T4(n = 28); N0(n = 103), N1(n = 32), N2(n = 40), N3(n = 33); M0(n = 177), M1(n = 31);Ⅰ期(n = 47), Ⅱ期(n = 70), Ⅲ期(n = 60), Ⅳ期(n = 31). 病理组织学类型: 乳头状腺癌(n = 8), 管状腺癌(n = 129), 黏液腺癌(n = 45), 印戒细胞癌(n = 26); 高分化癌(n = 13), 中分化癌(n = 63), 低分化癌(n = 128)及未分化癌或其他(n = 4).
兔抗人CHD5多克隆抗体购自美国Santa Cruz公司; 兔抗人KLF5多克隆抗体购自美国Millipore公司; 免疫组织化学SP法试剂盒及BAD显色剂均购自中国福州迈新生物技术有限公司.
1.2.1 实验免疫组化染色及结果判定: 所有标本均经100 g/L甲醛固定, 常规石蜡包埋, 3 μm切片, SP免疫组化染色步骤和抗体稀释度均按产品说明书进行. PBS代替一抗做阴性对照, 显微镜下观察结果.
根据肿瘤细胞显色的比例及染色强度, 对CHD5和KLF5表达做半定量判定. 为减少主观性, 一般至少由2人判断打分. 在显微镜下按显色程度肉眼评分: 弱染色为1分; 中等染色为2分; 强染色为3分. 在高倍镜下按阳性细胞所占百分比率计算评分: 阳性细胞数占10%-50%为2分; 50%-80%为3分; ≥80%为4分. 最后将肉眼一般评分与高倍镜下百分比率计算评分之和进行最终判断, 无论染色强度如何, 细胞阳性率<10%或少于2分者为阴性(-); 2-3分为弱阳性(+); 4-7分为强阳性(++).
1.2.2 随访: 纳入本研究的所有病例均有完整随访资料, 生存期从胃癌诊断之日开始计算, 至本研究结束(2011-06-23)止. 随访时间单位为月, 研究终点(阳性结局)定义为患者因胃癌或相应并发症死亡, 研究结束时仍未出现阳性结局者定为删失. 本研究随访时间1.0-64.2 mo(中位随访时间27.3 mo), 随访方式为患者复诊、电话及信函.
统计学处理 使用SPSS16.0统计软件, 细胞阳性率的比较采用χ2检验和Fisher精确概率法; 采用非参数检验进行单因素分析CHD5和KLF5的表达与临床病理指标的相关性, 筛查危险因素; 采用COX风险回归模型方法进行多因素分析; 用Kaplan-Meier 法计算生存率及绘制生存曲线, 并用Log-rank法进行组间比较. P<0.05具有统计学意义.
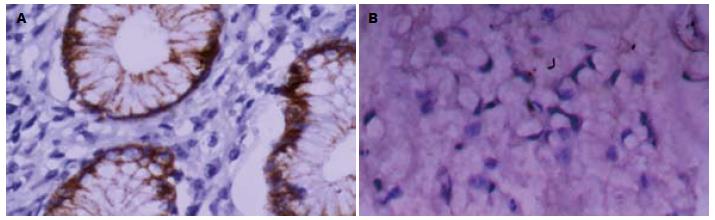
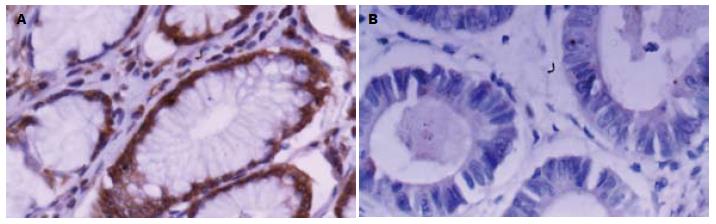
胃癌组织中CHD5和KLF5呈明显低表达特点. 208例胃癌组织中CHD5的阳性表达率为29.33%(61/208), KLF5的阳性表达率为38.46%(80/208), 68例正常的胃黏膜中可见CHD5高表达76.47%(52/68)和KLF5高表达66.18%(45/68)(图1, 2).
经单因素分析发现, CHD5蛋白的表达与患者年龄、肿瘤分化程度、浸润深度、TNM分期、区域淋巴结及远处转移有关, 而与性别、肿瘤部位、瘤体大小、组织学类型无关. 随着胃壁浸润深度的加深, CHD5的表达呈下降趋势, T1、T2、T3、T4各组的阳性率分别为88.2%、53.5%、18.3%、3.6%, 差异有统计学意义(χ2 = 56.533, P<0.0001). 另外, 有远处转移者CHD5表达阳性率为6.5%, 低于无转移组33.3%, 且差异有统计学意义(χ2 = 9.197, P = 0.002). 随着TNM分期的增加, CHD5的表达也逐渐下降, 且Ⅰ+Ⅱ期与Ⅲ+Ⅳ期之间差别显著, 有统计学意义(χ2 = 85.545, P<0.0001). KLF5蛋白的表达与患者性别、年龄、肿瘤部位、瘤体大小、组织学类型无关, 而与肿瘤分化程度、浸润深度、TNM分期、区域淋巴结及远处转移有关(P<0.05). 与CHD5的表达相似, 随着胃壁浸润深度的加深及TNM分期的增加, KLF5蛋白的表达也呈现出逐渐下降趋势, 并在淋巴结及远处转移时呈低表达现象, 差异均有统计学意义(表1). 应用COX比例风险回归模型进行多因素分析发现, 患者性别(P = 0.003)、肿瘤部位(P = 0.019)、组织分化程度(P = 0.019)、远处转移(P<0.0001)、TNM分期(P<0.0001)、CHD5(P<0.0001)和KLF5(P<0.0001)的表达为影响胃癌预后的独立危险因素(表2).
| 临床病理特征 | n | CHD5 | KLF5 | ||||||
| - | + | χ2值 | P 值 | - | + | χ2值 | P值 | ||
| 年龄 | |||||||||
| <50岁 | 70 | 43(61.4%) | 27(38.6%) | 4.350 | 0.037 | 39(55.7%) | 31(44.3%) | 1.512 | 0.219 |
| ≥50岁 | 138 | 104(75.4%) | 34(24.6%) | 89(64.5%) | 49(35.5%) | ||||
| 性别 | |||||||||
| 男 | 121 | 84(69.4%) | 37(30.6%) | 0.219 | 0.640 | 76(62.8%) | 45(37.2%) | 0.198 | 0.657 |
| 女 | 87 | 63(72.4%) | 24(27.6%) | 52(59.8%) | 35(40.2%) | ||||
| 肿瘤部位 | |||||||||
| 胃近端 | 14 | 12(85.7%) | 2(14.3%) | 1.773 | 0.412 | 11(78.6%) | 3(21.4%) | 2.707 | 0.258 |
| 胃体部 | 86 | 61(70.9%) | 25(29.1%) | 55(64.0%) | 31(36.0%) | ||||
| 胃远端 | 108 | 74(68.5%) | 34(31.5%) | 62(57.4%) | 46(42.6%) | ||||
| 瘤体大小 | |||||||||
| <5 cm | 102 | 72(70.6%) | 30(29.4%) | 0.001 | 0.979 | 64(62.7%) | 38(37.3%) | 0.123 | 0.726 |
| ≥5 cm | 106 | 75(70.8%) | 31(29.2%) | 64(60.4%) | 42(39.6%) | ||||
| 组织类型 | |||||||||
| 乳头状腺癌 | 8 | 4(50%) | 4(50%) | 5.816 | 0.121 | 4(50%) | 4(50%) | 5.412 | 0.144 |
| 管状腺癌 | 129 | 86(66.7%) | 43(33.3%) | 73(56.6%) | 56(43.4%) | ||||
| 黏液腺癌 | 45 | 36(80.0%) | 9(20.0%) | 31(68.9%) | 14(31.1%) | ||||
| 印戒细胞癌 | 26 | 21(80.8%) | 5(19.2%) | 20(76.9%) | 6(23.1%) | ||||
| 分化程度 | |||||||||
| 高分化 | 13 | 7(53.8%) | 6(46.2%) | 11.534 | 0.003 | 5(38.5%) | 8(61.5%) | 16.771 | <0.0001 |
| 中分化 | 63 | 36(57.1%) | 27(42.9%) | 28(44.4%) | 35(55.6%) | ||||
| 低分化 | 128 | 102(79.69%) | 26(20.31%) | 92(71.9%) | 36(28.1%) | ||||
| 未分化 | 4 | 2(50%) | 2(50%) | 3(75.0%) | 1(25.0%) | ||||
| 组织侵犯 | |||||||||
| T1+T2 | 60 | 22(36.7%) | 38(63.3%) | 56.533 | <0.0001 | 25(41.7%) | 35(58.3%) | 59.885 | <0.0001 |
| T3+T4 | 148 | 125(84.5%) | 23(15.5%) | 126(85.1%) | 22(14.9%) | ||||
| 区域淋巴转移 | |||||||||
| N0 | 103 | 44(42.7%) | 59(57.3%) | 77.018 | <0.0001 | 32(31.1%) | 71(68.9%) | 80.185 | <0.0001 |
| N1 | 32 | 31(96.9%) | 1(3.1%) | 30(93.8%) | 2(6.2%) | ||||
| N2 | 40 | 39(97.5%) | 1(2.5%) | 36(90.0%) | 4(10.0%) | ||||
| N3 | 33 | 33(100%) | 0(0%) | 30(90.9%) | 3(9.1%) | ||||
| 远处转移 | |||||||||
| M0 | 177 | 118(66.7%) | 59(33.3%) | 9.197 | 0.002 | 99(55.9%) | 78(44.1%) | 15.771 | <0.0001 |
| M1 | 31 | 29(93.5%) | 2(6.5%) | 29(93.5%) | 2(6.5%) | ||||
| TNM 分期 | |||||||||
| I+II | 117 | 59(50.43%) | 58(49.57%) | 85.545 | <0.0001 | 50(42.74%) | 67(57.26%) | 63.239 | <0.0001 |
| III+IV | 91 | 88(96.7%) | 3(3.3%) | 78(85.71%) | 13(14.29%) | ||||
| 危险因素 | P值 | OR值 | 95% CI |
| 性别 | 0.003 | 1.609 | 1.176-2.200 |
| 肿瘤部位 | 0.019 | 1.365 | 1.051-1.773 |
| 组织分化 | 0.019 | 0.723 | 0.550-0.949 |
| 远处转移 | <0.0001 | 4.946 | 2.273-10.762 |
| TNM分期 | <0.0001 | 2.631 | 1.787-3.873 |
| CHD5 | <0.0001 | 0.248 | 0.134-0.456 |
| KLF5 | <0.0001 | 0.372 | 0.227-0.608 |
经统计, CHD5和KLF5在胃癌组织中有126例同时呈阴性表达, 而二者同时阳性表达数量为59例. 经Spearman等级相关分析显示, CHD5和KLF5在胃癌中的表达呈高度正相关, 且具有统计学意义(r = 0.771, P<0.0001).
应用Kaplan-Meier法进行生存分析显示, CHD5阴性表达组中位生存期为(21.00±1.36) mo, 而阳性组为(55.00±6.97) mo; CHD5阴性组1, 3年生存率分别为76.6%、12.1%, 明显低于阳性表达组患者的1, 3年生存率(96.1%, 90.2%), 且Log-rank法进行2组间生存曲线比较, 差异有统计学意义(χ2 = 110.030, P<0.0001). KLF5阴性表达组中位生存期为(20.00±1.54) mo, 而阳性组为(45.00±3.27) mo; KLF5阴性组1, 3年生存率分别为73.0%、7.4%, 明显低于阳性表达组患者的1, 3年生存率(97.1%, 77.1%), 且Log-rank检验, 差异有统计学意义(χ2 = 109.952, P<0.0001, 图3).
众所周知, 肿瘤形成的过程包括始发突变、潜伏、促癌和演进[10-13]. 而这些过程往往涉及多个基因的改变, 与原癌基因、抑癌基因突变的逐渐积累有关[14-17]. CHD蛋白家族属于SWI2/SNF2相关的ATP酶超家族, 包含有染色质调节域(Chromodomains)、类SWI2/SNF2 ATP酶/解旋酶域(SWI2/SNF2-like ATPase/Helicases)和DNA结合域(DNA-binding domain)等结构[18,19]. 近年来, CHD5被认为是肿瘤抑制途径的关键调节因子, 定位于1p36基因组片段内[20,21]. 现已证实, 在神经母细胞瘤、黑色素瘤、血液系统的恶性肿瘤(AML、CML)和上皮源性的恶性肿瘤(甲状腺癌、结肠癌、宫颈癌、乳腺癌)中常发现CHD5的缺失, 提示CHD5作为一种新型肿瘤抑制因子在肿瘤病理过程中起到重要作用[22]. 本研究结果表明, CHD5在胃癌组织中呈明显低表达趋势, 208例胃癌组织中CHD5的阳性表达率为29.33%(61/208), 而68例正常的胃黏膜中可见CHD5高表达76.47%(52/68). 此外, 单因素分析发现CHD5蛋白的表达与患者年龄、肿瘤分化程度、浸润深度、TNM分期、区域淋巴结及远处转移有关, 而与性别、肿瘤部位、瘤体大小、组织学类型无关. 不仅如此, 随着胃壁浸润深度的加深及TNM分期的增加, CHD5的表达呈逐渐下降趋势, 提示CHD5异常表达与胃癌的恶性行为有关, 可能在胃癌发生发展等的生物学过程中起到一定作用.
之前, 唐莹莹等[23]在检测CHD5在30例肝癌及癌旁组织中的表达时发现, CHD5 mRNA在肝癌组织、癌旁组织的缺失率分别为53.3%(16/30)、13.3%(4/30). 随后, Wang等[24]发现CHD5在正常胃组织中呈高表达, 而在所有胃癌细胞株中表达下调; 另外, 还发现在胃癌细胞株及胃癌组织中CHD5启动子呈明显甲基化反应, 而在癌旁正常胃黏膜中并未发生甲基化或呈弱甲基化反应; 因此, Wang等认为, CHD5启动子甲基化反应可能是导致CHD5蛋白表达下调并参与胃癌形成的主要原因. 虽然实验结果与本研究基本相一致, 但因实验样本数量太少, 且并未进一步研究CHD5与胃癌患者预后的关系, CHD5的表达与胃癌临床预后的关系仍不十分清楚. 本实验回顾性分析了208例胃癌患者的临床和随访资料, 结合CHD5在胃癌患者中表达情况, 应用Kaplan-Meier法生存分析发现, CHD5阴性表达组中位生存期为21 mo, 而阳性组为55 mo; CHD5阴性组1, 3年生存率分别为76.6%、12.1%, 明显低于阳性表达组患者的1, 3年生存率(96.1%, 90.2%), 且Log-rank法进行两组间生存曲线比较, 差异有统计学意义(χ2 = 110.030, P<0.0001). 因此, 提示CHD5的异常表达可能与胃癌的不良预后有关.
KLF5是KLF家族转录因子中的成员之一, 广泛地参与细胞转化、增殖等相关基因的转录调节, 以保障机体各类细胞的正常增殖分化和组织发育的调控[25,26]. 然而, 这种调控一旦发生异常, 将导致细胞的无限增殖, 促进癌症的发生. 之前研究显示, KLF5在大多数肿瘤组织中呈表达缺失或者下调趋势, 提示KLF5可能起到抑癌基因的作用[27-29]. 本研究的结果表明, 与CHD5表达相似, KLF5在胃癌组织中同样呈低表达特点, 208例胃癌组织中KLF5的阳性表达率为38.46%(80/208), 而68例正常的胃黏膜中KLF5表达率为66.18%(45/68). KLF5蛋白的表达与患者性别、年龄、肿瘤部位、瘤体大小、组织学类型无关, 而与肿瘤分化程度、浸润深度、TNM分期、区域淋巴结及远处转移有关. 且同样随着胃壁浸润深度的加深及TNM分期的增加, KLF5的表达也呈逐渐下降趋势.
虽然以往许多实验提示KLF5在肿瘤发生发展中可能起到抑癌基因的作用, 但是最近, Mori等[30]在探索KLF5在胰腺癌中的表达时发现, KLF5呈过度表达趋势. 不仅如此, 也有实验发现, KLF5的高表达与乳腺癌的预后差有关[31]. 因此, 需要进一步的探索KLF5的生物学功能, 特别是在肿瘤形成过程中的调节机制, 以明确KLF5是作为原癌基因还是抑癌基因而发挥作用. 本组研究发现, KLF5的表达与胃癌患者的预后有关, KLF5阴性表达组中位生存期为20 mo, 而阳性组为 45 mo; KLF5阴性组1, 3年生存率分别为73.0%、7.4%, 明显低于阳性表达组患者的1, 3年生存率(97.1%, 77.1%), 且Log-rank检验, 差异有统计学意义(χ2 = 109.952, P<0.0001). 因此, 提示KLF5与胃癌的发生、发展及不良预后密切相关.
此外, 本组实验进一步行多因素分析发现, 患者性别、肿瘤部位、组织分化程度、远处转移、TNM分期、CHD5和KLF5的表达为影响胃癌预后的独立危险因素. 因CHD5和KLF5在大多数肿瘤中呈抑癌基因特点, 本组将两者同时在胃癌组织中进行研究, 以期探索两种蛋白的表达之间有无相关性. 经Spearman等级相关分析显示, CHD5和KLF5在胃癌中的表达呈高度正相关, 且存在统计学意义(r = 0.771, P<0.0001). 故而推测二者在胃癌的形成过程可能存在相互调节、协同效应.
总之, CHD5和KLF5与胃癌的发生、发展密切相关, CHD5和KLF的表达下调可能对胃癌的恶性程度和预后起到一定影响作用. 但毕竟肿瘤的发生、发展过程受多种因素的影响, 是多种基因相互协调、相互作用的结果. 有关CHD5和KLF5参与胃癌形成的具体机制及相关调节途径有待于更深入的探索. 相信随着对CHD5和KLF5研究的不断深入, 不久将来可为胃癌的诊断和分子靶向治疗提供了崭新的思路.
胃癌已成为全球继肺癌、乳腺癌、大肠癌之后发病率第4位的肿瘤, 也是导致肿瘤性死亡的第2位原因. 探讨胃癌的发生发展及浸润转移等过程中的分子机制, 寻求诊断和治疗的有效分子靶标尤为重要.
陈卫昌, 教授, 主任医师, 苏州大学附属第一医院
近年来, CHD5被认为是肿瘤抑制途径的关键调节因子, 在多种恶性肿瘤中常发现CHD5的缺失, 提示CHD5作为一种新型肿瘤抑制因子在肿瘤病理过程中起到重要作用. 同样, KLF5在大多数肿瘤组织中也呈表达缺失或者下调趋势, 提示KLF5可能起到抑癌基因的作用.
本文通过病例研究, 综合分析了CHD5和KLF5在胃癌中的表达情况及与胃癌生物学行为和预后的关系.
本研究采用免疫组织化学的方法检测CHD5和KLF5蛋白在胃癌组织的表达情况, 有助于阐释CHD5和KLF5在胃癌发生发展中的机制, 并为判断预后提供了参考依据.
本文采用免疫组织化学方法研究了CHD5与KLF5蛋白在胃癌组织中的表达及其与预后的关系, 有一定的科学性和可读性, 有潜在的研究价值.
编辑: 张姗姗 电编:闫晋利
| 1. | Ajani JA, Barthel JS, Bekaii-Saab T, Bentrem DJ, D'Amico TA, Das P, Denlinger C, Fuchs CS, Gerdes H, Hayman JA. Gastric cancer. J Natl Compr Canc Netw. 2010;8:378-409. [PubMed] |
| 2. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 3. | Schuster EF, Stöger R. CHD5 defines a new subfamily of chromodomain-SWI2/SNF2-like helicases. Mamm Genome. 2002;13:117-119. [PubMed] [DOI] |
| 4. | Bagchi A, Papazoglu C, Wu Y, Capurso D, Brodt M, Francis D, Bredel M, Vogel H, Mills AA. CHD5 is a tumor suppressor at human 1p36. Cell. 2007;128:459-475. [PubMed] [DOI] |
| 5. | Gorringe KL, Choong DY, Williams LH, Ramakrishna M, Sridhar A, Qiu W, Bearfoot JL, Campbell IG. Mutation and methylation analysis of the chromodomain-helicase-DNA binding 5 gene in ovarian cancer. Neoplasia. 2008;10:1253-1258. [PubMed] |
| 6. | Dong JT, Chen C. Essential role of KLF5 transcription factor in cell proliferation and differentiation and its implications for human diseases. Cell Mol Life Sci. 2009;66:2691-2706. [PubMed] [DOI] |
| 7. | Bateman NW, Tan D, Pestell RG, Black JD, Black AR. Intestinal tumor progression is associated with altered function of KLF5. J Biol Chem. 2004;279:12093-12101. [PubMed] [DOI] |
| 8. | Washington K. 7th edition of the AJCC cancer staging manual: stomach. Ann Surg Oncol. 2010;17:3077-3079. [PubMed] [DOI] |
| 9. | Santiago JM, Sasako M, Osorio J. [TNM-7th edition 2009 (UICC/AJCC) and Japanese Classification 2010 in Gastric Cancer. Towards simplicity and standardisation in the management of gastric cancer]. Cir Esp. 2011;89:275-281. [PubMed] [DOI] |
| 10. | Resende C, Ristimäki A, Machado JC. Genetic and epigenetic alteration in gastric carcinogenesis. Helicobacter. 2010;15 Suppl 1:34-39. [PubMed] [DOI] |
| 11. | Watanabe Y, Maekawa M. Methylation of DNA in cancer. Adv Clin Chem. 2010;52:145-167. [PubMed] [DOI] |
| 12. | Ruf W, Disse J, Carneiro-Lobo TC, Yokota N, Schaffner F. Tissue factor and cell signalling in cancer progression and thrombosis. J Thromb Haemost. 2011;9 Suppl 1:306-315. [PubMed] [DOI] |
| 13. | Berger AH, Knudson AG, Pandolfi PP. A continuum model for tumour suppression. Nature. 2011;476:163-169. [PubMed] [DOI] |
| 15. | Bardella C, Pollard PJ, Tomlinson I. SDH mutations in cancer. Biochim Biophys Acta. 2011;1807:1432-1443. [PubMed] |
| 16. | Saad AF, Hu W, Sood AK. Microenvironment and pathogenesis of epithelial ovarian cancer. Horm Cancer. 2010;1:277-290. [PubMed] [DOI] |
| 17. | 刘 伟, 王 丽, 余 英豪, 王 旭洲, 武 一曼, 吴 在增, 欧阳 学农, 王 烈. k-ras基因在中国结直肠癌患者中的突变状态. 世界华人消化杂志. 2011;19:1367-1374. [DOI] |
| 18. | Thompson PM, Gotoh T, Kok M, White PS, Brodeur GM. CHD5, a new member of the chromodomain gene family, is preferentially expressed in the nervous system. Oncogene. 2003;22:1002-1011. [PubMed] [DOI] |
| 19. | Fujita T, Igarashi J, Okawa ER, Gotoh T, Manne J, Kolla V, Kim J, Zhao H, Pawel BR, London WB. CHD5, a tumor suppressor gene deleted from 1p36.31 in neuroblastomas. J Natl Cancer Inst. 2008;100:940-949. [PubMed] [DOI] |
| 20. | Wong RR, Chan LK, Tsang TP, Lee CW, Cheung TH, Yim SF, Siu NS, Lee SN, Yu MY, Chim SS. CHD5 Downregulation Associated with Poor Prognosis in Epithelial Ovarian Cancer. Gynecol Obstet Invest. 2011;72:203-207. [PubMed] [DOI] |
| 21. | Wang J, Chen H, Fu S, Xu ZM, Sun KL, Fu WN. The involvement of CHD5 hypermethylation in laryngeal squamous cell carcinoma. Oral Oncol. 2011;47:601-608. [PubMed] [DOI] |
| 22. | Mulero-Navarro S, Esteller M. Chromatin remodeling factor CHD5 is silenced by promoter CpG island hypermethylation in human cancer. Epigenetics. 2008;3:210-215. [PubMed] [DOI] |
| 23. | 唐 莹莹, 田 德安, 晏 维, 夏 丽敏, 张 全乐, 王 伟. 一种潜在的抑癌基因-CHD5参与肝癌的发生和发展. 胃肠病学和肝病学杂志. 2008;12:994-996. |
| 24. | Wang X, Lau KK, So LK, Lam YW. CHD5 is down-regulated through promoter hypermethylation in gastric cancer. J Biomed Sci. 2009;16:95. [PubMed] [DOI] |
| 25. | Courboulin A, Tremblay VL, Barrier M, Meloche J, Jacob MH, Chapolard M, Bisserier M, Paulin R, Lambert C, Provencher S. Krüppel-like Factor 5 contributes to pulmonary artery smooth muscle proliferation and resistance to apoptosis in human pulmonary arterial hypertension. Respir Res. 2011;12:128. [PubMed] [DOI] |
| 26. | Bialkowska AB, Crisp M, Bannister T, He Y, Chowdhury S, Schürer S, Chase P, Spicer T, Madoux F, Tian C. Identification of small-molecule inhibitors of the colorectal cancer oncogene Krüppel-like factor 5 expression by ultrahigh-throughput screening. Mol Cancer Ther. 2011;10:2043-2051. [PubMed] [DOI] |
| 27. | Chen C, Bhalala HV, Vessella RL, Dong JT. KLF5 is frequently deleted and down-regulated but rarely mutated in prostate cancer. Prostate. 2003;55:81-88. [PubMed] [DOI] |
| 28. | Humbert M, Halter V, Shan D, Laedrach J, Leibundgut EO, Baerlocher GM, Tobler A, Fey MF, Tschan MP. Deregulated expression of Kruppel-like factors in acute myeloid leukemia. Leuk Res. 2011;35:909-913. [PubMed] [DOI] |
| 29. | Yang Y, Nakagawa H, Tetreault MP, Billig J, Victor N, Goyal A, Sepulveda AR, Katz JP. Loss of transcription factor KLF5 in the context of p53 ablation drives invasive progression of human squamous cell cancer. Cancer Res. 2011;71:6475-6484. [PubMed] [DOI] |
| 30. | Mori A, Moser C, Lang SA, Hackl C, Gottfried E, Kreutz M, Schlitt HJ, Geissler EK, Stoeltzing O. Up-regulation of Krüppel-like factor 5 in pancreatic cancer is promoted by interleukin-1beta signaling and hypoxia-inducible factor-1alpha. Mol Cancer Res. 2009;7:1390-1398. [PubMed] [DOI] |
| 31. | Tong D, Czerwenka K, Heinze G, Ryffel M, Schuster E, Witt A, Leodolter S, Zeillinger R. Expression of KLF5 is a prognostic factor for disease-free survival and overall survival in patients with breast cancer. Clin Cancer Res. 2006;12:2442-2448. [PubMed] [DOI] |