修回日期: 2011-11-12
接受日期: 2011-12-07
在线出版日期: 2011-12-18
目的: 研究H3K27me3在胃癌细胞和组织中的表达, 并分析与临床病理因素的关系, 探讨H3K27me3在胃癌发生发展中的作用和意义.
方法: 应用Western blot方法检测胃癌细胞系SGC7901、BGC823、AGS和正常胃黏膜上皮细胞GES-1中H3K27me3的表达; 免疫组织化学方法检测61例胃癌组织及20例正常胃黏膜组织中H3K27me3的表达.
结果: 与正常胃黏膜细胞GES-1相比, H3K27me3在胃癌细胞SGC7901、BGC823、AGS中高表达; H3K27me3在胃癌组织中阳性表达率为80.3%, 并与肿瘤大小、浸润深度、淋巴结转移、血管侵犯、临床分期、TNM分期有关(P = 0.049, 0.030, 0.034, 0.025, 0.003, 0.031), 而与患者的性别、年龄、病变部位、分化程度、神经侵犯之间无相关性.
结论: H3K27me3在胃癌中高表达, 并与肿瘤的侵袭转移有关, 可能是胃癌患者重要的预后因子.
引文著录: 高福利, 吕瑛, 曹俊, 邹晓平. H3K27me3在胃癌中的表达及其临床意义. 世界华人消化杂志 2011; 19(35): 3597-3602
Revised: November 12, 2011
Accepted: December 7, 2011
Published online: December 18, 2011
AIM: To investigate the expression of trimethylation at lysine 27 of histone H3 (H3K27me3) in gastric cancer tissue and cell lines and to evaluate its correlation with clinicopathological parameters of gastric carcinoma.
METHODS: The protein expression of H3K27me3 was detected by Western blot in gastric cancer lines SGC7901, BGC823, AGS and normal gastric mucosal epithelial cell line GES-1. Immunohistochemistry (IHC) was utilized to examine the protein expression of H3K27me3 in 61 gastric cancer specimens and 20 normal gastric epithelial specimens.
RESULTS: H3K27me3 expression significantly increased in gastric cancer lines (SGC7901, BGC823, and AGS) compared to normal gastric mucosal epithelial cell line GES-1. The positive rates of H3K27me3 protein expression in gastric cancer was 80.3%. The expression levels of H3K27me3 were significantly associated with tumor size, depth of invasion, lymph node metastasis, vascular invasion, clinical stage, and T staging (P = 0.049, 0.030, 0.034, 0.025, 0.003, and 0.031, respectively), but had no correlation with patient's age, sex, tumor location, tumor differentiation degree, or nerve invasion.
CONCLUSION: High expression of H3K27me3 correlates closely with tumor invasion and metastasis in gastric cancer and may be an important prognostic factor in patients with gastric cancer.
- Citation: Gao FL, Lv Y, Cao J, Zou XP, Gastroenterology DO, University TADTHOMSON, 210008 N, Province J, China. Significance of H3K27me3 expression in gastric cancer Fu-Li Gao, Ying Lv, Jun Cao, Xiao-Ping Zou. Shijie Huaren Xiaohua Zazhi 2011; 19(35): 3597-3602
- URL: https://www.wjgnet.com/1009-3079/full/v19/i35/3597.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i35.3597
胃癌是世界上常见的恶性肿瘤, 虽然近年来发病率有所下降, 但死亡率在恶性肿瘤中仍占有很大的比重[1]. 影响胃癌患者预后的主要因素是肿瘤分期, 包括浸润深度和转移程度. 一般分期越高, 患者预后越差, 但也有部分患者虽具有相同的肿瘤分期和分级, 预后差别却很大. 因此, 鉴定出新的与预后有关的肿瘤分子, 并且能区分这些亚分类患者就显得尤为重要. 近年研究表明组蛋白修饰在肿瘤的发生发展中起重要的作用, 大量的研究也已经发现多种组蛋白修饰在恶性肿瘤中发生改变[2], 并且这种变化还具有重要的临床应用价值, 如作为判断患者预后的指标、肿瘤早期诊断的标记物、判断对某些化疗药物的治疗反应[3-6]. 组蛋白H3K27三甲基化(H3K27me3), 主要是由PcG复合物核心成分EZH2催化, EZH2已经在多种恶性肿瘤中被发现高表达并与肿瘤侵袭转移有关[7-9], 而H3K27me3在恶性肿瘤中作用目前研究还较少, 有学者研究乳腺癌、胰腺癌、肝癌等[10,11]发现H3K27me3存在表达异常, 并且是个重要的独立预后指标, 但H3K27me3在胃癌中目前尚无人研究. 本文主要通过应用Western blot和免疫组化方法检测胃癌细胞和组织中H3K27me3的表达, 并分析与胃癌临床病理因素之间的关系, 探讨H3K27me3在胃癌中的作用和意义.
人胃癌细胞系SGC7901、BGC823、AGS及正常胃上皮细胞GES-1由我科实验室提供. 组织标本收集2009/12-2010/07南京大学医学院附属鼓楼医院病理科胃癌手术石蜡标本(n = 61), 所有胃癌患者术前均未接受过放疗、化疗及其他针对肿瘤的治疗, 术后均经病理学专家确诊为胃癌, 其中男性42例, 女性19例, 年龄44-85岁, 平均(65.18±10.22)岁; 胃癌标本中肿瘤直径>4 cm(n = 30), <4 cm(n = 31); 高/中分化(n = 24), 低分化(n = 37); 临床分期: Ⅰ/Ⅱ期(n = 21), Ⅲ/Ⅳ期(n = 40); 肿瘤浸润深度: pT1+pT2期(n = 18), pT3+pT4期(n = 43) (pT1+pT2: 肿瘤未侵犯到浆膜层组织; pT3+pT4: 肿瘤侵犯浆膜或浆膜外组织). 另取癌旁正常胃黏膜组织(n = 20)作为对照组, 标本取自距肿块5 cm以外区域, 病理检测未见癌细胞浸润.
1.2.1 细胞培养: 人胃癌细胞株SGC7901、BGC823、AGS培养于含100 mL/L小牛血清的RPMI-1640培养基中, 正常胃上皮细胞GES-1培养于含100 mL小牛血清的DMEM培养基中, 上述两种培养基在使用前均添加100 000 U/L双抗(青霉素和链霉素), 所有细胞均置于含50 mL/L CO2的37 ℃孵育箱内培养, 隔天换液,每3-4 d传代1次.
1.2.2 Western blot: 从上述细胞中提取总蛋白, 经12%SDS-PAGE电泳分离, 湿转法将蛋白转印至PVDF膜, 5%BSA封闭1 h, 然后与1:200比例稀释的H3K27me3抗体4 ℃孵育过夜, 再与辣根过氧化物酶(HRP)标记二抗孵育2 h后, ECL化学发光作用3-5 min左右后曝光、显影和定影.
1.2.3 免疫组织化学: 采用PV9000二步法免疫组织化学染色, 具体步骤如下: 将石蜡切片常规脱蜡至水, 采用高压锅加热法行抗原修复, 3% H2O2孵育10 min后, PBS漂洗3次, 滴加小鼠抗人H3K27me3单克隆抗体(abcam公司)并于4 ℃过夜, PBS漂洗3次, 滴加即用型二抗(北京中杉金桥公司)并在室温下孵育20-30 min, DAB显色, 苏木精复染后将切片脱水、透明并封片. 以已知的H3K27me3染色阳性切片作为阳性对照, PBS代替一抗作为阴性对照, 高倍镜(400倍)下随机观察5个视野, 以细胞核出现棕黄色或棕褐色颗粒为阳性, 根据阳性细胞百分比及染色强度分别计分判定H3K27me3染色结果: (1)阳性染色强度: 0分无染色; 1分淡黄色; 2分棕黄色; 3分棕褐色; (2)阳性细胞比例: 0分≤10%; 1分11%-50%; 2分51%-75%; 3分>75%. 两者相乘后积分: 0分(-)、1-2分(+)、3-4分(++)、5-9分(+++).
统计学处理 采用SPSS18.0软件进行统计学分析, Kruskal-Wallis H检验对H3K27me3在2种不同组织中的表达差异进行分析, χ2检验评估H3K27me3和胃癌组织临床病理因素之间的关系, P<0.05为差异有统计学意义.
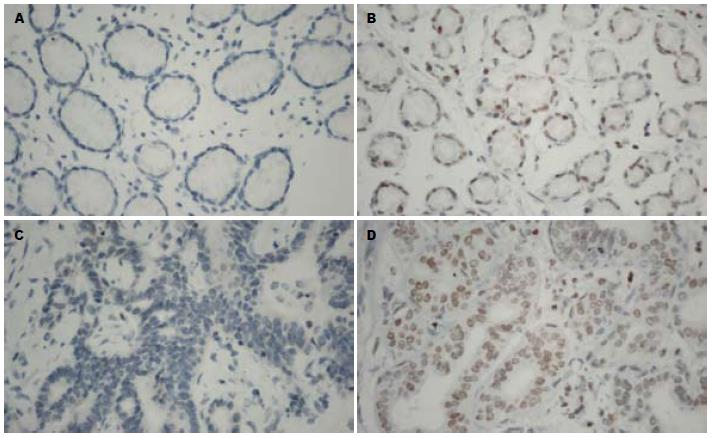
与正常胃上皮细胞(GES-1)相比, H3K27me3在胃癌细胞(SGC7901、BGC823、AGS)中高表达(图1). 且H3K27me3表达位于细胞核, 呈棕黄色颗粒, 细胞膜和细胞质不着色(图2). 胃癌组织中H3K27me3阳性表达细胞的比例明显高于正常胃黏膜组织中H3K27me3阳性表达细胞比例, 分别为80.3%和25%, 二者差异具有明显统计学意义(P<0.01, 表1).
H3K27me3表达与肿瘤大小、浸润深度、淋巴结转移、血管侵犯、临床分期、TNM分期有关(P<0.05), 而与患者的性别、年龄、病变部位、分化程度、神经侵犯之间无相关性(表2). 肿瘤最大径>4.0 cm的癌组织, H3K27me3表达水平高于最大径<4.0 cm者, 阳性率分别为83.9%和76.7%; 肿瘤侵犯浆膜或浆膜外组织(pT3+pT4)高于未侵犯浆膜层者(pTl+pT2), H3K27me3阳性率分别为83.7%和72.2%; 发生淋巴结转移者(87.5%)明显高于无淋巴结转移者(53.8%); 临床分期为Ⅲ+Ⅳ期高于Ⅰ+Ⅱ期, H3K27me3阳性率分别为90%和61.9%; 在TNM分期中T3+T4期H3K27me3表达高于T1+T2期, 分别为82.5%和76.2%.
| 临床病理特征 | 总例数(n) | H3K27me3 | 阳性率(%) | P值 | |||
| - | + | ++ | +++ | ||||
| 性别 | |||||||
| 男 | 42 | 7 | 11 | 21 | 3 | 83.3 | |
| 女 | 19 | 5 | 7 | 6 | 1 | 73.7 | 0.533 |
| 年龄 | |||||||
| ≤60岁 | 19 | 6 | 6 | 7 | 0 | 68.4 | |
| >60岁 | 42 | 6 | 12 | 20 | 4 | 85.7 | 0.243 |
| 病变部位 | |||||||
| 胃底/贲门 | 23 | 3 | 5 | 13 | 2 | 87.0 | |
| 胃体 | 20 | 2 | 8 | 8 | 2 | 90.0 | |
| 胃窦 | 18 | 7 | 5 | 6 | 0 | 61.1 | 0.166 |
| 肿瘤大小 | |||||||
| ≤4 cm | 30 | 7 | 13 | 9 | 1 | 76.7 | |
| >4 cm | 31 | 5 | 5 | 18 | 3 | 83.9 | 0.049 |
| 浸润深度 | |||||||
| pT1+pT2 | 18 | 5 | 9 | 3 | 1 | 72.2 | |
| pT3+pT4 | 43 | 7 | 9 | 24 | 3 | 83.7 | 0.030 |
| 淋巴结转移 | |||||||
| 否 | 13 | 6 | 4 | 3 | 0 | 53.8 | |
| 是 | 48 | 6 | 14 | 24 | 4 | 87.5 | 0.034 |
| 分化程度 | |||||||
| 高/中分化 | 24 | 5 | 7 | 12 | 0 | 70.4 | |
| 低分化 | 37 | 7 | 11 | 15 | 4 | 81.1 | 0.405 |
| 血管侵犯 | |||||||
| 否 | 12 | 6 | 3 | 3 | 0 | 50.0 | |
| 是 | 49 | 6 | 15 | 24 | 4 | 87.8 | 0.025 |
| 神经侵犯 | |||||||
| 否 | 14 | 4 | 6 | 3 | 1 | 71.4 | |
| 是 | 47 | 8 | 12 | 24 | 3 | 83.0 | 0.264 |
| 临床分期 | |||||||
| Ⅰ+Ⅱ | 21 | 8 | 9 | 3 | 1 | 61.9 | |
| Ⅲ+Ⅳ | 40 | 4 | 9 | 24 | 3 | 90.0 | 0.003 |
| TNM分期 | |||||||
| T1+T2 | 21 | 5 | 10 | 4 | 2 | 76.2 | |
| T3+T4 | 40 | 7 | 8 | 23 | 2 | 82.5 | 0.031 |
组蛋白修饰指的是核心组蛋白(H2A、H2B、H3、H4)在翻译完成后, 其N端尾区发生的多种共价修饰, 包括乙酰化、甲基化、磷酸化等. 这些组蛋白修饰可以通过改变染色质结构来影响各种基于DNA的重要生理过程如复制、转录、DNA修复[12], 从而调节基因表达. 但不同的组蛋白修饰, 调节基因表达的功能不同, 如组蛋白乙酰化与基因激活有关, 而组蛋白甲基化则依据甲基化位点和种类的不同, 功能亦不同[13]. 因此, 任何可以使这些组蛋白修饰水平发生改变或调节紊乱都有可能会导致基因表达失衡, 从而促进肿瘤的形成. 近年研究表明肿瘤的发生、发展是由遗传和表观遗传共同异常导致基因表达失常所致[14,15]. 表观遗传主要包括DNA甲基化和组蛋白修饰, 但以往研究大多集中在抑癌基因启动子CpG岛高甲基化, 而对组蛋白修饰在肿瘤中研究相对较少. 随着"组蛋白密码"学说[16]的提出以及大量组蛋白修饰酶[17]被发现, 组蛋白修饰在肿瘤中的作用才逐渐引起重视. 2005年, Seligson等[18]首次报道了组蛋白H3K4双甲基化和H3K18乙酰化可以预测前列腺癌的复发. 之后, 多种组蛋白修饰在恶性肿瘤中被发现表达异常并与患者预后有关, 如Barlesi等[19]在非小细胞肺癌中发现高表达H3K4双甲基化或低表达H3K9乙酰化的患者生存率高, 预后较好; Barbisan等[20]发现总体H3K9乙酰化水平可以预测低分化膀胱癌患者术后的复发. 组蛋白修饰的这方面应用在胃癌中也有类似发现, 如Park等[21]发现胃癌组织中H3K9三甲基化水平与肿瘤分期、淋巴管浸润、肿瘤复发、患者生存率有关, 多因素生存分析结果示H3K9三甲基化是胃癌患者的独立预后因素.
组蛋白H3K27三甲基化(H3K27me3)在恶性肿瘤中的作用亦有研究. Cai等[11]在肝癌中发现, 与正常肝组织相比, H3K27me3在肝癌中高表达, 并且与肿瘤大小、血管浸润、肿瘤分期等临床病理因素相关, 使用生存分析发现H3K27me3蛋白表达与肝癌患者预后有关, H3K27me3表达越高的患者预后越差. Tzao等[22]研究了包括H3K27me3在内的多种组蛋白修饰, 发现H3K27me3和H3K18ac在食管癌中高表达且表达越高患者预后越差; 不仅如此, He等[23]还发现H3K27me3不仅可以预测经过局部放化疗食管癌患者的预后, 而且还能区分出这些食管癌患者中不同病理级别的个体不同的预后结局. 但也有部分研究结果却得出相反结论. Wei等[10]发现H3K27me3在乳腺癌、胰腺癌和卵巢癌中表达下降, H3K27me3蛋白表达与肿瘤大小、淋巴结转移、病理分期等有关, 进一步分析提示H3K27me3是乳腺癌、胰腺癌和卵巢癌患者的独立预后指标, H3K27me3表达越低的患者预后越差. 因此, H3K27me3在恶性肿瘤中的研究目前尚有争论.
本研究中, 我们先用Western blot方法检测了人胃癌细胞系SGC7901、BGC823和AGS中H3K27me3表达, 发现与正常胃上皮细胞GES-1相比, H3K27me3在这3株胃癌细胞中高表达. 然后我们又用免疫组化方法检测61例胃癌组织中H3K27me3的表达情况, 同样可以发现H3K27me3在胃癌组织中高表达, 而正常胃黏膜组织中低表达. H3K27me3在胃癌等恶性肿瘤中高表达, 原因可能是由于催化H3K27me3的酶EZH2在恶性肿瘤中过表达所致. 但Wei等[10]在乳腺癌、胰腺癌和卵巢癌中却发现H3K27me3低表达, 说明H3K27me3在不同的恶性肿瘤中的表达差异明显, 一方面可能因为恶性肿瘤是一种异质性非常明显的疾病, 即使同一种蛋白在不同肿瘤中表达情况也不同; 另一方面可能是各种组蛋白修饰之间存在相互作用[13,16], H3K27me3蛋白表达受到其他组蛋白修饰的影响; 再者, 也有可能是催化H3K27me3的酶EZH2在恶性肿瘤中高表达导致PcG蛋白复合体发生改变, 形成新的复合体, 从而影响EZH2催化活性导致H3K27me3蛋白表达受影响[24-26].
我们接着评估了H3K27me3与胃癌临床病理因素的关系, 发现H3K27me3的表达与肿瘤大小、浸润深度、淋巴结转移、血管侵犯、临床分期、TNM分期有关(P<0.05), 而与患者的性别、年龄、病变部位、分化程度、神经侵犯之间无相关性. 这与其他作者研究结果基本相同[10,11,22,23]. 虽然本文缺乏这些胃癌患者的预后资料, 但从H3K27me3与肿瘤浸润深度、淋巴结转移、TNM分期等这些具有推断意义的预后因素具有相关性来看, H3K27me3可能是胃癌患者重要的预后因子, 当然这些尚需要进一步研究证明. 至于H3K27me3蛋白表达为什么与肿瘤侵袭转移有关, 原因可能有以下2点: 一是H3K27me3抑制下游抑癌基因的表达, 从而促进肿瘤转移. 如Fujii等[27]发现, EZH2在胃癌细胞中可通过H3K27me3下调E-cadherin基因的表达, 而E-cadherin蛋白是肿瘤侵袭转移的重要的因素; Yao等[28]还发现H3K27me3是抑癌基因p16INK4a早期的沉默事件; 二是催化H3K27me3的酶EZH2在恶性肿瘤存在高表达, 并且EZH2与肿瘤大小、浸润深度、血管浸润、淋巴结转移、临床分期等密切有关[7-9,29], 而EZH2和H3K27me3又存在正相关性[11,23]. 但值得一提的是, 组蛋白修饰在临床上的这些应用目前还仅限于总体蛋白修饰水平, 对于特定基因启动子区的组蛋白修饰变化目前尚未发现有临床应用价值.
总之, 我们研究发现H3K27me3在胃癌细胞和组织中高表达, 并且与肿瘤大小、淋巴结转移、血管侵犯、TNM分期等临床病理因素密切相关, H3K27me3可能是胃癌患者重要的预后因子.
组蛋白修饰在肿瘤发生、发展过程中起着重要的作用. 近年研究发现多种组蛋白修饰在恶性肿瘤中发生改变, 且这种变化还有重要的临床应用价值, 如作为判断患者预后的指标、肿瘤早期诊断的标记物、判断对某些化疗药物的治疗反应.
郑鹏远, 教授, 主任医师, 郑州大学第二附属医院消化科
国内外许多研究发现H3K27me3在恶性肿瘤中表达异常, 并与肿瘤侵袭转移有关. 生存分析发现H3K27me3表达与患者预后相关, 但在不同肿瘤中这一结果尚有争论.
He等发现H3K27me3不仅可以预测经过局部放化疗食管癌患者的预后, 而且还能区分出这些食管癌患者中不同病理级别的个体不同的预后结局.
本研究首次检测了胃癌中H3K27me3的表达, 并分析了其与临床病理因素的关系.
本文研究结果提示H3K27me3与胃癌侵袭转移有关, 可能作为胃癌患者预后的判断指标.
本课题设计合理, 资料全面, 参考文献权威, 对胃癌发生发展的研究具有一定的理论意义和潜在的临床价值.
编辑: 张姗姗 电编:闫晋利
| 1. | Catalano V, Labianca R, Beretta GD, Gatta G, de Braud F, Van Cutsem E. Gastric cancer. Crit Rev Oncol Hematol. 2009;71:127-164. [PubMed] [DOI] |
| 2. | Kurdistani SK. Histone modifications in cancer biology and prognosis. Prog Drug Res. 2011;67:91-106. [PubMed] |
| 3. | Elsheikh SE, Green AR, Rakha EA, Powe DG, Ahmed RA, Collins HM, Soria D, Garibaldi JM, Paish CE, Ammar AA. Global histone modifications in breast cancer correlate with tumor phenotypes, prognostic factors, and patient outcome. Cancer Res. 2009;69:3802-3809. [PubMed] [DOI] |
| 4. | Ellinger J, Kahl P, von der Gathen J, Rogenhofer S, Heukamp LC, Gütgemann I, Walter B, Hofstädter F, Büttner R, Müller SC. Global levels of histone modifications predict prostate cancer recurrence. Prostate. 2010;70:61-69. [PubMed] [DOI] |
| 5. | Manuyakorn A, Paulus R, Farrell J, Dawson NA, Tze S, Cheung-Lau G, Hines OJ, Reber H, Seligson DB, Horvath S. Cellular histone modification patterns predict prognosis and treatment response in resectable pancreatic adenocarcinoma: results from RTOG 9704. J Clin Oncol. 2010;28:1358-1365. [PubMed] [DOI] |
| 6. | Van Den Broeck A, Brambilla E, Moro-Sibilot D, Lantuejoul S, Brambilla C, Eymin B, Khochbin S, Gazzeri S. Loss of histone H4K20 trimethylation occurs in preneoplasia and influences prognosis of non-small cell lung cancer. Clin Cancer Res. 2008;14:7237-7245. [PubMed] [DOI] |
| 7. | Kidani K, Osaki M, Tamura T, Yamaga K, Shomori K, Ryoke K, Ito H. High expression of EZH2 is associated with tumor proliferation and prognosis in human oral squamous cell carcinomas. Oral Oncol. 2009;45:39-46. [PubMed] [DOI] |
| 8. | Collett K, Eide GE, Arnes J, Stefansson IM, Eide J, Braaten A, Aas T, Otte AP, Akslen LA. Expression of enhancer of zeste homologue 2 is significantly associated with increased tumor cell proliferation and is a marker of aggressive breast cancer. Clin Cancer Res. 2006;12:1168-1174. [PubMed] [DOI] |
| 9. | Varambally S, Dhanasekaran SM, Zhou M, Barrette TR, Kumar-Sinha C, Sanda MG, Ghosh D, Pienta KJ, Sewalt RG, Otte AP. The polycomb group protein EZH2 is involved in progression of prostate cancer. Nature. 2002;419:624-629. [PubMed] [DOI] |
| 10. | Wei Y, Xia W, Zhang Z, Liu J, Wang H, Adsay NV, Albarracin C, Yu D, Abbruzzese JL, Mills GB. Loss of trimethylation at lysine 27 of histone H3 is a predictor of poor outcome in breast, ovarian, and pancreatic cancers. Mol Carcinog. 2008;47:701-706. [PubMed] [DOI] |
| 11. | Cai MY, Hou JH, Rao HL, Luo RZ, Li M, Pei XQ, Lin MC, Guan XY, Kung HF, Zeng YX. High expression of H3K27me3 in human hepatocellular carcinomas correlates closely with vascular invasion and predicts worse prognosis in patients. Mol Med. 2011;17:12-20. [PubMed] |
| 12. | Kouzarides T. Chromatin modifications and their function. Cell. 2007;128:693-705. [PubMed] [DOI] |
| 15. | Esteller M. Epigenetics in cancer. N Engl J Med. 2008;358:1148-1159. [PubMed] [DOI] |
| 17. | Ellis L, Atadja PW, Johnstone RW. Epigenetics in cancer: targeting chromatin modifications. Mol Cancer Ther. 2009;8:1409-1420. [PubMed] [DOI] |
| 18. | Seligson DB, Horvath S, Shi T, Yu H, Tze S, Grunstein M, Kurdistani SK. Global histone modification patterns predict risk of prostate cancer recurrence. Nature. 2005;435:1262-1266. [PubMed] [DOI] |
| 19. | Barlési F, Giaccone G, Gallegos-Ruiz MI, Loundou A, Span SW, Lefesvre P, Kruyt FA, Rodriguez JA. Global histone modifications predict prognosis of resected non small-cell lung cancer. J Clin Oncol. 2007;25:4358-4364. [PubMed] [DOI] |
| 20. | Barbisan F, Mazzucchelli R, Santinelli A, Stramazzotti D, Scarpelli M, Lopez-Beltran A, Cheng L, Montironi R. Immunohistochemical evaluation of global DNA methylation and histone acetylation in papillary urothelial neoplasm of low malignant potential. Int J Immunopathol Pharmacol. 2008;21:615-623. [PubMed] |
| 21. | Park YS, Jin MY, Kim YJ, Yook JH, Kim BS, Jang SJ. The global histone modification pattern correlates with cancer recurrence and overall survival in gastric adenocarcinoma. Ann Surg Oncol. 2008;15:1968-1976. [PubMed] [DOI] |
| 22. | Tzao C, Tung HJ, Jin JS, Sun GH, Hsu HS, Chen BH, Yu CP, Lee SC. Prognostic significance of global histone modifications in resected squamous cell carcinoma of the esophagus. Mod Pathol. 2009;22:252-260. [PubMed] [DOI] |
| 23. | He LR, Liu MZ, Li BK, Rao HL, Liao YJ, Guan XY, Zeng YX, Xie D. Prognostic impact of H3K27me3 expression on locoregional progression after chemoradiotherapy in esophageal squamous cell carcinoma. BMC Cancer. 2009;9:461. [PubMed] [DOI] |
| 24. | Kuzmichev A, Margueron R, Vaquero A, Preissner TS, Scher M, Kirmizis A, Ouyang X, Brockdorff N, Abate-Shen C, Farnham P. Composition and histone substrates of polycomb repressive group complexes change during cellular differentiation. Proc Natl Acad Sci U S A. 2005;102:1859-1864. [PubMed] [DOI] |
| 25. | Cao R, Zhang Y. The functions of E(Z)/EZH2-mediated methylation of lysine 27 in histone H3. Curr Opin Genet Dev. 2004;14:155-164. [PubMed] [DOI] |
| 26. | Kuzmichev A, Jenuwein T, Tempst P, Reinberg D. Different EZH2-containing complexes target methylation of histone H1 or nucleosomal histone H3. Mol Cell. 2004;14:183-193. [PubMed] [DOI] |
| 27. | Fujii S, Ochiai A. Enhancer of zeste homolog 2 downregulates E-cadherin by mediating histone H3 methylation in gastric cancer cells. Cancer Sci. 2008;99:738-746. [PubMed] [DOI] |
| 28. | Yao JY, Zhang L, Zhang X, He ZY, Ma Y, Hui LJ, Wang X, Hu YP. H3K27 trimethylation is an early epigenetic event of p16INK4a silencing for regaining tumorigenesis in fusion reprogrammed hepatoma cells. J Biol Chem. 2010;285:18828-18837. [PubMed] [DOI] |
| 29. | Matsukawa Y, Semba S, Kato H, Ito A, Yanagihara K, Yokozaki H. Expression of the enhancer of zeste homolog 2 is correlated with poor prognosis in human gastric cancer. Cancer Sci. 2006;97:484-491. [PubMed] [DOI] |