修回日期: 2011-11-20
接受日期: 2011-12-07
在线出版日期: 2011-12-18
目的: 研究MUC1, MUC2和MUC3在胃增生性息肉(gastric hyperplastic polyp, GHP)中的表达模式, 旨在发现可以提示GHP发生癌变的有价值的标志物.
方法: 选用明确诊断的经手术切除或胃镜活检的GHP标本238例, 其中包括GHP未伴有不典型增生188例, GHP伴低级别不典型增生(low grade dysplasia, LGD)35例, GHP伴高级别不典型增生(high grade dysplasia, HGD)8例及GHP伴局灶癌变(carcinoma, Ca)7例. 同时选取30例正常胃黏膜标本为正常对照. 采用免疫组织化学方法评价MUC1, MUC2及MUC3的阳性表达百分率及其表达模式.
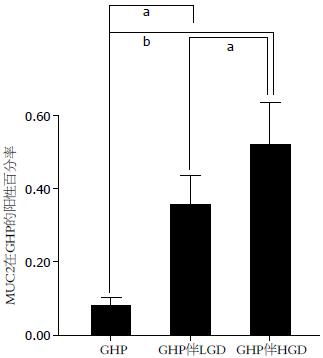
结果: MUC1呈现2种表达模式. 模式1: 细胞质和细胞膜弥漫阳性; 模式2: 腔缘侧细胞膜阳性. 所有正常的胃黏膜和85.6%的未伴有不典型增生的GHP, MUC1表达呈模式1. 80%的GHP伴LGD和100%的GHP伴高级别不典型增生或癌变(HGD/Ca)其MUC1的表达呈模式2(P<0.001). MUC2在GHP中表达阳性率为8.11%, GHP伴LGD为21.93%, GHP伴HGD/Ca为31.42%(P<0.001). MUC3仅在1例GHP伴LGD和3例GHP伴HGD/Ca中表达阳性.
结论: MUC1和MUC2可能是提示GHP具有恶变潜能的有价值的标志物.
引文著录: 李娟, 吴丽华, 石岩, 焦宇飞. MUC1, MUC2和MUC3在胃增生性息肉中的表达模式. 世界华人消化杂志 2011; 19(35): 3591-3596
Revised: November 20, 2011
Accepted: December 7, 2011
Published online: December 18, 2011
AIM: To evaluate the expression patterns of MUC1, MUC2 and MUC3 in gastric hyperplastic polyps (GHP) and to analyze their value as markers for judging the malignant potential of GHP.
METHODS: A total of 238 GHP biopsy or surgical specimens, including 188 cases without dysplasia, 35 cases with low grade dysplasia (LGD), 8 cases with high grade dysplasia(HGD), and 7 cases with carcinoma (Ca), were used in this study. Thirty normal gastric mucosal specimens were used as controls. Immunohistochemistry was performed to detect the expression patterns of mucin proteins (MUC1, MUC2 and MUC3) in these specimens.
RESULTS: Cytoplasmic and membranous expression of MUC1 was observed in 85.60% of GHP cases without dysplasia or carcinoma. Glandular luminal expression of MUC1 was observed in 80.0% of GHP cases with LGD and 100% of GHP cases with HGD/Ca. The positive rate of MUC2 expression was 8.11% in GHP, 21.93% in GHP with LGD, and 31.42% in GHP with HGD/Ca. MUC3 expression was detected in one case of GHP with LGD and three cases of GHP with HGD/Ca but not in GHP without dysplasia.
CONCLUSION: MUC1 and MUC2 may be useful markers for judging the malignant potential of GHP.
- Citation: Li J, Wu LH, Shi Y, Jiao YF, Pathology DO, University TSACHOHM, 150081 H, Province H, China. Expression patterns of MUC1, MUC2 and MUC3 in gastric hyperplastic polyps Juan Li, Li-Hua Wu, Yan Shi, Yu-Fei Jiao. Shijie Huaren Xiaohua Zazhi 2011; 19(35): 3591-3596
- URL: https://www.wjgnet.com/1009-3079/full/v19/i35/3591.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i35.3591
胃的增生性息肉(gastric hyperplastic polyp, GHP)是分化良好的成熟的小凹上皮细胞增生, 形成扭曲、伸长的类锯齿状, 延伸进入胃间质的有蒂或无蒂的赘生物. GHP是胃息肉状病变的主要类型, 在胃窦部多见[1,2], 具有一定的恶变潜能[3-9]. 其诊断标准为: (1)胃小凹上皮结构不规则, 腺体扩张、扭曲、伸长; (2)间质中有炎细胞浸润; (3)平滑肌细胞增生[1,2].
粘蛋白(Mucin, MUC)是一类高分子量的糖蛋白, 目前已发现20种MUC. 根据其结构和功能分为分泌型和膜结合型2大类[10]. 这些MUC在维持胃肠道正常的生理过程和肿瘤的发生、发展及转移中扮演着重要的角色. MUC2属于分泌型粘蛋白, 编码MUC2的基因位于染色体11q15.5上[10]. MUC2基因是从小肠cDNA文库中克隆出来的, 为正常杯状细胞所特有[11-13]. 跨膜型粘蛋白广泛表达于上皮细胞的表层, MUC1和MUC3属于此类. MUC1是克隆最早的跨膜粘蛋白, 定位于染色体1q21-24[13], 是从乳腺癌、胰腺癌等细胞系构建的cDNA表达文库获得[14]. MUC1在许多分泌型上皮细胞的顶端表达, 包括向大多数其他表达细胞膜黏附蛋白细胞的胞外区的过度延伸表达[10]. MUC3主要表达在胃肠道上皮细胞中, 其基因定位于染色体7q22[10]. MUC3主要表达在小肠绒毛上皮细胞中, 也少量表达于结肠绒毛缘上皮细胞和胰腺导管上皮细胞[10]. 胃癌组织中, MUC3的阳性表达与患者的预后性差相关[15].
目前, 许多研究报道表明GHP具有恶变潜能, 其发展为癌的百分率为0.5%-7.1%[1-9]. 覆盖在胃肠道黏膜表面的粘蛋白是防御机械性、化学性损伤和微生物侵袭的第一道屏障. 已有大量研究表明在胃癌组织中存在着多种粘蛋白的异常表达, 但是粘蛋白在GHP中表达模式的研究国内外均非常少. 本文研究粘蛋白在GHP中的表达模式, 旨在阐明MUC表达与GHP恶变潜能的关系. 以便寻找可以提示GHP癌变的有价值的标志物.
搜集哈尔滨医科大学附属第二医院2005-01/2011-04手术切除胃及胃镜活检病例, 我们将标本不足以进行大量切片、临床资料不全以及诊断不明确的病例剔除; 经2名病理科医生阅片, 选用明确诊断的GHP标本238例, 其中包括GHP未伴有不典型增生188例, GHP伴有低级别不典型增生(Low Grade Dysplasia, LGD)35例, GHP伴有高级别不典型增生(High Grade Dysplasia, HGD)8例及GHP伴局灶癌变(Carcinoma, Ca)7例. 同时选取30例正常胃黏膜作为对照组, 正常胃黏膜取自胃溃疡穿孔或胃癌手术切除标本(距肿瘤组织5 cm以上的胃黏膜组织). MUC1、MUC2、MUC3抗体均购自Thermo Fisher公司(MUC1、MUC2抗体4 ℃过夜, MUC3抗体37 ℃孵育30 min).
1.2.1 HE染色: 所有组织经100 g/L中性福尔马林固定, 石蜡包埋, 4 μm厚度切片, 常规HE染色.
1.2.2 免疫组织化学染色: 所有蜡块连续切片, 厚度为4 μm. 切片使用二甲苯脱蜡, 梯度酒精水化之后进行抗原修复, 然后滴加3%过氧化酶阻断剂室温反应10 min以阻断内源性过氧化物酶的活性. 二抗使用EnVisionTM检测试剂盒(Thermo Fisher). 然后进行DAB显色, 苏木素复染, 常规脱水, 透明封片. 具体步骤参照即用型快捷免疫组化MaxvisionTM试剂盒(鼠/兔)说明书.
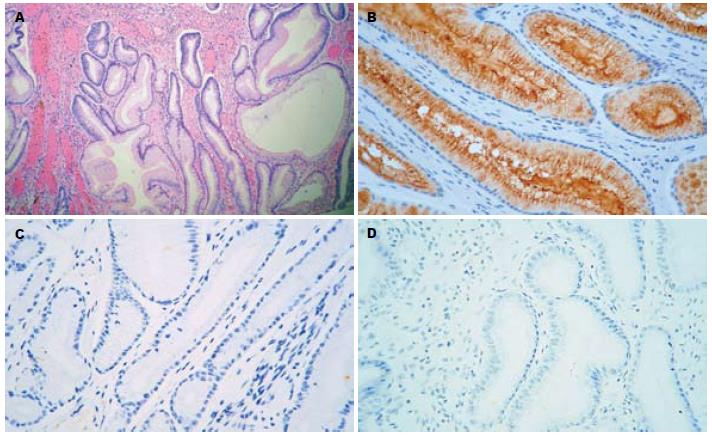
1.2.3 免疫组织化学染色结果判定: MUC1, MUC2表达在细胞质和细胞膜; MUC3表达在细胞膜. MUC2计数整个切片中阳性细胞的百分率, MUC3计数腔缘阳性的腺体数. 由于我们在试验中发现MUC1呈现2种表达模式, 模式1: 细胞质和细胞膜弥漫阳性; 模式2: 腔缘侧细胞膜阳性. 因此, MUC1的免疫组织化学染色结果便是判定其为何种表达模式.
统计学处理 运用SPSS13.0软件对数据进行Mann-Whitney双侧U检验及χ2检验, 必要时采用Fisher确切概率法, P<0.05具有统计学意义.
本研究应用的标本的临床病理学详细资料见表1.
| GHP | GHP伴LGD | GHP伴HGD/Ca | |
| 总数(n) | 188 | 35 | 15 |
| 性别(n) | |||
| 男 | 103 | 23 | 12 |
| 女 | 85 | 12 | 3 |
| 平均年龄(岁) | 51.12 | 56.57 | 56.92 |
| 部位(n) | |||
| 贲门、胃底 | 43 | 4 | 6 |
| 胃体 | 31 | 6 | 2 |
| 胃窦、胃角、幽门 | 114 | 25 | 7 |
| 平均大小(cm) | 1.15 | 1.24 | 2.19 |
| 大体形态(n) | |||
| 无蒂 | 112 | 25 | 4 |
| 有蒂 | 27 | 4 | 5 |
| 亚蒂 | 49 | 6 | 6 |
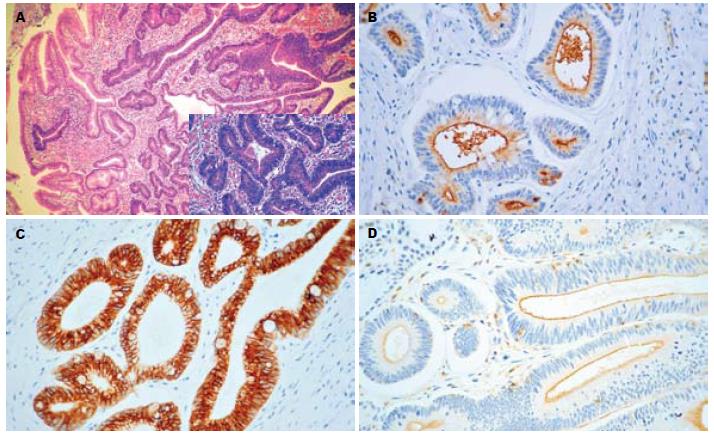
MUC1呈2种表达模式. 在所有正常的胃黏膜和85.6%的未伴有不典型增生的GHP, MUC1表达呈模式1(图1A, B). 然而, 80%的GHP伴LGD和100%的GHP伴HGD/Ca其MUC1的表达呈模式2(图2A, B, P<0.001, 表2).
| 诊断 | MUC1表达模式 | |
| 模式1 | 模式2 | |
| GHP | 161 (85.6%) | 27(14.4%) |
| GHP伴LGD | 7 (20.0%) | 28(80.0%) |
| GHP伴HGD/Ca | 0 | 15(100%) |
GHP通常被认为是一种良性病变, 但是近年来一些研究已经证实GHP具有一定的癌变潜能. GHP发生癌变的相关机制目前仍不清楚. 但已有一些研究结果提示GHP的癌变过程为: GHP→不典型增生→局灶癌变[16].
在我们的研究中, 所有的正常胃黏膜和85.6%的未伴有不典型增生或癌变的GHP中, MUC1表达为模式1. 但是值得注意的是, 我们观察到80.0%的伴有LGD的GHP中, MUC1表达为模式2; 100%的伴有HGD/Ca的GHP中, MUC1表达为模式2. 在Noguetra等[17]的研究中, MUC1在胃腺瘤和胃癌标本中的细胞质阳性表达缺失. 同样, 在Benjamin等[18]的研究中也指出了MUC1在胃腺瘤和胃癌组织中的异常表达. 虽然对MUC1表达模式的描述不是完全相同, 但是我们的结论与Noguetra、Benjamin等的结论有一点是一致的, 即MUC1在不典型增生或癌变的胃黏膜组织中, 细胞质的阳性表达缺失. 我们的研究结果还证实MUC1在伴有不典型增生或癌变的GHP中与未伴有不典型增生或癌变的GHP的表达相比, 多呈模式2(P<0.01), 此种表达模式的发生机制还没有明确的结论.
有关MUC1在胃癌组织中作用机制的研究提示此种表达模式是多因子相互诱导的结果[19]. 许多研究结果已经证实MUC1与细胞信号转导、免疫调节, 以及抑制细胞与细胞或细胞与间质的黏附相关[19-22]. 有报道显示MUC1的胞质尾区与β-catenin[20]以及其他信号分子(如: Grb2/Sos[21], EGFR[22]等)有关, 表明MUC1在细胞信号转导中可能具有一定的作用. MUC1通过与β-catenin相似的基序竞争结合E-cadherin, 从而阻止E-cadherin-β-catenin复合物的形成[19]. 所以MUC1可能参与了肿瘤细胞的分离、浸润与转移. 有许多研究显示MUC1介导细胞效应[23], 组织发生癌变后MUC1过表达提示肿瘤的侵袭性增加[13,24]. Retterspitz等[25]表明MUC1表达的强弱与肿瘤的分化相关联. Lapoinet等[26]在研究胰腺癌时证实MUC1可作为一种独立的判断肿瘤治疗预后的标志物. Retterspitz等[25]在研究胃癌时也得出了相同的结论. 也有学者表示细胞癌变时MUC1基因的表达与肿瘤细胞的黏附力、免疫识别、转移和预后密切相关[23]. Kontani等[27]证实MUC1的表达缺失或其抗原性改变可能致使癌细胞对细胞毒性T细胞的杀伤效应无应答. MUC1可以保护癌细胞免受自身免疫系统的攻击[28]. 目前, MUC1在胃癌组织中的表达模式尚存争议. 我们的研究结果显示: 在伴有不典型增生或癌变的GHP中, MUC1主要呈现腔缘阳性的表达模式. MUC1在不同类型的胃黏膜病变中呈现不同的表达模式的相关机制需要更进一步的研究.
在我们的研究中发现, MUC2阳性的标本中, 86.3%的GHP伴有不典型增生和局灶癌变的样本中呈阳性表达; 在GHP伴有HGD/Ca中, 其MUC2阳性率比GHP伴有LGD的阳性率显著增高(P<0.001). 同样在研究MUC2在胃癌组织的表达情况中提示: MUC2在正常胃黏膜不表达, 而在肠型胃癌中, MUC2的表达明显增加[29]. 并且证明MUC2的表达程度与肿瘤的浸润、淋巴结转移及预后有很大的关系[30]. 因此我们与其他研究者的结论支持GHP的癌变过程是GHP→GHP伴有不典型增生→癌变的这一推断.
Wang等[15]对胃癌的研究表明, MUC3的阳性表达与否与胃癌的预后、肿瘤大小、转移有明显的关联性. MUC3高表达的肿瘤瘤体大、预后差且容易发生转移. 在我们的研究中, MUC3在GHP中不表达, 在GHP伴有不典型增生和癌变的组织中个别阳性. 其表达情况还有待于大样本的进一步研究.
总之, MUC1在GHP中呈现出2种表达模式: 在正常的胃黏膜和未伴有不典型增生的GHP中, MUC1表达呈模式1; 而在伴有不典型增生或癌变的GHP中, MUC1的表达多呈模式2. MUC2的表达阳性率随着GHP不典型程度的增加而增加. 因此MUC1和MUC2可能是提示GHP恶变潜能的有价值的标志物, 即MUC1表达为模式2或MUC2过表达的GHP更具有恶变潜能.
感谢哈尔滨医科大学附属第二临床医院病理科刘瑾为本研究提供的精湛的HE染色切片和对免疫组织化学染色的技术支持.
粘蛋白是一类高分子量的糖蛋白, 在维持胃肠道正常的生理过程和肿瘤的发生、发展及转移中扮演着重要的角色. 但是探讨粘蛋白在GHP中的表达模式的相关研究国内外极少.
刘丽江, 教授, 江汉大学医学院病理学
GHP是最常见的息肉样病变, 许多研究报道表明GHP具有恶变潜能, 随着内窥镜下息肉切除术及黏膜下切除术的发展, GHP伴有不典型增生或癌变的报道相应增多. 因此, GHP发生癌变的机制引起了消化道肿瘤研究领域的关注.
研究发现MUC1的表达与肿瘤细胞的黏附力、免疫识别、转移和预后密切相关. MUC2在正常胃黏膜不表达, 肠型胃癌中MUC2的表达明显增加; 且MUC2的表达程度与肿瘤的浸润、淋巴结转移及预后有关. MUC3的阳性表达与胃癌的预后, 肿瘤的大小, 转移有关.
本文研究MUC1、MUC2及MUC3在GHP中的表达模式, 寻找提示GHP恶变潜能的有价值的标志物.
根据粘蛋白在GHP中的表达模式, MUC1及MUC2可能是提示GHP恶变潜能的有价值的标志物.
该文的选题有重要的临床意义和应用价值, 且图片清晰、病变典型.
编辑: 张姗姗 电编:闫晋利
| 1. | Jain R, Chetty R. Gastric hyperplastic polyps: a review. Dig Dis Sci. 2009;54:1839-1846. [PubMed] [DOI] |
| 2. | Carmack SW, Genta RM, Schuler CM, Saboorian MH. The current spectrum of gastric polyps: a 1-year national study of over 120,000 patients. Am J Gastroenterol. 2009;104:1524-1532. [PubMed] [DOI] |
| 3. | Hongou H, Fu K, Ueyama H, Takahashi T, Takeda T, Miyazaki A, Watanabe S. Mallory-Weiss tear during gastric endoscopic submucosal dissection. World J Gastrointest Endosc. 2011;3:151-153. [PubMed] [DOI] |
| 4. | Mishra R, Stelow EB, Powell S, Shami VM. Poorly differentiated adenocarcinoma arising from a hyperplastic polyp: which polyps should be endoscopically resected? Dig Dis Sci. 2007;52:1586-1588. [PubMed] [DOI] |
| 5. | Hirasaki S, Kanzaki H, Fujita K, Matsumura S, Matsumoto E, Yumoto E, Suzuki S. Papillary adenocarcinoma occurring in a gastric hyperplastic polyp observed by magnifying endoscopy and treated with endoscopic mucosal resection. Intern Med. 2008;47:949-952. [PubMed] [DOI] |
| 6. | Hirasaki S, Suzuki S, Kanzaki H, Fujita K, Matsumura S, Matsumoto E. Minute signet ring cell carcinoma occurring in gastric hyperplastic polyp. World J Gastroenterol. 2007;13:5779-5780. [PubMed] |
| 7. | Hirano H, Yoshida T, Yoshimura H, Fukuoka M, Ohkubo E, Tachibana S, Saito H, Nakasho K, Nishigami T. Poorly differentiated adenocarcinoma with signet-ring cell carcinoma in a hyperplastic polyp of the stomach: report of a case. Surg Today. 2007;37:901-904. [PubMed] [DOI] |
| 8. | Saravanan R, Kamalaporn P, Streutker C, May G, Kandel G, Marcon N, Kortan P. Gastric polyp in pernicious anemia: an argument to remove even when biopsy shows hyperplasia. Endoscopy. 2008;40 Suppl 2:E77-E78. [PubMed] [DOI] |
| 9. | Ubukata H, Katano M, Konishi S, Nakachi T, Goto Y, Watanabe Y, Nakada I, Tabuchi T. Multifocal gastric cancer with a variety of histological findings coexisting with hyperplastic polyps: report of a case. Surg Today. 2011;41:1106-1111. [PubMed] [DOI] |
| 10. | Rachagani S, Torres MP, Moniaux N, Batra SK. Current status of mucins in the diagnosis and therapy of cancer. Biofactors. 2009;35:509-527. [PubMed] [DOI] |
| 11. | Holmes K, Egan B, Swan N, O'Morain C. Genetic Mechanisms and Aberrant Gene Expression during the Development of Gastric Intestinal Metaplasia and Adenocarcinoma. Curr Genomics. 2007;8:379-397. [PubMed] [DOI] |
| 12. | Kim YS, Ho SB. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr Gastroenterol Rep. 2010;12:319-330. [PubMed] [DOI] |
| 13. | Kufe DW. Mucins in cancer: function, prognosis and therapy. Nat Rev Cancer. 2009;9:874-885. [PubMed] [DOI] |
| 14. | Hattrup CL, Gendler SJ. Structure and function of the cell surface (tethered) mucins. Annu Rev Physiol. 2008;70:431-457. [PubMed] [DOI] |
| 15. | Wang RQ, Fang DC. Alterations of MUC1 and MUC3 expression in gastric carcinoma: relevance to patient clinicopathological features. J Clin Pathol. 2003;56:378-384. [PubMed] [DOI] |
| 16. | Han AR, Sung CO, Kim KM, Park CK, Min BH, Lee JH, Kim JY, Chang DK, Kim YH, Rhee PL. The clinicopathological features of gastric hyperplastic polyps with neoplastic transformations: a suggestion of indication for endoscopic polypectomy. Gut Liver. 2009;3:271-275. [PubMed] [DOI] |
| 17. | Nogueira AM, Machado JC, Carneiro F, Reis CA, Gött P, Sobrinho-Simões M. Patterns of expression of trefoil peptides and mucins in gastric polyps with and without malignant transformation. J Pathol. 1999;187:541-548. [PubMed] [DOI] |
| 18. | Benjamin JB, Jayanthi V, Devaraj H. MUC1 expression and its association with other aetiological factors and localization to mitochondria in preneoplastic and neoplastic gastric tissues. Clin Chim Acta. 2010;411:2067-2072. [PubMed] [DOI] |
| 19. | Zhang HK, Zhang QM, Zhao TH, Li YY, Yi YF. Expression of mucins and E-cadherin in gastric carcinoma and their clinical significance. World J Gastroenterol. 2004;10:3044-3047. [PubMed] |
| 20. | Yamamoto M, Bharti A, Li Y, Kufe D. Interaction of the DF3/MUC1 breast carcinoma-associated antigen and beta-catenin in cell adhesion. J Biol Chem. 1997;272:12492-12494. [PubMed] [DOI] |
| 21. | Pandey P, Kharbanda S, Kufe D. Association of the DF3/MUC1 breast cancer antigen with Grb2 and the Sos/Ras exchange protein. Cancer Res. 1995;55:4000-4003. [PubMed] |
| 22. | Schroeder JA, Thompson MC, Gardner MM, Gendler SJ. Transgenic MUC1 interacts with epidermal growth factor receptor and correlates with mitogen-activated protein kinase activation in the mouse mammary gland. J Biol Chem. 2001;276:13057-13064. [PubMed] [DOI] |
| 23. | Kondo S, Yoshizaki T, Wakisaka N, Horikawa T, Murono S, Jang KL, Joab I, Furukawa M, Pagano JS. MUC1 induced by Epstein-Barr virus latent membrane protein 1 causes dissociation of the cell-matrix interaction and cellular invasiveness via STAT signaling. J Virol. 2007;81:1554-1562. [PubMed] [DOI] |
| 24. | İlhan Ö, Han Ü, Önal B, Çelık SY. Prognostic significance of MUC1, MUC2 and MUC5AC expressions in gastric carcinoma. Turk J Gastroenterol. 2010;21:345-352. [PubMed] |
| 25. | Retterspitz MF, Mönig SP, Schreckenberg S, Schneider PM, Hölscher AH, Dienes HP, Baldus SE. Expression of {beta}-catenin, MUC1 and c-met in diffuse-type gastric carcinomas: correlations with tumour progression and prognosis. Anticancer Res. 2010;30:4635-4641. [PubMed] |
| 26. | Lapointe J, Li C, Higgins JP, van de Rijn M, Bair E, Montgomery K, Ferrari M, Egevad L, Rayford W, Bergerheim U. Gene expression profiling identifies clinically relevant subtypes of prostate cancer. Proc Natl Acad Sci USA. 2004;101:811-816. [PubMed] [DOI] |
| 27. | Kontani K, Taguchi O, Narita T, Izawa M, Hiraiwa N, Zenita K, Takeuchi T, Murai H, Miura S, Kannagi R. Modulation of MUC1 mucin as an escape mechanism of breast cancer cells from autologous cytotoxic T-lymphocytes. Br J Cancer. 2001;84:1258-1264. [PubMed] [DOI] |
| 28. | Hasegawa H, Komoda M, Yamada Y, Yonezawa S, Tsutsumida H, Nagai K, Atogami S, Tsuruda K, Osaka A, Sasaki D. Aberrant overexpression of membrane-associated mucin contributes to tumor progression in adult T-cell leukemia/lymphoma cells. Leuk Lymphoma. 2011;52:1108-1117. [PubMed] [DOI] |
| 29. | Conze T, Carvalho AS, Landegren U, Almeida R, Reis CA, David L, Söderberg O. MUC2 mucin is a major carrier of the cancer-associated sialyl-Tn antigen in intestinal metaplasia and gastric carcinomas. Glycobiology. 2010;20:199-206. [PubMed] [DOI] |
| 30. | Toki F, Takahashi A, Aihara R, Ogata K, Ando H, Ohno T, Mochiki E, Kuwano H. Relationship between clinicopathological features and mucin phenotypes of advanced gastric adenocarcinoma. World J Gastroenterol. 2010;16:2764-2770. [PubMed] [DOI] |