修回日期: 2011-11-22
接受日期: 2011-12-07
在线出版日期: 2011-12-18
目的: 探讨肠三叶因子(intestinal trefoil factor, ITF)对肠组织Toll样受体2、4(Toll-like receptor 2, 4, TLR2、4)及核因子-κB(nuclear factor-κB, NF-κB)的调节与肠损伤保护作用的关系.
方法: 24只10日龄的Wistar幼鼠随机分为正常对照组、内毒素血症(lipopolysaccharide, LPS)组和LPS+ITF组(n = 8): 对照组给予生理盐水1 mL/kg; LPS组给予LPS(5 mg/ kg); LPS+ITF组给予重组肠三叶因子(rITF, 0.5 mg/只)+LPS 5 mg/kg. 均采用腹腔注射给药. 于腹腔注射后3 h处死幼鼠, 留取远端回肠组织, HE染色. 光镜下观察肠组织病理改变, RT-PCR检测肠组织TLR2、4和NF-κB mRNA的表达. 免疫组织化学检测肠组织TLR2、4及NF-κB蛋白的定位表达.
结果: 光镜下对照组肠组织结构正常, LPS+IT F组和LPS组均可见间质和上皮细胞水肿, LPS+ITF组较LPS组明显减轻; 肠组织TLR2 mRNA和蛋白定位表达LPS+ITF组较LPS组明显增高(7.453±1.90 vs 3.069±0.08, 52.125±4.1 vs 20.688±2.4, 均P<0.01); TLR4 mRNA和蛋白定位表达LPS+ITF组较LPS组明显下降(5.373±1.18 vs 16.711±1.28, 16.338±4.98 vs 22.760±3.68, 均P<0.01); NF-κB mRNA和蛋白定位表达LPS+ITF组较LPS组明显下降(0.533±0.05 vs 2.228±0.72, 36.526±9.18 vs 50.433±3.37, P<0.01, P<0.05).
结论: ITF减轻肠组织损伤的保护作用可能与其下调TLR4和NF-κB的mRNA、蛋白的表达相关.
引文著录: 荆科, 孙梅. 肠三叶因子对肠组织TLR2、4和NF-κB的作用及其与肠损伤保护的关系. 世界华人消化杂志 2011; 19(35): 3585-3590
Revised: November 22, 2011
Accepted: December 7, 2011
Published online: December 18, 2011
AIM: To investigate whether intestinal trefoil factor (ITF) regulates the expression of Toll-like receptor (TLR) 2/4 and nuclear factor-κB (NF-κB) and exerts a protective effect against lipopolysaccharide (LPS)-induced intestinal injury in rats.
METHODS: Twenty-four 10-day-old Wistar rats were randomly and equally divided into three groups: control group (intraperitoneally injected with normal saline 1 mL/kg ), endotoxemia group (intraperitoneally injected with LPS 5 mg/kg), and LPS + ITF group (intraperitoneally injected with LPS 5 mg/kg and recombinant ITF 0.1 mL/per rat). Rats were sacrificed 3 h after injection. A segment of the distal ileum was dissected for hematoxylin-eosin staining. Pathological changes in the small intestine were observed under an optical microscope. The mRNA and protein expression of TLR2/4 and NF-κB was detected by RT-PCR and immunohistochemistry, respectively.
RESULTS: The structure of the small intestine of rats in the control group was normal. Inflammatory cell infiltration and interstitial/epithelial edema were observed in rats in the LPS group and LPS + ITF group, and the pathological changes were significantly milder in the LPS + ITF group than in the LPS group. The expression of TLR2 mRNA and protein in the LPS + ITF group was significantly higher than that in the LPS group (7.453 ± 1.90 vs 3.069 ± 0.08, 52.125 ± 4.1 vs 20.688 ± 2.4, both P < 0.01). The expression of TLR4 and NF-κB mRNAs and proteins in the LPS + ITF group was significantly lower than that in the LPS group (TLR4 mRNA: 5.373 ± 1.18 vs 16.711 ± 1.28, P< 0.01; TLR4 protein: 16.338 ± 4.98 vs 22.760 ± 3.68, P< 0.01; NF-κB mRNA: 0.533 ± 0.05 vs 2.228 ± 0.72, P< 0.01; NF-κB protein: 36.526 ± 9.18 vs 50.433 ± 3.37, P< 0.05).
CONCLUSION: Treatment with ITF protects against LPS-induced intestinal injury in rats possibly via mechanisms associated with down-regulation of TLR4 and NF-κB expression.
- Citation: Jing K, Sun M. Treatment with intestinal trefoil factor regulates TLR2/4 and NF-κB expression and protects against LPS-induced intestinal injury in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(35): 3585-3590
- URL: https://www.wjgnet.com/1009-3079/full/v19/i35/3585.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i35.3585
Toll样受体(Toll-like receptor, TLR)是近年发现的一种免疫受体, 是一种跨膜蛋白, 能识别病原微生物或细胞壁成分, 通过信号转导激发先天性免疫反应[1-6]. 核因子-κB(nuclear factor-κB, NF-κB)是一种能与多种细胞基因的启动子和增强子中的κB序列位点发生特异结合的核转录因子, 是具有多向性调节作用的蛋白质分子, 具有广泛的生物学活性. NF-κB的过度活化会激活、增强机体的非特异及特异性免疫反应, 造成组织损伤和器官功能紊乱[7-9]. 肠三叶因子(intestinal trefoil factor, ITF)是三叶肽家族成员之一, 由肠黏膜上皮杯状细胞分泌, 广泛存在于胃肠道, 具有特征性的三叶结构, 被认为是内源性具有抗凋亡特性的肽类物质[10,11], 在肠道的自我保护和损伤后修复中占有重要地位. 但ITF对肠黏膜的保护作用的机制并不十分清楚. 本研究旨在探讨ITF对肠组织的保护作用是否可以通过抑制TLR和NF-κB的表达而实现.
清洁级Wistar幼鼠24只, 10日龄, 雌雄不限, 体质量为15-25 g, 由中国医科大学医学实验动物中心提供(许可证号: SCXK(辽)2000-0009). 内毒素(Escherichia coli O55: B5; 脂多糖, lipopolysaccharide, LPS)购于Sigma公司;基因重组小肠三叶因子(rITF)由北京大学蛋白质工程及植物基因工程国家重点实验室提供, 配制浓度5 mg/mL. TRIzol总RNA提取试剂购自美国Promega公司; RT-PCR试剂盒、反转录和PCR扩增所需要的酶及其他试剂购于TaKaRa公司; TLR2兔抗大鼠IgG(一抗)购于Santa Cruz公司; TLR4、NF-κB兔抗鼠IgG(一抗)购于武汉博士德生物工程有限公司; 即用型SABC试剂盒及DAB显色剂均购于武汉博士德生物工程有限公司. PCR引物根据Medline数据库自行设计, 由上海英骏生物公司合成.
1.2.1 分组和造模: 24只幼鼠随机分为正常对照组、LPS组和LPS+ITF组(n = 8). 对照组给予生理盐水1 mL/kg; 内毒素血症组给予LPS 5 mg/kg; LPS+ITF组给予LPS 5 mg/kg+rITF 0.5 mg/只[12], 均采用腹腔注射给药. 于腹腔注射后3 h处死, 留取距回盲端1 cm左右回肠组织, 于液氮速冻, 并转-70 ℃保存; 另取肠组织40 g/L多聚甲醛固定, 以待检测和分析.
1.2.2 石蜡切片制作: 40 g/L多聚甲醛固定液中标本, 常规进行石蜡包埋, 5 μm组织切片, HE染色, 光学显微镜下观测肠组织学改变.
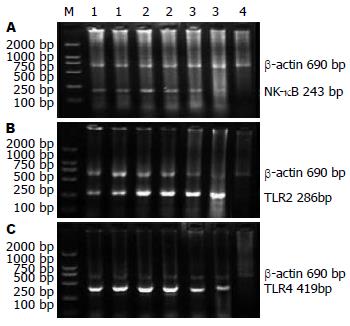
1.2.3 应用RT-PCR检测TLR和NF-κB mRNA的表达: 按TRIzol总RNA提取试剂说明书进行操作提取总RNA, 并经紫外分光光度计测定, 计算提取物RNA浓度. 并经反转录扩增cDNA, RT-PCR检测NF-κB mRNA表达. 取cDNA 1 μg, 10×buffer 2 μL, MgCl2 4 μL, 10 mmol/L dNTPs 2 μL, 引物100 ng, TagDNA多聚酶 1 U. 总体系20 μL. 将PCR扩增之后的产物进行2%琼脂糖凝胶电泳, 凝胶成像系统及分析系统进行条带分析. TLR和NF-κB引物序列见表1.
| 引物名称 | 扩增片断(bp) | 退火温度(℃) |
| TLR2 | ||
| F: 5'-CGC TTC CTG AAC TTG TCC-3' | 286 | 51.5 |
| R: 5'-GGT TGT CAC CTG CTT CCA-3' | ||
| TLR4 | ||
| F: 5'-CCA GAG CCG TTG GTG TAT -3' | 419 | 53.5 |
| R: 5'-GCC CTG TGA GGT CGT TGA -3' | ||
| NF-κB | ||
| F: 5'-TGC GAA TGG AGC GAC AGG -3' | 243 | 56 |
| R: 5'-AGG CCA AAT GAA AGG AGT GG-3' | ||
| β-actin | ||
| F: 5'-CAC CCT GTG CTG CTC ACC GAG GCC -3' | 690 | 55 |
| R: 5'-CCA CAC AGA TGA CTT GCG CTC AGG -3' |
1.2.4 采用SABC(Strept Avidin-Biotin Complex, 链霉素抗生物素蛋白-过氧化物酶)法检测肠组织TLR2、4和NF-κB蛋白定位表达: 石蜡切片常规脱蜡至水, 30%H2O2+蒸馏水混合, 室温孵育l0 min, 灭活内源性过氧化氢酶, 蒸馏水冲洗; 经热修复抗原, 滴加5%BSA封闭液, 室温下孵育30 min; 滴加稀释的兔抗大鼠TLR2、4和NF-κB抗体(一抗), 4 ℃孵育过夜; 冲洗后滴加生物素标记的山羊抗兔IgG(二抗), 37 ℃孵育30 min; 经冲洗, 再滴加SABC溶液, 37 ℃孵育30 min, 冲洗, 混匀后DAB显色, 室温条件下显色5 min, 蒸馏水充分洗涤; 苏木素轻度复染l0 min, 水洗返兰30 min; 脱水、二甲苯透明处理, 封片, 显微镜下观察. 阴性对照: 除用PBS代替兔抗大鼠TLR2、4和NF-κB抗体外, 其他步骤同上. 以细胞膜有棕黄色染色为TLR阳性细胞; 以细胞核和细胞质内有均匀的棕黄色颗粒染色为NF-κB阳性细胞.
免疫组织化学图片测定: 每组图片取8个视野, 采取日本OLYMPUS摄像系统和日本MetaMorph/BX41图像数据分析系统测定积分吸光度(IA).
统计学处理 所有数据以mean±SD表示, 用SPSS17.0统计软件包进行方差分析, 组间比较采用LSD法检验, P<0.05为差异有显著性.
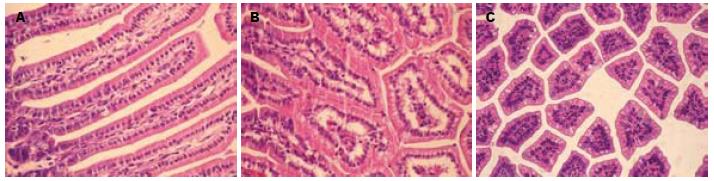
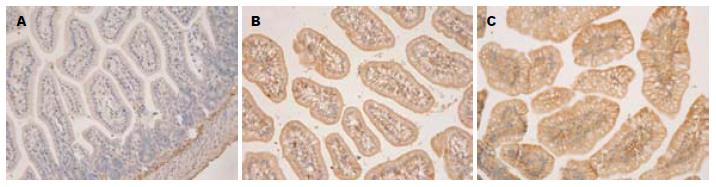
NS组肠绒毛完整, 上皮细胞排列整齐, 杯状细胞少见, 无明显异常改变(图1A). 给予LPS后3 h, LPS组肠组织可见明显异常, 绒毛间质可见有充血, 少许炎性细胞浸润, 水肿明显, 肠上皮细胞排列紊乱, 细胞水肿(图1B); LPS+ITF组间质和上皮细胞水肿较LPS组明显减轻, 杯状细胞明显增加(图1C).
NF-κB在NS组表达非常弱, LPS组表达较NS组明显增高, 差异有统计学意义(P<0.01); LPS+ITF组较LPS组表达明显下调, 差异有统计学意义(P<0.01). TLR2 mRNA表达LPS组较NS组明显增高, 差异非常显著(P<0.01), 有统计学意义; LPS+ITF组较NS组、LPS组均明显增高, 且差异有统计学意义(P<0.01). 肠组织TLR4 mRNA表达LPS组较NS组明显增高, 差异非常显著(P<0.01), 有统计学意义; LPS+ITF组TLR4 mRNA表达较LPS组明显降低, 差异非常显著(P<0.01), 有统计学意义(表2, 图2).
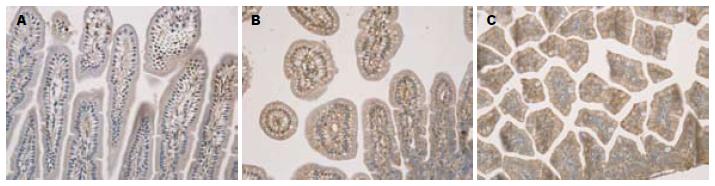
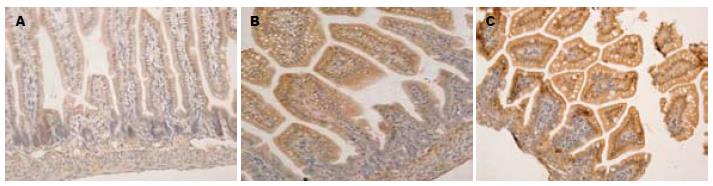
免疫组化见NF-κB蛋白表达在NS组肠绒毛顶端上皮细胞胞浆和胞核内, LPS组的蛋白表达较NS组明显增强, 有统计学意义(P<0.05); LPS+ITF组蛋白表达较LPS组明显降低, 差异有统计学意义(P<0.01). TLR2蛋白表达在NS组肠绒毛上皮细胞, 胞膜可见颜色较浅的棕黄色染色, LPS组蛋白表达明显增强, 较NS组有非常显著的差异, 有统计学意义(P<0.01); LPS+ITF组蛋白表达较NS组、LPS组均明显增强, 差异非常显著, 有统计学意义(P<0.01). TLR4蛋白表达在NS组肠绒毛上皮细胞, 胞膜可见棕黄色染色较浅, LPS组蛋白表达较NS组明显增强, 差异有统计学意义(P<0.01); LPS+ITF组蛋白表达较LPS组明显减弱, 差异非常显著(P<0.01, 表3, 图3-5).
感染是儿科常见病之一, 而重症感染常伴发胃肠功能障碍. 胃肠功能障碍常常被认为是多器官功能衰竭的始发因子[13], 胃肠功能障碍的发病机制与内毒素和肠黏膜屏障功能密切相关, 近年来备受人们的关注. 当肠黏膜的屏障功能破坏, 肠道内细菌及毒素大量入血及组织中, 引起内毒素血症, 内毒素血症又可促进细胞因子、炎性介质的释放, 加重肠黏膜屏障的损坏, 加速危重症的发展过程, 因此胃肠功能障碍是导致全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能衰竭(multiple organ failure, MOF)的重要因素之一[14,15]. ITF是三叶肽家族成员之一, 由肠黏膜上皮杯状细胞分泌, 广泛存在于胃肠道. 他对黏膜的保护作用主要在于增强受损黏膜周围完好的上皮细胞向黏膜损伤表面迁移覆盖, 并与黏液中糖蛋白结合, 形成稳定的凝胶复合物, 抵抗黏膜表面有害物质的损伤, 从而增强了胃肠道黏膜屏障的防御能力[10,16], 在肠道的自我保护和损伤后修复中占有重要地位. 研究表明[17-20]在实验性结肠炎模型中, 杯状细胞合成和分泌ITF, 维持肠黏膜上皮细胞的完整性并于炎症时发挥其黏膜修复作用. 敲除编码鼠ITF基因后, 小鼠由于肠道内缺乏ITF, 缺乏保护作用, 当饮用硫酸葡聚糖钠溶液时, 1/2死于结肠炎, 当给予口服重组ITF后肠黏膜损伤明显减轻.
在以往的研究中, ITF对肠黏膜的保护作用主要集中在肠黏膜上皮细胞的增殖和修复方面. 本研究中, 给予外源性rITF明显下调了LPS所致TLR4 mRNA和蛋白的表达, 同时NF-κB mRNA和蛋白表达也同步下调, 肠组织病理改变显示肠黏膜损伤明显减轻. ITF下调了TLR4的表达, 说明ITF抑制了TLR4的信号转导功能, 使NF-κB的激活受到抑制, 因而NF-κB mRNA和蛋白的表达出现下调, 促炎介质释放减少, 肠损伤减轻. LPS的识别和信号转导是宿主发生防御反应的关键, LPS介导的细胞激活需细胞表面能够与内毒素结合的蛋白参与, 这些蛋白包括LPS结合蛋白(LPS binding protein, LBP)和CD14, 这些蛋白并没有跨膜转导信号的功能[21,22]. 研究表明[23]TLR4与CD14在与LPS的反应中的功能是紧密相连的, 其在肠道的分布也是密切相关的, 在肠道的表达有相似的模式. TLR即是免疫识别受体, 又是跨膜信号转导分子. TLR2、4均可识别LPS, 而TLR4是主要的识别受体[24-26]. 研究表明[27,28], TLR4与单独LPS的亲和力实际是相当低的, 在体内LPS形成LPS-LBP-CD14复合物后与TLR4结合的亲和力明显增强, 并使TLR4激活, 通过信号转导作用激活NF-κB, 激活后的NF-κB向核内移位, 促进促炎介质合成和释放, 如TNF-α释放明显增加, 导致肠组织损伤, 使肠黏膜结构破坏和屏障功能降低, 导致细菌移位, 并可导致肠源性内毒素血症, 诱发MOF.
本研究表明ITF对TLR4 mRNA和蛋白的表达有明显的下调作用, 并同时伴有NF-κB表达的下调, 肠组织损伤明显减轻. ITF对TLR4的表达下调作用其机制可能是多方面的. 其中ITF可能阻抑了TLR4与LPS-LBP-CD14复合物或LPS-LBP与CD14等中间环节的结合, 使信号转导不能传导到细胞内, NF-κB不能被激活, 因而炎症介质的合成释放受到抑制, 使肠黏膜免遭损伤. 因此, 我们认为ITF阻抑了TLR与LPS的结合, 减少了炎症介质的释放, 可能是其减轻肠黏膜损伤, 保护肠屏障功能的主要作用之一.
研究表明, TLR2也被认为是LPS的信号转导分子, 在肠黏膜屏障保护方面起着一定作用[29,30]. 本研究中ITF对TLR2 mRNA和蛋白的表达无明显抑制作用, 甚至出现了明显上调. 但TLR2 mRNA表达的上调并未使肠组织损伤加重.
总之, ITF减轻肠损伤的作用主要是通过抑制了TLR4的表达而实现的, 这也说明TLR4在LPS的信号转导和介导炎症反应中起主要作用. TLR2在肠道中的作用还有待进一步研究.
NF-κB是具有多向性调节作用的蛋白质分子, 过度活化会激活、增强机体的非特异及特异性免疫反应, 造成组织损伤和器官功能紊乱. TLR是能识别病原微生物的免疫受体, 通过信号转导激发天然免疫反应. 肠三叶因子是三叶肽家族成员之一, 在肠道的自我保护和损伤后修复中具有重要作用. 但肠三叶因子对肠黏膜的保护作用的机制并不十分清楚.
邢建峰, 副教授, 西安交通大学医学院
滕旭等分别在坏死性小肠结肠炎和炎症性肠病的研究中证实, 给予外源性肠三叶因子对肠黏膜具有减轻肠损伤的作用.
本研究观察了外源性肠三叶因子对TLR和核因子-κB的调节作用与肠损伤保护作用的关系, 对肠三叶因子在减轻肠损伤的保护作用机制方面增加了新的认识.
肠三叶因子本身是肠道自身分泌的多肽类因子, 在肠道的自我保护和损伤后修复中具有重要作用. 在有害因素作用下对肠组织具有保护作用. 拓展外源性肠三叶因子在肠损伤保护作用的应用和研究, 具有一定的临床指导意义.
肠三叶因子: 是三叶肽家族成员之一, 由肠黏膜上皮杯状细胞分泌, 广泛存在于胃肠道, 具有特征性的三叶结构, 被认为是内源性具有抗凋亡特性的肽类物质, 在肠道的自我保护和损伤后修复中具有重要作用.
本文是一篇较好的学术论文, 有一定的学术价值.
编辑: 张姗姗 电编:闫晋利
| 1. | Medzhitov R, Janeway C. The Toll receptor family and microbial recognition. Trends Microbiol. 2000;8:452-456. [PubMed] [DOI] |
| 2. | Uematsu S, Akira S. Toll-like receptors and innate immunity. J Mol Med (Berl). 2006;84:712-725. [PubMed] [DOI] |
| 3. | Krieg AM. CpG motifs in bacterial DNA and their immune effects. Annu Rev Immunol. 2002;20:709-760. [PubMed] [DOI] |
| 4. | Medzhitov R, Janeway CA. An ancient system of host defense. Curr Opin Immunol. 1998;10:12-15. [PubMed] [DOI] |
| 5. | Akira S, Takeda K. Toll-like receptor signalling. Nat Rev Immunol. 2004;4:499-511. [PubMed] [DOI] |
| 6. | Beutler B. Inferences, questions and possibilities in Toll-like receptor signalling. Nature. 2004;430:257-263. [PubMed] [DOI] |
| 7. | Gadjeva M, Wang Y, Horwitz BH. NF-kappaB p50 and p65 subunits control intestinal homeostasis. Eur J Immunol. 2007;37:2509-2517. [PubMed] [DOI] |
| 8. | Gadjeva M, Tomczak MF, Zhang M, Wang YY, Dull K, Rogers AB, Erdman SE, Fox JG, Carroll M, Horwitz BH. A role for NF-kappa B subunits p50 and p65 in the inhibition of lipopolysaccharide-induced shock. J Immunol. 2004;173:5786-5793. [PubMed] |
| 9. | Liboni KC, Li N, Scumpia PO, Neu J. Glutamine modulates LPS-induced IL-8 production through IkappaB/NF-kappaB in human fetal and adult intestinal epithelium. J Nutr. 2005;135:245-251. [PubMed] |
| 11. | Wang L, Li J, Li Q, Zhang J, Duan XL. Morphological changes of cell proliferation and apoptosis in rat jejunal mucosa at different ages. World J Gastroenterol. 2003;9:2060-2064. [PubMed] |
| 13. | Deitch EA. The role of intestinal barrier failure and bacterial translocation in the development of systemic infection and multiple organ failure. Arch Surg. 1990;125:403-404. [PubMed] [DOI] |
| 14. | Söderholm JD, Perdue MH. Stress and gastrointestinal tract. II. Stress and intestinal barrier function. Am J Physiol Gastrointest Liver Physiol. 2001;280:G7-G13. [PubMed] |
| 17. | Shi L, Zhang BH, Yu HG, Yu JP, Xi JL. Intestinal trefoil factor in treatment of neonatal necrotizing enterocolitis in the rat model. J Perinat Med. 2007;35:443-446. [PubMed] [DOI] |
| 18. | Renes IB, Verburg M, Van Nispen DJ, Büller HA, Dekker J, Einerhand AW. Distinct epithelial responses in experimental colitis: implications for ion uptake and mucosal protection. Am J Physiol Gastrointest Liver Physiol. 2002;283:G169-G179. [PubMed] |
| 19. | Marchbank T, Cox HM, Goodlad RA, Giraud AS, Moss SF, Poulsom R, Wright NA, Jankowski J, Playford RJ. Effect of ectopic expression of rat trefoil factor family 3 (intestinal trefoil factor) in the jejunum of transgenic mice. J Biol Chem. 2001;276:24088-24096. [PubMed] [DOI] |
| 20. | Vieten D, Corfield A, Carroll D, Ramani P, Spicer R. Impaired mucosal regeneration in neonatal necrotising enterocolitis. Pediatr Surg Int. 2005;21:153-160. [PubMed] [DOI] |
| 21. | Wright SD, Ramos RA, Tobias PS, Ulevitch RJ, Mathison JC. CD14, a receptor for complexes of lipopolysaccharide (LPS) and LPS binding protein. Science. 1990;249:1431-1433. [PubMed] [DOI] |
| 22. | Ulevitch RJ, Tobias PS. Receptor-dependent mechanisms of cell stimulation by bacterial endotoxin. Annu Rev Immunol. 1995;13:437-457. [PubMed] [DOI] |
| 23. | Ortega-Cava CF, Ishihara S, Rumi MA, Kawashima K, Ishimura N, Kazumori H, Udagawa J, Kadowaki Y, Kinoshita Y. Strategic compartmentalization of Toll-like receptor 4 in the mouse gut. J Immunol. 2003;170:3977-3985. [PubMed] |
| 24. | Chow JC, Young DW, Golenbock DT, Christ WJ, Gusovsky F. Toll-like receptor-4 mediates lipopolysaccharide-induced signal transduction. J Biol Chem. 1999;274:10689-10692. [PubMed] [DOI] |
| 25. | Shimazu R, Akashi S, Ogata H, Nagai Y, Fukudome K, Miyake K, Kimoto M. MD-2, a molecule that confers lipopolysaccharide responsiveness on Toll-like receptor 4. J Exp Med. 1999;189:1777-1782. [PubMed] [DOI] |
| 26. | Heumann D, Roger T. Initial responses to endotoxins and Gram-negative bacteria. Clin Chim Acta. 2002;323:59-72. [DOI] |
| 27. | da Silva Correia J, Soldau K, Christen U, Tobias PS, Ulevitch RJ. Lipopolysaccharide is in close proximity to each of the proteins in its membrane receptor complex. transfer from CD14 to TLR4 and MD-2. J Biol Chem. 2001;276:21129-21135. [PubMed] [DOI] |
| 28. | Abreu MT, Vora P, Faure E, Thomas LS, Arnold ET, Arditi M. Decreased expression of Toll-like receptor-4 and MD-2 correlates with intestinal epithelial cell protection against dysregulated proinflammatory gene expression in response to bacterial lipopolysaccharide. J Immunol. 2001;167:1609-1616. [PubMed] |
| 29. | Cario E, Gerken G, Podolsky DK. Toll-like receptor 2 controls mucosal inflammation by regulating epithelial barrier function. Gastroenterology. 2007;132:1359-1374. [PubMed] [DOI] |
| 30. | Ey B, Eyking A, Gerken G, Podolsky DK, Cario E. TLR2 mediates gap junctional intercellular communication through connexin-43 in intestinal epithelial barrier injury. J Biol Chem. 2009;284:22332-22343. [PubMed] [DOI] |