修回日期: 2011-11-01
接受日期: 2011-11-04
在线出版日期: 2011-12-08
目的: 研究影响胰腺癌早期诊断及生存和预后的因素.
方法: 收集2005-01/2010-12有完整临床资料并随访成功的胰腺癌患者156例, 对所有患者的临床资料进行回顾分析. Kaplan-Meier及寿命表计算生存率, Log-rank检验进行影响预后的单因素分析, 符合条件的纳入Cox比例风险模型进行多因素分析.
结果: 本研究中, 77.50% 患者的年龄>45岁, 高峰年龄在60-70岁, 平均中位年龄64岁. 主要临床症状为腹痛、腹胀和黄疸. 影像学检查以B超和CT为主, 阳性率分别为60.63%、87.39%. CA19-9敏感性为84.62%. 淋巴结, 腹腔大血管, 肝脏等为胰腺癌主要转移部位, 淋巴结转移(n = 69), 大血管侵犯(n = 70), 肝脏转移(n = 55). 中位生存期为4.00 mo, l-5年生存率分别为: 25.00%、14.00%、6.00%、4.00%、0%. 单因素分析提示, 年龄>60岁、CA19-9>100 U/mL、TNM Ⅲ或Ⅳ期、肝脏转移、非手术治疗、肿瘤体积大等都是预后不良的因素; Cox多因素分析结果表明, TNM分期和有无腹水是影响患者预后的独立危险因素.
结论: 患者有无腹水、肿瘤分期是影响本组胰腺癌预后的独立因素. 早期诊断与治疗是提高胰腺癌患者生存时间, 改善患者预后的关键.
引文著录: 张文仙, 石海, 许建明. 胰腺癌患者临床病例分析与预后156例. 世界华人消化杂志 2011; 19(34): 3526-3531
Revised: November 1, 2011
Accepted: November 4, 2011
Published online: December 8, 2011
AIM: To analyze factors influencing early diagnosis, survival and prognosis of patients with pancreatic carcinoma.
METHODS: The clinical data for 156 patients with pancreatic carcinoma who were treated from January 2006 to December 2010 and had complete follow-up data were reviewed respectively. Survival rate was estimated using the life table method and the Kaplan-Meier method. Log-rank test was used for univariate prognostic analysis, and Cox regression model was used for multivariate prognostic analysis.
RESULTS: The peak age for pancreatic carcinoma was 60-70 years, and 77.50% of the patients were more than 45 years (median age, 64 years). Main clinical manifestations were abdominal pain, abdominal distention and jaundice. B-ultrasound and CT were major imaging tests, which had positive rates of 60.63% and 87.39%, respectively. The sensitivity of CA19-9 detection was 84.62%. Lymph nodes, celiac large blood vessels and the liver were typical sites of metastases in pancreatic cancer. In this study, lymph node metastases were detected in 69 patients, vascular invasion in 70 patients and liver metastasis in 55 patients. The median survival time was 4.0 months. Overall survival rates at 1-5 years were 25.00%, 14.00%, 6.00%, 4.00%, and 0%, respectively. Univariate analysis suggested that age >60 years, CA19-9>100 U/mL, TNM stage III or IV, non-surgical treatment, large tumor size and liver metastasis were poor prognostic factors, while Cox multivariate analysis showed that TNM stage and ascites were independent risk factors for dismal prognosis.
CONCLUSION: Ascites and tumor stage affected the prognosis of patients with pancreatic cancer. Early diagnosis and treatment were important for improving the survival time and prognosis of patients with pancreatic cancer.
- Citation: Zhang WX, Shi H, Xu JM. Survival and prognosis of patients with pancreatic carcinoma: an analysis of 156 cases. Shijie Huaren Xiaohua Zazhi 2011; 19(34): 3526-3531
- URL: https://www.wjgnet.com/1009-3079/full/v19/i34/3526.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i34.3526
近年来, 胰腺癌的发病率在全球不断上升. 因其早期临床症状不明显, 约有80%的患者在确诊时已处于中晚期, 失去根治的机会, 中位生存期仅3-6 mo, 手术切除率10%-20%[1]. 即使在根治性手术的患者中, 由于胰腺癌早期即可发生周围神经侵犯及淋巴结跳跃转移, 肝脏微转移[2], 约有80-95%的患者在术后5年发生肿瘤复发或转移[3]. 胰腺癌总体预后较差, 5年生存率不到5%[4]. 本文回顾性分析我院156例胰腺癌患者的诊断和治疗情况, 并对影响预后的因素进行综合分析.
选取安徽医科大学第一附属医院2005-01/2010-12收治的300例临床诊断胰腺癌患者. 收集有完整临床资料并随访成功的胰腺癌患者(n = 156), 手术切除标本或术中冰冻获得病理诊断(n = 59), 临床确诊(n = 97). 诊断标准参照《中国胰腺癌诊治指南》[5].
记录患者的一般情况、症状、诊断及治疗情况等, 电话或信函随访出院后治疗情况及生存时间. 生存时间为确诊之日至死亡日[6]. 随访时间从确诊至2011-05. 随访成功156例(52.00%).
统计学处理 采用寿命表、Kaplan-Meier法计算中位生存期及生存率; 对可能影响生存时间的因素进行Log-rank检验, 并对有显著差异的变量引入Cox风险比例模型进行多因素分析, P<0.05为差异有统计学意义. 统计分析采用SPSS 16.0软件完成.
本组患者男(n = 98), 女(n = 58), 男女比例1.69:1. 年龄最小为30岁, 最大为86岁, 平均中位年龄64岁. 77.50%患者年龄>45岁, 64.10%患者的年龄>60岁, 高峰年龄在60-70岁.
患者多因显著的临床症状入院检查, 首发症状最多见为腹痛(n = 108, 69.23%), 其次为腹胀(n = 48, 30.77%), 黄疸(n = 43, 27.56%)和食欲下降(n = 21, 13.46%, 表1). 其他首发症状有进食哽噎, 脐部渗液等. 胰腺癌患者临床表现主要与肿瘤所在部位有关, 如胰头癌患者多因黄疸, 腹痛入院, 而胰尾癌因肿瘤位置深, 患者常因大量腹水致腹胀,食欲下降入院.
| 首发症状 | n(%) |
| 腹痛 | 108(69.23) |
| 腹胀 | 48(30.77) |
| 黄疸 | 43(27.56) |
| 食欲下降 | 21(13.46) |
| 腰背部胀痛不适 | 13(8.33) |
| 体质量下降 | 13(8.33) |
| 腹泻 | 9(5.77) |
| 恶心呕吐 | 7(4.49) |
| 乏力 | 6(3.85) |
| 腹部包块 | 3(1.92) |
| 发热 | 3(1.92) |
| 消化道出血 | 2(1.28) |
| 其他 | 24(15.38) |
影像学检查中, 腹超声检查127例, 腹部CT检查119例, MRI+MRCP检查31例, PET-CT检查3例, 超声内镜4例. 其中, 超声发现可疑病变(n = 38, 29.92%); 明确胰腺占位性病变(n = 77, 60.63%); 发现异常(n = 115, 90.55%). CT发现可疑病变(n = 15, 12.61%); 明确胰腺占位性病变(n = 104, 87.39%); 发现异常100%. 超声联合CT检查阳性率92.47%(表2). 实验室检查中CA19-9≥100 U/mL(66.03%, 103/156), CA19-9<100 U/mL(25.64%, 40/156).
| 检查方法 | 阳性例数/总例数 | 阳性率(%) |
| 超声 | 77/127 | 60.63 |
| CT | 104/119 | 87.39 |
| 超声+CT | 86/93 | 92.47 |
| MRI(MRCP) | 28/31 | 90.32 |
| PET-CT | 3/3 | 100.00 |
| EUS | 4/4 | 100.00 |
在有明确病理结果的59例中, 中分化腺癌(n = 22), 低分化腺癌(n = 9, 表3).
| 病理类型 | n(%) |
| 高分化腺癌 | 3(5.08) |
| 中分化腺癌 | 22(37.29) |
| 低分化腺癌 | 9(15.25) |
| 中-低分化腺癌 | 5(8.47) |
| 乳头状管状腺癌 | 2(3.39) |
| 黏液性囊腺癌 | 1(1.69) |
| 黏液腺癌 | 2(3.39) |
| 鳞癌 | 1(1.69) |
| 梭形细胞癌 | 1(1.69) |
| 内分泌癌 | 1(1.69) |
| 其他 | 12(33.89) |
在随访的156例患者中, 胰头癌(n = 78, 50.00%), 胰体尾癌(n = 67, 42.95%), 全胰腺癌(n = 9, 5.77%), 其他(n = 2, 1.28%). TNMⅠ期(n = 7, 4.48%), Ⅱ期(n = 18, 11.54%), Ⅲ期(n = 42, 26.92%), Ⅳ期(n = 86, 55.13%). 胰头癌Ⅰ期和Ⅱ期(n = 13, 16.67%), Ⅲ期(n = 32, 41.03%), Ⅳ期(n = 31, 39.74%), 胰体尾癌Ⅰ期和Ⅱ期(n = 9, 13.43%), Ⅲ期(n = 8, 11.94%), Ⅳ期(n = 49, 73.13%).
胰腺癌明确诊断时患者多处于疾病中晚期, 周围脏器的浸润转移发生率也较高, 主要有淋巴结转移(包括胰周淋巴结, 肠系膜淋巴结, 肝门淋巴结等)共69例, 血管侵犯(包括肠系膜上动脉, 肠系膜上静脉, 门静脉, 下腔静脉, 腹主动脉等)共70例, 肝脏转移共55例(表4).
| Ⅰ期 | Ⅱ期 | Ⅲ期 | Ⅳ期 | |
| 淋巴结转移 | 0 | 5 | 15 | 49 |
| 邻近脏器转移 | 2 | 15 | 32 | 76 |
| 远处脏器转移 | 0 | 3 | 2 | 49 |
| 肝脏转移 | 0 | 0 | 0 | 55 |
| 血管侵犯 | ||||
| 肠系膜上血管 | 0 | 2 | 24 | 14 |
| 门静脉 | 0 | 1 | 13 | 7 |
| 下腔静脉 | 0 | 0 | 0 | 5 |
| 腹主动脉 | 0 | 0 | 6 | 8 |
| 其他血管 | 0 | 2 | 11 | 8 |
根治性切除术(n = 18, 11.54%), 包括Whipple手术(n = 9, 5.77%)、胰尾及脾脏切除术(n = 9, 5.77%); 姑息性治疗(n = 76, 48.72%), 包括姑息性胃肠、胆肠吻合内引流术(n = 30, 19.23%)、单纯手术探查术(n = 13, 8.33%), PTCD下胆管支架植入术介入治疗(n = 4, 2.56%), 化疗(n = 42, 26.92 %), 放疗(n = 2, 1.28%)等; 单纯对症支持治疗(n = 56, 35.90%).
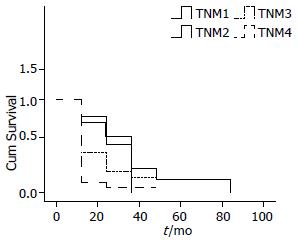
总的中位生存期为4.00 mo, Ⅰ期和Ⅱ期为21.23 mo, Ⅲ期为9.12 mo、Ⅳ期为6.62 mo, 三者比较具有显著统计学意义(P<0.001). 总计1-5年的生存率为: 25.00%、14.00%、6.00%、4.00%、0%; Ⅰ期和Ⅱ期1-5年生存率为73.00%、43.00%、14.00%、7.00%、7.00%; Ⅲ期患者的1、2、3年生存率: 34.00%、17.00%、11.00%; Ⅳ期患者1、2年生存率为9.00%、5.00%(图1).
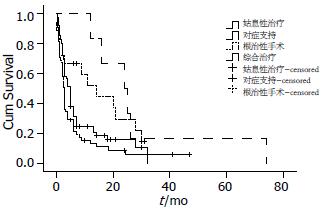
对变量行Kaplan-Meier法单因素分析, 得出影响预后的不良的因素有: 年龄>60岁, TNM Ⅲ期或Ⅳ期、肝脏转移、非手术治疗、有腹水、胰体尾癌, CA19-9>100等(表5), 与文献等一致[7]. 对治疗方式行分层检验提示, 根治性手术、姑息性治疗、对症支持治疗、综合治疗(即行根治术后再行姑息性治疗和对症支持等治疗)的中位生存期分别为10.80、7.24、6.72、28.00 mo. 其中, 根治性手术与对症支持治疗之间, 综合治疗与对症支持治疗之间, 姑息性治疗与综合治疗之间, 根治性手术与姑息治疗之间的生存率有统计学差异, P值分别为0.002、0.004、0.012、0.012(图2). 将反应预后危险因素的变量引入Cox回归中多因素分析, 有6个变量引入方程(表6). 结果表明TNM分期与患者预后关系最密切(P<0.001), 腹水提示预后(P<0.05).
| 影响因素 | n | 1年生存率(%) | 2年生存率(%) | 中位生存期(mo) | P值 |
| 年龄(岁) | |||||
| ≤60 | 56 | 25.00 | 12.00 | 8.00 | 0.027 |
| >60 | 100 | 19.00 | 8.00 | 7.41 | |
| TNM | |||||
| I,Ⅱ期 | 25 | 64.00 | 36.00 | 18.00 | <0.001 |
| Ⅲ期 | 42 | 26.00 | 10.00 | 8.13 | |
| Ⅳ期 | 86 | 7.00 | 2.00 | 6.45 | |
| 淋巴结转移或浸润 | |||||
| 无 | 83 | 28 .00 | 16.00 | 8.29 | >0.050 |
| 有 | 69 | 24 .00 | 11.00 | 7.86 | |
| 大血管浸润 | |||||
| 无 | 82 | 22.00 | 11.00 | 7.69 | >0.050 |
| 有 | 70 | 21.00 | 9.00 | 7.64 | |
| 邻近脏器浸润 | |||||
| 无 | 28 | 21.00 | 14.00 | 7.64 | >0.050 |
| 有 | 125 | 22.00 | 9.00 | 7.65 | |
| 肝脏转移 | |||||
| 无 | 98 | 34.00 | 18.00 | 9.05 | 0.001 |
| 有 | 55 | 12.00 | 8 .00 | 6.81 | |
| 肿瘤大小(cm) | |||||
| <2 | 1 | 1.00 | 0 | 18.00 | >0.050 |
| 2-4 | 21 | 19.00 | 10.00 | 7.41 | |
| >4 | 63 | 21.00 | 8.00 | 7.56 | |
| 肿瘤部位 | |||||
| 胰头部 | 78 | 23.00 | 9 .00 | 7.80 | 0.007 |
| 胰体尾部 | 67 | 16.00 | 9 .00 | 7.18 | |
| 治疗方式 | |||||
| 根治性手术 | 18 | 44.00 | 28.00 | 10.80 | <0.020 |
| 姑息性治疗 | 76 | 17.00 | 4.00 | 7.24 | |
| 对症支持 | 56 | 11.00 | 5.00 | 6.72 | |
| 综合治疗 | 6 | 100 | 67.00 | 28.00 | |
| 腹水 | |||||
| 无 | 91 | 24.00 | 11.00 | 7.91 | 0.014 |
| 有 | 58 | 14.00 | 7.00 | 6.96 | |
| 黄疸 | |||||
| 无 | 113 | 22.00 | 12.00 | 7.70 | >0.050 |
| 有 | 43 | 19.00 | 50.00 | 7.37 | |
| 症状-确诊的时间(mo) | |||||
| <3 | 95 | 20.00 | 9.00 | 7.50 | >0.050 |
| ≥3 | 60 | 22.00 | 10.00 | 7.66 | |
| CA19-9(U/mL) | |||||
| <100 | 40 | 30.00 | 10.00 | 8.57 | 0.025 |
| ≥100 | 103 | 18.00 | 10.00 | 7.36 | |
| 影响因素 | B | SE | Wald | df | P值 | Exp(B) | 95%CI |
| 年龄 | -0.093 | 0.204 | 0.209 | 1 | 0.648 | 0.911 | 0.611-1.358 |
| TNM分期 | 0.593 | 0.141 | 17.669 | 1 | 0.000 | 1.809 | 1.372-2.385 |
| 腹水 | 0.481 | 0.203 | 5.597 | 1 | 0.018 | 1.617 | 1.086-2.409 |
| CA19-9 | 0.340 | 0.242 | 1.982 | 1 | 0.159 | 1.405 | 0.875-2.256 |
| 肝转移 | 0.341 | 0.246 | 1.926 | 1 | 0.165 | 1.407 | 0.869-2.278 |
| 肿瘤大小 | -0.145 | 0.150 | 0.934 | 1 | 0.334 | 0.865 | 0.645-1.160 |
胰腺癌患者早期表现不典型, 如腹部不适、腹痛、腹胀、食欲下降、腹泻、便秘等, 常误诊为胃肠疾病. 本文中仅25例(16.02%)的患者确诊时为Ⅰ期和Ⅱ期, 与文献报道一致[8,9]. 当症状典型时常处于中晚期, 本文患者128例(82.05%)诊断时处于Ⅲ期和Ⅳ期, 此时肿瘤多侵犯血管, 淋巴结或周围及远处其他脏器, 根治性手术不能实施, 文献报道约85%-90%患者确诊时失去根治机会[8,9]. 此外在胰腺癌的临床表现中, 腹痛﹑腹胀﹑黄疸﹑食欲下降等临床表现最为常见. 156例患者中, 腹痛108例(69.23%), 其次为腹胀48例(30.77%), 黄疸43例(27.56%)和食欲下降21例(13.46%), 文献也有报道78%-82%的患者出现腹痛, 64%的患者出现食欲减退[10]. 故需加强对胰腺癌非特异症状的警惕, 尤其是对40岁以上有不明原因腹痛的患者, 必要时行影像学检查排除. 早期常有影像学遗漏的病例, 需加强随访观察.
普通经腹部超声是最常用的筛查胰腺癌的方法, 但易受胃肠道内气体的干扰, 且常对操作者的临床经验及技能有较高的要求. CT诊断胰腺癌的敏感性为91%, 特异性85%[11], 此外对肿瘤的血管侵袭及手术治疗可切除性有较好的评估价值[12]. Phoa等[13]认为CT诊断肿瘤与周围血管关系时, 分级在D-E时的肿瘤88%存在血管浸润, 肿瘤可切除性分别为7%(D级)和0(E级); Loyar等[14]发现肿瘤与血管分级在A和B级时, 肿瘤的可切除性在95%, 因此该两类的患者预后较好. 对于肿瘤直径<1 cm的胰腺癌, 淋巴结浸润转移和肝内小转移灶等, CT的准确性下降, 多排螺旋CT的诊断效率有所提高[15]. 本研究中107例选择CT检查, 其中95%以上在本院行多排螺旋CT, 阳性率87.39%, 但在评估血管可切除性方面做得还不够. MRI在诊断肝内转移灶及胆道系统等方面优于CT, 但在淋巴结浸润诊断效果上比CT差[16,17], 本研究中MRI或联合MRCP阳性率达到100%, PET-CT在诊断小胰腺癌或常规影像学不能发现病灶而高度怀疑胰腺癌的情况下有很大的帮助. 本篇研究中, 阳性率达100%.
腹水可能与预后相关, 本组中约有58例(37.18%)的患者有明确的腹腔积液, 平均中位生存期为6.96 mo, 而无腹水的患者中位生存期为7.91 mo, 两者比较具有统计学差异(P = 0.014). 可能与肿瘤晚期由于出现腹腔转移或腹膜转移, 或因侵犯门静脉等较大静脉, 引起静脉回流受阻等相关, 故预后较差.
CA19-9在多数胰腺癌患者中有明显升高, 但其高低不能作为评估胰腺癌预后的指标. 本研究中CA19-9升高组与未升高组患者的中位生存期比较无明显统计学意义. 但在评估治疗效果或术后随访的过程中具有实际的应用价值[10,12].
姑息性手术治疗因能缓解患者黄疸或消化道梗阻状况, 可显著该善患者生活质量, 稍延长患者生存时间[10], 但不能从根本上控制肿瘤的发展. 近年来, 放化疗治疗取得了很大的突破与进展, 尤其是以吉西他滨为基础的化疗方案在延长进展期胰腺癌患者的中位生存期上有明显作用[18,19]. 根治性手术仍然是唯一可治愈的方式, 可显著改善患者的生存率. 本研究中根治性手术患者平均中位生存期大于姑息性治疗和对症支持治疗组的患者. 近期对胰腺癌围手术期采用多种方案的综合治疗是有共识的, 但尚需大组病例的前瞻性对照临床试验和长期随访结果.
总之, 胰腺癌的预后主要与肿瘤分期有关, 肿瘤分期决定着治疗方式的选择, 治疗方式又影响着患者生存时间. 因此提高早期诊断率, 早期诊断早期治疗, 尽可能行根治性切除, 可提高患者预后. 仍需在胰腺癌基础和临床方面做大量研究.
胰腺癌的发病率在全球不断上升. 因其早期临床症状不明显, 约有80%的患者在确诊时已处于中晚期, 失去根治的机会, 中位生存期仅3-6 mo, 手术切除率10%-20%.
周国雄, 主任医师, 南通大学附属医院消化内科
CT诊断胰腺癌的敏感性为91%, 特异性85%, 此外对肿瘤的血管侵袭及手术治疗可切除性有较好的评估价值.
Phoa等认为CT诊断肿瘤与周围血管关系时, 分级在D-E时的肿瘤88%存在血管浸润, 肿瘤可切除性分别为7%(D级)和0(E级).
本研究对胰腺癌的临床特征和预后进行了调查、分析, 对胰腺癌的早期诊治及预后有重要的参考价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Loos M, Kleeff J, Friess H, Büchler MW. Surgical treatment of pancreatic cancer. Ann N Y Acad Sci. 2008;1138:169-180. [PubMed] [DOI] |
| 2. | Westerdahl J, Andrén-Sandberg A, Ihse I. Recurrence of exocrine pancreatic cancer--local or hepatic? Hepatogastroenterology. 1993;40:384-387. [PubMed] |
| 4. | Wagner M, Redaelli C, Lietz M, Seiler CA, Friess H, Büchler MW. Curative resection is the single most important factor determining outcome in patients with pancreatic adenocarcinoma. Br J Surg. 2004;91:586-594. [PubMed] [DOI] |
| 8. | Arslan A, Buanes T, Geitung JT. Pancreatic carcinoma: MR, MR angiography and dynamic helical CT in the evaluation of vascular invasion. Eur J Radiol. 2001;38:151-159. [PubMed] [DOI] |
| 9. | DeWitt J, Devereaux B, Chriswell M, McGreevy K, Howard T, Imperiale TF, Ciaccia D, Lane KA, Maglinte D, Kopecky K. Comparison of endoscopic ultrasonography and multidetector computed tomography for detecting and staging pancreatic cancer. Ann Intern Med. 2004;141:753-763. [PubMed] |
| 10. | Sharma C, Eltawil KM, Renfrew PD, Walsh MJ, Molinari M. Advances in diagnosis, treatment and palliation of pancreatic carcinoma: 1990-2010. World J Gastroenterol. 2011;17:867-897. [PubMed] [DOI] |
| 11. | Bipat S, Phoa SS, van Delden OM, Bossuyt PM, Gouma DJ, Laméris JS, Stoker J. Ultrasonography, computed tomography and magnetic resonance imaging for diagnosis and determining resectability of pancreatic adenocarcinoma: a meta-analysis. J Comput Assist Tomogr. 2005;29:438-445. [PubMed] [DOI] |
| 12. | Cascinu S, Falconi M, Valentini V, Jelic S. Pancreatic cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2010;21 Suppl 5:v55-v58. [PubMed] [DOI] |
| 13. | Phoa SS, Reeders JW, Stoker J, Rauws EA, Gouma DJ, Laméris JS. CT criteria for venous invasion in patients with pancreatic head carcinoma. Br J Radiol. 2000;73:1159-1164. [PubMed] |
| 14. | Loyer EM, David CL, Dubrow RA, Evans DB, Charnsangavej C. Vascular involvement in pancreatic adenocarcinoma: reassessment by thin-section CT. Abdom Imaging. 1996;21:202-206. [PubMed] [DOI] |
| 15. | Kala Z, Válek V, Hlavsa J, Hana K, Vánová A. The role of CT and endoscopic ultrasound in pre-operative staging of pancreatic cancer. Eur J Radiol. 2007;62:166-169. [PubMed] [DOI] |
| 16. | Soriano A, Castells A, Ayuso C, Ayuso JR, de Caralt MT, Ginès MA, Real MI, Gilabert R, Quintó L, Trilla A. Preoperative staging and tumor resectability assessment of pancreatic cancer: prospective study comparing endoscopic ultrasonography, helical computed tomography, magnetic resonance imaging, and angiography. Am J Gastroenterol. 2004;99:492-501. [PubMed] [DOI] |
| 17. | Schima W. MRI of the pancreas: tumours and tumour-simulating processes. Cancer Imaging. 2006;6:199-203. [PubMed] [DOI] |
| 18. | Merl MY, Abdelghany O, Li J, Saif MW. First-line treatment of metastatic pancreatic adenocarcinoma: can we do better? Highlights from the "2010 ASCO Annual Meeting". Chicago, IL, USA. June 4-8, 2010. JOP. 2010;11:317-320. [PubMed] |
| 19. | Bayraktar S, Bayraktar UD, Rocha-Lima CM. Recent developments in palliative chemotherapy for locally advanced and metastatic pancreas cancer. World J Gastroenterol. 2010;16:673-682. [PubMed] [DOI] |