修回日期: 2011-10-29
接受日期: 2011-11-06
在线出版日期: 2011-12-08
目的: 观察CD44+/ki-67-结直肠癌干细胞的特征及其与临床病理特征的关系.
方法: 应用免疫组织化学染色、免疫组织化学双重染色和苏木精-伊红(HE)染色, 检测10例正常肠黏膜, 15例腺瘤, 59例结直肠癌标本和人结肠癌细胞株SW620中CD44和ki-67的表达, 定位CD44+/ki-67-肿瘤细胞, 观察、计数并与对应的HE染色切片进行形态学比较, 讨论CD44+/ki-67-癌干细胞与其临床病理特征的关系.
结果: CD44+/ki-67-肿瘤细胞的数量占肿瘤细胞0.1%-25.0%, 平均5.82%, 这种细胞主要分布在腺体基底膜侧或者在共壁腺体的共壁侧, 呈散在分布, 核的形态较一致, 呈圆形或卵圆形, 染色质较深, 胞浆较少, 与正常肠黏膜隐窝底部干细胞形态较一致, 与肿瘤浸润深度(χ2 = 1.851, P<0.05)和是否有淋巴结转移相关(χ2 = -4.113, P<0.01).
结论: CD44+/ki-67-可以作为肿瘤干细胞的标志, 这为肿瘤干细胞的分离、靶向治疗和个体化治疗提供了可靠的分子生物学指标, 也是预测肿瘤转移和判断患者预后的可靠指标.
引文著录: 韩军平, 刘斌, 杨艳丽, 苏勤军, 史敏, 钱震, 董亮, 张彩兰, 哈英娣. 结直肠癌CD44+/ki-67-癌干细胞特征及其与临床病理关系. 世界华人消化杂志 2011; 19(34): 3483-3488
Revised: October 29, 2011
Accepted: November 6, 2011
Published online: December 8, 2011
AIM: To investigate the number, location, distribution and staining features of CD44+/ki-67- colorectal cancer stem cells and to analyze their relation with clinicopathological characteristics in patients with colorectal carcinoma.
METHODS: Streptavidin-HRP immunohistochemical staining, double immunohistochemical staining and hematoxylin-eosin staining were performed to detect the expression of CD44 and ki-67 in 10 cases of normal mucosal tissue, 15 cases of adenoma with atypical hyperplasia, 59 cases of colorectal carcinoma, and human colon cancer cell line SW620. The number, location, distribution and staining features of CD44+/ki-67- colorectal cancer stem cells were observed, and their relation with clinicopathological characteristics was analyzed.
RESULTS: The number of CD44+/ki-67- tumor cells accounted for 0.1%-25.0% (average 5.82%) of all tumor cells, and the cells were mainly distributed in the sides of the basal membrane or common wall of glands. These cells had round or oval nuclei that were consistent in size, and contained deep stained chromatin and less cytoplasm. These features are consistent with those of stem cells in the intestinal crypts. The number of CD44+/ki-67- tumor cells was significantly correlated with depth of cancer infiltration (χ2 = 1.851, P < 0.05) and lymph node metastasis (χ2 = -4.113, P < 0.01).
CONCLUSION: CD44+/ki-67- are suitable specific markers for tumor stem cells and can be used for tumor stem cell isolation, targeted therapy, individualized treatment, prediction of tumor metastasis, and estimation of prognosis in patients with colorectal cancer.
- Citation: Han JP, Liu B, Yang YL, Su QJ, Shi M, Qian Z, Dong L, Zhang CL, Ha YD. Relationship between characteristics of CD44+/ki-67- colorectal cancer stem cells and clinicopathological characteristics in patients with colorectal cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(34): 3483-3488
- URL: https://www.wjgnet.com/1009-3079/full/v19/i34/3483.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i34.3483
结直肠癌是严重威胁人类生命的疾病之一, 其发病率不断上升, 关键是临床治疗的失败, 治疗失败的原因主要是肿瘤的转移与复发[1]. 当前癌症治疗的传统手段及近年来建立的基因治疗、免疫治疗等, 都无法彻底完全杀灭肿瘤细胞, 因为这些方法主要是杀灭绝大多数已经分化的肿瘤细胞, 而那些具有耐药性的肿瘤细胞不能被杀灭, 这其中包括肿瘤干细胞[2-10]. 肿瘤干细胞(tumor stem cell, CSC)理论的提出是对癌症本质认识的一种突破, 这一假说认为肿瘤组织中存在少量干细胞样的癌细胞亚群, 这是一类能够分化成肿瘤的细胞, 并能维持肿瘤的异质性、浸润等特性, 对肿瘤的无限增殖、发生、发展、复发、转移起着决定性作用; CSC在临床治疗时多处于休眠状态, 即停止于细胞周期中的G0期, 从而得以存活[11]. 若细胞外条件适宜, 在细胞生长和分裂信号的刺激下, 进入细胞周期, 产生新的肿瘤细胞, 导致癌症复发. 许多研究表明, CD44是结直肠癌干细胞的主要标志[12], Ki-67是细胞增殖的重要标记, 表达在G1、S、G2和M期, 是细胞增殖的重要标志物, G0期细胞不表达[13,14]. 本文利用免疫组织化学双染法, 标记CD44+/ki-67-的结直肠癌干细胞, 研究他的分布特点、数量及临床病理学特点.
选取2009-05/2010-10中国人民解放军兰州军区兰州总医院病理科结直肠癌标本(n = 59), 其中男性(n = 42), 女性(n = 17), 平均年龄59.7岁; 肿瘤部位: 直肠(n = 29), 结肠(n = 30); 肿瘤分化程度: 高-中分化腺癌(n = 49), 低分化腺癌(n = 10); 肿瘤类型: 腺癌(n = 52), 黏液腺癌(n = 7); 浸润深度: 肌层(n = 14), 外膜(n = 45); 淋巴结转移: 未转移(n = 33), 转移(n = 26); 另选取正常肠黏膜(n = 10), 腺瘤(n = 15); 人结肠癌细胞株SW620购自武汉大学典型物种保藏中心.
1.2.1 组织芯片制作: 将所有送检的结肠癌大体标本剖开, 经10%的中性福尔马林固定6-12 h, 采取病变部位, 脱水, 包埋, 石蜡2-3 mm切片, 进行HE染色, 显微镜下观察、打点选样; 制作标准2.5 cm×2 cm×1 cm大小蜡块, 利用手工组织打孔/阵列仪进行打孔, 然后采取已选好的样本, 包埋, 连续2-3 mm切片数张, 备用.
1.2.2 SW620结肠癌细胞爬片: 复苏一管冻存SW620细胞, 连续培养数代, 每一代取对数生长期的细胞, 制成单细胞悬液后爬片, 待细胞基本长成单层后, 经10%的中性福尔马林固定、备用.
1.2.3 免疫组织化学染色过程: 试剂为福州迈新生物技术开发有限公司KIT-9999, DoSPTM免疫组化双染试剂盒, 操作步骤按试剂盒说明书进行, PBS代替一抗作阴性对照. CD44和Ki-67鼠抗人单克隆抗体购自美国Vector公司.
1.2.4 结果判断: Ki-67阳性细胞的细胞核被染成蓝黑色, CD44阳性细胞的细胞膜染成红色. 观察瘤组织的丰富区和不同部位包括黏膜层和外膜层癌组织; 在细胞爬片中, 选择细胞分布比较均一, 无重叠区域; 观察10个高倍视野, 每个视野计数200个细胞, 分别计数ki-67阳性细胞、CD44阳性细胞、CD44+/ki-67-细胞, 计算各自的百分比; 然后和HE染色切片进行对比, 观察数量、位置和分布方式.
1.2.5 主要观察指标: CD44+/ki-67-细胞的数量、位置、分布方式及苏木精-伊红染色形态.
统计学处理 采用Excel建立数据库, SPSS17.0统计软件进行统计分析, 定性资料的比较采用χ2检验.
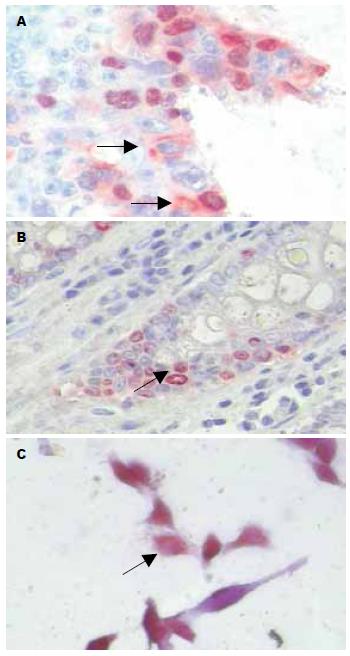
在正常肠黏膜及腺瘤中, CD44表达阴性; 在癌组织中表达强度和数量不一, 主要沿腺管基底侧或共壁腺体的共壁侧分布, 呈小灶状表达(图1A, 图2). CD44在正常肠黏膜和腺瘤中的表达与癌组织的表达, 两者存在差异(P<0.05). 在正常肠黏膜中ki-67表达较少, <3%, 大多位于肠黏膜隐窝底部的位置, 属于修复性隐窝干细胞(图1B). 在腺瘤中, 表达略有增加, 5%左右, 表达位置不一, 属于增生活跃的细胞, 在核分裂富裕区, 表达较高; 在癌组织中, 表达部位、数量和强度不一. ki-67在正常肠黏膜和癌组织的表达, 两者存在差异(P<0.05); 在腺瘤和癌组织中表达, 两者存在差异(P<0.05); 在腺瘤和正常黏膜间的表达, 两者差异不明显(P>0.05).
在59例结直肠癌中, CD44表达与浸润深度、淋巴结转移有关(P<0.05), 随着癌组织的浸润深度的增加、淋巴结转移率的增高, 其表达率增高. ki-67的表达与癌组织浸润深度、淋巴结转移有关(P<0.05), 随着癌组织浸润深度的增加、淋巴结转移率的增高, 其表达率增高(表1).
| n | CD44 | ki-67 | ki-67 | CD44+/ki-67- | |||||||||
| 阳性 率% | χ2值 | P值 | 阳性率% | χ2值 | P值 | 阴性率% | χ2值 | P值 | 细胞数比率% | χ2值 | P值 | ||
| 性别 | |||||||||||||
| 男 | 42 | 8.71 | 1.079 | >0.05 | 25.28 | 0.625 | >0.05 | 74.52 | -0.625 | >0.05 | 6.45 | 1.079 | >0.05 |
| 女 | 17 | 5.41 | 21.79 | 78.21 | 4.06 | ||||||||
| 部位 | |||||||||||||
| 直肠 | 29 | 8.78 | 0.649 | >0.05 | 26.90 | 0.775 | >0.05 | 73.1 | -0.775 | >0.05 | 6.59 | 0.649 | >0.05 |
| 结肠 | 30 | 6.94 | 22.74 | 77.26 | 5.21 | ||||||||
| 分化程度 | |||||||||||||
| 高-中分化 | 49 | 7.33 | -0.681 | >0.05 | 22.51 | -1.610 | >0.05 | 77.49 | 1.610 | >0.05 | 5.50 | -0.681 | >0.05 |
| 低分化 | 10 | 9.87 | 33.75 | 66.25 | 7.40 | ||||||||
| 类型 | |||||||||||||
| 腺癌 | 52 | 6.72 | -1.092 | >0.05 | 24.04 | 3.130 | >0.05 | 75.96 | -3.130 | >0.05 | 5.04 | -1.092 | >0.05 |
| 黏液腺癌 | 6 | 11.33 | 26.83 | 73.17 | 8.50 | ||||||||
| 浸润深度 | |||||||||||||
| 肌层 | 14 | 3.00 | -2.036 | <0.05 | 14.68 | 2.214 | <0.05 | 85.32 | -2,214 | <0.05 | 1.50 | 1.851 | <0.05 |
| 外膜 | 44 | 8.30 | 28.05 | 71.95 | 6.98 | ||||||||
| 淋巴结转移 | |||||||||||||
| 未转移 | 33 | 3.27 | -4.113 | <0.01 | 9.02 | -12.609 | <0.01 | 90.98 | 12.609 | <0.01 | 2.45 | -4.113 | <0.01 |
| 转移 | 26 | 13.46 | 43.96 | 56.04 | 10.10 | ||||||||
在59例结直肠癌中, CD44+/ki-67-癌细胞数5.82%, 在具有淋巴结转移和浸润至外膜的癌组织中表达较高, 与浸润深度、淋巴结转移有关(P<0.05), 并呈正相关. CD44+/ki-67-肿瘤细胞主要分布在腺体基底膜侧或者在共壁腺体的共壁侧, 呈散在分布, 核的形态较一致, 呈圆形或卵圆形, 胞浆较少, 与其肠黏膜隐窝底部正常干细胞形态较一致(图1A, 表1).
ki-67-的细胞中, CD44+的细胞占67%, CD44-的细胞占33%, 两者具有差异(P<0.05).
在SW620结肠癌细胞株中, CD44+细胞占7.56%, ki-67+细胞占91.94%, ki-67-细胞占8.06%, CD44+/ki-67-细胞占5.68%; 我们研究发现, CD44+的比率和CD44+/ki-67-细胞数比率与组织学相比, 无差异(P>0.05), 而且比值接近. 而ki-67的表达率组织学和细胞学有显著差异(P<0.05), 这可能是培养细胞在爬片时, 大多处于细胞增殖对数期所致. SW620培养细胞主要包括纤维母细胞样(双极)细胞, 细胞核椭圆形, 胞突尖细; 类圆形细胞和单极细胞, 细胞核圆形淡染, 有1-2个核仁以及少量的瘤巨细胞, CD44+/ki-67-主要表达在小圆细胞和单极细胞, 其他细胞表达甚少(图1C, 表2).
| 组织表达率(%) | CD44+ | ki-67+ | ki-67- | CD44+/ki-67- |
| SW620 | 7.56 | 91.94 | 8.06 | 5.68 |
| 癌组织中 | 7.76 | 24.96 | 75.04 | 5.82 |
CSC学说的提出及证实, 为恶性肿瘤的诊断和治疗提供了新思路. CSC学说由Reya等[15]提出, 将CSC定义为肿瘤中少量具有无限增殖潜能, 并驱动肿瘤形成和生长的细胞; 研究认为CSC起源于正常干细胞或祖细胞, 白血病的相关研究为CSC的研究提供了有力的证据. Bonnet等[16]研究发现白血病初始细胞表型为CD34+CD38-(正常人造血干细胞的表型是CD34+CD38-Thy-1+ c-Kit+IL-3Ra-). 肺癌、卵巢癌、神经母细胞瘤的体外培养结果也表明, 仅有0.02%-0.1%细胞能形成克隆[17]. Hajj等[18]在乳腺癌研究中发现200个细胞表面标志为ESA+CD44+CD24-/low Lin-的癌细胞能形成肿瘤, 并有很强的致瘤性, 而1万个ESA-CD44+CD24-/low的乳腺癌细胞在相同的时间内未形成肿瘤. 这种干细胞样特性的肿瘤细胞, 尽管在数量上只占整个乳腺肿瘤细胞的2%, 但其致瘤能力是其他表型肿瘤细胞的50倍.
CD44是细胞表面跨膜蛋白, 主要参与细胞-细胞, 细胞-基质之间的特异性黏附. 人CD44基因位于染色体11p, 至少由20个外显子组成, 包括编码标准型CD44蛋白分子(CD44s)的组合型外显子和编码变异性CD44蛋白分子(CD44v)的v区变异性剪接外显子[19-20]. CD44可能使细胞获得转移能力, 通过与远隔血管和淋巴管内某些配体结合, 使转移至那里的癌细胞更稳定地寄宿, 形成转移灶[21]. CD44最初的研究认为, 他不仅表达于癌细胞上, 而且表达在间质细胞上, 特别是在浸润的淋巴细胞上表达显著. 癌组织中CD44高表达可能是CD44阳性细胞有较强的存活率, 其他研究模型也证明了这一点[22]; 化疗本身DNA受损, 受损的DNA导致细胞活素的产生, 一些细胞活素能够诱导CD44的过多表达, 因此就提出了这样的一个发生机制模型. 相比较而言, P53能够抑制CD44的表达[23]. 因此, DNA损伤从多种途径促进了CD44分子的表达水平. CD44也可通过MAP激酶和Ras信号途径提高细胞再生能力[24]. 乳腺癌患者新辅助化疗前后的研究也证明了这一点, 在接受新辅助化疗后, 通过流式细胞仪检测CD44+CD24-细胞的比率, 结果显示, 接受治疗者CD44+CD24-的比率较高, 而未接受治疗者CD44+CD24-较低[25]. 在培养的乳腺癌细胞系中, DNA损伤的细胞, CD44+CD24-表达的细胞优先生存, CSC抵御DNA损伤而得以生存是好的解释机制[26]. 研究发现, 在静止期的细胞中, CD44+的细胞要比CD44-的细胞多, 这些结果也可被解释为是细胞调节周期蛋白, 他的表达水平在处于细胞周期和静止期细胞中不断地波动造成[27]. 在一些培养的细胞系中, CSC标志CD133也随着细胞周期不断的波动.
ki-67属非组蛋白, 是一种大分子蛋白质, 由相对分子量为345 ku和395 ku的2条多肽链组成. 编码Ki-67的人类基因定位于第10号染色体的长臂2区5带(10q25). Ki-67是细胞核增殖抗原, 参与细胞的有丝分裂, 表达在G1、S、G2和M期, 是细胞增殖的重要标志物, G0期细胞不表达. CSC多处于静息期, 即细胞生长周期的G0期, 常规放化疗都不易被消灭, 即使99.99%肿瘤细胞都被杀死, 但只要有0.01%的CSC还活着, 这就成为今后肿瘤复发的根源[28,29]. 研究表明, CSC与成体干细胞相似, 往往在药物治疗时处于休眠状态, 即停止于细胞周期中的G0/G1期, 从而得以存活, 并在药物治疗后继续产生新的肿瘤细胞, 导致癌症复发[30]. 若细胞外条件适宜, 在细胞生长和分裂信号的刺激下, 进入细胞周期.
本文研究中, CD44及ki-67在结直肠癌中的表达与癌组织浸润深度及淋巴结转移明显相关, 存在差异. G0期细胞中, CD44+的细胞要比CD44-的细胞多. CD44+/ki-67-癌细胞数5.82%, 这种细胞主要分布在腺体基底膜侧或者在共壁腺体的共壁侧, 呈散在分布, 核的形态较一致, 呈圆形或卵圆形, 胞浆较少, 与其肠黏膜隐窝底部正常干细胞形态较一致. 在肿瘤中, 含量甚少, 大约是0.1%-10.1%左右, 与肿瘤浸润深度及淋巴结转移相关. 因此, CD44+/ki-67-癌细胞无论从形态上、数量上、分布部位上, 还是从肿瘤分子标志、临床治疗的角度方面, 更加适合作为CSC的标志, 为CSC的分离及靶向治疗, 个体化治疗提供了可靠的分子生物学指标, 也是预测肿瘤转移和患者预后可靠的指标.
当前癌症治疗的传统手段及近年来建立的基因治疗、免疫治疗等, 都无法彻底完全杀灭肿瘤细胞, 因为这些方法主要是杀灭绝大多数已经分化的肿瘤细胞, 而那些具有耐药性的肿瘤细胞不能被杀灭, 这其中包括肿瘤干细胞.
朴云峰, 教授, 吉林大学第一临床医院消化科
Bonnet等研究发现白血病初始细胞表型为CD34+CD38-(正常人造血干细胞的表型是CD34+ CD38-Thy-1+ c-Kit+IL-3Rα-).
CD44+/ki-67-癌细胞更加适合作为CSC的标志, 为CSC的分离及靶向治疗, 个体化治疗提供了可靠的分子生物学指标, 也是预测肿瘤转移和患者预后可靠的指标.
该文研究内容有新意, 设计合理, 方法及结果可靠, 结论对癌干细胞研究具有指导意义.
编辑: 李军亮 电编:何基才
| 2. | Cheng L, Alexander R, Zhang S, Pan CX, MacLennan GT, Lopez-Beltran A, Montironi R. The clinical and therapeutic implications of cancer stem cell biology. Expert Rev Anticancer Ther. 2011;11:1131-1143. [PubMed] [DOI] |
| 3. | Florian IS, Tomuleasa C, Soritau O, Timis T, Ioani H, Irimie A, Kacso G. Cancer stem cells and malignant gliomas. From pathophysiology to targeted molecular therapy. J BUON. 2011;16:16-23. [PubMed] |
| 4. | Lu X, Kang Y. Cell fusion hypothesis of the cancer stem cell. Adv Exp Med Biol. 2011;714:129-140. [PubMed] [DOI] |
| 5. | Borovski T, Vermeulen L, Sprick MR, Medema JP. One renegade cancer stem cell? Cell Cycle. 2009;8:803-808. [PubMed] [DOI] |
| 6. | Vlashi E, Pajonk F. Targeted cancer stem cell therapies start with proper identification of the target. Mol Cancer Res. 2010;8:291; author reply 291. [PubMed] [DOI] |
| 7. | Sehl ME, Sinsheimer JS, Zhou H, Lange KL. Differential destruction of stem cells: implications for targeted cancer stem cell therapy. Cancer Res. 2009;69:9481-9489. [PubMed] [DOI] |
| 8. | Liu YQ. [An update: stem cell and cancer stem cells]. Zhonghua Binglixue Zazhi. 2009;38:511-512. [PubMed] |
| 9. | Varnat F, Duquet A, Malerba M, Zbinden M, Mas C, Gervaz P, Ruiz i Altaba A. Human colon cancer epithelial cells harbour active HEDGEHOG-GLI signalling that is essential for tumour growth, recurrence, metastasis and stem cell survival and expansion. EMBO Mol Med. 2009;1:338-351. [PubMed] [DOI] |
| 10. | Lewis MT. Faith, heresy and the cancer stem cell hypothesis. Future Oncol. 2008;4:585-589. [PubMed] [DOI] |
| 11. | Nguyen GH, Murph MM, Chang JY. Cancer Stem Cell Radioresistance and Enrichment: Where Frontline Radiation Therapy May Fail in Lung and Esophageal Cancers. Cancers (Basel). 2011;3:1232-1252. [PubMed] |
| 12. | Yang YM, Chang JW. Bladder cancer initiating cells (BCICs) are among EMA-CD44v6+ subset: novel methods for isolating undetermined cancer stem (initiating) cells. Cancer Invest. 2008;26:725-733. [PubMed] [DOI] |
| 13. | Dituri F, Mazzocca A, Lupo L, Edling CE, Azzariti A, Antonaci S, Falasca M, Giannelli G. PI3K class 1B controls the cell cycle checkpoint promoting cell proliferation in hepatocellular carcinoma. Int J Cancer. 2011; Jul 27. [Epub ahead of print]. [PubMed] |
| 14. | Bubán T, Tóth L, Tanyi M, Kappelmayer J, Antal-Szalmás P. [Ki-67 -- new faces of an old player]. Orv Hetil. 2009;150:1059-1070. [PubMed] [DOI] |
| 15. | Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105-111. [PubMed] [DOI] |
| 16. | Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997;3:730-737. [PubMed] [DOI] |
| 17. | Hamburger AW, Salmon SE. Primary bioassay of human tumor stem cells. Science. 1977;197:461-463. [PubMed] [DOI] |
| 18. | Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci U S A. 2003;100:3983-3988. [PubMed] [DOI] |
| 19. | Heider KH, Kuthan H, Stehle G, Munzert G. CD44v6: a target for antibody-based cancer therapy. Cancer Immunol Immunother. 2004;53:567-579. [PubMed] [DOI] |
| 20. | Duca S, Bãlã O, Al-Hajjar N, Lancu C, Puia IC, Munteanu D, Graur F. Laparoscopic cholecystectomy: incidents and complications. A retrospective analysis of 9542 consecutive laparoscopic operations. HPB (Oxford). 2003;5:152-158. [PubMed] [DOI] |
| 21. | Ahmed FE. Molecular markers that predict response to colon cancer therapy. Expert Rev Mol Diagn. 2005;5:353-375. [PubMed] [DOI] |
| 22. | Biswas S, Guix M, Rinehart C, Dugger TC, Chytil A, Moses HL, Freeman ML, Arteaga CL. Inhibition of TGF-beta with neutralizing antibodies prevents radiation-induced acceleration of metastatic cancer progression. J Clin Invest. 2007;117:1305-1313. [PubMed] [DOI] |
| 23. | Vincent T, Mechti N. IL-6 regulates CD44 cell surface expression on human myeloma cells. Leukemia. 2004;18:967-975. [PubMed] [DOI] |
| 24. | Marhaba R, Bourouba M, Zöller M. CD44v6 promotes proliferation by persisting activation of MAP kinases. Cell Signal. 2005;17:961-973. [PubMed] [DOI] |
| 25. | Li X, Lewis MT, Huang J, Gutierrez C, Osborne CK, Wu MF, Hilsenbeck SG, Pavlick A, Zhang X, Chamness GC. Intrinsic resistance of tumorigenic breast cancer cells to chemotherapy. J Natl Cancer Inst. 2008;100:672-679. [PubMed] [DOI] |
| 26. | Fillmore CM, Kuperwasser C. Human breast cancer cell lines contain stem-like cells that self-renew, give rise to phenotypically diverse progeny and survive chemotherapy. Breast Cancer Res. 2008;10:R25. [PubMed] [DOI] |
| 27. | Snyder EL, Bailey D, Shipitsin M, Polyak K, Loda M. Identification of CD44v6(+)/CD24- breast carcinoma cells in primary human tumors by quantum dot-conjugated antibodies. Lab Invest. 2009;89:857-866. [PubMed] [DOI] |
| 29. | Zhang M, Rosen JM. Stem cells in the etiology and treatment of cancer. Curr Opin Genet Dev. 2006;16:60-64. [PubMed] [DOI] |
| 30. | McGowan PM, Kirstein JM, Chambers AF. Micrometastatic disease and metastatic outgrowth: clinical issues and experimental approaches. Future Oncol. 2009;5:1083-1098. [PubMed] [DOI] |