修回日期: 2011-10-25
接受日期: 2011-11-04
在线出版日期: 2011-11-28
目的: 研究肉桂油对胰岛素抵抗小鼠糖脂代谢的影响, 探讨其作用机制.
方法: 采用高脂饲料喂养建立小鼠胰岛素抵抗模型, 经肉桂油治疗后测定口服糖耐量及胰岛素耐受, 观察体质量、血糖、血清胰岛素、甘油三酯、总胆固醇、瘦素、抵抗素、脂联素的变化.
结果: 肉桂油能降低胰岛素抵抗小鼠的体质量(30.3±3.6 vs 34.6±3.1, P<0.05)、血糖(7.6±2.2 vs 9.2±1.3, P<0.05)、血清胰岛素(1.3±0.1 vs 1.7±0.2, P<0.05)、甘油三酯(70.1±10.9 vs 65.4±19.5, P<0.05)、总胆固醇(93.2±13.8 vs 102.3±21.5, P<0.05)、瘦素、抵抗素水平, 同时改善口服糖耐量, 降低胰岛素抵抗.
结论: 肉桂油能有效改善胰岛素抵抗小鼠糖脂代谢, 其作用与降低血清瘦素、抵抗素水平, 增加胰岛素敏感性有关.
引文著录: 陈璿瑛, 彭小平, 王琳, 魏筱华, 李文娟, 何明. 肉桂油对胰岛素抵抗小鼠糖脂代谢的影响. 世界华人消化杂志 2011; 19(33): 3441-3445
Revised: October 25, 2011
Accepted: November 4, 2011
Published online: November 28, 2011
AIM: To investigate the effect of volatile oil from Cinnamomi Cortex (VOCC) on blood glucose and lipid metabolism in insulin-resistant mice and to investigate the possible mechanisms involved.
METHODS: Insulin resistance was induced by feeding a high-fat diet. After insulin-resistant mice were treated orally with VOCC, oral glucose tolerance test and insulin tolerance test were performed. The body weight, blood glucose, serum insulin, total cholesterol, triglyceride, leptin, resistin, and adiponectin were determined using biochemical methods.
RESULTS: VOCC administration decreased body weight gain (30.3 ± 3.6 vs 34.6 ± 3.1, P < 0.05), blood glucose (7.6 ± 2.2 vs 9.2 ± 1.3, P < 0.05), serum insulin (1.3 ± 0.1 vs 1.7 ± 0.2, P < 0.05), total cholesterol (70.1 ± 10.9 vs 65.4 ± 19.5, P < 0.05), triglyceride (93.2 ± 13.8 vs 102.3 ± 21.5, P < 0.05), leptin, and resistin levels. Treatment with VOCC also decreased insulin resistance by improving oral glucose tolerance and insulin tolerance.
CONCLUSION: VOCC improved blood glucose and lipid metabolism by reducing serum leptin and resistin in insulin-resistant mice, thereby enhancing insulin sensitivity.
- Citation: Chen XY, Peng XP, Wang L, Wei XH, Li WJ, He M. Effect of volatile oil from Cinnamomi Cortex on blood glucose and lipid metabolism in insulin-resistant mice. Shijie Huaren Xiaohua Zazhi 2011; 19(33): 3441-3445
- URL: https://www.wjgnet.com/1009-3079/full/v19/i33/3441.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i33.3441
代谢综合征(metabolic syndrome, MS)是以肥胖、胰岛素抵抗, 伴有脂质代谢紊乱等为病理特点的一组疾病[1]. MS可增加糖尿病、心血管疾病的发生以及心血管疾病死亡的危险性, 因此已经成为全球关注的公共卫生和临床难题[2]. 其中, 肥胖与胰岛素抵抗是MS中诱发2型糖尿病和心血管疾病的关键因素[3]. 因此, 开发具有降低胰岛素抵抗, 控制糖脂代谢异常的药物对于减少MS相关疾病的发生具有重要临床意义和应用价值. 中医药重视从整体上、多环节、多途径、多靶点地对MS进行调节, 对高糖、高脂与代谢紊乱等多危险因素进行综合防治, 与目前临床治疗MS的主要目标相吻合[4]. 因此, 中医药在MS的预防和治疗中显示出优越的开发前景. 肉桂(Cinnamomum cassia Presl)为樟科植物肉桂的干燥树皮, 在民间有广泛的药用价值[5,6]. Couturier等[7]通过高胰岛素-正葡萄糖钳夹试验研究发现, 肉桂提取物显著增加胰岛素抵抗大鼠葡萄糖输注速率, 增强胰岛素敏感性. 最新临床研究结果表明, 2型糖尿病患者连续食用肉桂40 d, 停药20 d后仍可明显改善高血糖高血脂症状[8]. 因肉桂本身为应用广泛的香辛料, 价格低廉, 将其开发为治疗代谢综合征的天然药物具有广阔的前景. 本实验拟采用高脂饲料喂养C57BL/6小鼠, 建立胰岛素抵抗模型, 研究肉桂油(VOCC)对胰岛素抵抗小鼠糖脂代谢的影响, 并通过对脂肪细胞分泌相关因子的分析, 探讨其作用机制.
健康♂SPF级C57BL/6小鼠, 4 wk, 15 g±2 g, 由江西中医学院实验动物部提供, 许可证号: SCXK(赣)2006-0001. 肉桂购自湖北省中药材公司(经南昌大学药学院何明教授鉴定为樟科植物肉桂Cinnamomum cassia Presl的干燥树皮); 总胆固醇、甘油三酯试剂盒购自中生北控生物科技有限公司; 小鼠瘦素、抵抗素、脂联素、胰岛素ELISA试剂盒由R&D公司提供; 盐酸二甲双胍由天津太平洋制药有限公司提供; 胰岛素注射液(10 mL: 400 U, 江苏万邦生化医药有限公司产品); 葡萄糖(Amresco公司); 快速血糖测试仪(强生中国医疗器材有限公司); 高脂饲料(上海鑫邦科技有限公司); AVE-852半自动生化分析仪(长沙爱威科技实业有限公司); 酶标仪(Thermo公司).
1.2.1 肉桂油的提取: 称取肉桂粗粉, 过20目筛, 萃取压力35 MPa, 萃取温度31 ℃, 解析压力5.5 MPa, 解析温度38 ℃, 超临界萃取4 h, 挥发油提取率为3.0%.
1.2.2 胰岛素抵抗糖尿病小鼠模型的建立: 健康♂C57BL/6小鼠, 给予高脂饲料(50%脂肪, 36%碳水化合物, 14%蛋白质), 自由饮水, 持续喂养8 wk建立糖尿病小鼠模型[9]. 8 wk后, 禁食6 h, 选取空腹血糖大于7.8 mmol/L小鼠作为胰岛素抵抗模型, 模型成功率为80%左右.
1.2.3 动物分组及给药: 造模成功的C57BL/6糖尿病小鼠(n = 30), 随机分为3组: 模型对照组、阳性对照组和肉桂油组, 10只/组. 另设正常对照组C57BL/6小鼠(n = 10), 与模型对照组小鼠具有相同周龄, 给予普通标准小鼠饲料(12%脂肪, 62%碳水化合物, 26%蛋白质)喂养. 除正常对照组外, 其余各组继续喂以高脂饲料直至实验结束. 阳性对照组灌胃给予盐酸二甲双胍肠溶片0.25 g/(kg•d), 相当于临床用量10倍; 肉桂油按生药30 g/kg灌胃给药, 即相当于挥发油0.9 mL/kg; 正常对照组和模型对照组灌胃给予等量生理盐水, 0.1 mL/10g. 连续给药3 wk, 1次/d.
1.2.4 口服糖耐量测试: 给药1 wk后, 小鼠禁食6 h, 灌胃给予2 g/kg的葡萄糖, 分别在0、30、60、90、120 min采集小鼠尾静脉血, 通过快速血糖测试仪测定小鼠血糖.
1.2.5 胰岛素耐量测试: 给药2 wk后, 小鼠禁食2 h, 皮下注射胰岛素(0.28 U/kg), 分别在0、30、60、90、120 min采集小鼠尾静脉血, 通过快速血糖测试仪测定小鼠血糖.
1.2.6 血清生化指标测定: 给药3 wk后, 测定小鼠体质量, 禁食6 h, 采集小鼠尾静脉血, 通过快速血糖测试仪测定小鼠血糖. 摘眼球取血, 分离血清, -20 ℃冻存. 检测血清总胆固醇、甘油三酯水平, 采用半自动生化分析仪测定, 结果以mg/dL表示. 血清瘦素、脂联素、抵抗素、胰岛素测定按照ELISA试剂盒操作, 结果以ng/mL表示.
统计学处理 数据以(mean±SD)表示, 实验数据以组间t检验处理, P<0.05具有统计学意义. 数据统计由SPSS13.0软件包完成.
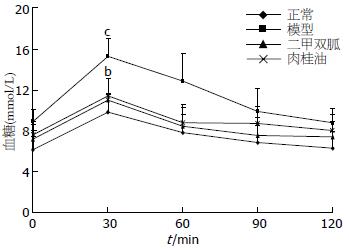
口服糖耐量测试结果显示, 给予葡萄糖0.5 h后, 模型组血糖显著高于正常对照组(P<0.001), 而肉桂油及二甲双胍均可快速降低最大血糖浓度(P<0.01, 图1), 表明肉桂油可增加组织对葡萄糖的利用.
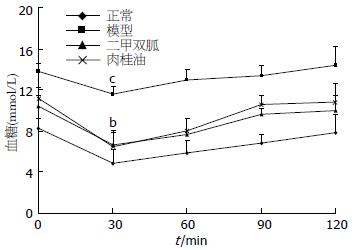
采用胰岛素耐量试验评估外周胰岛素抵抗, 通过外周组织对葡萄糖代谢来反映胰岛素的敏感性. 结果显示, 给予胰岛素30 min后, 模型组血糖下降程度明显低于空白对照组(P<0.001), 表明模型组小鼠外周组织胰岛素抵抗明显. 肉桂油组和二甲双胍组小鼠, 给予胰岛素后, 可显著降低血糖, 其作用有显著性差异(P<0.01), 表明肉桂油可增加外周组织对胰岛素的敏感性(图2).
给药3 wk后, 与正常对照组相比, 模型组小鼠体质量、血糖、血清胰岛素、总胆固醇和甘油三酯水平显著升高(P<0.05), 表现为肥胖、高血糖、高血脂、高胰岛素血脂的特点, 表明胰岛素抵抗糖尿病小鼠造模成功. 给予肉桂油后, 小鼠体质量、血糖水平、胰岛素水平、总胆固醇和甘油三酯水平均明显低于模型组(P<0.05), 表明肉桂油可改善糖尿病小鼠肥胖、高血糖、高血脂、高胰岛素血症状态, 其作用于二甲双胍相当(表1).
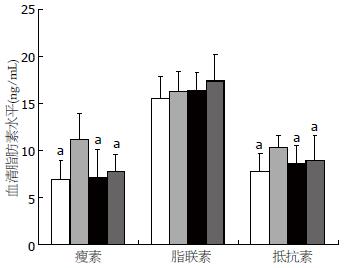
模型对照组小鼠血清瘦素, 抵抗素水平显著高于空白对照组(P<0.05), 表明采用高脂饲料喂养可造成小鼠脂肪素水平紊乱. 给予肉桂及二甲双胍后, 小鼠瘦素和抵抗素水平显著低于模型对照组(P<0.05). 此外, 各组小鼠血清脂联素水平无显著性差异(图3).
在MS的发病过程中, 甘油三酯合成的减少和脂肪组织脂解作用的增加导致血浆游离脂肪酸的增加, 最终导致脂质在内脏和骨骼肌中的沉积. 脂质代谢障碍通过活化PKCs/JNK(Protein kinase C/Jun amino-terminal kinase)和诱导氧化应激等方式促进全身的胰岛素抵抗. 游离脂肪酸还通过直接作用于胰岛beta细胞而产生高胰岛素血症. 因为胰岛素能刺激甘油三酯的合成和储存并抑制脂解作用, 所以脂肪细胞中的胰岛素功能受损反过来促进脂肪组织的脂质代谢障碍. 因此, 胰岛素抵抗和脂质代谢紊乱构成了MS的重要病理生理学机制[10].
本研究结果显示, C57BL/6小鼠采用高脂饲料喂养, 体质量显著增加, 并表现为胰岛素抵抗、脂质代谢紊乱、高瘦素血症及高抵抗素血症等MS症状. 而肉桂油能有效控制胰岛素抵抗小鼠的体质量, 降低血糖, 改善血清总胆固醇和甘油三酯水平. 同时口服糖耐量及胰岛素耐量测试均表明, 肉桂油具有增加胰岛素的敏感性, 增加外周组织对葡萄糖的利用. 此外, 血清瘦素及抵抗素水平亦得到改善. 说明肉桂提取物具有改善MS相关症状的药理作用.
胰岛素抵抗是代谢综合征重要的病理基础, 表现为胰岛素在肌肉、脂肪、肝脏等外周组织中敏感性降低[11]. 其中脂肪组织分泌的众多细胞因子如脂联素、抵抗素、瘦素等通过自分泌、旁分泌等途径影响胰岛素在外周组织的作用. 当脂质代谢紊乱, 脂质沉积, 由此引发的脂肪细胞代谢紊乱会造成这些因子的分泌出现失调, 进而影响血糖的正常代谢, 是发生胰岛素抵抗的重要原因之一[12]. 瘦素是人类肥胖(ob)基因编码的多肽激素, 主要由白色脂肪组织合成分泌, 其主要功能是抑制摄食, 增加能量消耗, 减少脂肪堆积[13]. 当出现瘦素抵抗时, 瘦素对胰岛素的抑制作用减弱, 正常的脂肪胰岛素反馈机制破坏, 胰岛素大量分泌, 引起高胰岛素血症, 并降低胰岛素受体数量, 导致IR的发生[14]. 抵抗素主要表达于白色脂肪组织, 具有抵抗胰岛素的作用, 可作用于脂肪、骨骼肌和肝细胞, 减弱这些细胞对胰岛素的敏感性[15]. 因此, 瘦素和抵抗素在胰岛素抵抗中扮演重要的角色, 是降低胰岛素抵抗的重要靶点. 肉桂油具有调节脂肪细胞因子的分泌水平, 从而降低了胰岛素抵抗, 进而降低血糖, 改善脂质代谢.
同时, 血清甘油三酯, 总胆固醇的含量的降低, 以及肥胖小鼠体质量的减轻, 进一步促进了脂质沉积减少, 该作用共同调节脂肪组织对脂肪细胞因子的分泌. 以上作用提示, 肉桂油通过改善胰岛素抵抗, 改善脂质代谢紊乱, 调节瘦素、抵抗素的分泌, 对MS相关的多方面危险因素进行防治.
此外, 各组血清脂联素水平无显著变化, 说明采用高脂饲料喂养C57BL/6小鼠不能造成脂联素代谢紊乱. 脂联素主要通过增加胰岛素促进的骨骼及胰岛素受体酪氨酸磷酸化改善全身胰岛素抵抗, 尽管脂联素是胰岛素抵抗的重要指标, 但其血清水平由遗传、环境等多种因素控制[11], 因此在本研究中未发现胰岛素抵抗小鼠脂联素水平的变化.
总之, 肉桂油能增强外周组织对胰岛素的敏感性, 增加葡萄糖的利用, 降低胰岛素抵抗小鼠高血糖, 高血脂症状, 改善口服糖耐量, 同时降低重要脂肪细胞因子瘦素和抵抗素的水平, 从而最终改善胰岛素抵抗小鼠的糖脂代谢紊乱.
肉桂在民间具有广泛的药用价值, 尽管有研究报道肉桂可改善胰岛素抵抗, 但其与代谢综合征相关的胰岛素抵抗, 脂质代谢紊乱的关系尚不明确.
王学美, 研究员, 北京大学第一医院中西医结合研究室
研发前沿 中药治疗具有多靶点和多途径作用的特点, 在代谢综合征的治疗中具有良好的开发前景. 因此研究肉桂油治疗代谢综合征及其机制具有十分重要的价值.
Couturier等通过高胰岛素-正葡萄糖钳夹试验研究发现, 肉桂提取物显著增加胰岛素抵抗大鼠葡萄糖输注速率, 增强胰岛素敏感性, 但深入机制尚未阐明.
本研究首次报道了肉桂油可以同时改善糖脂代谢紊乱, 发现肉桂油降低胰岛素抵抗, 改善脂质代谢紊乱的作用机制与降低血清抵抗素、瘦素水平的有关.
根据本研究结论, 肉桂油可改善糖脂代谢, 调节重要脂肪细胞因子水平, 因此具有开发为预防和治疗代谢综合征的药物的可能.
代谢综合征的发病率逐年增加, 并随着年龄增长发病率也逐渐升高, 文章研究肉桂油对胰岛素抵抗小鼠的糖脂代谢影响, 有着很好的现实意义.
编辑: 李军亮 电编:闫晋利
| 1. | Poanta LI, Albu A, Fodor D. Association between fatty liver disease and carotid atherosclerosis in patients with uncomplicated type 2 diabetes mellitus. Med Ultrason. 2011;13:215-219. [PubMed] |
| 2. | Mancia G, Bombelli M, Facchetti R, Casati A, Ronchi I, Quarti-Trevano F, Arenare F, Grassi G, Sega R. Impact of different definitions of the metabolic syndrome on the prevalence of organ damage, cardiometabolic risk and cardiovascular events. J Hypertens. 2010;28:999-1006. [PubMed] [DOI] |
| 3. | Yin J, Gao Z, He Q, Zhou D, Guo Z, Ye J. Role of hypoxia in obesity-induced disorders of glucose and lipid metabolism in adipose tissue. Am J Physiol Endocrinol Metab. 2009;296:E333-E342. [PubMed] [DOI] |
| 4. | Yin J, Zhang H, Ye J. Traditional chinese medicine in treatment of metabolic syndrome. Endocr Metab Immune Disord Drug Targets. 2008;8:99-111. [PubMed] [DOI] |
| 7. | Couturier K, Batandier C, Awada M, Hininger-Favier I, Canini F, Anderson RA, Leverve X, Roussel AM. Cinnamon improves insulin sensitivity and alters the body composition in an animal model of the metabolic syndrome. Arch Biochem Biophys. 2010;501:158-161. [PubMed] [DOI] |
| 8. | Khan A, Safdar M, Ali Khan MM, Khattak KN, Anderson RA. Cinnamon improves glucose and lipids of people with type 2 diabetes. Diabetes Care. 2003;26:3215-3218. [PubMed] [DOI] |
| 9. | de Wilde J, Smit E, Mohren R, Boekschoten MV, de Groot P, van den Berg SA, Bijland S, Voshol PJ, van Dijk KW, de Wit NW. An 8-week high-fat diet induces obesity and insulin resistance with small changes in the muscle transcriptome of C57BL/6J mice. J Nutrigenet Nutrigenomics. 2009;2:280-291. [PubMed] [DOI] |
| 10. | Assumpcao CR, Brunini TM, Pereira NR, Godoy-Matos AF, Siqueira MA, Mann GE, and Mendes-Ribeiro AC. Insulin resistance in obesity and metabolic syndrome: is there a connection with platelet l-arginine transport? Blood Cells Mol Dis. 2010;45:338-342. [PubMed] [DOI] |
| 11. | Zhang W, Liu CQ, Wang PW, Sun SY, Su WJ, Zhang HJ, Li XJ, Yang SY. Puerarin improves insulin resistance and modulates adipokine expression in rats fed a high-fat diet. Eur J Pharmacol. 2010;649:398-402. [PubMed] [DOI] |
| 13. | Sarigianni M, Bekiari E, Tsapas A, Kaloyianni M, Koliakos G, Paletas K. Effect of leptin and insulin resistance on properties of human monocytes in lean and obese healthy participants. Angiology. 2010;61:768-774. [PubMed] [DOI] |
| 14. | Tajtakova M, Petrasova D, Pidanicova A, Gallovicova A, Blanarova C, Petrovicova J. Serum levels of leptin, adiponectin, retinol binding protein 4 and leptin/adiponectin molar ratio as another possible marker of insulin resistance in obese. Bratisl Lek Listy. 2010;111:212-215. [PubMed] |