修回日期: 2011-10-28
接受日期: 2011-11-04
在线出版日期: 2011-11-28
目的: 从细胞周期的角度探讨RNA干扰抑制表皮生长因子受体(epidermal growth factor receptor, EGFR)表达对结直肠癌细胞增殖影响的机制.
方法: 以人结直肠癌细胞HCT-15为研究对象, 构建EGFR-短发夹RNA(short hairpin RNA, shRNA)载体, 采用脂质体转染的方法转染细胞, G418筛选稳定细胞株以获得稳定的转染细胞模型, 分为4组: 转染shRNA-NC, 转染shRNA-1组, 转染shRNA-2组, 转染shRNA-3组; 应用半定量RT-PCR和流式细胞术检测转染细胞模型的mRNA和蛋白表达水平; 应用平板克隆实验检测转染后细胞增殖能力; 应用流式细胞术检测转染后细胞周期的变化.
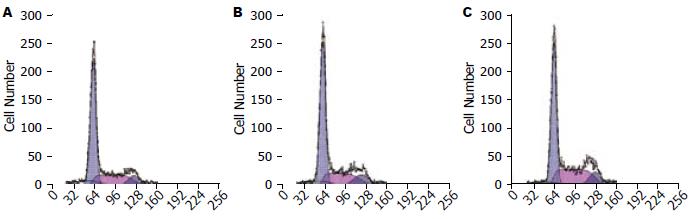
结果: 正确构建了shRNA质粒表达载体, 成功转染; 转染shRNA-1、2、3组较转染shRNA-NC组mRNA、蛋白表达水平均有下降, 以转染shRNA-1和2组的抑制效应好(40.2%±3.2%, 52.8%±11.3%); 转染shRNA-1、2两组较对照组增殖能力下降, G0/G1期细胞增多(63.69±2.75%, 60.10±2.00% vs 51.08±3.42%)、S期细胞减少 (28.20%±2.42%, 27.19%±1.95% vs 36.11±1.84%), 差异有统计学意义(P<0.05).
结论: RNA干扰技术可以有效地抑制HCT-15细胞EGFR表达, 并抑制了细胞增殖能力, 这可能与诱导细胞出现G0/G1期阻滞有关.
引文著录: 闵寒, 陈志荣, 张舒羽, 周俊东, 胡群超, 孟星君, 吴锦昌. ShRNA靶向干扰EGFR抑制结直肠癌细胞增殖的机制. 世界华人消化杂志 2011; 19(33): 3402-3408
Revised: October 28, 2011
Accepted: November 4, 2011
Published online: November 28, 2011
AIM: To examine the effect of short hairpin RNA (shRNA)-mediated silencing of the epidermal growth factor receptor (EGFR) gene on the proliferation of human colorectal cancer cells and to explore the potential mechanisms involved.
METHODS: Vectors containing shRNA targeting EGFR were constructed. HCT-15 cells were transfected with EGFR-shRNA-1, EGFR-shRNA-2, EGFR-shRNA-3 or shRNA-NC expression vectors, and stably transfected cell lines were screened. The mRNA level of EGFR was assessed by semi-quantitative RT-PCR. Protein expression and cell cycle changes were determined by flow cytometry. Cell proliferative capacity was assessed by colony formation assay.
RESULTS: Compared to shRNA-NC, transfection of the three shRNA vectors significantly inhibited EGFR expression, especially shRNA-1 and shRNA-2 vectors (40.2% ± 3.2% and 52.8% ± 11.3%, respectively). The mRNA expression of EGFR in shRNA-1- and shRNA-2-transfected cells also decreased significantly. The colony size and number decreased significantly in cells tranfected with shRNA-1 or shRNA (P < 0.05). The percentage of cells in G0/G1 phase increased (63.69% ± 2.75%, 60.10% ± 2.00%; both P < 0.05) and that of in S phase decreased (28.20% ± 2.42%, 27.19% ± 1.95%; both P < 0.05) in shRNA-1- and shRNA-2-transfected cells.
CONCLUSION: Transfection with shRNAs targeting the EGFR gene was capable of suppressing EGFR expression, decreasing cell proliferative capacity and inducing cycle arrest at G0/G1 phase.
- Citation: Min H, Chen ZR, Zhang SY, Zhou JD, Hu QC, Meng XJ, Wu JC. ShRNA-mediated silencing of the epidermal growth factor receptor gene inhibits proliferation of human HCT-15 colorectal cancer cells. Shijie Huaren Xiaohua Zazhi 2011; 19(33): 3402-3408
- URL: https://www.wjgnet.com/1009-3079/full/v19/i33/3402.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i33.3402
结直肠癌是常见的恶性肿瘤, 其中直肠癌约占70%, 发病率世界排名第3, 居癌症死因的第4位[1,2]. 其在我国发病率也呈逐年上升趋势, 以上海为例, 增长速度约4%, 高于世界平均增速(2%)[3]. 针对结直肠癌, 手术是主要治疗手段[4], 但并不理想, 近40年来术后5年生存率徘徊在50%左右, 局部复发率高达20%-40%, 辅助放化疗也只能延长部分晚期患者的生存期[5]. 近年来分子靶向治疗在结直肠癌中取得了突破性的进展[6,7], 其中抑制结直肠癌增殖的治疗靶点显得尤为重要. 因为与其他肿瘤细胞一样, 在结直肠癌的发生发展过程中, 增殖与凋亡这一对矛盾体起着重要的调控作用. 表皮生长因子受体(epidermal growth factor receptor, EGFR)是原癌基因c-ErbB l的表达产物, 属于表皮生长因子受体家族, 在25%-77%的结直肠癌组织中高表达, 与肿瘤细胞的增殖、凋亡等关系密切, 是重要的抑制肿瘤增殖的治疗靶点[8,9]. RNA干扰(RNA interference, RNAi)是双链RNA介导的、序列特异的转录后基因沉默现象, 广泛存在于各种生物体中. 因为RNAi技术较其他抑制基因手段能高效、特异地降低或关闭某些基因的表达, 产生基因功能缺失或基因敲除模型, 所以已正被广泛的应用在肿瘤学的机制研究中[10-15]. 本研究旨在通过构建RNAi抑制EGFR基因表达的结直肠癌细胞模型, 探索其对增殖的影响, 及细胞周期在其中的可能机制.
针对EGFR基因的小片段RNA(small interference RNAs, siRNAs)寡核苷酸序列设计, 通过在GenBank上比对, 分别选择EGFR基因(NM 005228)CDs编码序列中的第456-476、648-668、767-787特异性序列为siRNA的正义链, 按siRNA设计原则, 由上海吉玛制药技术有限公司设计、合成EGFR-shRNA-1、shRNA-2、shRNA-3表达载体, 靶序列分别为: 5'-GCAGAGGAATTATGATCTTTC-3'、5'-GCTGCCCATGAGAAATTTACA-3'、5'-GCAACA-TGTCGATGGACTTCC-3', shRNA-NC的靶序列为5'-GTCAATGGTCGTGTCGTGC-3'. 人结直肠癌细胞株HCT-15购自中科院上海细胞库, 试剂用脂质体Lipofectamine 2000 (Polyplus公司).
1.2.1 细胞培养和转染: 人结直肠癌细胞株HCT-15常规培养传代. 按产品说明书进行转染. 转染48 h后去掉培养液, PBS漂洗1次, 加入终浓度为600 mg/L的G418培养基进行筛选, 连续筛选3-4 wk获得抗性克隆. 分为4组: 1组为转染shRNA-NC组; 2组为转染shRNA-1组; 3组为转染shRNA-2组; 4组为转染shRNA-3组.
1.2.2 RT-PCR检测EGFR mRNA的表达: 按TRIzol法分别提取细胞RNA, 逆转录后进行RT-PCR. 通过引物设计软件Primer 5, 参照Gene Bank基因序列自行设计, 由生工生物工程(上海)有限公司合成. 内参照GADPH上、下游引物序列分别为5'-GGTGTGTGCAGATCGCAAAG-3'、5'-GACATGCTGCGGTGTTTTCAC-3'. EGFR上、下游引物序列分别为5'-GAAGATGGTGATGGGATTTC-3'、5'-GAAGGTGAAGGTCGGAGTC-3'.
1.2.3 流式细胞术检测蛋白表达抑制率: 用0.25%胰酶消化并收集转染后的细胞. 2 000 r/min, 5 min离心, 弃上清, 取细胞沉淀. 每管加 1 mL 40 g/L多聚甲醛, 固定15 min. 2 000 r/min, 5 min离心, 弃上清. PBS洗涤细胞2次, 收集细胞沉淀. 加100 μL打孔剂混匀后, 分2管移至流式的检测管, 每管50 μL, 分别为A、B管. A管中加入一抗(鼠抗EGFR基因的单克隆抗体, 1:50稀释), 避光放置30 min; B管为只加二抗(兔抗鼠FITC-IgG)的对照. A管加PBS洗涤2次. A、B管中均加入二抗(1:50稀释), 避光放置30 min. PBS洗涤A、B管中未结合的二抗, 洗涤3次, 取沉淀. 每管加500 μL PBS重悬细胞, 上机检测. EGFR的抑制率 = (实验组表达-对照组表达)/对照组表达. 以上实验重复3次, 实验结果为3次平均值.
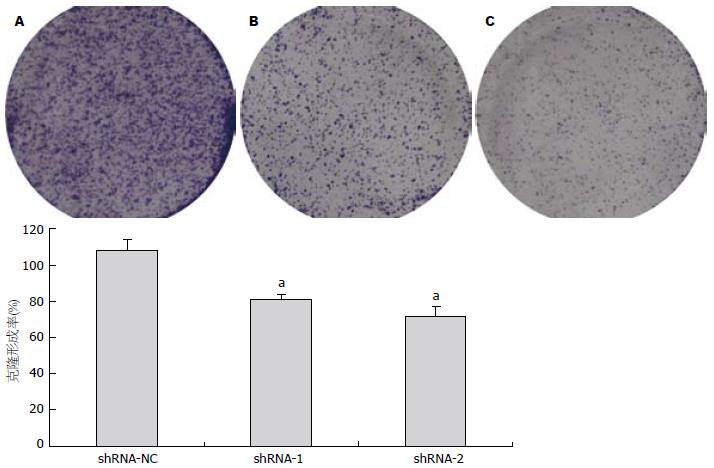
1.2.4 平板克隆形成实验法检测细胞增殖能力: 将对数生长期的转染后HCT-15细胞用胰蛋白酶消化制备细胞悬液, 调整细胞密度, 接种到6孔板中, 每组细胞接种3个孔, 1 000个/孔, 轻轻晃动6孔板使细胞分散均匀, 于37 ℃、50 mL/L CO2培养箱中静置培养约10 d, 出现肉眼可见的克隆, 弃去培养液, PBS小心冲洗细胞2次, 甲醛固定15 min, 0.4%结晶紫染色10 min, 流水缓慢洗去染色液, 空气干燥. 镜下计数大于50个细胞的克隆数, 并按公式计算克隆形成率: 克隆形成率 = (克隆数/接种细胞数)×100%.
1.2.5 流式细胞术分析细胞周期: 用0.25%胰酶消化并收集转染后的细胞. 用PBS洗涤细胞1次, 2000 r/min, 5 min离心, 弃上清, 取细胞沉淀. 加500 μL的700 mL/L乙醇固定细胞, 室温放置3 h. PBS洗涤细胞, 2 000 r/min, 5 min离心, 弃上清. 每管加100 μL的RNaseA, 37 ℃水浴30 min. 再加入400 μL的PI染色混匀, 4 ℃, 避光放置30 min. 上流式检测, 记录激发波长488 nm处红色荧光. 实验重复3次, 进行统计学分析处理.
统计学处理 实验结果采用SPSS13.0统计软件检验分析, 数据均以mean±SD表示, 组间比较采用成组设计两两比较的t检验. 以P<0.05为差异有统计学意义.
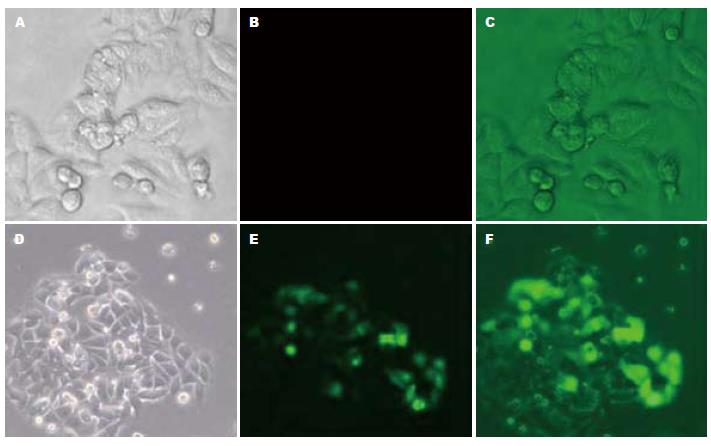
编码shRNA的带绿色荧光蛋白的质粒载体转入细胞后, 在绿色荧光激发波长下细胞显示为绿色, 转染后24 h荧光显微镜拍片证实转染成功(图1).
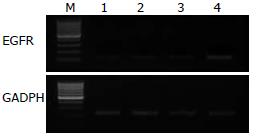
mRNA表达的影响 采用RT-PCR的方法来检测转染不同的shRNA载体后的细胞中EGFR的mRNA表达情况(图2). 从图2中可以看出, 转染shRNA-1、2、3三组EGFR的mRNA表达水平较转染shRNA-NC组均有下降, 这表明shRNA能干扰EGFR的mRNA表达.
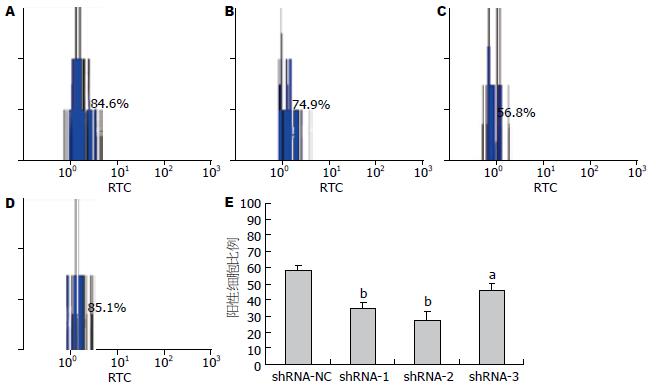
采用流式细胞术间接免疫荧光法来检测转染不同的EGFR-shRNA载体后的细胞中EGFR的蛋白阳性细胞比例及蛋白抑制率(图3). 从中可以看出: 与转染shRNA-NC组相比, 转染shRNA-1、2、3组的EGFR表达阳性细胞比例均下降, 且有统计学意义(t = 8.096, P<0.01; t = 8.155, P<0.01; t = 3.754, P<0.05). 其中以前两组下降明显, EGFR的抑制率分别为40.2%±3.2%和52.8%±11.3%, 这一结果与实验2结果一致, 说明shRNA能干扰EGFR的mRNA和蛋白表达. 并从中可以看出, 转染shRNA-1、2两组的EGFR蛋白表达抑制率高, 结合实验2, 表明EGFR抑制效应最好, 故挑选这两组作为下面实验的实验组.
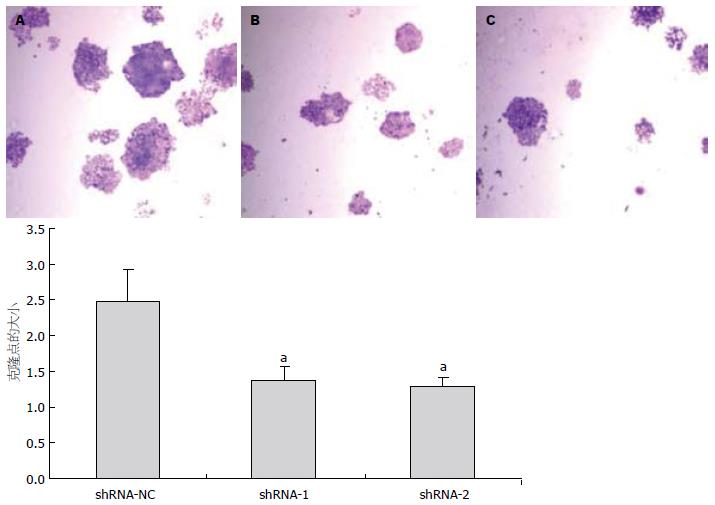
通过平板克隆形成实验法, 并采用Image J软件扫描克隆点大小, 重复3次, 统计发现, 转染shRNA-1和转染shRNA-2组细胞克隆形成大小与转染shRNA-NC组相比明显减小(t = 3.941, P<0.05; t = 4.414, P<0.05, 图4), 转染shRNA-1组细胞克隆形成率为81.5%±2.2%, 转染shRNA-2组为71.5%±5.65%, 与对照组(107.8%±6.37%)相比, 差异有统计学意义(t = 6.819, P<0.01; t = 7.393, P<0.01, 图5), 反映转染shRNA-1和转染shRNA-2细胞增殖能力受到抑制.
EGFR是表皮生长因子细胞增殖和信号传导的受体, 他是一种总相对分子质量约170 kDa的跨膜糖蛋白, 属于I型跨膜酪氨酸激酶受体(tyrosine kinase receptor, TKR)[16]. EGFR在很多肿瘤组织中高表达(如25%-77%的结直肠肿瘤呈高表达[8]), 并与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移、对放化疗的敏感性及细胞凋亡有关[17,18], 目前临床上应用的EGFR靶向药物主要是单克隆抗体和酪氨酸激酶抑制剂[19], 更多的EGFR靶向治疗手段正在探索中.
RNAi是双链RNA介导的、序列特异的转录后基因沉默现象, 最早是1998年在线虫中发现的, 目前研究发现这不仅是线虫独有的现象, 而是广泛存在于从真菌到植物, 从无脊椎动物到哺乳动物的各种生物体中. 其核心生物学功能是真核生物的遗传监视器和基因组水平的免疫系统, 可能是生物体行使其正常生物学功能所必需的一种调控方式[20]. 在体外, RNAi技术已经作为基因功能研究、基因治疗及药物筛选的一种有效方法得到广泛应用. 目前, 因为RNAi技术能高效、特异地降低或关闭某些基因的表达, 产生基因功能缺失或基因敲除模型, 所以被广泛的应用在肿瘤学的研究中[10-15].
在哺乳动物细胞中, 只有21个核苷酸大小的siRNA才能有效引发特异的基因沉默, 所以RNAi的设计较为复杂, 目前制备siRNA的方法主要有2类, 即体外制备和体内表达. 本实验中采用的是siRNA表达载体的办法, 其包含了1种RNA聚合酶启动子(PolⅢ)以启动体内的转录, 另外还有4-5个T的转录终止位点, 通过转染, 体内表达shRNA. 由于质粒可以在细胞内复制扩增, 这种带有抗生素标记的载体抑制基因, 表达的效果可以储蓄几周甚至更长, 是唯一适用于长周期研究的方法. 缺点是制备时间较长, 且对细胞的转染效率要求比较高[21]. 鉴于本实验的实验周期及研究内容, 是一种比较适宜的方法. 从本实验中可以看出, 在转染EGFR表达载体后, 通过实验筛选出基因沉默效应较好的两组shRNA-1及shRNA-2转染细胞株, 在这2个细胞株中, EGFR基因mRNA及蛋白水平的表达均有下降(P<0.05), 证实通过RNAi技术成功构建了EGFR抑制细胞株, 为下一步实验做准备.
细胞增殖异常是肿瘤的一个重要特征, 正常细胞所存在的凋亡和增殖的平衡一旦被打破, 就会向肿瘤发展. 在结直肠癌的发生和发展过程中, 增殖和凋亡的失衡参与了每个阶段[22]. 而EGFR被发现与肿瘤细胞的增殖密切相关, 通过抑制EGFR表达可以抑制肿瘤细胞的增殖能力. 通过本次实验可以看出, EGFR表达受到抑制的肿瘤细胞, 其增殖能力受到了抑制, 与对照组相比, 差异有统计学意义(P<0.05). 肿瘤的无限制增殖的机制与细胞增殖周期的失控有关, 细胞周期主要分为G1期、S期(DNA复制)、G2期、M期(染色体分离), 其中G1期是细胞增殖的关键时相. 检测点(checkpoint)又称关卡, 是在细胞周期的暂停中允许编辑和修复遗传信息, 并使每个子细胞接受与亲代细胞相同的整套遗传信息, 其中G1/S检测点又是细胞增殖的关键步骤[23-26]. 通过对EGFR靶向药物的研究发现, EGFR的抑制可以诱导G0/G1期阻滞, 从而使细胞不能进入S期进行DNA合成, 最终使肿瘤细胞的体外增殖受到抑制[27,28]. 本实验也通过RNA干扰, 抑制EGFR表达, 诱导了结直肠癌HCT-15细胞出现了G0/G1期阻滞, 从而体外抑制了结直肠癌肿瘤细胞的增殖能力. 与EGFR靶向药物的研究结果是相符合的, 另一方面也证实了本实验构建的EGFR抑制细胞模型是稳定可信的, 为下一步机制的研究奠定了实验基础.
在真核动物的细胞周期的调控中, 其核心成分是细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性激酶(Cyclin dependent kinase, CDKs)以及细胞周期蛋白依赖性激酶抑制因子(CKIs). Cyclin能够与CDKs结合形成复合物, 是推动细胞周期运行的动力因素, 而CKIs则作为抑制因子的角色出现, 无论哪一个成分失控, 则会出现细胞的增殖失控, 以至肿瘤的发生[24]. 有研究发现, 通过EGFR的抑制, 可以引起下游的Cyclin D1、P16、CDK-4/6等因子的系列反应, 从而影响肿瘤细胞的增殖与凋亡[29]. 而通过对结直肠癌的研究发现, 在肿瘤的发生发展过程中, Cyclin-CDKs-CKIs调控网络同样非常重要, 特别是CyclinD1、E以及CDK2、4等, 他们的表达异常往往与肿瘤的侵袭性和患者的生存期有关[30]. 故我们设想, 在结直肠癌细胞中, EGFR介导的G0/G1期阻滞的机制是否与其中的某些通路或因子有关, 这是我们进一步的研究方向.
结直肠癌是常见的恶性肿瘤, 在我国发病率逐年上升. 在目前抗肿瘤分子靶向治疗中, 表皮生长因子受体(epidermal growth factor receptor, EGFR)是最受关注的治疗靶点之一.
刘宝林, 教授, 中国医科大学附属盛京医院普通外科
近年来国内外围绕着EGFR单抗在结直肠癌中的应用进行了广泛深入的研究, 取得了巨大的进展, 但仍有很多亟待解决的问题, 解决问题的关键在于对其抗肿瘤的具体机制仍不确切.
Spano等报道在结直肠癌中EGFR高表达, 并与肿瘤细胞的增殖、凋亡等关系密切, 是重要的抑制肿瘤增殖的治疗靶点.
本研究从细胞周期的角度来探讨RNA干扰抑制EGFR表达对结直肠癌细胞增殖影响的机制.
本研究以人结直肠癌细胞HCT-15为研究对象, 构建EGFR-短发夹RNA(short hairpin RNA, shRNA)载体, 采用脂质体转染的方法构建了稳定可信的转染细胞模型, 为进一步细胞周期调控因子的研究奠定基础.
课题设计合理, 方法科学, 手段先进, 统计分析得当, 结论可信, 是一篇较好的实验论文.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Li M, Gu J. Changing patterns of colorectal cancer in China over a period of 20 years. World J Gastroenterol. 2005;11:4685-4688. [PubMed] |
| 2. | Weitz J, Koch M, Debus J, Höhler T, Galle PR, Büchler MW. Colorectal cancer. Lancet. 2005;365:153-165. [PubMed] [DOI] |
| 4. | Goodwin RA, Asmis TR. Overview of systemic therapy for colorectal cancer. Clin Colon Rectal Surg. 2009;22:251-256. [PubMed] [DOI] |
| 6. | Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W, Berlin J, Baron A, Griffing S, Holmgren E. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med. 2004;350:2335-2342. [PubMed] [DOI] |
| 8. | Spano JP, Lagorce C, Atlan D, Milano G, Domont J, Benamouzig R, Attar A, Benichou J, Martin A, Morere JF. Impact of EGFR expression on colorectal cancer patient prognosis and survival. Ann Oncol. 2005;16:102-108. [PubMed] [DOI] |
| 9. | Italiano A, Saint-Paul MC, Caroli-Bosc FX, François E, Bourgeon A, Benchimol D, Gugenheim J, Michiels JF. Epidermal growth factor receptor (EGFR) status in primary colorectal tumors correlates with EGFR expression in related metastatic sites: biological and clinical implications. Ann Oncol. 2005;16:1503-1507. [PubMed] [DOI] |
| 10. | Plasterk RH. RNA silencing the genome's immune system. Science. 2002;296:1263-1265. [PubMed] [DOI] |
| 11. | 郭 勇杭, 刘 中宏, 许 军, 姚 媛媛, 黄 平. 联合转染Survivin shRNA和CD44v3 shRNA对结直肠癌SW480细胞增殖和侵袭能力的影响. 世界华人消化杂志. 2011;19:905-911. [DOI] |
| 12. | Matzke M, Matzke AJ, Kooter JM. RNA: guiding gene silencing. Science. 2001;293:1080-1083. [PubMed] [DOI] |
| 14. | 张 朝晖, 张 志伟, 王 名伟, 黄 滔, 楚 晨龙, 赵 晨晖, 杨 安卿, 沈 周俊, 周 文龙. 应用RNA干扰技术抑制人膀胱癌细胞EGFR基因表达的研究. 中华肿瘤防治杂志. 2011;18:755-757, 761. |
| 15. | McInroy L, Määttä A. Down-regulation of vimentin expression inhibits carcinoma cell migration and adhesion. Biochem Biophys Res Commun. 2007;360:109-114. [PubMed] [DOI] |
| 16. | Mendelsohn J, Baselga J. Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer. J Clin Oncol. 2003;21:2787-2799. [PubMed] [DOI] |
| 17. | Diamantis A, Magiorkinis E, Sakorafas GH, Androutsos G. A brief history of apoptosis: from ancient to modern times. Onkologie. 2008;31:702-706. [PubMed] [DOI] |
| 18. | Modjtahedi H, Essapen S. Epidermal growth factor receptor inhibitors in cancer treatment: advances, challenges and opportunities. Anticancer Drugs. 2009;20:851-855. [PubMed] [DOI] |
| 20. | Bosher JM, Labouesse M. RNA interference: genetic wand and genetic watchdog. Nat Cell Biol. 2000;2:E31-E36. [PubMed] [DOI] |
| 21. | 石 燕. RNAi实验技术研究进展. 标记免疫分析与临床. 2003;10:235-238. |
| 25. | Adamsen BL, Kravik KL, Clausen OP, De Angelis PM. Apoptosis, cell cycle progression and gene expression in TP53-depleted HCT116 colon cancer cells in response to short-term 5-fluorouracil treatment. Int J Oncol. 2007;31:1491-1500. [PubMed] |
| 26. | Evan GI, Vousden KH. Proliferation, cell cycle and apoptosis in cancer. Nature. 2001;411:342-348. [PubMed] [DOI] |
| 27. | Huang SM, Harari PM. Modulation of radiation response after epidermal growth factor receptor blockade in squamous cell carcinomas: inhibition of damage repair, cell cycle kinetics, and tumor angiogenesis. Clin Cancer Res. 2000;6:2166-2174. [PubMed] |
| 28. | Ling YH, Li T, Yuan Z, Haigentz M, Weber TK, Perez-Soler R. Erlotinib, an effective epidermal growth factor receptor tyrosine kinase inhibitor, induces p27KIP1 up-regulation and nuclear translocation in association with cell growth inhibition and G1/S phase arrest in human non-small-cell lung cancer cell lines. Mol Pharmacol. 2007;72:248-258. [PubMed] [DOI] |