修回日期: 2011-10-28
接受日期: 2011-11-04
在线出版日期: 2011-11-28
目的: 探讨RNA干扰DNMT1基因对胰腺癌细胞BxPC-3增殖的影响及相关机制.
方法: 利用LipofectamineTM2000转染DNMT1-siRNA至胰腺癌细胞BxPC-3. 实验共分为3组: 实验组(转染DNMT1-siRNA)、阴性对照组(转染negative-siRNA)和空白对照组(转染脂质体). 转染48 h后, 应用荧光定量PCR法和Western blot法分别检测细胞中DNMT1 mRNA和蛋白的表达水平; MTT法检测细胞体外增殖活力; FCM法检测细胞凋亡; 甲基化特异性PCR法(MSP)检测抑癌基因p16、RASSF1A和ppENK的启动子甲基化状态.
结果: 与空白对照组和阴性对照组相比, 实验组的DNMT1 mRNA及蛋白表达量均显著降低(P<0.01); 实验组细胞增殖明显受到抑制(P<0.05), 细胞凋亡率明显增加(44.46%±5.98% vs 3.74%±1.02% vs 5.07%±1.16%, P<0.01). 空白对照组与阴性对照组的p16、RASSF1A和ppENK基因甲基化阳性, 而实验组的p16和ppENK基因甲基化阴性, RASSF1A基因部分甲基化.
结论: DNMT1基因表达下调后, 能抑制胰腺癌细胞BxPC-3细胞增殖, 并能诱导其发生细胞凋亡; 其作用机制与抑癌基因p16、RASSF1A和ppENK去甲基化有关.
引文著录: 肖卫东, 李勇, 李学明, 蔡军, 曾林山, 胡伟. RNA干扰DNMT1基因对胰腺癌细胞BxPC-3增殖的影响及相关机制. 世界华人消化杂志 2011; 19(33): 3397-3401
Revised: October 28, 2011
Accepted: November 4, 2011
Published online: November 28, 2011
AIM: To investigate the effect of RNA interference-mediated silencing of the DNA methyltransfe-rase 1 (DNMT1) gene on the proliferation of pancreatic carcinoma BxPC-3 cells and to explore the possible mechanisms involved.
METHODS: BxPC-3 cells were divided into three groups: experimental group, negative control group and blank control group, which were transfected with a DNMT1-specific siRNA, a negative siRNA and empty liposomes using LipofectamineTM 2000, respectively. The expression of DNMT1 mRNA and protein in the transfected cells was analyzed by real-time PCR and Western blot, respectively. Cell growth was measured by MTT assay, and cell apoptosis was examined by flow cytometry. The methylation of tumor suppressor genes (p16, ppENK and RASSF1A) was detected by methylation-specific PCR (MSP) 48 h after transfection.
RESULTS: The expression of DNMT1 mRNA and protein in the experimental group was markedly down-regulated compared to that in the negative control group and blank control group (all P < 0.01). Cell growth was significantly slower (both P < 0.05) and the apoptosis rate was significantly higher (44.46% ± 5.98% vs 3.74% ± 1.02% vs 5.07% ± 1.16%, both P < 0.01) in the experimental group than in the negative and blank control groups. The methylation of the p16 and ppENK genes was detected in the blank and negative control groups but not in the experimental group. The methylation of RASSF1A gene was detected in the two control groups, while only partial methylation of this gene was detected in the experimental group.
CONCLUSION: Down-regulation of DNMT1 inhibited cell growth and promoted apoptosis in human pancreatic carcinoma cell line BxPC-3 possible via mechanisms associated with the demethylation of tumor suppress genes (p16, ppENK and RASSF1A).
- Citation: Xiao WD, Li Y, Li XM, Cai J, Zeng LS, Hu W. RNA interference-mediated silencing of the DNMT1 gene inhibits cell proliferation in human pancreatic carcinoma cell line BxPC-3. Shijie Huaren Xiaohua Zazhi 2011; 19(33): 3397-3401
- URL: https://www.wjgnet.com/1009-3079/full/v19/i33/3397.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i33.3397
胰腺癌的发病率在世界范围内呈逐年上升趋势, 美国癌症协会的最新资料显示其发病率达11/10万, 居恶性肿瘤的第10位, 病死率已跃居恶性肿瘤的第4位[1]. 国内的流行病学资料也显示胰腺癌发病率在逐年上升[2,3]. 胰腺癌的发生发展是一个多因素、多阶段的过程, 其中DNA甲基化等表观遗传学改变发挥了重要作用[4,5]. DNA甲基化过程有赖于DNA甲基转移酶(DNA methyltransferases, DNMTs)的介导, 其中DNMT1所起的维持甲基化的作用尤为重要[6-8]. 本研究通过脂质体将DNMT1小干扰RNA片段(small interference RNA, siRNA)稳定转染入胰腺癌细胞BxPC-3, 观察其对细胞增殖和凋亡的影响, 并探讨相关作用机制.
人胰腺癌细胞株BxPC-3购自上海细胞生物研究所细胞库, DNMT1以及阴性对照siRNA由Thermo公司设计合成, DNMT1-siRNA的靶序列为: 5'-GGAAGAAGAGUUACUAUAA-3'. 兔抗人DNMT1单克隆抗体购于Santa Cruz公司, 二抗及发光试剂等购于晶美生物工程公司; 逆转录试剂盒购于TaKaRa公司; RPMI-1640培养基、Trizol RNA分离试剂和LipofectamineTM2000购于Invitrogen公司; Wizard DNA clean-up system购于Promega公司; Annexin V-FITC细胞凋亡检测试剂盒购于南京凯基生物; RealMasterMix(probe)购于北京天根生化科技有限公司; PCR引物和荧光探针由上海生工生物工程有限公司合成.
1.2.1 细胞培养和siRNA转染: 用含有100 mL/L胎牛血清RPMI-1640培养液在37 ℃、50 mL/L CO2培养箱中常规培养胰腺癌细胞BxPC-3, 取对数生长期的细胞用于实验. 将细胞以2×105个/孔接种于96孔培养板中, 实验分3组: 实验组(转染DNMT1-siRNA); 阴性对照组(转染negative-siRNA); 空白对照组(转染脂质体). 采用LipofectamineTM2000脂质体转染siRNA, siRNA终浓度为40 nmol/L, 每组设3个复孔. 转染6 h后更换成RPMI-1640培养液, 继续常规培养, 48 h时收集细胞.
1.2.2 荧光定量PCR检测DNMT1 mRNA表达水平:DNMT1引物序列: 上游: 5'-GTTCTTCCTCC-TGGAGAATGTCA-3', 下游: 5'-GGGCCACGCCGTACTG-3', 探针5'-TTGTCTCCTTCAAGCGCTCCATGGTC-3', 扩增产物138 bp; 内参3-磷酸甘油醛脱氢酶(GAPDH)引物序列: 上游: 5'-CCCATGTTCGTCATGGGTGT-3', 下游: 5'-TGGTCATGAGTCCTTCCACGATA-3', 探针: 5'-CTGCACCACCAACTGCTTAG-3', 扩增产物145 bp.
Trizol法提取总RNA, 用逆转录试剂盒将总RNA逆转录合成cDNA. PCR总反应体系为25 µL, 其中含2.5×RealMasterMix、引物(目的基因/内参)、探针、cDNA模板、20×Probe Enhancer solution和ddH2O. PCR反应条件: 94 ℃预变性2 min, 94 ℃变性15 s, 62 ℃退火延伸30 s, 共40个循环. 实验重复3次. 由PCR反应曲线得到域值循环数(Ct), 以GAPDH作为内参照, 计算基因相对表达量(RQ值 = 2-△△Ct).
1.2.3 Western blot检测DNMT1蛋白表达水平: 收集各组细胞, 蛋白提取液提取蛋白, Bradford法测蛋白含量. 每泳道25 µg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳, 转硝酸纤维素膜(NC膜), 鼠抗人DNMT1(1:100)过夜, 二抗羊抗兔(1:5 000)室温孵育1 h, 二氨基联苯胺(DAB)显色, Bio-Rad凝胶成像系统摄影. 以β-肌动蛋白(β-actin)作为参照.
1.2.4 MTT法检测细胞增殖活性: 将细胞接种96孔板(2×l04个/孔), 每孔100 µL, 每组设3个复孔. 细胞铺板密度达到90%-95%后进行转染, 转染6 h后加入完全培养基, 培养12、24、48、72 h后, 每孔加入浓度为5 g/L MTT 30 µL, 在37 ℃下作用4 h后弃去. 用磷酸盐缓冲液(PBS)洗2次后每孔加入150 µL二甲基亚砜(DMSO), 振荡15 min使结晶充分溶解. 在酶标仪测定492 nm波长下的吸光度值(A), 以A值为纵坐标, 培养时间(h)为横坐标绘制细胞生长曲线, 并计算细胞生长抑制率, 抑制率(%) = (A空白对照组-A实验组)/A空白对照组×100%.
1.2.5 FCM检测细胞凋亡: 用不含乙二胺四乙酸(EDTA)的胰酶消化收集各组细胞; 加入PBS洗涤细胞2次, 收集5×105个细胞; 加入250 µL Banding Buffer悬浮细胞; 加入5 µL Annexin V-FITC混匀, 再加入5 µL碘化丙锭(PI)混匀; 室温、避光反应5-10 min; 在l h内进行流式细仪分析, 分别检测各组细胞凋亡.
1.2.6 甲基化特异性PCR法(MSP)检测p16、RASSF1A和ppENK基因启动子甲基化: 收集各组细胞, 按DNA纯化试剂盒说明书步骤提取DNA. 取1 µg DNA溶解于36 µL ddH2O中, 加入新鲜配制的3M NaOH(终浓度为0.3 mol/L) 4 µL变性, 37 ℃水浴15 min, 加入新鲜配制的10 mmol/L 对苯二酚30 µL和3.6 mol/L(PH5.0)重亚硫酸钠520 µL, 55 ℃水浴16 h, 用Wizard DNA clean-up system纯化. 同一标本以甲基化和未甲基化引物分别扩增, p16基因未甲基化引物序列: 上游: 5'-GGGTGGATTGTGTGTGTTTG-3', 下游: 5'-CCATAACCAACCAATCAACCA-3'; 甲基化引物序列: 上游: 5'-GGCGGATCGCGTGCGTTC-3', 下游: 5'-CGTAACCAAATCAACCG-3'. RASSF1A基因未甲基化引物序列: 上游: 5'-TTTGGTTGGAGTGTGTTAATGTG-3', 下游: 5'-CAAACCCCACAAACTAAAAACAA-3'; 甲基化引物序列: 上游: 5'-GTGTTAACGCGTTGCGTATC-3', 下游: 5'-AACCCCGCGAACTAAAAACGA-3'. ppENK基因未甲基化引物序列: 上游: 5'-TTGTGTGGGGAGTTATTGAGT-3', 下游: 5'-CACCTTCACAAAAAAAATCAATC-3'; 甲基化引物序列: 上游: 5'-TGTGGGGAGTTATCGAGC-3', 下游: 5'-GCCTTCGCGAAAAAAATCG-3'. PCR总反应体系25 µL, 含ddH2O、10×PCR buffer、dNTP、上游和下游引物、模板DNA、Taq酶. 循环参数: 95 ℃预变性10 min; 80 ℃加入Taq DNA聚合酶; 94 ℃ 45 s, 退火温度62 ℃ 45 s, 72 ℃ 50 s; 共36个循环, 最后72 ℃延伸3 min. 取6 µL扩增产物于3%琼脂糖凝胶电泳, 在凝胶图像成像仪下观察结果.
统计学处理 数据采用均数±标准差(mean±SD)表示, 应用SPSS11.0统计软件中的t检验和单因素方差分析(ANOVA), P<0.05为差异具有显著性.
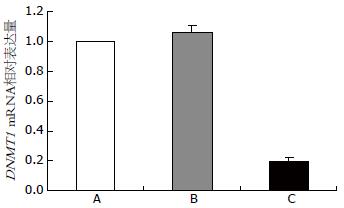
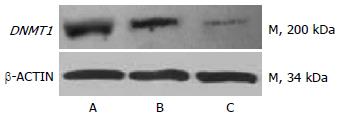
与空白对照组和阴性对照组相比, 实验组DNMT1 mRNA和蛋白表达量显著降低(P<0.01), 而阴性对照组与空白对照组无明显差异(P>0.05, 图1, 2).
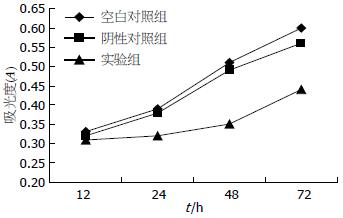
MTT法检测结果显示, 转染后24-72 h, 实验组的细胞生长速度较空白对照组和阴性对照组明显减慢, 差异有统计学意义(P<0.05). 24 h、48 h和72 h时实验组的细胞生长抑制率分别为17.9%、30.9%和26.8%(图3).
FCM检测结果显示, 转染后48 h, 空白对照组、阴性对照组和实验组的细胞凋亡率分别为3.74%±1.02%、5.07%±1.16%和44.46%±5.98%. 与空白对照组和阴性对照组比较, 实验组的细胞凋亡率显著增加(P<0.01).
MSP检测结果显示, 空白对照组与阴性对照组的p16、RASSF1A和ppENK基因甲基化阳性, 而实验组p16和ppENK基因甲基化阴性, RASSF1A基因部分甲基化(图4).
目前, 许多研究显示在多种不同的肿瘤组织或细胞中检测出DNMT1的高表达, 并密切参与肿瘤的发生发展, 其作用机制可能与DNMT1的高表达导致多种抑癌基因启动子高甲基化而表达失活有关. 以往的实验研究发现, 在非小细胞肺癌细胞NCI-H1299[9]和乳腺癌细胞HCC1954[9]、食管鳞癌细胞EC9706[10]以及膀胱癌细胞T24[11]等癌细胞株中, 以DNMT1为靶点的基因治疗能有效抑制细胞增殖并诱导细胞凋亡.
在对胰腺癌的研究中, Peng等[12,13]报道, DNMT1在胰腺癌组织中高表达, 并与肿瘤T分期及TNM分期密切相关. DNMT1高表达预示患者预后不良, 而且BRCA1、APC、p16、TIMP-3等基因的高甲基化与DNMT1表达上调有关. 因此, 推测DNMT1也可作为胰腺癌基因治疗的靶点. 国内学者徐岷等[14,15]报道转染DNMT1 siRNA能有效抑制胰腺癌PaTu8988细胞DNMT1 mRNA的表达, 同时抑制细胞增殖、促进细胞凋亡, 其机制可能与上调细胞周期调控基因p21的表达有关. 本研究同样以DNMT1为靶基因, 在胰腺癌细胞BxPC-3中利用RNAi技术沉默靶基因的表达, 从而观察其对细胞增殖和凋亡的影响. 实验结果显示, 在DNMT1基因表达下调后, 胰腺癌细胞BxPC-3生长速度明显减缓, 细胞凋亡率明显增加.
p16、RASSF1A和ppENK是与多种肿瘤发生发展密切相关的重要抑癌基因, 参与细胞周期的调控, 负调节细胞增殖及分裂, 他们在胰腺癌中都因基因启动子CpG岛高甲基化而表达失活[16-19]. Ueki等[16]报道胰腺癌组织中ppENK基因启动子甲基化发生率为93%; Dammann等[19]的研究结果显示, 胰腺癌组织中RASSF1A和p16基因启动子甲基化发生率分别为64%和43%; 在8株胰腺癌细胞系中, RASSF1A和p16基因启动子甲基化发生率则分别高达87.5%和63%. 为进一步探讨DNMT1-siRNA对胰腺癌细胞BxPC-3的相关抑癌作用机制, 本研究观察了沉默DNMT1基因对p16、RASSF1A和ppENK基因启动子甲基化状态的影响, 结果显示, 空白对照组与阴性对照组的p16、RASSF1A和ppENK基因甲基化阳性, 而实验组的p16和ppENK基因甲基化阴性, RASSF1A基因部分甲基化. 该结果提示, DNMT1基因表达下调后抑癌基因p16、RASSF1A和ppENK不同程度去甲基化, 抑癌基因去甲基化后可以在细胞中重新表达, 从而通过多种途径发挥其抑癌作用.
总之, 本研究结果表明, DNMT1基因表达下调后, 能抑制胰腺癌细胞BxPC-3细胞生长, 并能诱导其发生细胞凋亡, 其作用机制与抑癌基因p16、RASSF1A和ppENK去甲基化有关, 提示DNMT1是胰腺癌去甲基化治疗的一个有效靶点.
胰腺癌的发生发展是一个多因素、多阶段的过程, 其中DNA甲基化等表观遗传学改变发挥了重要作用, 其中DNMT1所起的维持甲基化的作用尤为重要.
巩鹏, 教授, 大连医科大学附属第一医院普外二科
去甲基化治疗是当前胰腺癌治疗的研究热点和发展方向之一, 亟待解决的问题是靶基因的选择和以何种安全、方便、有效的方式导入受体并实现治疗目的.
许多研究显示在多种不同的肿瘤组织或细胞中检测出DNMT1的高表达, 并密切参与肿瘤的发生发展, 其作用机制可能与DNMT1的高表达导致多种抑癌基因启动子高甲基化而表达失活有关.
本研究通过干扰DNMT1基因表达, 证明该基因可抑制胰腺癌细胞生长并诱导其凋亡, 为临床上去甲基化治疗提供了一个新靶点.
编辑: 李军亮 电编:闫晋利
| 1. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 5. | Omura N, Goggins M. Epigenetics and epigenetic alterations in pancreatic cancer. Int J Clin Exp Pathol. 2009;2:310-326. [PubMed] |
| 6. | Robert MF, Morin S, Beaulieu N, Gauthier F, Chute IC, Barsalou A, MacLeod AR. DNMT1 is required to maintain CpG methylation and aberrant gene silencing in human cancer cells. Nat Genet. 2003;33:61-65. [PubMed] [DOI] |
| 7. | Jung Y, Park J, Kim TY, Park JH, Jong HS, Im SA, Robertson KD, Bang YJ, Kim TY. Potential advantages of DNA methyltransferase 1 (DNMT1)-targeted inhibition for cancer therapy. J Mol Med (Berl). 2007;85:1137-1148. [PubMed] [DOI] |
| 8. | Egger G, Jeong S, Escobar SG, Cortez CC, Li TW, Saito Y, Yoo CB, Jones PA, Liang G. Identification of DNMT1 (DNA methyltransferase 1) hypomorphs in somatic knockouts suggests an essential role for DNMT1 in cell survival. Proc Natl Acad Sci U S A. 2006;103:14080-14085. [PubMed] [DOI] |
| 9. | Suzuki M, Sunaga N, Shames DS, Toyooka S, Gazdar AF, Minna JD. RNA interference-mediated knockdown of DNA methyltransferase 1 leads to promoter demethylation and gene re-expression in human lung and breast cancer cells. Cancer Res. 2004;64:3137-3143. [PubMed] [DOI] |
| 11. | 张 士龙, 曾 甫清, 彭 世波, 董 继华, 廖 贵益, 汪 良. shRNA沉默基因DNMT1的表达对膀胱癌T24细胞增殖与凋亡的影响. 华中科技大学学报(医学版). 2009;38:165-168. |
| 12. | Peng DF, Kanai Y, Sawada M, Ushijima S, Hiraoka N, Kosuge T, Hirohashi S. Increased DNA methyltransferase 1 (DNMT1) protein expression in precancerous conditions and ductal carcinomas of the pancreas. Cancer Sci. 2005;96:403-408. [PubMed] [DOI] |
| 13. | Peng DF, Kanai Y, Sawada M, Ushijima S, Hiraoka N, Kitazawa S, Hirohashi S. DNA methylation of multiple tumor-related genes in association with overexpression of DNA methyltransferase 1 (DNMT1) during multistage carcinogenesis of the pancreas. Carcinogenesis. 2006;27:1160-1168. [PubMed] [DOI] |
| 14. | 徐 岷, 高 道键, 张 玉琦, 高 军, 李 兆申, 龚 燕芳, 吴 洪玉, 杜 奕奇, 金 晶, 满 晓华. RNA干扰DNA甲基转移酶1对人胰腺癌PaTu8988细胞增殖和凋亡的影响. 中华胰腺病杂志. 2008;8:92-94. |
| 15. | 徐 岷, 高 军, 高 道键, 张 玉琦, 杜 奕奇, 刘 枫, 龚 燕芳, 吴 洪玉, 李 兆申. DNMTl siRNA对人胰腺癌PaTu8988细胞周期的调控机制研究. 中华胰腺病杂志. 2009;34:21-23. |
| 16. | Ueki T, Toyota M, Skinner H, Walter KM, Yeo CJ, Issa JP, Hruban RH, Goggins M. Identification and characterization of differentially methylated CpG islands in pancreatic carcinoma. Cancer Res. 2001;61:8540-8546. [PubMed] |
| 17. | Sato N, Ueki T, Fukushima N, Iacobuzio-Donahue CA, Yeo CJ, Cameron JL, Hruban RH, Goggins M. Aberrant methylation of CpG islands in intraductal papillary mucinous neoplasms of the pancreas. Gastroenterology. 2002;123:365-372. [PubMed] [DOI] |
| 18. | Fukushima N, Sato N, Ueki T, Rosty C, Walter KM, Wilentz RE, Yeo CJ, Hruban RH, Goggins M. Aberrant methylation of preproenkephalin and p16 genes in pancreatic intraepithelial neoplasia and pancreatic ductal adenocarcinoma. Am J Pathol. 2002;160:1573-1581. [PubMed] [DOI] |