修回日期: 2011-10-15
接受日期: 2011-11-04
在线出版日期: 2011-11-18
目的: 探讨抑癌基因TSC2反义寡核苷酸对人食管癌EC9706细胞增殖、凋亡的影响.
方法: 运用阳离子脂质体介导TSC2的反义寡聚核苷酸(ASODN)转染食管癌EC9706细胞, 并分5 μmol/L、10 μmol/L、15 μmol/L3组作为实验组. 以终浓度为15 μmol/L正义寡核苷酸(SODN)/无关寡核苷酸(N-ODN)及未转染组分别作为无关对照组、细胞对照组. 分别在转染后连续培养24 h、48 h、72 h 这3个不同时间点, 用MTT检测细胞的增殖情况; 免疫细胞化学检测TSC2蛋白表达; RT-PCR检测tsc2 mRNA表达. 用TUNEL检测转染后48 h细胞的凋亡情况.
结果: 同一时间点, 不同浓度的TSC2反义寡核苷酸对食管癌EC9706细胞增殖有不同的促进作用, 实验组与正义组、无关组及正常对照组相比, 差异有统计学意义(P<0.05), 以浓度为15 μmol/L作用最强; 实验组各组凋亡指数均低于对照组, 且与对照组相比, 差异具有统计学意义(13.11±0.13, 9.31±0.29, 4.38±0.43 vs 16.46±0.43, 16.63±0.34, 16.23±0.45, 均P<0.05). 同一浓度的TSC2反义寡核苷酸, 在不同时间点对食管癌EC9706细胞增殖的促进作用, 随时间的增加而增强, 以72 h作用最强. 同一时间, 不同浓度的TSC2反义寡核苷酸对食管癌EC9706细胞TSC2基因的表达有不同程度的抑制作用, 实验组与正义、无关及正常对照组相比, 差异有统计学意义(F蛋白 = 50.60、330.69及1221.28, 均P<0.05; FmRNA = 260.23、572.22及1004.35, 均P<0.05), 以浓度为15 μmol/L作用最强; 同一浓度的TSC2反义寡核苷酸, 在不同时间内对食管癌EC9706细胞TSC2基因的表达的抑制作用, 随时间的增加而增强, 以72 h作用最强.
结论: 抑癌基因TSC2反义寡核苷酸可促进食管癌EC9706细胞增殖、抑制其凋亡.
引文著录: 冯付明, 杨娟, 张红, 赵路, 于婧, 李晟磊, 陈奎生. TSC2反义寡核苷酸对人食管癌EC9706细胞增殖、凋亡的影响. 世界华人消化杂志 2011; 19(32): 3302-3307
Revised: October 15, 2011
Accepted: November 4, 2011
Published online: November 18, 2011
AIM: To observe the impact of a tuberous sclerosis complex 2 (TSC2)-specific antisense oligonucleotide (ASODN) on cell proliferation and apoptosis in human esophageal cancer cell line EC9706.
METHODS: A TSC2 ASODN at different concentrations (5, 10 and 15 μmol/L) was transfected into EC9706 cells using cationic liposomes. A sense oligonucleotide (15 μmol/L) and nonsense oligonucleotide (15 μmol/L) were used as negative controls, and non-transfected EC9706 cells were used as a normal control. At 24, 48 and 72 h after transfection, MTT and TUNEL assays were used to examine the proliferation and apoptosis of EC9706 cells, respectively, and immunocytochemistry and RT-PCR were used to determine the expression of TSC2.
RESULTS: Compared to the three control groups, transfection of the TSC2 ASODN increased proliferation, decreased apoptosis (13.11 ± 0.13, 9.31 ± 0.29, 4.38 ± 0.43 vs 16.46 ± 0.43, 16.63 ± 0.34, 16.23 ± 0.45, all P < 0.05), and reduced the expression of TSC2 mRNA and protein (FmRNA = 260.23, 572.22, 1004.35, Fprotein = 50.60, 330.69, 1221.28, all P < 0.05) in EC9706 cells in a time- and concentration-dependent manner. Transfection with a dose of 15 μmol/L for 72 h exhibited the most strong effect (P < 0.05).
CONCLUSION: The TSC2 ASODN could enhance proliferation and inhibit apoptosis in human esophageal cancer cell line EC9706.
- Citation: Feng FM, Yang J, Zhang H, Zhao L, Yu J, Li SL, Chen KS. Effect of a TSC2 antisense oligonucleotide on cell proliferation and apoptosis in human esophageal cancer cell line EC9706. Shijie Huaren Xiaohua Zazhi 2011; 19(32): 3302-3307
- URL: https://www.wjgnet.com/1009-3079/full/v19/i32/3302.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i32.3302
mTOR(mammalian target of rapamycin)是一种进化上保守的丝/苏氨酸蛋白酶, 在细胞生长调控中起重要的作用, 他可通过整合能量、生长因子﹑氨基酸等所激发的信号通路来调控细胞生长、增殖及凋亡[1-3]. TSC1(tuberous sclerosis complex 1)和TSC2(tuberous sclerosis complex 2)是2个肿瘤抑制基因, 分别表达错构瘤蛋白(hamartin)、马铃薯球蛋白(tuberin), 他们对以mTOR为媒介的下游通路起负向调控作用[4-6]. 近年来研究发现, mTOR信号通路及其调控与细胞的恶性转化及乳腺癌、肾细胞癌、肺癌等肿瘤的形成密切相关, mTOR信号通路相关基因已成为肿瘤治疗的新靶点[7-15]. 另外, mTOR信号通路与食管癌的发生关系的研究也取得了较大进展[16,17]. 研究表明, TSC在乳腺癌[18]、喉鳞状细胞癌[19]等肿瘤中均低表达, 但关于TSC基因与食管癌发生的关系的研究却鲜有报道. 本研究采用反义寡核苷技术沉默TSC基因, 观察其对食管癌细胞EC9706细胞TSC基因的表达及细胞生长与凋亡的影响, 以期为靶向治疗食管癌提供新思路.
人食管癌EC9706细胞株(中国医学科学院肿瘤研究所分子肿瘤学国家重点实验室馈赠); 胎牛血清和RPMI 1640培养液均购自四季青公司; Lipofectamine 2000转染试剂购自碧云天生物技术研究所; 全硫代修饰TSC2的ASODN(5'-CCGCTGTTCATCGTTACCCTCTGTCGC-3), TSC2的SODN(5'-GGGCAGGTTGCGGTCAGACACGA3), 无关序列N-ODN(5'-GTCTATACTACCAGACAGCTTGAGT-3)由上海生工生物工程合成; 兔抗人TSC2多克隆抗体购自EPITOMICS公司; PV-9000二步法免疫组化检测试剂及ZLI-9031/9032/9033浓缩型DAB试剂盒购自中杉金桥; 碱磷酶标记链亲和素(Alkaline Phosphatase Streptavidin)、5-溴-4-氯-3吲哚磷酸/显色原硝基四氯唑蓝(BCIP/NBT)购自中杉金桥; TSC2 mRNA上游引物(5'-ACCAGCATCTCATACACACG-3), 下游引物(5'-CCACACA CACCACTTCAACA-3)及内参上游引物(5'-CCTAGAAGCATTTGCGGTGG-3), 下游引物(5'-GAGCTAC GAGCTGCCTGACG)由上海生工生物工程设计合成.
1.2.1 细胞分组培养及转染: 将人食管癌EC9706细胞于含有胎牛血清的RPMI-1640培养液中, 并置于细胞培养箱中培养, 细胞在培养瓶中贴壁生长良好, 隔天换液1次并传代. 待细胞长满培养瓶后消化、离心、计数后分别以细胞数1.0×104个/孔、5.0×104个/孔、1.0×106个/孔种于3个96孔板和3个24孔板培养及9个6孔板中过夜培养. 96孔板和24孔板每板分终浓度为5、10、15 μmol/L的TSC2反义寡聚核苷酸(ASODN)实验组, 以终浓度为15 μmol/L SODN、N-ODN及不转染组分别作为正义对照组、无关对照组和正常对照组, 每组设3个重复, 6孔板也以此分组. 细胞板培养24 h后, 按照脂质体转染试剂使用说明, 在脂质体介导下转染终浓度为5、10及15 μmol/L的ASODN和终浓度为15 μmol/L的SODN及N-ODN分别培养24 h、48 h和72 h.
1.2.2 MTT检测转染后细胞的增殖率及结果判定: 在不弃去培养液的情况下, 分别向转染后的24 h、48 h、72 h的96孔细胞培养板每孔中加入20 μL MTT溶液, 置于细胞培养箱中继续培养, 4 h后终止培养, 吸弃上层液体, 向每孔中加入150 μL DMSO, 恒温下震荡10 min, 待结晶完全溶解. 用酶标仪在492 nm泼长处测各孔的吸光度(A), 并记录结果. 结果判定: 细胞增殖率 = (实验组A值/空白对照组A值)×100%.
1.2.3 细胞爬片的制备及固定: 将大小适宜的盖玻片(已清洗、泡酸、消毒)平铺于24孔板孔底, 取处于对数生长期的细胞, 消化, 制备成细胞悬液, 按5.0×104个/孔接种于24孔板中, 常规培养. 待细胞充分贴壁后, 吸出每孔中的培养液, 按上述转染方法和要求处理细胞, 分别继续培养至24 h、48 h、72 h后, 吸出培养液, 用PBS冲洗, 甲醛固定, PBS再冲洗, 最后用镊子夹起细胞爬片, 用中性树胶粘贴于载玻片上(有细胞的一面朝上), 放入4 ℃冰箱保存备用.
1.2.4 TUNEL检测细胞的凋亡: 取转染48 h的各组细胞爬片, 参照TUNEL试剂盒说明书操作. 凋亡指数(AI)的计算方法: 每张爬片计数200个细胞中的凋亡细胞数, 重复3次, 取均值. 每组做3张爬片, 凋亡指数 = (凋亡细胞数/200)×100%.
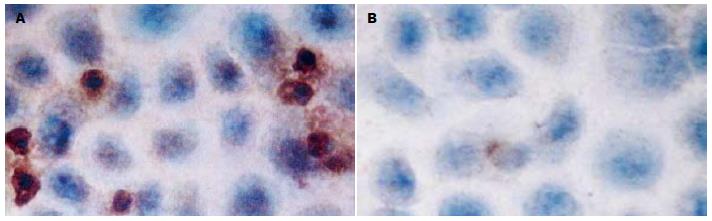
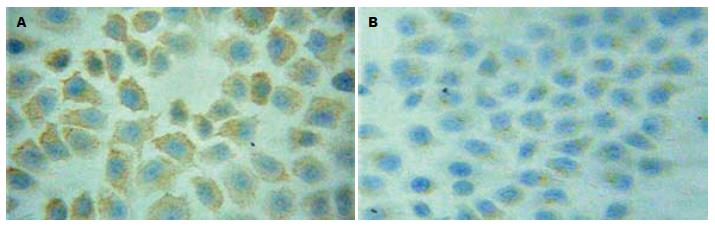
1.2.5 免疫细胞化学检测及结果判定: 将待测的各组细胞爬片常温下放置30 min, PBS冲洗; 浸入0.3% TritonX-100通透液中, 冰浴中孵育30 min, PBS冲洗; TSC2和mTOR抗体分别以1:50和1:100稀释后, 按照PV-9000二步法免疫组化检测试剂使用说明和ZLI-9031/9032/9033浓缩型DAB试剂盒使用说明进行操作. 用PBS代替一抗做阴性对照, 分别用已知的TSC2蛋白阳性表达的喉癌组织, 已知的mTOR蛋白阳性表达的乳腺癌组织做阳性对照. 结果判定: TSC2、mTOR蛋白免疫细胞化学阳性信号位于细胞胞质内, 均呈棕黄色; 每张片子镜下随机取10个高倍视野, 按阳性细胞数所占百分比及阳性细胞着色深浅进行评分(10): <1%为0分、1%-25%为1分、26%-50%为2分、51%-75%为3分、>76%为4分; 无着色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 上述2种评分结果相乘, 以积分值表示蛋白的表达水平.
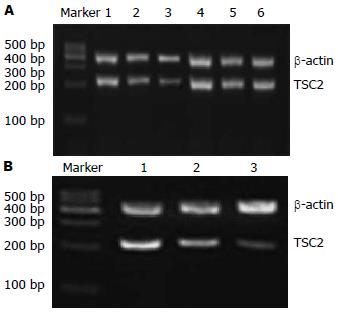
1.2.6 RT-PCR检测方法及结果判定: 收集前述已处理的6孔板细胞, 每3个复孔的细胞相当于25 mL培养瓶1瓶细胞, 然后采用总RNA提取试剂盒提取总RNA. 取1-5 μg总RNA加入总体为20 μL的反应体系中, 按70 ℃5 min后迅速冰上冷却2 min, 42 ℃50 min, 95 ℃5 min终止, 进行逆转录. 然后按95 ℃1 min、95 ℃30 s、59 ℃30 s、72 ℃1 min、72 ℃5 min、4 ℃终止进行PCR. 取2-5 μL PCR产物进行琼脂糖凝胶电泳, 紫外灯下观察PCR结果, 并用凝胶成像分析处理系统摄像, 分析计算各组的灰度比值, 获得目的片段的相对量.
统计学处理 采用SPSS17.0软件分析, 数据采用mean±SD数据表示, 进行完全随机设计资料的单因素方差分析, 以P<0.05为差异有统计学意义.
转染TSC2的反义寡聚核苷酸(ASODN)后, 随浓度和时间的增加, EC9706细胞的增殖能力增强, 且在15 μmol/L、72 h作用最强. 同一时间点, 各实验组与对照组比较细胞增殖的差异有统计学意义(F = 140.66、153.57及160.65, 均P<0.05), 而各对照组之间的差异无统计学意义(均P>0.05); 同一浓度, 实验组各时间点比较差异有统计学意义(F = 167.59、247.39及541.54, 均P<0.05, 表1).
转染TSC2的反义寡聚核苷酸(ASODN)48 h后, 实验组各组凋亡指数均低于对照组, 且与对照组相比, 差异具有统计学意义(F = 562.46, P<0.05); 不同浓度的各实验组两两比较, 差异均有统计学意义(均P<0.05), 且随着浓度的增加, 对细胞凋亡的抑制作用增强(图1, 表2).
转染TSC2的反义寡聚核苷酸(ASODN)后, 随浓度和时间的增加, EC9706细胞中TSC2蛋白及mRNA表达下降, 且在15 μmol/L、72 h作用最强. 同一时间段, 各实验组与对照组比较, 差异均有统计学意义(F蛋白 = 50.60、330.69及1221.28, 均P<0.05; FmRNA = 260.23、572.22及1004.35, 均P<0.05), 而各对照组之间比较P>0.05; 同一浓度, 实验组各时间点比较, 差异均有统计学意义(F蛋白 = 123.47、83.59及13.29, 均P<0.05; FmRNA = 67.81、139.61及392.57, 均P<0.05), 而对照组各时间点比较P>0.05(图2, 3; 表3, 4).
食管癌是我国最常见的恶性肿瘤之一, 目前, 临床上用于食管癌治疗的方法主要是外科手术治疗、化疗、放疗以及综合治疗等. 尽管近年来各种治疗方法得以不断改进和完善, 但食管癌患者的预后仍然较差, 我国食管癌患者治疗后的5年存活率仅为20%-30%[20]. 寻找新的毒副作用小、效果好的抗肿瘤药物及敏感的分子作为药物的治疗靶点成为研究者关注的热点问题.
在生理状态下, mTOR受一系列癌基因(如EG FR、Ras、PI3K/AKT等)和抑癌基因(如PTEN和TSC1、TSC2蛋白复合物)的调控. 其中AKT/TSC1-TSC2/mTOR是一条进化保守的信号通路, 广泛存在于果蝇﹑鱼类及哺乳动物体内. 他在调节蛋白质合成﹑细胞生长﹑细胞增殖, 决定细胞大小和数量等方面发挥重要的作用, 是促进细胞生长和维持细胞正常功能关键的信号途径, 在肿瘤的发生发展中也起到十分重要的作用. AKT是PI3K下游直接的靶蛋白, 当细胞外生长因子或胰岛素等和受体结合后, PI3K被激活产生3, 4二磷酸磷脂酰肌醇(PI-3, 4P2)和3, 4, 5三磷酸磷脂酰肌醇(PI-3, 4, 5P3), 在后两者和磷脂酰肌醇依赖性激酶-1(PDK1)共同作用下使AKT蛋白磷酸化, 而活化的AKT可磷酸化TSC2的Ser939和Thr1462, 从而抑制下游TSC1-TSC2复合物的功能, 解除TSC1-TSC2复合物对小GTP酶Rheb的抑制, 使Rheb活化, 活化形式的Rheb正向调节mTOR[21-24]. mTOR作为蛋白质合成调节过程中重要的调节分子, 其公认的2个重要的底物包括p70S6K和4EBP1. p70S6K是核糖体40S小亚基S6K蛋白激酶. 他可通过磷酸化S6蛋白对5'末端含寡聚嘧啶转录本(5'Top)mRNAs翻译起始起上调作用[25], 5'Top是蛋白质生物合成的基础, 他的主要翻译产物包括核糖体蛋白, 延长因子EF1α、EF2和polyA结合蛋白等. 而4EBP1为一种翻译抑制因子, 结合并抑制翻译起始因子eIF4E上解离下来, 游离的eIF4E结合到支架蛋白eIF4G上, eIF4G募集其他起始因子组装成起始复合物, 促进翻译[26]. 在上述2个底物分子的共同调控下, 促进细胞的生长和增殖.
该研究采用TSC2反义寡聚核苷酸转染食管癌EC9706细胞使TSC2基因封闭, 后用MTT检测细胞的增殖能力, 流式细胞技术检测细胞的凋亡, 免疫细胞化学、RT-PCR检测TSC2表达. 结果证实TSC2反义寡核苷酸转染食管癌EC9706细胞后, 能够封闭TSC2的表达, 使TSC2的表达下降, 细胞的增殖能力增强, 凋亡能力下降. 从而证实TSC2的底表达对食管癌的发展有促进作用, 使TSC2有望成为肿瘤发生和治疗的新的靶点, 为临床食管癌的治疗提供一些理论基础.
TSC2(tuberous scl-erosis complex 2)是一个肿瘤抑制基因, 表达马铃薯球蛋白(tuberin), 对以mTOR为媒介的下游通路起负向调控作用.
曹秀峰, 教授, 南京医科大学附属南京第一医院肿瘤中心
目前关于TSC基因与食管癌发生的关系的研究鲜有报道.
研究表明, TSC在乳腺癌、喉鳞状细胞癌等肿瘤中均低表达.
本研究采用反义寡核苷技术沉默TSC基因, 观察其对食管癌细胞EC9706细胞TSC基因的表达及细胞生长与凋亡的影响.
TSC2反义寡核苷酸促进食管癌EC9706细胞增殖、抑制其凋亡.
本研究结果认为TSC2反义寡核苷酸转染食管癌EC9706细胞后, 能够封闭TSC2的表达, 使TSC2的表达下降, 细胞的增殖能力增强, 凋亡能力下降. 从而证实TSC2的低表达对食管癌的发展有促进作用, 使TSC2有望成为食管癌发生和治疗的新的靶点, 为食管癌分子治疗的研究又提供一条新的线索.
编辑: 李军亮 电编:闫晋利
| 1. | Bracho-Valdés I, Moreno-Alvarez P, Valencia-Martínez I, Robles-Molina E, Chávez-Vargas L, Vázquez-Prado J. mTORC1- and mTORC2-interacting proteins keep their multifunctional partners focused. IUBMB Life. 2011;63:880-898. [PubMed] [DOI] |
| 2. | Dobashi Y, Watanabe Y, Miwa C, Suzuki S, Koyama S. Mammalian target of rapamycin: a central node of complex signaling cascades. Int J Clin Exp Pathol. 2011;4:476-495. [PubMed] |
| 3. | Caron E, Ghosh S, Matsuoka Y, Ashton-Beaucage D, Therrien M, Lemieux S, Perreault C, Roux PP, Kitano H. A comprehensive map of the mTOR signaling network. Mol Syst Biol. 2010;6:453. [PubMed] [DOI] |
| 4. | Huang J, Manning BD. A complex interplay between Akt, TSC2 and the two mTOR complexes. Biochem Soc Trans. 2009;37:217-222. [PubMed] [DOI] |
| 5. | Lu KH, Wu W, Dave B, Slomovitz BM, Burke TW, Munsell MF, Broaddus RR, Walker CL. Loss of tuberous sclerosis complex-2 function and activation of mammalian target of rapamycin signaling in endometrial carcinoma. Clin Cancer Res. 2008;14:2543-2550. [PubMed] [DOI] |
| 6. | Han S, Witt RM, Santos TM, Polizzano C, Sabatini BL, Ramesh V. Pam (Protein associated with Myc) functions as an E3 ubiquitin ligase and regulates TSC/mTOR signaling. Cell Signal. 2008;20:1084-1091. [PubMed] [DOI] |
| 7. | Wu P, Hu YZ. PI3K/Akt/mTOR pathway inhibitors in cancer: a perspective on clinical progress. Curr Med Chem. 2010;17:4326-4341. [PubMed] [DOI] |
| 8. | Generali D, Fox SB, Brizzi MP, Allevi G, Bonardi S, Aguggini S, Milani M, Bersiga A, Campo L, Dionisio R. Down-regulation of phosphatidylinositol 3'-kinase/AKT/molecular target of rapamycin metabolic pathway by primary letrozole-based therapy in human breast cancer. Clin Cancer Res. 2008;14:2673-2680. [PubMed] [DOI] |
| 9. | Mitsudomi T. Advances in target therapy for lung cancer. Jpn J Clin Oncol. 2010;40:101-106. [PubMed] [DOI] |
| 10. | Zhang J, Yang PL, Gray NS. Targeting cancer with small molecule kinase inhibitors. Nat Rev Cancer. 2009;9:28-39. [PubMed] [DOI] |
| 11. | Kudo M. Molecular targeted therapy for hepatocellular carcinoma: bench to bedside. Dig Dis. 2011;29:273-277. [PubMed] [DOI] |
| 13. | Jerusalem G, Collignon J, Rorive A, Lifrange E, André C, Martin M, Maweja S, Coucke P. [Targeted therapies in breast cancer]. Rev Med Liege. 2011;66:379-384. [PubMed] |
| 14. | Fu L, Kim YA, Wang X, Wu X, Yue P, Lonial S, Khuri FR, Sun SY. Perifosine inhibits mammalian target of rapamycin signaling through facilitating degradation of major components in the mTOR axis and induces autophagy. Cancer Res. 2009;69:8967-8976. [PubMed] [DOI] |
| 15. | Kudo M. mTOR inhibitor for the treatment of hepatocellular carcinoma. Dig Dis. 2011;29:310-315. [PubMed] [DOI] |
| 16. | Boone J, Ten Kate FJ, Offerhaus GJ, van Diest PJ, Rinkes IH, van Hillegersberg R. mTOR in squamous cell carcinoma of the oesophagus: a potential target for molecular therapy? J Clin Pathol. 2008;61:909-913. [PubMed] [DOI] |
| 17. | 张 威, 陈 玉, 亚 国伟, 陈 奎生. RNA干扰对EC9706细胞mTOR表达及细胞生长与凋亡的影响. 郑州大学学报(医学版). 2010;45:11-15. |
| 18. | Jiang WG, Sampson J, Martin TA, Lee-Jones L, Watkins G, Douglas-Jones A, Mokbel K, Mansel RE. Tuberin and hamartin are aberrantly expressed and linked to clinical outcome in human breast cancer: the role of promoter methylation of TSC genes. Eur J Cancer. 2005;41:1628-1636. [PubMed] [DOI] |
| 19. | Chakraborty S, Mohiyuddin SM, Gopinath KS, Kumar A. Involvement of TSC genes and differential expression of other members of the mTOR signaling pathway in oral squamous cell carcinoma. BMC Cancer. 2008;8:163. [PubMed] [DOI] |
| 20. | 王 立东, 郑 树. 河南高发区人群食管和责门癌变机制. 郑州大学学报(医学版). 2002;37:717-729. |
| 21. | Zhang HH, Huang J, Düvel K, Boback B, Wu S, Squillace RM, Wu CL, Manning BD. Insulin stimulates adipogenesis through the Akt-TSC2-mTORC1 pathway. PLoS One. 2009;4:e6189. [PubMed] [DOI] |
| 22. | Huang J, Manning BD. The TSC1-TSC2 complex: a molecular switchboard controlling cell growth. Biochem J. 2008;412:179-190. [PubMed] [DOI] |
| 23. | Cai SL, Tee AR, Short JD, Bergeron JM, Kim J, Shen J, Guo R, Johnson CL, Kiguchi K, Walker CL. Activity of TSC2 is inhibited by AKT-mediated phosphorylation and membrane partitioning. J Cell Biol. 2006;173:279-289. [PubMed] [DOI] |
| 25. | Jefferies HB, Fumagalli S, Dennis PB, Reinhard C, Pearson RB, Thomas G. Rapamycin suppresses 5'TOP mRNA translation through inhibition of p70s6k. EMBO J. 1997;16:3693-3704. [PubMed] [DOI] |
| 26. | Dilling MB, Germain GS, Dudkin L, Jayaraman AL, Zhang X, Harwood FC, Houghton PJ. 4E-binding proteins, the suppressors of eukaryotic initiation factor 4E, are down-regulated in cells with acquired or intrinsic resistance to rapamycin. J Biol Chem. 2002;277:13907-13917. [PubMed] [DOI] |