修回日期: 2011-10-25
接受日期: 2011-11-04
在线出版日期: 2011-11-18
目的: 探讨抑制JAK/STAT3信号通路对重症急性胰腺炎(severe acute pancreatitis, SAP)肾损伤作用的实验研究.
方法: ♂SD大鼠(n = 56)随机分为3组: 对照组、SAP造模组和JAK抑制剂-AG490治疗组. 以4%牛磺胆酸钠胰胆管逆行注射诱导大鼠SAP模型. 动态检测血清淀粉酶(AMY)、肌酐(Cr)、尿素氮(BUN)水平; ELISA法检测血清IL-6及TNF-α表达情况; 光镜下观察胰腺及肾脏病理变化; Western blotting法检测STAT3及p-STAT3在肾脏中蛋白表达水平.
结果: 与正常对照组比较, SAP各组胰腺和肾脏病理损伤程度随病情进展逐渐加重, AMY、Cr、BUN水平均明显升高(P<0.01), IL-6及TNF-α表达水平显著上调(P<0.01), STAT3及p-STAT3表达明显增加, 且18 h后达高峰; AG490处理后, 上述各指标与SAP各组同时间点均显著降低(P<0.01), AG490治疗组病理损伤改善程度优于SAP组.
结论: JAK/STAT3信号通路参与了SAP肾损伤的病理过程, 抑制JAK/STAT3可以明显抑制STAT3的过度激活, 有效减轻大鼠SAP时的炎症反应和肾损伤.
引文著录: 李敏利, 张晓华, 朱人敏, 杨妙芳, 王斌. 抑制JAK/STAT3信号通路对重症急性胰腺炎肾损伤的保护作用. 世界华人消化杂志 2011; 19(32): 3297-3301
Revised: October 25, 2011
Accepted: November 4, 2011
Published online: November 18, 2011
AIM: To investigate whether inhibition of the JAK/STAT3 signaling pathway exerts a protective effect against acute renal injury in rats with experimental severe acute pancreatitis (SAP) and to explore the potential mechanisms involved.
METHODS: Fifty-six male SD rats were randomly divided into three groups: control group, SAP group and JAK inhibitor (AG490)-treated group. A rat model of SAP was reproduced by retrograde infusion of 4% sodium taurocholate into the biliopancreatic duct. The levels of serum amylase (AMY), creatinine (Cr) and urea nitrogen (BUN) were measured. The concentrations of IL-6 and TNF-α were determined by ELISA. Pathological changes in the pancreas and kidney were evaluated. The expression of STAT3 and p-STAT3 in the kidney was determined by Western blotting.
RESULTS: Compared to the normal control group, pancreatic and renal injuries were gradually aggravated with disease progression, and serum levels of IL-6, TNF-α AMY, Cr and BUN and expression of STAT3 and p-STAT3 increased significantly (all P < 0.01) in the SAP group. In the AG490-treated group, all the above parameters improved significantly in comparison with those in the SAP model group (all P < 0.01).
CONCLUSION: The JAK/STAT3 signaling pathway is involved in the development of renal injury in rats with SAP, and inhibition of this pathway can significantly inhibit excessive STAT3 activation, which may in turn effectively reduce renal injury.
- Citation: Li ML, Zhang XH, Zhu RM, Yang MF, Wang B. Inhibition of the JAK/STAT3 signaling pathway reduces acute renal injury in rats with experimental severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2011; 19(32): 3297-3301
- URL: https://www.wjgnet.com/1009-3079/full/v19/i32/3297.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i32.3297
SAP是临床常见重症之一, 多数患者常伴有局部并发症, 部分合并为全身炎症反应综合征, 导致多脏器功能衰竭, 其中约23%的住院患者可并发急性肾损伤[1], 同时急性肾损伤是评价SAP预后的重要指标. 近年来研究发现, JAK酪氨酸蛋白激酶激酶(Janus kinase, JAK)信号转导子和转录活化子(signal transducers and activators of transcription, STAT)途径作为重要的炎症反应信号通路, 在炎症反应途径中起重要调节作用. 最新研究表明, 早期阻断JAK/STAT信号通路可在一定程度上缓解SAP炎症反应[2], 然而有关SAP并发全身炎症反应时, 通过JAK/STAT3信号通路介导炎症因子过度表达导致急性肾损伤的研究目前尚缺乏研究. 本文通过建立SAP模型, 观察抑制JAK/STAT3信号通路对SAP合并急性肾损伤作用的研究, 为临床防治SAP并发肾损伤提供新的理论依据和实验基础.
AG490和牛磺胆酸钠由美国Sigma公司提供; IL-6和TNF-α试剂盒均由美国ADL公司提供; STAT3及p-STAT3大鼠单克隆抗体由美国Cell Signal公司提供; 兔抗大鼠β-actin抗体、辣根过氧化物酶标记的羊抗鼠IgG由武汉博士德公司提供. PVDF膜由美国Millipore公司提供; 酶标仪、PAGE凝胶电泳仪、垂直电泳槽、电泳凝胶图像分析系统均由美国Bio-Rad公司提供.
1.2.1 分组及造模: 健康♂SD大鼠56只, 体质量227 g±31 g, 由中国人民解放军南京军区总医院实验动物中心提供. 随机分为3组: 对照组; SAP造模组; JAK抑制剂-AG490治疗组. 后2组再分为6 h、12 h、18 h 3个时间点, 每组各8只SD大鼠, 术前禁食12 h, 禁水6 h. AG490治疗组于造模前30 min腹部皮下注射8.0 mg/kg AG490[3]. 氯胺酮(100 mg/kg)经腹腔内注射麻醉; 由正中切口进腹, 对照组开腹后翻动胰腺数次; SAP造模组和AG490处理组用显微动脉夹夹闭肝门胆管及十二指肠乳头对系膜肠壁, 用4%牛磺胆酸钠(1 mL/kg), 0.2 mL/min匀速逆行注入胰胆管, 造模结束后过5 min取去动脉夹, 将各脏器回纳至正常解剖位置.
1.2.2 标本收集: 各组大鼠分别于右心房取血, 静置1 h, 3 000 r/min离心20 min, 取血清冻存. 取肾组织和胰腺各2份, 1份放入10%中性甲醛溶液中固定24 h, 常规石蜡包埋, 另1份置于-70 ℃冰箱中保存备用.
1.2.3 血清淀粉酶(amylase, AMY)、肌酐(creatinine, Cr)、尿素氮(blood urea nitrogen, BUN)测定: Olympus Au-2700型自动生化分析仪测定.
1.2.4 胰腺及肾组织病理学观察: 胰腺和肾组织标本常规制作病理石蜡切片, HE染色, 在光镜下观察胰腺和肾组织学变化. 胰腺病理评参考Grewal[4]改良评分标准进行病理评分; 肾脏病理评分参考Fofi等[5]分级标准进行病理评分.
1.2.5 血清IL-6和TNF-α含量测定: 酶免疫吸附(ELISA)法检测, 具体步骤严格按试剂盒使用说明书进行操作, 通过绘制标准曲线得出样品中相应细胞因子含量. 该方法检测IL-6及TNF-α的灵敏度为1 ng/L.
1.2.6 Western blotting检测肾组织中STAT3及p-STAT3表达: 取肾组织称重, 液氮、研钵粉碎组织块, RIPA细胞裂解液裂解后冰浴下超声匀浆, 提取总蛋白, 采用Bradford法行总蛋白定量. 各取蛋白100 μg/孔, 行10%SDS-聚丙烯酰胺凝胶电泳分离; 电泳结束后, 将蛋白转至PVDF膜上, 封闭后加入兔抗大鼠STAT3及p-STAT3单克隆抗体(1:500稀释); 辣根过氧化物酶标记的羊抗兔二抗(1:1 000稀释). 结果以ECL化学发光检测杂交信号, 以β-actin作为内参照, 用Image-Pro软件分析仪测定条带灰度值, 以相应条带灰度值表示相对蛋白含量.
统计学处理 数据以mean±SD表示, 所有数据采用SPSS17.0统计软件包处理, 多组均数间比较采用单因素方差分析, 两组均数间比较采用LSD-t检验进行显著性检验, P<0.05表明差异有统计学意义.
对照组血清AMY、Cr、BUN水平均较低; SAP造模组血清AMY、Cr、BUN水平均显著增加(P<0.01), 随着作用时间延长逐渐升高, 18 h升至最高值, 与对照组比较有显著性差异(P<0.01); AG490治疗后, 与同时间点SAP组比较AMY、Cr、BUN表达显著减低(P<0.01, 表1)
| 分组 | AMY(U/L) | Cr(μmol/L) | BUN(mmol/L) |
| 对照组 | 656.94±53.69 | 37.41±1.71 | 3.45±0.31 |
| SAP造模组 | |||
| 6 h | 2542.25±287.511bd | 57.44±1.19bd | 9.52±0.61bd |
| 12 h | 3257.69±237.991bd | 68.37±1.96bd | 14.66±0.84bd |
| 18 h | 4091.13±368.481bd | 91.78±2.40bd | 19.53±1.07bd |
| AG490治疗组 | |||
| 6 h | 1614.30±77.16bd | 42.41±1.63bd | 7.91±0.45bd |
| 12 h | 2634.48±97.63bd | 65.99±3.15bd | 11.24±0.53bd |
| 18 h | 3246.94±133.57bd | 74.58±1.95bd | 13.61±0.75bd |
各实验组血清均有少量IL-6和TNF-α蛋白表达; SAP造模组血清IL-6和TNF-α水平均显著增加(P<0.01), 随着作用时间延长逐渐升高, 18 h升至最高值, 与对照组比较有显著性差异(P<0.01); AG490治疗后, 与同时间点SAP组比较IL-6和TNF-α蛋白表达显著减低(P<0.01, 表2).
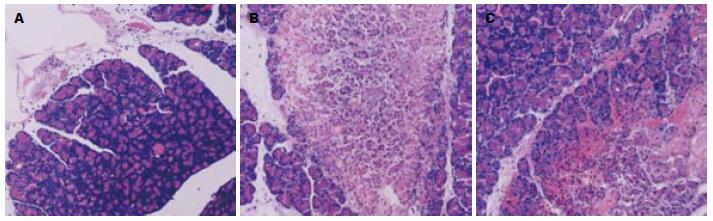
2.3.1 胰腺组织病理学检查: 对照组胰腺结构正常, 腺泡上皮细胞形态正常化, 胞浆着色均匀, 无出血及炎症细胞浸润. SAP-6 h组胰腺上皮细胞变性、坏死, 胞核浓缩、碎裂、溶解, 局部可见紫红色坏死灶, 坏死区大量炎症细胞浸润(图1A); SAP-12 h组胰腺大片坏死, 间质血管破裂, 仅残留胰腺腺叶轮廓, 炎症细胞浸润更明显; SAP-18 h坏死程度进一步加重, 腺叶正常结构消失, 胰腺实质广泛出血坏死及炎症细胞浸润(图1B). AG490治疗组胰腺组织改变与SAP组同时间点相比有所减轻, AG490-18 h组, 胰腺上皮细胞肿胀明显, 大量炎症细胞浸润(图1C).
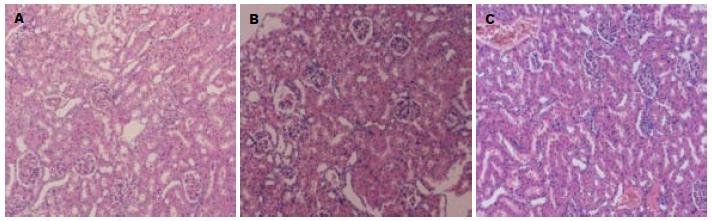
2.3.2 肾脏组织病理学检查: 对照组肾脏结构基本正常. SAP-6 h组肾小管轻度扩张, 细胞扁平, 肾间质轻度水肿, 肾小球未见明显异常(图2A); SAP-12 h组肾小管上皮细胞变性水肿, 偶见上皮细胞坏死, 管腔内见少量脱落坏死细胞碎片, 细胞浆空泡形成; SAP-18 h组肾小球淤血, 间质充血、水肿增宽, 肾小管上皮细胞广泛坏死, 管腔内见大量红细胞及细胞管型(图2B). AG490治疗组肾组织改变与SAP组同时间点相比有所减轻, AG490-18 h组肾小球轻度淤血水肿, 间质增宽, 少量散在炎症细胞浸润, 偶见细胞管型或碎片形成(图2C).
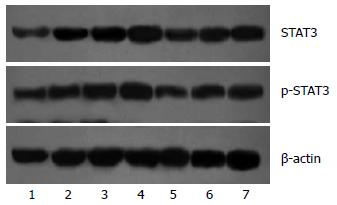
各实验组胰腺组织中均有少量STAT3及p-STAT3表达; SAP造模组血清STAT3及p-STAT3水平均显著增加(P<0.01), 随着作用时间延长逐渐升高, 18 h升至最高值, 与对照组比较有显著性差异(P<0.01); AG490治疗后, 与同时间点SAP造模组比较STAT3及p-STAT3蛋白表达显著减低(P<0.01, 图3).
SAP是一种非感染性、内源性疾病, 主要表现为自我消化而导致的急性化学性炎症, 严重时可致全身炎症反应和远处器官损伤, 如肝、肺、肾等多器官功能障碍[6], 各种促炎因子在重症急性胰腺炎发生、发展过程中起重要促进作用[7]. 在众多炎症介质中, TNF-α作为始动因子, 是SAP最早升高的促炎因子, 他可引起全身毛细血管通透性升高, ARDS, 电解质紊乱等; 此外, TNF-α可诱导炎症细胞释放IL-6等各种促炎因子的释放, 而IL-6则是SAP严重程度评价的关键介质[8,9]. 目前认为, SAP时炎性渗出, 炎症因子大量释放是造成SAP并发肾损伤的重要机制之一, 然而, 这些促炎因子在SAP合并肾损伤中的作用机制尚未完全阐明.
STAT3作为JAK/STAT信号通路中的重要成员, 广泛表达于多种类型的组织和细胞中, 各种细胞因子可诱导JAK活化, 活化的JAK可使受体的酪氨酸结合位点磷酸化, 当细胞受到信号刺激时与酪氨酸残基相结合形成活化STAT3(p-STAT3), p-STAT3将信号传导至细胞核内, 调节相应基因表达, 进而介导细胞活化及其他重要的生理活性. p-STAT3可直接或间接地上调炎症因子的表达[10]. STAT3信号通路异常激活可引起细胞功能失调, 导致全身炎症反应的发生和放大效应. 近年来, 多项研究表明各种细胞因子、炎症介质、蛋白酶等, 包括TNF-α、IL-6、IL-1β、NF-κB等, 他们通过激活JAK/STAT信号转导通路, 在炎症反应的发生、发展过程中发挥作用[11-13], 而这些炎症因子在急性肾损伤时明显增加, 同时加重对肾小球内皮细胞和系膜细胞损伤作用[14,15]. 因此推测, 针对性地阻断JAK/STAT3信号通路将有可能达到改善SAP并发肾损伤病理过程的目的.
本研究采用4%牛磺胆酸钠诱导建立了大鼠SAP动物模型, 并利用Western blotting检测肾脏中STAT3和p-STAT3蛋白的表达, 同时结合血清AMY、BUN、Cr、IL-6、TNF-α以及组织病理学检测等, 初步探讨STAT3和p-STAT3在SAP合并肾损伤发生发展中的作用. 本研究发现, 对照组肾脏可见少量STAT3和p-STAT3蛋白, 而SAP组大鼠肾脏STAT3和p-STAT3呈高表达, 18 h组达高峰, 且随胰腺和肾脏病理损伤程度加重而增加, 提示STAT3的异常激活可能与早期SAP时炎症反应有关. AG490作为JAK2特异性抑制剂, 可通过阻断JAK特异结合位点从而达到阻断下游STAT的活化[16]. 我们给予AG490预处理后, SAP大鼠肾组织STAT3和p-STAT3蛋白表达较同时间点未处理组均有不同程度减低. 与此同时, 与对照组相比, 各SAP组血清IL-6和TNF-α表达水平均显著升高, 且与STAT3和p-STAT3表达在动态变化上基本保持一致, 而AG490预处理组IL-6和TNF-α与同时间点SAP组比较均相应减低, 提示SAP时, JAK/STAT3信号通路被激活, IL-6和TNF-α表达上调, 进而造成SAP肾损伤; 但阻断JAK活化后, 由于抑制了其下游信号活化而减少了STAT3和p-STAT3的产生; 另外, 结合血清学指标可见, 病程越长, 胰腺和肾组织病理损伤程度越严重. 因此, 笔者推测SAP时, 由于STAT3和p-STAT3可能作为SAP预后判断的辅助指标.
总之, JAK/STAT3信号通路的激活, 以及其下游STAT3的过度活化在SAP的发生、发展中可能起重要调节作用; 抑制该信号通路过度活化可减少各种促炎因子的产生, 从而有效改善胰腺局部及远处器官损伤, 但还需要大量动物实验和临床研究才能得到进一步证实.
JAK/STAT信号通路作为重要的炎症反应性通路, 参与多种炎症介质介导的信号转导过程, 早期阻断JAK/STAT信号通路可在一定程度上缓解SAP炎症反应及胰外器官损伤.
刘超, 副教授, 中山大学孙逸仙纪念医院肝胆胰外科; 白雪巍, 副教授, 哈尔滨医科大学第一临床医学院肝胆胰外科
JAK/STAT3信号通路是参与SAP并发肾损伤的一条重要信号通路, SAP时释放大量炎症介质激活JAK/STAT3信号通路, 介导IL-6和TNF-α表达上调, 在SAP病程中起重要调节作用.
本文用ELISA法检测血清IL-6和TNF-α含量, 采用Western blotting方法直接检测肾脏组织中STAT3和p-STAT3表达量的变化, 分析其与SAP肾损伤的可能关系.
本文主要研究在SAP发生、发展过程中多条信号通路中的一条重要信号通路JAK/STAT3信号通路在SAP肾损伤中表达的变化情况, 可为SAP治疗提供新的思路.
本文理论依据充分, 实验设计合理, 方法可靠, 讨论能够结合实验结果进行, 有一定的新意及实用价值.
编辑: 李军亮 电编:闫晋利
| 1. | Toouli J, Brooke-Smith M, Bassi C, Carr-Locke D, Telford J, Freeny P, Imrie C, Tandon R. Guidelines for the management of acute pancreatitis. J Gastroenterol Hepatol. 2002;17 Suppl:S15-S39. [PubMed] [DOI] |
| 2. | Chen P, Huang L, Zhang Y, Qiao M, Yao W, Yuan Y. The antagonist of the JAK-1/STAT-1 signaling pathway improves the severity of cerulein-stimulated pancreatic injury via inhibition of NF-κB activity. Int J Mol Med. 2011;27:731-738. [PubMed] |
| 3. | Constantin G, Brocke S, Izikson A, Laudanna C, Butcher EC. Tyrphostin AG490, a tyrosine kinase inhibitor, blocks actively induced experimental autoimmune encephalomyelitis. Eur J Immunol. 1998;28:3523-3529. [PubMed] [DOI] |
| 4. | Grewal HP, Mohey el Din A, Gaber L, Kotb M, Gaber AO. Amelioration of the physiologic and biochemical changes of acute pancreatitis using an anti-TNF-alpha polyclonal antibody. Am J Surg. 1994;167:214-218; discussion 218-219. [PubMed] [DOI] |
| 5. | Fofi C, Pecci G, Galliani M, Comunian MC, Muda AO, Pierucci A, Cinotti GA. IgA nephropathy: multivariate statistical analysis aimed at predicting outcome. J Nephrol. 2001;14:280-285. [PubMed] |
| 6. | Zyromski N, Murr MM. Evolving concepts in the pathophysiology of acute pancreatitis. Surgery. 2003;133:235-237. [PubMed] [DOI] |
| 7. | Singh VK, Wu BU, Bollen TL, Repas K, Maurer R, Mortele KJ, Banks PA. Early systemic inflammatory response syndrome is associated with severe acute pancreatitis. Clin Gastroenterol Hepatol. 2009;7:1247-1251. [PubMed] [DOI] |
| 8. | Sandoval J, Pereda J, Rodriguez JL, Escobar J, Hidalgo J, Joosten LA, Franco L, Sastre J, López-Rodas G. Ordered transcriptional factor recruitment and epigenetic regulation of tnf-alpha in necrotizing acute pancreatitis. Cell Mol Life Sci. 2010;67:1687-1697. [PubMed] [DOI] |
| 9. | Gregoric P, Sijacki A, Stankovic S, Radenkovic D, Ivancevic N, Karamarkovic A, Popovic N, Karadzic B, Stijak L, Stefanovic B. SIRS score on admission and initial concentration of IL-6 as severe acute pancreatitis outcome predictors. Hepatogastroenterology. 2010;57:349-353. [PubMed] |
| 10. | Mejías-Luque R, Peiró S, Vincent A, Van Seuningen I, de Bolós C. IL-6 induces MUC4 expression through gp130/STAT3 pathway in gastric cancer cell lines. Biochim Biophys Acta. 2008;1783:1728-1736. [PubMed] |
| 11. | Fridman JS, Scherle PA, Collins R, Burn TC, Li Y, Li J, Covington MB, Thomas B, Collier P, Favata MF. Selective inhibition of JAK1 and JAK2 is efficacious in rodent models of arthritis: preclinical characterization of INCB028050. J Immunol. 2010;184:5298-5307. [PubMed] [DOI] |
| 12. | Jee SH, Chu CY, Chiu HC, Huang YL, Tsai WL, Liao YH, Kuo ML. Interleukin-6 induced basic fibroblast growth factor-dependent angiogenesis in basal cell carcinoma cell line via JAK/STAT3 and PI3-kinase/Akt pathways. J Invest Dermatol. 2004;123:1169-1175. [PubMed] [DOI] |
| 13. | Centurion SA, Centurion LM, Souza ME, Gomes MC, Sankarankutty AK, Mente ED, Castro e Silva O. Effects of ischemic liver preconditioning on hepatic ischemia/reperfusion injury in the rat. Transplant Proc. 2007;39:361-364. [PubMed] [DOI] |
| 14. | Sanchez-Niño MD, Benito-Martin A, Gonçalves S, Sanz AB, Ucero AC, Izquierdo MC, Ramos AM, Berzal S, Selgas R, Ruiz-Ortega M. TNF superfamily: a growing saga of kidney injury modulators. Mediators Inflamm. 2010;2010. Epub 2010 Oct 4. [PubMed] |
| 15. | Liu S, Lutz J, Chang J, Liu D, Heemann U, Baumann M. TRAF6 knockdown promotes survival and inhibits inflammatory response to lipopolysaccharides in rat primary renal proximal tubule cells. Acta Physiol (Oxf). 2010;199:339-346. [PubMed] |
| 16. | Seo IA, Lee HK, Shin YK, Lee SH, Seo SY, Park JW, Park HT. Janus Kinase 2 Inhibitor AG490 Inhibits the STAT3 Signaling Pathway by Suppressing Protein Translation of gp130. Korean J Physiol Pharmacol. 2009;13:131-138. [PubMed] [DOI] |