修回日期: 2011-10-18
接受日期: 2011-11-02
在线出版日期: 2011-11-08
目的: 分析应用125I放射性粒子植入近距离放疗治疗肝转移癌的近期疗效.
方法: 24例肝转移癌患者共32个病灶, 因不宜或不同意外科手术切除而行粒子植入治疗, 病灶直径4.5-12.8 cm, 平均7.8 cm. 术后复查随访统计有效率、局部控制率和生存率以及副反应等情况.
结果: 32个病灶中肿瘤完全缓解(CR)7个, 部分缓解(PR)16个, 无缓解(NR)5个, 肿瘤进展(PD)4个; 有效率CR+PR为71.9%. 术后随访时间为7-22 mo, 平均16 mo, 局部控制率为65.6%, 总生存率为70.1%, 未发现严重并发症.
结论: 对于手术禁忌或不接受手术的肝转移癌患者, 125I放射性粒子植入近距离放疗可以获得较好的近期疗效.
引文著录: 郑加贺, 畅智慧, 刘兆玉, 卢再鸣, 郭启勇. 125I放射性粒子植入治疗肝转移癌的近期疗效. 世界华人消化杂志 2011; 19(31): 3264-3267
Revised: October 18, 2011
Accepted: November 2, 2011
Published online: November 8, 2011
AIM: To detect the efficacy of 125I radioactive seed interstitial brachytherapy for liver metastases.
METHODS: Thirty-two tumors in 24 patients with liver metastases were treated by 125I radioactivity seed interstitial brachytherapy. The tumor diameter ranged from 4.5 to 12.8 cm, with an average value of 7.8 cm. The treatment response, local control rate and survival rate were evaluated and adverse events observed.
RESULTS: Complete remission (CR) was achieved in 7 tumors, and partial remission (PR) was achieved in 16 tumors. Five tumors had no remission (NR), and 4 tumors had progressive deterioration (PD). The response rate was 71.9%. The patients were followed up for 7 to 22months (median 16 mo). The local control rate was 65.9%, and total survival rate 70.1%. No serious side effects were observed.
CONCLUSION: Radioactive seed interstitial brachytherapy is an effective form of treatment for patients with liver metastases.
- Citation: Zheng JH, Chang ZH, Liu ZY, Lu ZM, Guo QY. 125I radioactive seed interstitial brachytherapy for liver metastases. Shijie Huaren Xiaohua Zazhi 2011; 19(31): 3264-3267
- URL: https://www.wjgnet.com/1009-3079/full/v19/i31/3264.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i31.3264
肝转移癌多数源于结、直肠癌, 预后不佳, 平均生存时间仅6-12 mo[1-3]. 手术切除是公认的根治性方法, 但只有10%-20%适合手术[4-6]. 125I粒子永久性组织间植入近距离放射治疗的出现及其技术的不断改进为此类患者提供了一种新的治疗手段, 现将24例在我院采用125I粒子植入治疗肝转移癌的临床结果报道并分析如下.
回顾性分析2008-01/2010-12我院采用125I粒子植入治疗的24肝转移瘤患者的临床资料, 术前均行常规穿刺活检证实, 其中男13例, 女11例, 年龄范围39-65岁, 中位年龄51岁. 原发灶为肺癌2例, 结、直肠癌18例, 卵巢癌4例. 所有病例术前CT增强扫描病灶均表现为乏血供, 24例患者中15例为单发, 9例多发, 共有32个病灶, 病灶直径4.5-12.8 cm, 平均7.8 cm. 所有患者均为不宜或不同意外科手术切除而行粒子植入治疗. 采用GE Lightspeed 16排螺旋CT引导定位; 125I粒子由北京原子高科核技术应用股份有限公司生产, 长度为4.5 mm, 直径为0.8 mm, 平均能量27-35 keV, 半衰期59.6 d, 组织穿透能力1.7 cm, 单个粒子的活性23.31-29.97 MBq(0.63-0.81 mCi).
1.2.1 术前准备: 常规检查包括胸片、心电图及血压. 实验室检查包括肝、肾功能、凝血5项、血糖、血常规及血型. 常规行增强CT扫描检查确定瘤体大小、浸润范围、瘤体与周围组织关系等, 以帮助确定完整的植入计划.
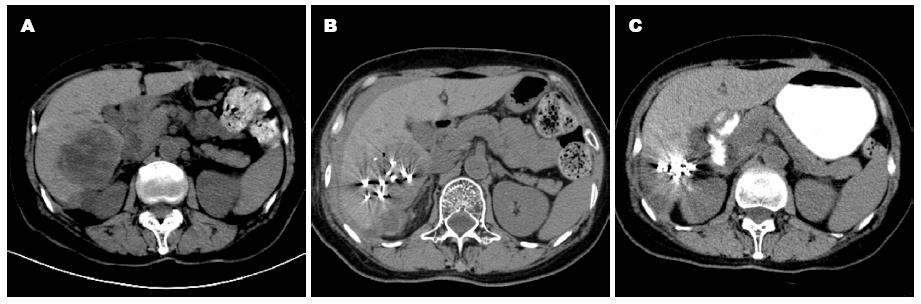
1.2.2 植入计划的确定: 根据CT扫描图像(图1)精确测量肿瘤靶体积的3个互相垂直的直径, 遵循Halarism的125I经验公式mCi = Da×5. Da为靶组织长、宽、高的平均值(L+W+H)/3, 单位为cm, 求出的mCi为需用125I粒子的总活度, 再除以拟用粒子的活度计算出治疗粒子的数量. 同时根据CT图像制作若干计划切面图像, 切面之间的距离为1-1.5 cm, 计算出各层面所需粒子数量.
1.2.3 植入过程: 先行病灶区CT扫描, 扫描层厚、间隔与制定植入计划的图像一致. 依据治疗计划每一层面上所需植入粒子数量和位置, 确定每一层面上合适的皮肤进针点和最佳进针路径, 常规消毒、铺无菌巾, 局部麻醉, 在CT引导下将18G穿刺针按所需间距逐针或同时经皮穿刺到瘤体内, 连接植入器, 将125I粒子植入到瘤体内, 粒子的纵向间距为0.8-1.2 cm, 横向间距为1.0-1.5 cm. 医护人员近距离接触125I粒子时穿铅防护衣, 其他人员采取1 m外距离防护.
1.2.4 术后处理: 粒子植入后行CT扫描了解125I粒子的粒数、分布情况、置入范围以及有无并发症. 术后予以患者常规抗炎、保肝等治疗, 监测血常规、肝功能等.
1.2.5 疗效评价及随访: 对于放射性粒子植入的效果评价主要依靠影像学标准. 在治疗后1、3、6 mo进行螺旋CT增强检查, 6 mo后每半年复查1次, 把治疗前后影像学上2个相互垂直的肿瘤最大直径的乘积进行比较, 按WHO疗效评价指标进行评价. 疗效评价标准为: (1)完全缓解(CR): 肿瘤完全消失, 影像学检查不能显示肿瘤或仅残留粒子影像; (2)部分缓解(PR): 肿瘤缩小, 乘积比治疗前减少≥50%; (3)无变化(NR): 乘积比治疗前减少<50%或增大<25%; (4)进展(PD): 乘积比治疗前增大≥25%或出现新病灶.
统计学处理 应用SPSS10.0软件Kaplan-Meier对局部控制率和生存率进行统计分析.
所有24例患者均顺利完成粒子治疗, 植入粒子22-85粒, 平均48粒, 随访最短7 mo, 最长22 mo, 平均16 mo.
根据125I放射性粒子半衰期推算, 粒子植入后6 mo, 达到处方剂量, 根据CT扫描32个病灶中CR7个, PR16个, NC5个, PD4个; 有效率CR+PR为71.9%. 局部控制率以治疗开始至发现局部肿瘤复发计算, 即肿瘤总数减去无效肿瘤数和肿瘤复发数患再除以病变总数. 术后随访时间为7-22 mo, 平均16 mo, 6个病灶治疗后局部复发, 其中4个为治疗后局部消退, 之后又出现复发, 分别为治疗后至10-12 mo发现复发, 2个病灶治疗结束后完全消退, 随访15及19 mo后发现肿瘤复发. Kaplan-Meier分析显示总的局部控制率为68.8%, 1年局部控制率为75.0%.
至随访截止, 共有7人死亡, 5例患者在术后10-12 mo相继死亡, 其中2人死于肝脏肿瘤, 均为粒子治疗无效; 3人死于肺及其他部位转移, 1例术后14 mo死于肝脏肿瘤, 1例术后15 mo远处转移. Kaplan-Meier分析显示总生存率为70.1%, 1年生存率为79.2%.
24例患者术后均出现不同程度肝区疼痛、予以口服或肌注止痛药物后缓解; 4例出现少量被膜下出血, 未予特殊处理, 1 wk后复查CT积液量减少或消失; 10例患者出现低热, 考虑与穿刺引起的肝内或肝周出血有关, 予以抗炎治疗后好转, 未出现继发感染; 全部病例均未出现粒子移位及气胸等并发症.
肝转移癌在临床上极为常见, 手术切除仍是公认的根治性方法, 但大多数患者由于肿瘤体积较大、转移灶较多或靠近血管限制了手术切除的彻底性; 另外手术切除的远期疗效尚不令人满意, 其主要原因是肝转移多为弥漫性转移, 局限于一个肝段或一叶肝内相对较少, 手术根治只是相对的; 一些较小的肿瘤(直径<1 cm)术前、术中影像检查不一定能发现, 术中认为是已根治者术后2-3 mo仍有较大比例复发[7-10].
对于肝脏恶性肿瘤, 常规放疗很难奏效, 主要是由于肝脏对射线的耐受度低, 肝癌必须有超过40Gy的吸收剂量才能得到较好的局部控制, 而肝脏的耐受剂量仅30Gy, 超过30Gy会产生严重的放射性肝损伤, 因此,常规的放射治疗在肝癌的应用受到限制[11,12]. 125I粒子植入属于近距离放疗范畴, 放射性粒子植入到瘤体内, 利用其释出的γ射线破坏肿瘤细胞的DNA双链, 使细胞失去增殖能力; 肿瘤组织间植入125I粒子所产生的能量虽然不大, 但能持续地对肿瘤细胞起作用, 因此能不断地杀伤肿瘤干细胞, 经过足够的半衰期积累剂量使肿瘤细胞全部失去繁殖能力, 从而达到杀灭肿瘤的效果. 由于125I粒子的照射半径小, 粒子活度低, 只增高靶剂量, 周围正常组织剂量陡降, 高度适形, 明显降低了放射损伤发生率, 而增加了对肿瘤的疗效[13]. 本组随访时间为7-22 mo, 平均16 mo, 总的有效率71.9%, 局部控制率为68.8%, 1年生存率为79.2%, 与Nag等[14]报道125I粒子内放疗治疗不可手术切除的结直肠癌肝转移的1年生存率为73%结果相近, 近期疗效满意. 本组患者至随访截止时共有7例死亡, 总生存率为70.1%. 其中死于远处转移的4人, 局部复发的为3人, 和其他局部控制肿瘤的方法一样, 在局部控制率提高情况下, 远处转移仍是影响远期生存率的重要因素.
肝转移癌粒子植入的常见并发症主要有肝被膜下出血、肝区疼痛、低热等[15], 出血主要是由于反复穿刺所致, 嘱患者卧床24 h, 注意观察血压变化情况, 一般出血量较少, 多自行停止, 无需特殊处理, 可予以适当止痛, 并注意抗炎预防感染. 气胸及粒子移位临床少见, 只要认真选择穿刺点, 严格操作, 多可避免.
总之, CT引导下125I放射性粒子植入治疗肝转移癌创伤小, 局部剂量高, 近期疗效满意, 且并发症发生率低, 为肝脏恶性肿瘤的治疗提供了一种新的有效手段.
肝转移癌多数源于结、直肠癌, 预后不佳, 平均生存时间仅6-12 mo. 手术切除是公认的根治性方法, 但只有10%-20%适合手术. 125I粒子永久性组织间植入近距离放射治疗的出现及其技术的不断改进为此类患者提供了一种新的治疗手段.
李革, 副教授, 延边大学附属医院普外1科
125I粒子永久性组织间植入近距离放射治疗已广泛应用于胰腺癌、肝癌等恶性肿瘤, 近期疗效显著, 但究其远期疗效尚需进一步研究证实.
杨之光等的研究表明, 125I粒子永久性植入治疗肝内胆管细胞癌疗效确切, 安全可靠, 值得临床推广.
本论文有一定的先进性, 样本充足, 结果可信, 设计合理, 统计学分析可以, 有一定的学术价值和应用价值.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Heslin MJ, Medina-Franco H, Parker M, Vickers SM, Aldrete J, Urist MM. Colorectal hepatic metastases: resection, local ablation, and hepatic artery infusion pump are associated with prolonged survival. Arch Surg. 2001;136:318-323. [PubMed] [DOI] |
| 2. | Moldovan B, Copotoiu C, Bud V, Nemes I, Serac G, Molnar C, Florea S, Cornăteanu S, Milutin D, Coţovanu A. [The importance of the I-colic time in colorectal cancer with synchronous hepatic metastases. Specifics of surgical strategy]. Chirurgia (Bucur). 2008;103:539-546. [PubMed] |
| 3. | Ciferri E, Bondanza GS, Municinò O, Castagnola M, Gazzaniga GM. Colorectal cancer metastases: surgical indications and multimodal approach. Hepatogastroenterology. 2003;50:1836-1846. [PubMed] |
| 4. | Lau WY, Lai EC, Leung TW, Yu SC. Adjuvant intra-arterial iodine-131-labeled lipiodol for resectable hepatocellular carcinoma: a prospective randomized trial-update on 5-year and 10-year survival. Ann Surg. 2008;247:43-48. [PubMed] [DOI] |
| 5. | Gasent Blesa JM, Dawson LA. Options for radiotherapy in the treatment of liver metastases. Clin Transl Oncol. 2008;10:638-645. [PubMed] [DOI] |
| 7. | Dagnew E, Kanski J, McDermott MW, Sneed PK, McPherson C, Breneman JC, Warnick RE. Management of newly diagnosed single brain metastasis using resection and permanent iodine-125 seeds without initial whole-brain radiotherapy: a two institution experience. Neurosurg Focus. 2007;22:E3. [PubMed] [DOI] |
| 8. | Zhang L, Mu W, Hu CF, Huang XQ. Treatment of portal vein tumor thrombus using 125Iodine seed implantation brachytherapy. World J Gastroenterol. 2010;16:4876-4879. [PubMed] [DOI] |
| 9. | Martinez-Monge R, Nag S, Nieroda CA, Martin EW. Iodine-125 brachytherapy in the treatment of colorectal adenocarcinoma metastatic to the liver. Cancer. 1999;85:1218-1225. [PubMed] [DOI] |
| 10. | Armstrong JG, Anderson LL, Harrison LB. Treatment of liver metastases from colorectal cancer with radioactive implants. Cancer. 1994;73:1800-1804. [PubMed] [DOI] |
| 11. | Huang K, Sneed PK, Kunwar S, Kragten A, Larson DA, Berger MS, Chan A, Pouliot J, McDermott MW. Surgical resection and permanent iodine-125 brachytherapy for brain metastases. J Neurooncol. 2009;91:83-93. [PubMed] [DOI] |
| 12. | Zhang FJ, Li CX, Zhang L, Wu PH, Jiao DC, Duan GF. Short- to mid-term evaluation of CT-guided 125I brachytherapy on intra-hepatic recurrent tumors and/or extra-hepatic metastases after liver transplantation for hepatocellular carcinoma. Cancer Biol Ther. 2009;8:585-590. [PubMed] [DOI] |
| 13. | Aloia TA, Vauthey JN, Loyer EM, Ribero D, Pawlik TM, Wei SH, Curley SA, Zorzi D, Abdalla EK. Solitary colorectal liver metastasis: resection determines outcome. Arch Surg. 2006;141:460-466; discussion 460-466. [PubMed] [DOI] |
| 14. | Nag S, DeHaan M, Scruggs G, Mayr N, Martin EW. Long-term follow-up of patients of intrahepatic malignancies treated with iodine-125 brachytherapy. Int J Radiat Oncol Biol Phys. 2006;64:736-744. [PubMed] [DOI] |