修回日期: 2011-10-18
接受日期: 2011-11-04
在线出版日期: 2011-11-08
目的: 探讨肿瘤坏死因子样凋亡微弱诱导剂(TNF-like weak inducer of apoptosis, TWEAK)及其受体早期反应蛋白14(fibroblast growth factor-inducible 14, Fn14)表达与食管鳞状细胞癌发生、发展及浸润、转移的关系.
方法: 应用免疫组化法分别检测手术切除的45例食管鳞癌组织、22例癌旁不典型增生组织及22例正常食管黏膜组织中TWEAK及Fn14蛋白表达, 并且对二者在食管鳞状细胞癌组织中的表达情况进行相关性分析.
结果: 食管鳞癌组织中TWEAK蛋白表达与癌的浸润深度、淋巴结转移及TNM分期均密切相关(χ2分别为6.455, 11.645及4.185, P均<0.05); 在食管鳞癌癌变过程中TWEAK蛋白表达在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次增高, 分别为27.3%(6/22)、40.9%(9/22)、64.4%(29/45), 组间比较差异具有统计学意义(χ2 = 9.018, P<0.05); Fn14蛋白表达也与癌的组织学分级、浸润深度、淋巴结转移及TNM分期均密切相关(χ2分别为10.873、12.513、9.244及13.137; 均P<0.05); Fn14蛋白在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次增高, 分别为22.7%(5/22)、59.1%(13/22)、62.2%(28/45), 组间比较差异具有统计学意义(χ2 = 9.872, P<0.05). TWEAK及Fn14的表达无相关性(γp = 0.091, P>0.05).
结论: TWEAK及Fn14蛋白在食管鳞癌组织中表达显著升高, 并与食管鳞癌生物学特性密切相关, 提示TWEAK及Fn14过表达可能参与了食管鳞状细胞癌的发生、发展.
引文著录: 杨建萍, 李晟磊. TWEAK及其受体Fn14蛋白在食管鳞癌中的表达及临床病理意义. 世界华人消化杂志 2011; 19(31): 3217-3221
Revised: October 18, 2011
Accepted: November 4, 2011
Published online: November 8, 2011
AIM: To explore the role of TWEAK and its receptor Fn14 in the development, progression, invasion and metastasis of esophageal squamous cell carcinoma (ESCC).
METHODS: Immunohistochemistry was used to detect the expression of TWEAK and Fn14 in 45 cases of ESCC specimens, 22 cases of adjacent atypical hyperplasia epithelial specimens and 22 cases of normal esophageal epithelial specimens.
RESULTS: The expression of TWEAK protein was closely correlated with tumor infiltration, lymphatic metastasis and TNM grade in ESCC (χ2 = 6.455, 11.645 and 4.185, all P < 0.05). The positive rate of TWEAK protein expression in normal esophageal epithelium, adjacent atypical hyperplasia epithelium and ESCC were 27.3% (6/22), 40.9% (9/22) and 64.4% (29/45), respectively, showing a significant upward trend (χ2 = 9.018, P < 0. 05). The expression of Fn14 protein was closely correlated with the tumor grade, infiltration, lymphatic metastasis and TNM grade in ESCC (χ2 = 10.873, 12.513, 9.244 and 13.137, all P < 0. 05). The positive rate of Fn14 protein expression in normal esophageal epithelium, adjacent atypical hyperplasia epithelium and ESCC were 22.7% (5/22), 59.1% (13/22) and 62.2%(28/45), also showing a significant upward trend ( χ2 = 9.872, P < 0.05). There was a positive correlation between the expression of TWEAK and Fn14 in ESCC ( γp = 0.091, P < 0.05).
CONCLUSION: TWEAK and Fn14 play an important role in the development, infiltration, and metastasis of ESCC.
- Citation: Yang JP, Li SL. Clinical pathological significance of expression of TWEAK and its receptor Fn14 in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(31): 3217-3221
- URL: https://www.wjgnet.com/1009-3079/full/v19/i31/3217.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i31.3217
肿瘤坏死因子样凋亡的微弱诱导剂(TNF-like weak inducer of apoptosis, TWEAK)是肿瘤坏死因子配体超家族成员之一, 根据其发现的顺序被命名为了肿瘤坏死因子配体超家族成员12(TNFSF12). 他是一类Ⅱ型跨膜蛋白, 具有诱导细胞凋亡、增殖, 参与炎症反应并可促进细胞因子的分泌, 参与免疫调节等作用[1]. Fn14是TWEAK的受体, 可以通过连接不同的含有肿瘤坏死因子受体相关因子(TNF receptor-associated Factor, TRAF)结构域的受体蛋白或胞浆蛋白而启动细胞内多条信号转导途径, 诱发相应的基因活化[2]. 目前的研究结果显示, TWEAK/Fn14信号转导通路参与许多疾病的发生, 尤其是实体肿瘤的发生、发展及演进过程, 但其确切机制至今不清. 为揭示TWEAK及Fn14与食管鳞状细胞癌的关系, 本研究采用免疫组织化学法系统地检测了TWEAK与Fn14基因在食管鳞状细胞癌患者不同部位组织内的表达情况, 并对二者在食管鳞状细胞癌组织中的表达情况进行了相关性分析, 深入地探讨了TWEAK与Fn14在食管癌演进过程中的作用.
本研究所采用的全部45例标本均取自食管癌高发区河南省安阳市肿瘤医院, 所有病例术前均无化疗、放疗及免疫治疗史, 中位年龄(57.8±2.61)岁. 取无坏死癌组织为主要研究对象, 另选取癌旁3 cm以内及远端正常食管黏组织(所有标本均经HE染色证实, 45例癌旁组织中有22例为Ⅱ级以上不典型增生或原位癌)为对照. 所有标本均经40 g/L的多聚甲醛固定, 常规脱水, 石蜡包埋, 连续切片, 切片厚度4-6 μm, 分别用于HE染色及免疫组织化学染色. 兔抗人多克隆TWEAK抗体及羊抗人Fn14多克隆抗体均购自美国Santa Cruz公司, PV9000免疫组化试剂盒、Ⅱ抗及DAB显色购自北京中杉金桥生物技术开发公司.
1.2.1 免疫组织化学染色步骤: 采用PV9000法, TWEAK及Fn14单抗稀释, 稀释倍数分别为1∶100和1∶200, DAB显色, 苏木素复染. 所有实验操作步骤严格按说明书进行, 以PBS液代替一抗作为阴性对照, 用已知高表达的扁桃体组织作为阳性对照.
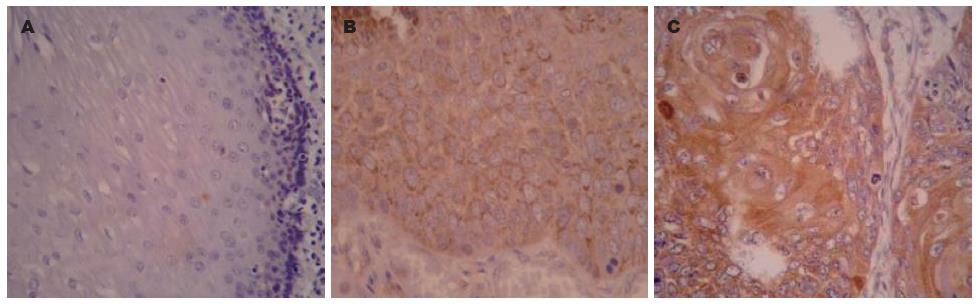
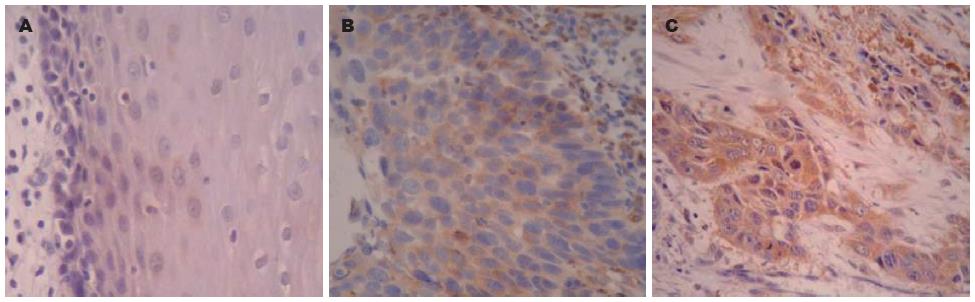
1.2.2 结果判定方法: TWEAK及Fn14蛋白阳性信号均呈黄色至棕黄色颗粒样物质, 位于细胞质内. 200倍镜下随机选取5个视野, 分别按阳性细胞所占百分比及着色深浅进行结果判定. (1)按阳性细胞数占同类细胞数的百分比: <30%为1分, 30%-70%为2分, >70%为3分; (2)按切片中细胞着色深浅评分: 0分, 细胞无显色; 1分, 浅黄色; 2分, 棕黄色; 3分, 棕褐色. 取(1)、(2)的乘积作为总评分, ≥1分者为阳性[3,4].
统计学处理 应用SPSS13.0统计学软件, 采用χ2检验. 检验水准α = 0.05.
TWEAK蛋白阳性表达主要位于食管鳞状细胞癌癌细胞的胞质中, 呈浅黄色至深黄色颗粒信号(图1). 结果显示: 其在食管鳞癌组织中过表达, 在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率均明显降低, 分别为64.4%(29/45)、40.9%(9/22)、27.3%(6/22), 组间比较差异有统计学意义(χ2 = 9.018, P<0.05, 表1). 另外, TWEAK蛋白表达与食管鳞癌组织的浸润深度、淋巴结转移及TNM分期均有关(χ2分别为6.455, 11.645及4.185, P均<0.05, 表2).
| TWEAK | χ2值 | P值 | Fn14 | χ2值 | P值 | ||||||
| n | - | + | 阳性率(%) | - | + | 阳性率(%) | |||||
| 正常黏膜上皮 | 22 | 16 | 6 | 27.3 | 9.018 | 0.011 | 17 | 5 | 22.7 | 9.872 | 0.007 |
| 非典型增生 | 22 | 13 | 9 | 40.9 | 9 | 13 | 59.1 | ||||
| 鳞癌 | 45 | 16 | 29 | 64.4 | 17 | 28 | 62.2 | ||||
| 病理特征 | TWEAK | Fn14 | |||||
| n | 阳性表达率(%) | χ2值 | P值 | 阳性表达率(%) | χ2值 | P值 | |
| 组织学分级 | |||||||
| Ⅰ | 18 | 12(66.7) | 0.087 | 0.958 | 6(33.3) | 10.873 | 0.004 |
| Ⅱ | 13 | 8(61.5) | 10(76.9) | ||||
| Ⅲ | 14 | 9(64.3) | 12(85.7) | ||||
| 浸润深度 | |||||||
| 浅层 | 17 | 7(41.2) | 6.455 | 0.011 | 5(29.4) | 12.513 | 0.000 |
| 深层 | 28 | 22(78.6) | 23(82.1) | ||||
| 淋巴结转移 | |||||||
| 无 | 24 | 10(41.7) | 11.645 | 0.001 | 10(41.7) | 9.244 | 0.002 |
| 有 | 21 | 19(90.5) | 18(85.7) | ||||
| TNM分期 | |||||||
| Ⅰ、Ⅱ | 19 | 9(47.4) | 4.185 | 0.041 | 6(31.6) | 13.137 | 0.000 |
| Ⅲ、Ⅳ | 26 | 20(76.9) | 22(84.6) | ||||
Fn14蛋白阳性着色定位于细胞质内, 呈棕黄色或深黄色颗粒样信号(图2). 结果显示: 其在食管鳞癌癌变过程中过表达, 在正常黏膜组织、癌旁不典型增生组织表达率均明显降低, 分别为22.7%(5/22)、59.1%(13/22)、62.2%(28/45), 组间比较差异有统计学意义(χ2 = 9.872, P<0.05, 表1). Fn14蛋白阳性表达率与食管鳞癌组织学分级、浸润深度、淋巴结转移及TNM分期均密切相关(χ2分别为10.873、12.513、9.244及13.137; P均<0.05, 表2).
TWEAK是肿瘤坏死因子超家族成员之一, 国内外的研究结果显示, 其广泛表达于人类多种正常组织如扁桃体、淋巴结、心、肺、脾等. 此外, 在多种实体肿瘤细胞的细胞系中也有不同程度的表达. TWEAK定位于人类17号染色体的13区3带, 分子量大约为30 kDa, 可以水解产生出一个约18 kDa的具有多种生物特性的可溶性因子, 从而发挥远距离的生物学效应[5-9]. 还有研究发现, 可溶性的TWEAK不仅可以介导细胞的凋亡, 诱导某些细胞分化, 而且还具有促进细胞因子分泌及内皮细胞的增生及血管生成的作用; 与此同时还参与了先天性的免疫调节作用. 然而, TWEAK如何参与并诱导血管形成作用机制还不十分清楚[10,11].
Fn14是TWEAK的多功能受体之一, 其同源体位于人类16号染色体短臂的13区三带, 在人体在组织中以心、肾表达量最高, 近些年来的研究发现, Fn14同样也参与了内皮细胞增殖及血管的生成[12-16]. 最初的研究发现, TWEAK通过与细胞膜表面的死亡受体3(Death Recepotr 3)结合而传递死亡信号, 并诱导细胞凋亡, 此后的研究发现并非所有的细胞均表达死亡受体3(DR3), TWEAK仅在有限的细胞中传递微弱的诱导凋亡信号. 多项研究结果表明, TWEAK可以诱导Fn14转染体的凋亡性细胞死亡, TWEAK诱导细胞的死亡通路可能是由Fn14单独介导的, 二者在肿瘤的发生、凋亡及增殖、分化过程中可能起到重要的协同作用[17-23].
本研究结果显示, TWEAK及Fn14在食管鳞癌组织中的表达远高于其在相对应的癌旁不典型增生组织及正常食管黏膜内, 说明TWEAK及Fn14高表达的食管鳞癌具有更强的侵袭能力. 本实验还发现, 随食管鳞癌组织浸润深度的增加, TNM分期的增加及伴有淋巴结转移的发生, TWEAK蛋白染色阳性率呈逐渐增强趋势, 组间比较差异具有统计学意义(P<0.05); 而Fn14的异常过表达则与食管鳞癌的组织学分级、浸润深度、TNM分期及淋巴结均密切相关(P<0.05), 这就提示二者可能在食管鳞癌的癌变过程及演进过程中均可能起到了重要的作用. TWEAK及Fn14蛋白在食管鳞状细胞癌中的表达无关, 但在总共45例食管鳞状细胞癌组织中二者共同表达阳性的病理达到了19例(42.2%), 我们分析这可能与标本量过小有一定的关系, 进一步加大实验标本量可能会改变实验结果. 因此, 下一步我们拟采用siRNA技术及翻译寡核苷酸技术下调TWEAK的表达并检测其对细胞凋亡作用的影响等实验.
总之, 联合检测TWEAK及Fn14蛋白的表达可能会有利于我们进一步了解食管鳞状细胞癌的生物学特性, 为食管鳞鳞状细胞癌的早期诊断和预防治疗提供一个新的思路.
TWEAK是一类Ⅱ型跨膜蛋白, 具有诱导细胞凋亡、增殖, 参与炎症反应并可促进细胞因子的分泌, 参与免疫调节等作用.
门秀丽, 教授, 河北联合大学病理生理学教研室
关于TWEAK在食管癌发生、发展及演进过程中的作用国内外少见报道.
国内外研究结果均显示: TWEAK/Fn14信号转导通路参与许多疾病的发生, 尤其是实体肿瘤的发生、发展及演进过程.
本文首次采用免疫组织化学法联合检测了食管鳞状细胞癌组织中TWEAK及Fn14的表达情况, 并分析了二者与食管鳞状细胞癌临床病理学特征的关系.
本研究的内容充实, 有一定的创新性, 具有一定的临床参考价值.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Dionne S, Levy E, Levesque D, Seidman EG. PPARgamma ligand 15-deoxy-delta 12,14-prostaglandin J2 sensitizes human colon carcinoma cells to TWEAK-induced apoptosis. Anticancer Res. 2010;30:157-166. [PubMed] |
| 2. | Watts GS, Tran NL, Berens ME, Bhattacharyya AK, Nelson MA, Montgomery EA, Sampliner RE. Identification of Fn14/TWEAK receptor as a potential therapeutic target in esophageal adenocarcinoma. Int J Cancer. 2007;121:2132-2139. [PubMed] [DOI] |
| 3. | 高 冬玲, 李 晟磊, 陈 奎生, 赵 志华, 赵 秋民, 刘 宗文, 张 云汉. 金属蛋白酶抑制基因RECK在食管鳞癌中的表达及生物学意义. 世界华人消化杂志. 2008;16:1634-1638. [DOI] |
| 4. | 李 晟磊, 赵 秋民, 刘 宗文, 赵 志华, 高 冬玲, 郑 湘予, 陈 奎生, 张 云汉. 食管鳞癌中RECK和MMP-9蛋白表达的相关性及临床病理意义. 世界华人消化杂志. 2007;15:1082-1086. [DOI] |
| 5. | Zou H, Wang D, Gan X, Jiang L, Chen C, Hu L, Zhang Y. Low TWEAK expression is correlated to the progression of squamous cervical carcinoma. Gynecol Oncol. 2011;123:123-128. [PubMed] [DOI] |
| 6. | Zhou H, Marks JW, Hittelman WN, Yagita H, Cheung LH, Rosenblum MG, Winkles JA. Development and characterization of a potent immunoconjugate targeting the Fn14 receptor on solid tumor cells. Mol Cancer Ther. 2011;10:1276-1288. [PubMed] [DOI] |
| 7. | Ikner A, Ashkenazi A. TWEAK induces apoptosis through a death-signaling complex comprising receptor-interacting protein 1 (RIP1), Fas-associated death domain (FADD), and caspase-8. J Biol Chem. 2011;286:21546-21554. [PubMed] [DOI] |
| 8. | Pelekanou V, Notas G, Theodoropoulou K, Kampa M, Takos D, Alexaki VI, Radojicic J, Sofras F, Tsapis A, Stathopoulos EN. Detection of the TNFSF members BAFF, APRIL, TWEAK and their receptors in normal kidney and renal cell carcinomas. Anal Cell Pathol (Amst). 2011;34:49-60. [PubMed] |
| 9. | Abend JR, Uldrick T, Ziegelbauer JM. Regulation of tumor necrosis factor-like weak inducer of apoptosis receptor protein (TWEAKR) expression by Kaposi's sarcoma-associated herpesvirus microRNA prevents TWEAK-induced apoptosis and inflammatory cytokine expression. J Virol. 2010;84:12139-12151. [PubMed] [DOI] |
| 10. | Peternel S, Manestar-Blažić T, Brajac I, Prpić-Massari L, Kaštelan M. Expression of TWEAK in normal human skin, dermatitis and epidermal neoplasms: association with proliferation and differentiation of keratinocytes. J Cutan Pathol. 2011;38:780-789. [PubMed] |
| 11. | Kawakita T, Shiraki K, Yamanaka Y, Yamaguchi Y, Saitou Y, Enokimura N, Yamamoto N, Okano H, Sugimoto K, Murata K. Functional expression of TWEAK in human colonic adenocarcinoma cells. Int J Oncol. 2005;26:87-93. [PubMed] |
| 12. | Sanz AB, Sanchez-Niño MD, Ortiz A. TWEAK, a multifunctional cytokine in kidney injury. Kidney Int. 2011;80:708-718. [PubMed] [DOI] |
| 13. | Michaelson JS, Amatucci A, Kelly R, Su L, Garber E, Day ES, Berquist L, Cho S, Li Y, Parr M. Development of an Fn14 agonistic antibody as an anti-tumor agent. MAbs. 2011;3:362-375. [PubMed] [DOI] |
| 14. | Lu J, Kwan BC, Lai FM, Choi PC, Tam LS, Li EK, Chow KM, Wang G, Li PK, Szeto CC. Gene expression of TWEAK/Fn14 and IP-10/CXCR3 in glomerulus and tubulointerstitium of patients with lupus nephritis. Nephrology (Carlton). 2011;16:426-432. [PubMed] [DOI] |
| 15. | Zimmermann M, Koreck A, Meyer N, Basinski T, Meiler F, Simone B, Woehrl S, Moritz K, Eiwegger T, Schmid-Grendelmeier P. TNF-like weak inducer of apoptosis (TWEAK) and TNF-α cooperate in the induction of keratinocyte apoptosis. J Allergy Clin Immunol. 2011;127:200-207, 207. e1-10. [PubMed] |
| 16. | Weinberg JM. TWEAK-Fn14 as a mediator of acute kidney injury. Kidney Int. 2011;79:151-153. [PubMed] [DOI] |
| 17. | Feng SL, Guo Y, Factor VM, Thorgeirsson SS, Bell DW, Testa JR, Peifley KA, Winkles JA. The Fn14 immediate-early response gene is induced during liver regeneration and highly expressed in both human and murine hepatocellular carcinomas. Am J Pathol. 2000;156:1253-1261. [PubMed] [DOI] |
| 18. | Burkly LC, Dohi T. The TWEAK/Fn14 pathway in tissue remodeling: for better or for worse. Adv Exp Med Biol. 2011;691:305-322. [PubMed] [DOI] |
| 19. | Burkly LC. Introductory words about TWEAK/Fn14. Adv Exp Med Biol. 2011;691:275-277. [PubMed] [DOI] |
| 20. | Schölzke MN, Röttinger A, Murikinati S, Gehrig N, Leib C, Schwaninger M. TWEAK regulates proliferation and differentiation of adult neural progenitor cells. Mol Cell Neurosci. 2011;46:325-332. [PubMed] [DOI] |
| 21. | Muñoz-García B, Madrigal-Matute J, Moreno JA, Martin-Ventura JL, López-Franco O, Sastre C, Ortega L, Burkly LC, Egido J, Blanco-Colio LM. TWEAK-Fn14 interaction enhances plasminogen activator inhibitor 1 and tissue factor expression in atherosclerotic plaques and in cultured vascular smooth muscle cells. Cardiovasc Res. 2011;89:225-233. [PubMed] [DOI] |
| 22. | Frauenknecht K, Bargiotas P, Bauer H, von Landenberg P, Schwaninger M, Sommer C. Neuroprotective effect of Fn14 deficiency is associated with induction of the granulocyte-colony stimulating factor (G-CSF) pathway in experimental stroke and enhanced by a pathogenic human antiphospholipid antibody. J Neuroimmunol. 2010;227:1-9. [PubMed] [DOI] |
| 23. | Zhang JX, Sang M, Zhao W, Ai HX, Shui Y, Li JF, Song R, Zhang SQ. Molecular characterization of the canine cytokine TWEAK (CD255) and its receptor, Fn14 (CD266). Vet Immunol Immunopathol. 2010;137:172-175. [PubMed] [DOI] |