修回日期: 2011-10-18
接受日期: 2011-11-02
在线出版日期: 2011-11-08
炎肿瘤多药耐药性影响着胃癌化疗的效果, 肿瘤微环境变化与多药耐药密切相关, 而酸化与缺氧是微环境的两大特征. 肿瘤细胞内无氧酵解生成大量H+, 但却仍能维持胞内中性pH环境, 推测与调节肿瘤泌酸功能的空泡型质子泵密切相关. 胞外pH值的酸化可活化胞内PI3K/Akt信号通路, 活化mTOR, 上调HIF-1α, 进而促进P-gp及MRP1的表达产生胃癌化疗耐药. PPIs可能是通过抑制空泡型质子泵的表达, 改变肿瘤微环境, 影响PI3K/Akt/mTOR/HIF-1α信号通路而逆转胃癌化疗多药耐药.
引文著录: 李建琦, 陈敏, 邹晓平. PPIs抑制空泡型质子泵逆转胃癌化疗多药耐药. 世界华人消化杂志 2011; 19(31): 3201-3206
Revised: October 18, 2011
Accepted: November 2, 2011
Published online: November 8, 2011
Multidrug resistance (MDR) in gastric cancer influences the effects of chemotherapy. The change in tumor microenvironment is intimately associated with multidrug resistance. Acidification and hypoxia are the two major characteristics of tumor microenvironment. The glucose metabolism in hypoxic conditions by the neoplasms leads to an intercellular pH drift towards acidity. But tumor cells can maintain intracellular to neutro-alkalinity. Vacuolar H+-ATPases may be involved in this process by regulating H+ excretion. Acidification of extracellular pH would trigger the intracellular PI3K/Akt signal pathway, activate mTOR, up-regulate the expression of HIF-1α, and promote the expression of P-gp and MRP1, resulting in multidrug resistance in gastric cancer. PPIs may change the tumor microenvironment by inhibiting the expression of vacuolar H+-ATPases, trigger the PI3K/Akt/mTOR/HIF-1α signal pathway and reverse multidrug resistance to chemotherapy in gastric cancer.
- Citation: Li JQ, Chen M, Zou XP. PPIs reverse multidrug resistance to chemotherapy in gastric cancer by inhibiting vacuolar H+-ATPase signal pathway. Shijie Huaren Xiaohua Zazhi 2011; 19(31): 3201-3206
- URL: https://www.wjgnet.com/1009-3079/full/v19/i31/3201.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i31.3201
胃癌是消化系最常见的恶性肿瘤之一, 早期发现率低, 多数为进展期胃癌, 单纯手术常难以根治, 化疗在综合治疗中发挥了重要作用, 成为治疗胃癌的主要方法之一[1], 但肿瘤多药耐药性(multidrug resistance, MDR), 即一种药物作用于肿瘤细胞使之产生耐药性后, 该肿瘤细胞逐渐对未接触过的、结构无关、作用靶点和机制不同的多种抗肿瘤药物也具有交叉耐药性, 影响着胃癌化疗的效果[2]. 肿瘤细胞获得性耐药能力的产生与宿主本身的因素有着密切关系, 且遗传因素和后生环境的变化也起到了重要的作用. 传统的耐药机制包括: (1)药物转运蛋白的活化; (2)细胞内药物摄入减少; (3)降低药物活化或增强胞内药物解毒功能; (4)药物靶点的改变和损伤靶点的修复增强; (5)肿瘤细胞凋亡抑制或存活肿瘤细胞增加[3]. 阻断这些途径可望逆转肿瘤细胞多药耐药, 增强肿瘤细胞化疗的敏感性, 对改善患者预后起着至关重要的作用. 目前人们也着眼于新的耐药机制的研究, 尤其是对肿瘤微环境认识, 发现肿瘤细胞处于一种酸性、缺氧的环境中, 内外存在PH值梯度, 可刺激肿瘤细胞内部一系列的信号转导分子的产生, 导致耐药相关基因的表达, 且据Kang等[4]在耐5-氟尿嘧啶、阿霉素或顺铂的胃癌细胞株中发现了250多种特异性耐药基因的表达, 故肿瘤微环境可能激活肿瘤细胞内部产生一系列的信号转导通路, 促进特异性的耐药基因的表达, 活化药物转运蛋白, 增强对化疗药物的抵抗性.
肿瘤细胞无限增殖, 血液和营养处于低灌注状态, 代谢产生乳酸与其他多种有害分子一起共同构成了肿瘤的微环境[5], 提示肿瘤细胞可能存在某种机制避免胞内毒性分子聚集造成的损伤, 研究发现其中最有效的机制为质子的外排作用[6]. 肿瘤细胞内外存在pH梯度, 胞外pH值偏酸性, 而胞内pH值偏中性. 肿瘤细胞主要通过空泡型质子泵(Vacuolar H+-ATPases), Na+⁄H+交换及碳酸酐酶的作用调节胞内外pH值[6], 这种pH梯度可影响化疗药物在肿瘤细胞内的聚集与分布[7], 因绝大多数化疗药物为弱碱性, 在酸性环境中易于离子化, 故肿瘤细胞胞外pH值呈酸性使碱性化疗药物易于解离, 脂溶性降低, 从而阻碍这些化疗药物透过细胞膜进入胞内得以阻止其发挥细胞毒作用[8,9]. 有报道称许多肿瘤在慢性的酸暴露情况下可增强其侵袭、转移能力, 产生对细胞毒性药物的耐药, 且这种异常的pH值梯度与肿瘤相关的细胞功能密切相关, 如酸性囊泡的转运功能增强, 多药耐药性的提高, 以及水解酶和巨噬细胞的功能异常等[10-12]. 实际上, 肿瘤细胞外酸性环境是恶性肿瘤的显著特征, 质子泵是造成肿瘤细胞外酸性环境的主要原因. 据Warburg效应, 肿瘤细胞内无氧酵解旺盛使胞内生成大量H+, 但肿瘤细胞仍能维持胞内中性pH环境, 考虑与调节肿瘤泌酸功能的空泡型质子泵密切相关[13-15]. 且空泡型质子泵在恶性肿瘤中的活性极强, 在细胞膜和酸性囊泡膜上高度表达[16]. 已有研究证实空泡型质子泵在肿瘤细胞中表达过量且活性增强, 在肿瘤细胞耐药株中表达更高[17]. 据研究者You等[18]证实用小RNA干扰技术抑制空泡型质子泵的ATP6L亚基表达, 可以逆转耐阿霉素的乳腺癌细胞株的多药耐药, 这提示着空泡型质子泵是产生多药耐药的重要初始和促进因子之一, 故抑制其功能或表达有望为逆转肿瘤化疗多药耐药提供新思路.
缺氧是肿瘤微环境的另一特征. 已有研究证实肿瘤细胞的缺氧是肿瘤发生增殖、侵袭、转移的始动因素, 也会导致肿瘤细胞对放化疗的抵抗性增强, 而且使肿瘤细胞更具有侵袭性, 容易发生远处转移, 导致治疗失败[19,20]. 肿瘤缺氧状态时HIF-1α表达上调, 参与耐药机制的形成, 包括耐药蛋白P-糖蛋白(P-glycoprotein, P-gp), MRP表达的增强[21]. 缺氧诱导因子-1(hypoxia-inducible factor 1, HIF-1)是细胞传递缺氧信号并引发"缺氧效应"的关键分子, 为缺氧诱导的重要转录调控因子, 由α、β两个亚基组成[22]. HIF-1α在人类胃癌细胞中过度表达, 通过转录激活众多下游基因参与肿瘤细胞的血管生成、无氧代谢、对化疗药物抵抗及肿瘤细胞侵袭和转移等[23]. Rohwer等[24]采用RNA干扰技术抑制HIF-1α和P53的表达, 可提高胃癌细胞株AGS和MKN28对5-氟尿嘧啶和顺铂的化疗敏感性, 并证实HIF-1α决定了胃癌细胞株对5-氟尿嘧啶和顺铂的化疗敏感性, 说明抑制P53的表达可抑制肿瘤细胞的周期停滞与凋亡. 且在P53基因突变的胃癌细胞株中, HIF-1α并不影响其化疗的敏感性, 同时发现NF-kB在其中起着重要的作用. 据Daskalow等[25]发现与野生型鼠肝细胞癌相比, 采用依托泊苷处理HIF-1α缺陷的肝癌细胞可产生更明显的抗增殖作用, 但并未发现其在肿瘤生长和血管发生方面的中枢调节作用. 因此预示着HIF-1α抑制剂可以作为化疗的辅助增敏剂, 增强肿瘤化疗的敏感性. 另有实验[26]证实泮托拉唑预处理24 h可显著抑制HIF-1α蛋白表达及胞内分布, 且泮托拉唑可呈浓度依赖性地提高阿霉素在胃癌细胞敏感株和耐药株的胞内浓度. 阿霉素为ABC转运蛋白超家族P-gp和MRP1的共同底物之一[27], 且进一步研究还证实泮托拉唑还可抑制P-gp和MRP1的蛋白表达及胞内分布, 但其相关机制及途径尚未阐明.
质子泵抑制剂(proton pump inhibitors, PPIs)作为抑酸药物, 主要用于治疗酸相关性疾病, 大都是脂溶性弱碱性苯并咪唑类化合物的衍生物, 吸收进入血液后转运至胃粘膜壁细胞, 最后到达分泌管酸性腔, 在此酸性环境下易被离子化而带正电荷, 使药物不断聚集, 并在酸催化下转化为具有嗜硫的环化次磺酰胺, 再与壁细胞膜表面的H+/K+-ATPase质子通道上的巯基(-SH)脱水偶联形成一个共价二硫键, 从而抑制该酶H+的转运, 发挥抑酸作用[28,29]. 据Luciani等[30]对肿瘤耐药细胞株研究证实, PPIs预处理可以增强肿瘤耐药细胞对化疗药物敏感性, 其机制与增加化疗药物在胞质内聚集、抑制空泡型质子泵活性、降低细胞内和溶酶体内pH值有关. 质子泵抑制剂可促使肿瘤胞内的酸化, 激活半胱天冬酶, 增加肿瘤细胞早期胞内活性氧的聚集, 触发快速的细胞死亡, 且在诸多人类肿瘤细胞均发现PPIs的此类反应, 如黑色素瘤、骨肉瘤、淋巴瘤和各种腺癌, 质子泵有望成为一种新型的抗癌制剂[6]. 据Spugnini等[31]证实肿瘤细胞外pH值为5.5-6.8, 胞内的pH值为7.3-7.8. 且发现PPIs的抗癌作用具有pH依耐性, 酸性pH值环境可明显增强埃索美拉唑对黑色素瘤的抗癌作用[32]. Vacuolar H+-ATPases主要分布在肿瘤细胞的细胞膜和胞内酸性囊泡膜上, 且在肿瘤细胞中高度表达, 而正常组织细胞的胞膜上不表达Vacuolar H+-ATPases, 只在其胞内酸性囊泡中少量表达[6,16,33,34], 其主要功能就是将肿瘤细胞胞浆中糖酵解代谢的H+泵出细胞外或泵入胞内的酸性囊泡, 维持胞浆内的弱碱性环境, 参与肿瘤的浸润和远处转移, 且与肿瘤化疗的多药耐药密切相关[18]. PPIs能在体内外阻断肿瘤细胞H+的转运, 逆转肿瘤细胞胞内外pH值梯度[35], 改善肿瘤细胞微环境, 增加肿瘤细胞和组织的坏死和凋亡[36,37]. 实验证实[26]泮托拉唑(20 μg/mL)预处理24 h后可明显抑制胃癌细胞(SGC7901)敏感株和耐药株中空泡型质子泵的表达, 并改变其胞内蛋白定位, 提高胞外pH值, 降低胞内pH值, 可提高化疗药物的细胞毒性, 体内试验证实泮托拉唑灌胃可提高阿霉素对裸鼠移植瘤的抗肿瘤疗效, 并可提高瘤体组织早期凋亡率和总凋亡率, 故泮托拉唑可提高胃癌细胞株对化疗药物的敏感性. 总之, PPIs有望在今后作为一种新型的化疗增敏剂和耐药逆转剂用于临床肿瘤化疗, 但其具体的机制尚不明确, 有待进一步证实.
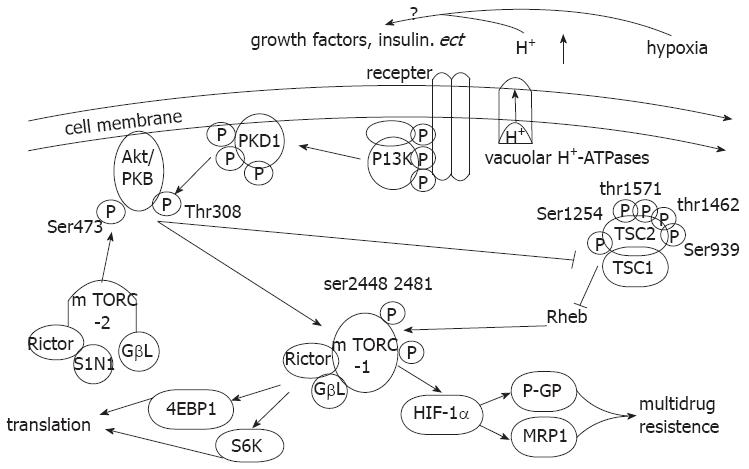
肿瘤作为一个相互作用的细胞群体, 瘤细胞与微环境之间存在密切的联系, 共同构成复杂的信号传递网络, 且PPIs可有效增强胃癌化疗药物的敏感性, 故需进一步证实PPIs与空泡型质子泵作用后如何通过胞内信号网络通路来逆转肿瘤多药耐药. 研究[38]证实胞外pH值的酸化可活化胞内磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路, 而泮托拉唑能使胞外pH值明显升高, 故可能对胞内该信号通路产生抑制作用. PI3K/Akt信号通路可调节细胞的生长、增殖, 促进凋亡和细胞骨架的形成[39-41]. 目前发现只有IA型PI3Ks与肿瘤的发生密切相关, 由催化亚基(P110)和调节亚基(P85)组成[41-43]. Akt(蛋白激酶B)位于PI3K的下游, 是逆转录病毒致癌基因v-Akt的细胞同系物, 是控制细胞存活和凋亡的关键分子, Akt的活化受到双重机制的调节, 包括Akt向细胞膜的易位和Thr308、Ser473的磷酸化. 结节性硬化复合物1/2(TSC1/2)属于抑癌基因[44], 位于Akt下游, 是PI3k/Akt信号通路重要的调控位点. 当Akt激活后, 磷酸化TSC2(Tuberin), 导致TSC1与TSC2解离, 而解除TSC1/2对Rheb(大脑中大量存在的一种Ras同源物)的抑制[45,46]. TSC2上被Akt磷酸化的位点在人类是Ser939和Thr1462, 而在果蝇则是Ser924和Thr1518[47-49]直接的生化研究数据证实TSC2在体外对Rheb具有GAP(GTP活化蛋白)活性, 同时TSC2在体内可调节Rheb-GTP的水平, 且证实Rheb是TSC2下游的直接靶点, 在mTOR(哺乳动物雷帕霉素靶蛋白)的上游发挥作用, 调节翻译和细胞增殖[45,50]. mTOR也是一种保守的丝/苏氨酸蛋白激酶, 作为一种重要的信号传导分子, 通过调节细胞周期, 蛋白质合成, 细胞能量代谢等多种途径发挥重要的生理功能, 在细胞增殖, 生长, 分化和凋亡过程中起着中心调控点的作用[51-54], 且主要发挥作用的是mTORC1[55](图1). 研究证实mTOR不仅是PI3K/Akt下游靶蛋白, 也是HIF-1α的上游关键调节分子[52,56]. 据Liu等[21]研究证实使用雷帕霉素可以抑制HIF-1α的表达, 故说明抑制mTOR表达可下调HIF-1α表达. 而目前研究[26]还证实泮托拉唑可抑制空泡型质子泵, HIF-1α, P-gp及MRP1的蛋白表达并改变胞内蛋白分布, 因此mTOR可能在其中起着重要的"中转站"作用[51,57]. 故在此推测, 泮托拉唑可能通过下调PI3K/Akt/mTOR信号通路来抑制HIF-1α, 而HIF-1α的下调可进一步抑制药物转运蛋白P-gp和MRP1的表达, 从而提高胞内化疗药物浓度进而逆转多药耐药. 因此有待进一步研究证实PPIs是否通过抑制空泡型质子泵改变胞内外pH值而影响PI3K/Akt/mTOR信号通路从而下调HIF-1α表达, 进而抑制P-gp及MRP1的表达, 逆转肿瘤多药耐药.
质子泵抑制剂可通过抑制空泡型质子泵的表达, 逆转肿瘤细胞内外pH梯度, 促使肿瘤细胞内酸化, 改变肿瘤细胞微环境, 同时抑制缺氧诱导因子HIF-1α、P-gp及MRP1的表达, 促进肿瘤细胞的凋亡, 提高肿瘤细胞对化疗药物的敏感性, 逆转肿瘤多药耐药. 故质子泵抑制剂有望成为一种新型的肿瘤化学治疗的佐剂, 但目前的研究尚处于细胞和动物水平, 还缺乏大量的临床试验研究. 同时肿瘤微环境形成的细胞内外pH值梯度可激活胞内PI3K/Akt信号通路, 为我们研究逆转肿瘤多药耐药提供了新思路[58,59]. 目前进一步研究肿瘤化疗多药耐药胞内信号转导途径, 摸清肿瘤多药耐药的根本经络对我们逆转肿瘤化疗多药耐药性, 改善患者预后将起到至关重要的作用.
酸化与缺氧是微环境的两大特征, 肿瘤细胞内无氧酵解生成大量H+, 但肿瘤细胞仍能维持胞内中性pH环境, 考虑与调节肿瘤泌酸功能的空泡型质子泵密切相关, 胞外pH值的酸化可能活化胞内PI3K/Akt信号通路, 活化mTOR, 上调HIF-1α, 进而促进P-gp及MRP1的表达产生胃癌化疗耐药.
曹秀峰, 教授, 南京医科大学附属南京第一医院肿瘤中心
PPIs可抑制空泡型质子泵的表达, 增加胃癌化疗的敏感性, 但目前具体的机制还不明确. PI3K/Akt/mTOR/HIF-1α信号通路与肿瘤的增殖, 转移和化疗耐药有着密切的关系, 急需进一步证实PPIs抑制空泡型质子泵逆转胃癌化疗耐药是通过PI3K/Akt/mTOR/HIF-1α信号通路发挥作用的.
mTOR是雷帕霉素的靶蛋白, 作为一种重要的信号传导分子, 在细胞增殖, 生长, 分化和凋亡过程中起着中心调控点的作用. 且研究证实mTOR不仅是PI3K/Akt下游靶蛋白, 也是HIF-1α的上游关键调节分子.
本文初步证实PPIs逆转胃癌细胞化疗多药耐药的机制是通过PI3K/Akt/mTOR/HIF-1α信号通路.
PPIs可通过抑制空泡型质子泵的表达, 提高肿瘤细胞对化疗药物的敏感性, 故有望成为一种新型的肿瘤化学治疗的佐剂; 同时肿瘤微环境形成的细胞内外pH值梯度可激活胞内PI3K/Akt信号通路, 为我们研究逆转肿瘤多药耐药提供了新思路.
MDR: 肿瘤化疗多药耐药, 即一种药物作用于肿瘤细胞使之产生耐药性后, 该肿瘤细胞逐渐对未接触过的、结构无关、作用靶点和机制不同的多种抗肿瘤药物也具有交叉耐药性, 影响着胃癌化疗的效果.
质子泵抑制剂有望成为一种新型的肿瘤化学治疗的佐剂, 同时肿瘤微环境形成的细胞内外pH值梯度可激活胞内PI3K/Akt信号通路, 本文为研究逆转肿瘤多药耐药提供了新思路, 学术价值很高.
编辑: 李军亮 电编:闫晋利
| 1. | Cunningham D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJ, Nicolson M, Scarffe JH, Lofts FJ, Falk SJ, Iveson TJ. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006;355:11-20. [PubMed] [DOI] |
| 2. | Liang XJ, Aszalos A. Multidrug transporters as drug targets. Curr Drug Targets. 2006;7:911-921. [PubMed] [DOI] |
| 3. | Gillet JP, Gottesman MM. Mechanisms of multidrug resistance in cancer. Methods Mol Biol. 2010;596:47-76. [PubMed] [DOI] |
| 4. | Kang HC, Kim IJ, Park JH, Shin Y, Ku JL, Jung MS, Yoo BC, Kim HK, Park JG. Identification of genes with differential expression in acquired drug-resistant gastric cancer cells using high-density oligonucleotide microarrays. Clin Cancer Res. 2004;10:272-284. [PubMed] [DOI] |
| 5. | DeClerck K, Elble RC. The role of hypoxia and acidosis in promoting metastasis and resistance to chemotherapy. Front Biosci. 2010;15:213-225. [PubMed] [DOI] |
| 6. | Fais S. Proton pump inhibitor-induced tumour cell death by inhibition of a detoxification mechanism. J Intern Med. 2010;267:515-525. [PubMed] [DOI] |
| 7. | Rauch C. Toward a mechanical control of drug delivery. On the relationship between Lipinski's 2nd rule and cytosolic pH changes in doxorubicin resistance levels in cancer cells: a comparison to published data. Eur Biophys J. 2009;38:829-846. [PubMed] [DOI] |
| 8. | Mahoney BP, Raghunand N, Baggett B, Gillies RJ. Tumor acidity, ion trapping and chemotherapeutics. I. Acid pH affects the distribution of chemotherapeutic agents in vitro. Biochem Pharmacol. 2003;66:1207-1218. [PubMed] [DOI] |
| 9. | Kung SK. Introduction of shRNAs into primary NK cells with lentivirus. Methods Mol Biol. 2010;612:233-247. [PubMed] [DOI] |
| 10. | Lugini L, Matarrese P, Tinari A, Lozupone F, Federici C, Iessi E, Gentile M, Luciani F, Parmiani G, Rivoltini L. Cannibalism of live lymphocytes by human metastatic but not primary melanoma cells. Cancer Res. 2006;66:3629-3638. [PubMed] [DOI] |
| 11. | Martínez-Zaguilán R, Raghunand N, Lynch RM, Bellamy W, Martinez GM, Rojas B, Smith D, Dalton WS, Gillies RJ. pH and drug resistance. I. Functional expression of plasmalemmal V-type H+-ATPase in drug-resistant human breast carcinoma cell lines. Biochem Pharmacol. 1999;57:1037-1046. [PubMed] [DOI] |
| 12. | Glunde K, Guggino SE, Solaiyappan M, Pathak AP, Ichikawa Y, Bhujwalla ZM. Extracellular acidification alters lysosomal trafficking in human breast cancer cells. Neoplasia. 2003;5:533-545. [PubMed] |
| 13. | Huber V, De Milito A, Harguindey S, Reshkin SJ, Wahl ML, Rauch C, Chiesi A, Pouysségur J, Gatenby RA, Rivoltini L. Proton dynamics in cancer. J Transl Med. 2010;8:57. [PubMed] [DOI] |
| 14. | Jefferies KC, Cipriano DJ, Forgac M. Function, structure and regulation of the vacuolar (H+)-ATPases. Arch Biochem Biophys. 2008;476:33-42. [PubMed] [DOI] |
| 15. | Pedersen PL. Transport ATPases: structure, motors, mechanism and medicine: a brief overview. J Bioenerg Biomembr. 2005;37:349-357. [PubMed] [DOI] |
| 16. | Sennoune SR, Luo D, Martínez-Zaguilán R. Plasmalemmal vacuolar-type H+-ATPase in cancer biology. Cell Biochem Biophys. 2004;40:185-206. [PubMed] [DOI] |
| 17. | Kubota S, Seyama Y. Overexpression of vacuolar ATPase 16-kDa subunit in 10T1/2 fibroblasts enhances invasion with concomitant induction of matrix metalloproteinase-2. Biochem Biophys Res Commun. 2000;278:390-394. [PubMed] [DOI] |
| 18. | You H, Jin J, Shu H, Yu B, De Milito A, Lozupone F, Deng Y, Tang N, Yao G, Fais S. Small interfering RNA targeting the subunit ATP6L of proton pump V-ATPase overcomes chemoresistance of breast cancer cells. Cancer Lett. 2009;280:110-119. [PubMed] [DOI] |
| 19. | Mizokami K, Kakeji Y, Oda S, Irie K, Yonemura T, Konishi F, Maehara Y. Clinicopathologic significance of hypoxia-inducible factor 1alpha overexpression in gastric carcinomas. J Surg Oncol. 2006;94:149-154. [PubMed] [DOI] |
| 20. | Brökers N, Le-Huu S, Vogel S, Hagos Y, Katschinski DM, Kleinschmidt M. Increased chemoresistance induced by inhibition of HIF-prolyl-hydroxylase domain enzymes. Cancer Sci. 2010;101:129-136. [PubMed] [DOI] |
| 21. | Liu L, Sun L, Zhang H, Li Z, Ning X, Shi Y, Guo C, Han S, Wu K, Fan D. Hypoxia-mediated up-regulation of MGr1-Ag/37LRP in gastric cancers occurs via hypoxia-inducible-factor 1-dependent mechanism and contributes to drug resistance. Int J Cancer. 2009;124:1707-1715. [PubMed] [DOI] |
| 22. | Semenza GL. HIF-1 and tumor progression: pathophysiology and therapeutics. Trends Mol Med. 2002;8:S62-S67. [PubMed] [DOI] |
| 23. | Rohwer N, Lobitz S, Daskalow K, Jöns T, Vieth M, Schlag PM, Kemmner W, Wiedenmann B, Cramer T, Höcker M. HIF-1alpha determines the metastatic potential of gastric cancer cells. Br J Cancer. 2009;100:772-781. [PubMed] [DOI] |
| 24. | Rohwer N, Dame C, Haugstetter A, Wiedenmann B, Detjen K, Schmitt CA, Cramer T. Hypoxia-inducible factor 1alpha determines gastric cancer chemosensitivity via modulation of p53 and NF-kappaB. PLoS One. 2010;5:e12038. [PubMed] [DOI] |
| 25. | Daskalow K, Rohwer N, Raskopf E, Dupuy E, Kühl A, Loddenkemper C, Wiedenmann B, Schmitz V, Cramer T. Role of hypoxia-inducible transcription factor 1alpha for progression and chemosensitivity of murine hepatocellular carcinoma. J Mol Med (Berl). 2010;88:817-827. [PubMed] [DOI] |
| 26. | Chen M, Zou X, Luo H, Cao J, Zhang X, Zhang B, Liu W. Effects and mechanisms of proton pump inhibitors as a novel chemosensitizer on human gastric adenocarcinoma (SGC7901) cells. Cell Biol Int. 2009;33:1008-1019. [PubMed] [DOI] |
| 27. | Aller SG, Yu J, Ward A, Weng Y, Chittaboina S, Zhuo R, Harrell PM, Trinh YT, Zhang Q, Urbatsch IL. Structure of P-glycoprotein reveals a molecular basis for poly-specific drug binding. Science. 2009;323:1718-1722. [PubMed] [DOI] |
| 28. | Shin JM, Sachs G. Pharmacology of proton pump inhibitors. Curr Gastroenterol Rep. 2008;10:528-534. [PubMed] [DOI] |
| 29. | De Milito A, Fais S. Proton pump inhibitors may reduce tumour resistance. Expert Opin Pharmacother. 2005;6:1049-1054. [PubMed] [DOI] |
| 30. | Luciani F, Spada M, De Milito A, Molinari A, Rivoltini L, Montinaro A, Marra M, Lugini L, Logozzi M, Lozupone F. Effect of proton pump inhibitor pretreatment on resistance of solid tumors to cytotoxic drugs. J Natl Cancer Inst. 2004;96:1702-1713. [PubMed] [DOI] |
| 31. | Spugnini EP, Citro G, Fais S. Proton pump inhibitors as anti vacuolar-ATPases drugs: a novel anticancer strategy. J Exp Clin Cancer Res. 2010;29:44. [PubMed] [DOI] |
| 32. | De Milito A, Canese R, Marino ML, Borghi M, Iero M, Villa A, Venturi G, Lozupone F, Iessi E, Logozzi M. pH-dependent antitumor activity of proton pump inhibitors against human melanoma is mediated by inhibition of tumor acidity. Int J Cancer. 2010;127:207-219. [PubMed] [DOI] |
| 33. | Sun-Wada GH, Wada Y. Vacuolar-type proton pump ATPases: roles of subunit isoforms in physiology and pathology. Histol Histopathol. 2010;25:1611-1620. [PubMed] |
| 34. | Toei M, Saum R, Forgac M. Regulation and isoform function of the V-ATPases. Biochemistry. 2010;49:4715-4723. [PubMed] [DOI] |
| 35. | McCarty MF, Whitaker J. Manipulating tumor acidification as a cancer treatment strategy. Altern Med Rev. 2010;15:264-272. [PubMed] |
| 36. | De Milito A, Fais S. Tumor acidity, chemoresistance and proton pump inhibitors. Future Oncol. 2005;1:779-786. [PubMed] [DOI] |
| 37. | Fais S, De Milito A, You H, Qin W. Targeting vacuolar H+-ATPases as a new strategy against cancer. Cancer Res. 2007;67:10627-10630. [PubMed] [DOI] |
| 38. | Rafiee P, Theriot ME, Nelson VM, Heidemann J, Kanaa Y, Horowitz SA, Rogaczewski A, Johnson CP, Ali I, Shaker R. Human esophageal microvascular endothelial cells respond to acidic pH stress by PI3K/AKT and p38 MAPK-regulated induction of Hsp70 and Hsp27. Am J Physiol Cell Physiol. 2006;291:C931-C945. [PubMed] [DOI] |
| 39. | Amin RM, Hiroshima K, Miyagi Y, Kokubo T, Hoshi K, Fujisawa T, Nakatani Y. Role of the PI3K/Akt, mTOR, and STK11/LKB1 pathways in the tumorigenesis of sclerosing hemangioma of the lung. Pathol Int. 2008;58:38-44. [PubMed] [DOI] |
| 40. | Liu JF, Zhou XK, Chen JH, Yi G, Chen HG, Ba MC, Lin SQ, Qi YC. Up-regulation of PIK3CA promotes metastasis in gastric carcinoma. World J Gastroenterol. 2010;16:4986-4991. [PubMed] [DOI] |
| 41. | Vivanco I, Sawyers CL. The phosphatidylinositol 3-Kinase AKT pathway in human cancer. Nat Rev Cancer. 2002;2:489-501. [PubMed] [DOI] |
| 43. | Simpson L, Parsons R. PTEN: life as a tumor suppressor. Exp Cell Res. 2001;264:29-41. [PubMed] [DOI] |
| 44. | van Slegtenhorst M, Nellist M, Nagelkerken B, Cheadle J, Snell R, van den Ouweland A, Reuser A, Sampson J, Halley D, van der Sluijs P. Interaction between hamartin and tuberin, the TSC1 and TSC2 gene products. Hum Mol Genet. 1998;7:1053-1057. [PubMed] [DOI] |
| 45. | Huang J, Manning BD. The TSC1-TSC2 complex: a molecular switchboard controlling cell growth. Biochem J. 2008;412:179-190. [PubMed] [DOI] |
| 46. | Urano J, Sato T, Matsuo T, Otsubo Y, Yamamoto M, Tamanoi F. Point mutations in TOR confer Rheb-independent growth in fission yeast and nutrient-independent mammalian TOR signaling in mammalian cells. Proc Natl Acad Sci U S A. 2007;104:3514-3519. [PubMed] [DOI] |
| 47. | Dan HC, Sun M, Yang L, Feldman RI, Sui XM, Ou CC, Nellist M, Yeung RS, Halley DJ, Nicosia SV. Phosphatidylinositol 3-kinase/Akt pathway regulates tuberous sclerosis tumor suppressor complex by phosphorylation of tuberin. J Biol Chem. 2002;277:35364-35370. [PubMed] [DOI] |
| 48. | Manning BD, Tee AR, Logsdon MN, Blenis J, Cantley LC. Identification of the tuberous sclerosis complex-2 tumor suppressor gene product tuberin as a target of the phosphoinositide 3-kinase/akt pathway. Mol Cell. 2002;10:151-162. [PubMed] [DOI] |
| 49. | Inoki K, Li Y, Zhu T, Wu J, Guan KL. TSC2 is phosphorylated and inhibited by Akt and suppresses mTOR signalling. Nat Cell Biol. 2002;4:648-657. [PubMed] [DOI] |
| 50. | Nobukini T, Thomas G. The mTOR/S6K signalling pathway: the role of the TSC1/2 tumour suppressor complex and the proto-oncogene Rheb. Novartis Found Symp. 2004;262:148-154; discussion 154-159, 265-268. [PubMed] |
| 51. | Caron E, Ghosh S, Matsuoka Y, Ashton-Beaucage D, Therrien M, Lemieux S, Perreault C, Roux PP, Kitano H. A comprehensive map of the mTOR signaling network. Mol Syst Biol. 2010;6:453. [PubMed] [DOI] |
| 52. | Advani SH. Targeting mTOR pathway: A new concept in cancer therapy. Indian J Med Paediatr Oncol. 2010;31:132-136. [PubMed] [DOI] |
| 53. | Segerström L, Baryawno N, Sveinbjörnsson B, Wickström M, Elfman L, Kogner P, Inge Johnsen J. Effects of small molecule inhibitors of PI3K/Akt/mTOR signaling on neuroblastoma growth in vitro and in vivo. Int J Cancer. 2011;129:2958-2965. [PubMed] [DOI] |
| 54. | Sudarsanam S, Johnson DE. Functional consequences of mTOR inhibition. Curr Opin Drug Discov Devel. 2010;13:31-40. [PubMed] |
| 55. | Pollizzi K, Malinowska-Kolodziej I, Stumm M, Lane H, Kwiatkowski D. Equivalent benefit of mTORC1 blockade and combined PI3K-mTOR blockade in a mouse model of tuberous sclerosis. Mol Cancer. 2009;8:38. [PubMed] [DOI] |
| 56. | Wouters BG, Koritzinsky M. Hypoxia signalling through mTOR and the unfolded protein response in cancer. Nat Rev Cancer. 2008;8:851-864. [PubMed] [DOI] |
| 57. | Borders EB, Bivona C, Medina PJ. Mammalian target of rapamycin: biological function and target for novel anticancer agents. Am J Health Syst Pharm. 2010;67:2095-2106. [PubMed] [DOI] |
| 58. | Emerling BM, Akcakanat A. Targeting PI3K/mTOR Signaling in Cancer. Cancer Res. 2011; Oct 10. [Epub ahead of print]. [PubMed] |
| 59. | Zhou Q, Lui VW, Yeo W. Targeting the PI3K/Akt/mTOR pathway in hepatocellular carcinoma. Future Oncol. 2011;7:1149-1167. [PubMed] [DOI] |