修回日期: 2011-10-20
接受日期: 2011-10-26
在线出版日期: 2011-10-28
目的: 探讨EB病毒(Epstein-Barr virus, EBV)感染相关胃癌的构成比, 其淋巴结转移癌的感染状况、临床病理特征及与血管生成的关系.
方法: 用原位杂交法检测胃癌组织中EBV编码的小RNA(EBERs), 分析EB病毒相关胃癌的病理形态、患者年龄、性别、淋巴结转移状况等临床特征; 用免疫组织化学EnVision法检测血管生成(即血管内皮生长因子(vascular endothelial growth factor, VEGF)蛋白的表达水平, 分析EBV和血管生成在胃癌的表达与患者淋巴结转移状态、Lauren's分型等的关系及其相互关系.
结果: 486例胃癌患者中检测出感染EB病毒者(n = 18, 3.7%). 该病毒位于肿瘤细胞核内; 14例EB病毒相关胃癌患者中(77.8%)伴淋巴结转移癌, 其中所有癌细胞均表达EBERs; 与非EB病毒感染胃癌相比, EB病毒相关胃癌分化程度低(P<0.05), 而临床TNM分期无明显差别(P>0.05); 血管生成在胃癌组织中的表达率(28.2%, 137/486); 血管生成与患者淋巴结转移状态, TNM分期相关(P<0.05); 同时, 血管生成与EBV感染胃癌二者之间呈正相关(r = 0.088, P = 0.001).
结论: EB病毒独立存在于胃癌及其淋巴结转移癌细胞核中; EB病毒相关胃癌具有独特的临床病理特征; 胃癌组织中的血管生成对判断EBV感染胃癌的恶性程度和估计预后有一定意义.
引文著录: 何影娟, 白光辉, 郭云娣. EB病毒感染与血管生成在胃癌组织芯片中的关系. 世界华人消化杂志 2011; 19(30): 3172-3176
Revised: October 20, 2011
Accepted: October 26, 2011
Published online: October 28, 2011
AIM: To evaluate the characteristics of Epstein-Barr virus (EBV)-associated gastric cancer and to explore the correlation between EBV infection and tumor angiogenesis in patients with gastric carcinoma.
METHODS: EBV infection was examined by localizing EBV-encoded small RNAs (EBERs) using in situ hybridization. Tumor angiogenesis was evaluated by examining the expression of VEGF protein using immunohistochemistry and tissue microarray technique. The association of EBV infection with clinicopathological parameters, including age, gender, tumor type, lymph node metastasis, and tumor stage, was analyzed. The correlation of VEGF expression with lymph node metastasis and Lauren's classification was also analyzed.
RESULTS: Among 486 patients, 18 showed nuclear expression of EBV. EBV staining was seen only in tumor cells. 14 of 18 patients with EBV-associated gastric cancer had regional lymph node metastasis. Of note, metastatic tumor cells in all of the involved lymph nodes contained EBV. EBER-positive gastric carcinomas tended to have lymphoid stroma (17/18) and were mostly poorly differentiated type (P<0.05). There was no significant difference in TNM stage between EBV-positive and -negative carcinomas (P>0.05). The positive rate of VEGF protein expression was 28.2% (137/486). Angiogenesis was significantly associated with lymph node metastasis and TNM stage (both P<0.05). EBV infection was closely correlated with angiogenesis (r = 0.119, P = 0.009).
CONCLUSION: EBV is present exclusively in gastric cancer cells and tumor cells in all of the lymph nodes involved. EBV-positive gastric cancer has distinct clinicopathological features. Angiogenesis may be a good predictor of metastasis and prognosis of gastric carcinoma in patients with EBV-associated gastric cancer.
- Citation: He YJ, Bai GH, Guo YD. Correlation between Epstein-Barr virus infection and tumor angiogenesis in patients with gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(30): 3172-3176
- URL: https://www.wjgnet.com/1009-3079/full/v19/i30/3172.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i30.3172
Epstein. Barr Virus(EBV)属于疱疹病毒科g疱疹病毒亚科成员, 广泛分布于世界各地, 是最早发现的与人类肿瘤存在明显病因关系的病毒. 近年来有学者报道EBV感染与胃癌之间有一定的关系[1-4], 并发现大多数淋巴上皮瘤样胃癌和少部分胃腺癌组织中均检测到EBV基因组的存在, 因此EBV感染与胃癌的发生发展存在某种相关性[4,5]. 肿瘤血管生成在恶性肿瘤的发生、发展过程中起重要作用. 迄今为止学者们已描述了多种促血管生成及抗血管生成因子, 其中最重要的是血管内皮生长因子(vascular endothelial growth factor, VEGF)[6,7], 此种糖蛋白能刺激内皮细胞增殖、阻止新生血管退化、增加微血管通透性. Shi等[8]研究发现, 胃癌组织中VEGF的表达预示增高的肿瘤转移风险和差的预后, 而EBV感染胃癌即EBV相关胃癌组织中VEGF蛋白的表达及其相关功能报道较少. 我们通过检测486例胃癌组织中EBV和VEGF的表达探讨其相互关系及临床意义.
收集2000/01/01-2010/12/31住院患者手术切除胃癌标本(n = 486), 患者男性(n = 357), 女性(n = 129); 年龄22-85(中位年龄63)岁. 所有标本均经2位病理专家进行组织病理证实, 患者术前均未进行放疗和化疗. EBERs原位杂交检测试剂盒购于福建泰普生物科学有限公司. VEGF一抗及二抗均购自福州迈新公司. 常规石蜡包埋、切片, 采用Envision免疫组织化学法进行染色, 以PBS液代替一抗作为阴性对照, 以试剂公司提供的阳性对照片作为阳性对照.
1.2.1组织芯片的构建: 组织标本经4%的甲醛固定、常规石蜡包埋制片, HE染色后, 在显微镜下定位、对应找出蜡块上相应部位并做标记, 选取无坏死的肿瘤组织. 自制10×16(6个蜡块, 每个蜡块75例x2点)和10×9(1个蜡块, 40例x2点)的组织阵列蜡块(每例组织块取2个组织芯, 其直径为1.6 mm), 其中1列的特定部位为已知EB病毒阳性的鼻咽癌组织1-2例及正常胃组织1-2例作为芯片的自身对照. 共收集肿瘤组织(n = 489), 其中未取到肿瘤组织(n = 3), 予以剔除, 胃癌芯片有效组织(n = 486).
1.2.2 结果判定: EBV原位杂交染色结果判断标准: 仅细胞核着棕褐色为阳性; 细胞质和细胞膜在核分裂时可以有阳性着色, 但视为阴性. VEGF阳性表达于肿瘤细胞质, 呈现棕黄色颗粒为阳性信号. 结果判定方法按照Fromovitz[9]方法: 表达强度由染色深度(A)及阳性细胞百分比(B)共同评分. A: 阳性细胞染色深度按无着色、淡黄色、棕黄色、棕褐色分别计0、1、2、3分; B: 阳性细胞所占百分比按:阳性细胞数≤5%、5%-25%、25%-50%、50%-75%、>75%分别计0、1、2、3、4分. A+B即为免疫组化评分, 评分≥4者为阳性, <4者为阴性.
统计学处理 所有实验数据均采用SPSS13.0软件分析. 组间差异比较采用c2检验, 采用Spearman等级相关分析胃癌组织中EBV和VEGF表达的相互关系. P<0.05为差异有统计学意义.
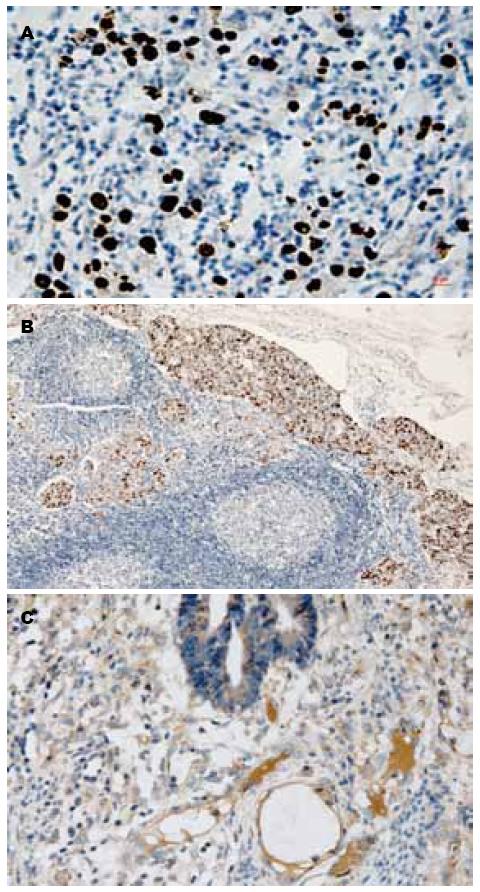
原位杂交EBERs染色的棕褐色颗粒只显示在肿瘤细胞核中, 正常胃黏膜、肠上皮化生腺体及间质细胞或淋巴滤泡等炎细胞均未见阳性细胞核染色. 胃癌患者(n = 486)中, EB病毒阳性表达者(n = 18), 占所有胃癌的3.7%, 包括进展期胃癌(n = 17), 早期胃癌(n = 1); 年龄34-84(中位年龄58.5)岁. 大体病理特征: 肿瘤位于贲门(n = 6)、胃体(n = 7)、胃窦(n = 5); 肿瘤大体类型: 溃疡性(n = 14)、蕈伞型(n = 2)、浸润型(n = 2); 肿瘤直径2-9 cm; 肿瘤局部淋巴结有转移者数目为2-14枚不等. 按Lauren分型: 弥漫及混合型(n = 16)、肠型(n = 2); 本组同时检测了EB病毒感染胃癌患者(n = 14)的淋巴结转移癌情况, 发现所有淋巴结转移癌细胞核均表达EBERs, 而作为对照的随机抽取的10例淋巴结转移癌患者中未检测到EBERs表达(图1).
486例胃癌中VEGF的阳性表达率为28.2%(图1).
486例胃癌中, EBV和VEGF与患者的年龄、性别、肿瘤浸润深度阳性表达均无关(P>0.05), EBV感染胃癌与Lauren分型、肿瘤分化程度相关(P<0.05); VEGF的表达与肿瘤淋巴结转移、TNM分期密切相关(P<0.05, 表1).
| 临床病理参数 | n | VEGF阳性 | EBV阳性 | ||||
| n | χ2值 | P值 | n | χ2值 | P值 | ||
| 年龄(岁) | |||||||
| <65 | 267 | 82 | 12 | ||||
| ≥65 | 219 | 55 | 1.862 | 0.172 | 6 | 1.039 | 0.308 |
| 性别 | |||||||
| 男 | 357 | 104 | 16 | ||||
| 女 | 129 | 33 | 0.590 | 0.442 | 2 | 2.283 | 0.131 |
| 分化程度 | |||||||
| 高、中分化 | 255 | 74 | 1 | ||||
| 低分化 | 231 | 63 | 0.183 | 0.669 | 17 | 16.496 | 0.000 |
| 淋巴结转移 | |||||||
| 无 | 354 | 28 | 4 | ||||
| 有 | 132 | 109 | 4.358 | 0.037 | 14 | 0.230 | 0.631 |
| 浸润深度 | |||||||
| 肌层 | 87 | 23 | 3 | ||||
| 浆膜及外 | 399 | 114 | 0.161 | 0.688 | 15 | 0.019 | 0.889 |
| Lauren's分型 | |||||||
| 肠型 | 255 | 75 | 2 | ||||
| 弥漫及混合型 | 231 | 62 | 0.396 | 0.529 | 16 | 12.820 | 0.000 |
| TNM分期 | |||||||
| Ⅰ/Ⅱ期 | 167 | 37 | 5 | ||||
| Ⅲ/Ⅳ期 | 319 | 100 | 4.576 | 0.032 | 13 | 0.359 | 0.549 |
Spearman等级相关分析结果显示, 18例EBV阳性胃癌中VEGF全部阳性, EBV和VEGF在胃癌中的表达呈正相关(r = 0.119, P = 0.009).
EBV是一种全球分布、人群感染率很高的g疱疹病毒(属DNA病毒). 20岁以上超过95%的人群存在EB病毒感染, 并常终身潜伏[2]; 原发性感染多发生在儿童期, 常表现为隐性感染; 若原发性感染发生在成年人, 可导致传染性单核细胞增多症[3]. 同时, EBV也涉及许多良、恶性肿瘤的发病机制, 如鼻咽癌、Hodgkin淋巴瘤、Burkitt淋巴瘤等. 1990年, Burke首次报道用PCR技术在胃癌组织中检测出EBV, 其病理形态是一类伴有淋巴样间质的特殊胃癌类型.
原位杂交方法被公认为是在石蜡包埋组织切片中检测EB病毒的金标准[4,10-12]. 本组实验用此方法在已构建好的486例原发胃癌组织芯片中检测出棕褐色的EBERs颗粒, 该阳性颗粒只存在于胃癌细胞核中, 正常胃黏膜上皮、肠上皮化生腺体及间质均呈阴性表达. 18例EBV感染胃癌所有癌细胞核及其转移的淋巴结癌细胞核中也均呈阳性表达, 提示EB病毒与肿瘤细胞复制同时存在[13]. 这种在恶性肿瘤细胞中EBERs呈全或无的表达支持EB病毒感染可能是EB病毒相关胃癌发生、发展及转移的早期事件[4,14]. EBV感染胃癌占胃癌的3.6%, 而韩静等[15]的研究显示, 中国广州地区的鼻咽癌高发区EB病毒相关胃癌的构成比是6.4%, 而苏州地区的非鼻咽癌高发区其EB病毒感染胃癌的发病率也很低, 由此推测EB病毒感染有一定的地域性[12].
本研究证明, 与非EB病毒感染性胃癌相比, EBV感染胃癌的组织学类型以弥漫型为主、分化程度低. 显微镜下观察HE染色切片, 将其大致分为4种组织结构, 包括: 淋巴上皮样型, 表现为肿瘤细胞巢缺乏腺体结构, 细胞呈片状排列, 间质可见大量淋巴细胞样细胞或淋巴滤泡结构, 肿瘤周围正常黏膜中也可见淋巴细胞和淋巴滤泡; 条带或网状型, 表现为肿瘤细胞呈连续的线状、条带或网状排列; 小细胞巢状、未分化型以及腺样结构型, 即腺体相互吻合. 进一步的观察显示: 肿瘤细胞中等大小或呈小细胞状, 细胞质红染或几乎无胞质, 细胞核淡染, 核膜清楚, 核染色质呈细颗粒状, 偶见多个核仁; 小细胞的细胞核深染, 核分裂少见.
目前研究发现, VEGF在正常人多种组织中不表达或少量表达, 而在恶性肿瘤组织中常过量表达, 并以自分泌或旁分泌作用于肿瘤细胞,与多种肿瘤的转移、预后及复发相关[16]. 本实验中VEGF阳性表达率为28.2%, 与胃癌临床分期呈正相关, 同时与淋巴结转移相关, 进一步验证了VEGF是促癌因子这一假设. 18例EBV感染胃癌患者中VEGF全部阳性, EBV和VEGF在胃癌中的表达呈正相关, 这就提示了VEGF可能作为胃癌肿瘤侵袭性的一个有用的生物指标, 包括EBV感染胃癌. 这一结果与Kang[17]的研究结果相一致. VEGF免疫组化在EBV感染胃癌细胞及间质血管内皮细胞弥漫阳性, 提示EBV感染胃癌中有增多的血管供应并反映了增高的转移能力. 肿瘤形成血管前, 肿瘤细胞很少进入全身血液循环, 新生的肿瘤血管有增加的长度、直径和不完整的内皮细胞层和基底膜, 其形状不规则, 且易于出血和/或血栓形成, 进而使肿瘤细胞进入循环系统. 所谓的血管生成开关依赖于肿瘤正阳性和负性血管生成物质的静平衡, 而EBV感染胃癌患者几乎全为VEGF阳性, 其中VEGF在EBV感染胃癌中有可能发挥着关键的正性调节作用.
总之, EB病毒感染胃癌具有独特的临床病理特征; VEGF是血管生成中的很重要的环节, 对判断胃癌包括EBV感染胃癌的恶性程度和估计预后有一定意义. 但目前还需要更多的前瞻性研究去确认VEGF在胃癌, 特别是在EBV感染胃癌中所起的作用.
EBV属于疱疹病毒科γ疱疹病毒亚科, 广泛分布于世界各地, 是最早发现的与人类肿瘤存在明显病因关系的病毒. 近年来有学者报道EBV感染与胃癌之间有一定的关系, 并在胃腺癌组织中检测到EBV基因组的存在, 因此EBV感染与胃癌的发生发展存在某种相关性, 而肿瘤血管生成在胃癌发生、发展过程中所起的作用研究尚少.
杨江华, 副教授, 安徽省芜湖市皖南医学院弋矶山医院感染科
一项纳入15 952例胃癌患者的荟萃分析显示, "EB病毒阳性胃癌可能具独特意义". VEGF在EBV相关性胃癌的血管微环境中起着非常重要的作用, 而EBV相关性胃癌的发病机制尚未研究清楚.
Kang等研究发现, VEGF在EBV相关性胃癌的血管微环境中起着非常重要的作用.
EBV表达阳性的胃癌可能具有独特的临床意义,为以后病因治疗提供依据.
文章有一定程度的科学性、创新性和可读性.
编辑: 李军亮 电编:何基才
| 2. | Fukayama M, Hino R, Uozaki H. Epstein-Barr virus and gastric carcinoma: virus-host interactions leading to carcinoma. Cancer Sci. 2008;99:1726-1733. [PubMed] [DOI] |
| 3. | Thompson MP, Kurzrock R. Epstein-Barr virus and cancer. Clin Cancer Res. 2004;10:803-821. [PubMed] [DOI] |
| 4. | Ryan JL, Morgan DR, Dominguez RL, Thorne LB, Elmore SH, Mino-Kenudson M, Lauwers GY, Booker JK, Gulley ML. High levels of Epstein-Barr virus DNA in latently infected gastric adenocarcinoma. Lab Invest. 2009;89:80-90. [PubMed] [DOI] |
| 5. | Herath CH, Chetty R. Epstein-Barr virus-associated lymphoepithelioma-like gastric carcinoma. Arch Pathol Lab Med. 2008;132:706-709. [PubMed] |
| 6. | Hoeben A, Landuyt B, Highley MS, Wildiers H, Van Oosterom AT, De Bruijn EA. Vascular endothelial growth factor and angiogenesis. Pharmacol Rev. 2004;56:549-580. [PubMed] [DOI] |
| 8. | Shi H, Xu JM, Hu NZ, Xie HJ. Prognostic significance of expression of cyclooxygenase-2 and vascular endothelial growth factor in human gastric carcinoma. World J Gastroenterol. 2003;9:1421-1426. [PubMed] |
| 9. | Fromowitz FB, Viola MV, Chao S, Oravez S, Mishriki Y, Finkel G, Grimson R, Lundy J. ras p21 expression in the progression of breast cancer. Hum Pathol. 1987;18:1268-1275. [PubMed] [DOI] |
| 10. | Gulley ML, Tang W. Laboratory assays for Epstein-Barr virus-related disease. J Mol Diagn. 2008;10:279-292. [PubMed] [DOI] |
| 11. | Gulley ML. Molecular diagnosis of Epstein-Barr virus-related diseases. J Mol Diagn. 2001;3:1-10. [PubMed] [DOI] |
| 12. | Middeldorp JM, Brink AA, van den Brule AJ, Meijer CJ. Pathogenic roles for Epstein-Barr virus (EBV) gene products in EBV-associated proliferative disorders. Crit Rev Oncol Hematol. 2003;45:1-36. [PubMed] [DOI] |
| 13. | Truong CD, Feng W, Li W, Khoury T, Li Q, Alrawi S, Yu Y, Xie K, Yao J, Tan D. Characteristics of Epstein-Barr virus-associated gastric cancer: a study of 235 cases at a comprehensive cancer center in U.S.A. J Exp Clin Cancer Res. 2009;28:14. [PubMed] [DOI] |
| 14. | Lee HS, Chang MS, Yang HK, Lee BL, Kim WH. Epstein-barr virus-positive gastric carcinoma has a distinct protein expression profile in comparison with epstein-barr virus-negative carcinoma. Clin Cancer Res. 2004;10:1698-1705. [PubMed] [DOI] |
| 16. | Wu TT, Wang JS, Jiann BP, Yu CC, Tsai JY, Lin JT, Huang JK. Expression of vascular endothelial growth factor in Taiwanese benign and malignant prostate tissues. J Chin Med Assoc. 2007;70:380-384. [PubMed] [DOI] |
| 17. | Kang J, Ko Y, Roh S, Hong S, Lee M, Chae H. Both VEGF and bFGF play an important role in distinctive angiogenic feature of microenvirnment surrounding EBV positive gastric cancer. J Clin Oncol. 2008;26:15551. |