修回日期: 2010-11-25
接受日期: 2010-12-01
在线出版日期: 2011-01-28
目的: 观察β-catenin在结直肠传统锯齿状腺瘤(TSA)、普通腺瘤及腺癌中的免疫组织化学表达及外显子3基因突变, 分析β-catenin与锯齿状腺瘤癌变的关系及意义.
方法: 收集TSA30例, 管状腺瘤/绒毛管状腺瘤(TA/VTA)20例, 结直肠腺癌(CRC)21例, 应用免疫组织化学方法检测β-catenin在病变组织中的表达情况; 选取细胞质/核表达阳性的TSA 8例、TA 6例、VA 5例及CRC 10例进行了β-catenin外显子3突变的检测.
结果: 免疫组织化学结果显示β-catenin在TSA中的表达阳性率为76.6%(23/30), TA/VTA中70.0%(14/20), CRC中为95.2%(20/21); β-catenin在3种病变中的表达具有显著差异(P = 0.000), 对其进行两两比较后发现β-catenin在TSA(23/30)中的表达与TA/VTA组(14/20)之间无显著性差异(P>0.05), 与CRC(20/21)之间有显著性差异(P<0.05); 随着TSA及普通腺瘤异型增生程度增加, β-catenin表达阳性率增高, 异型增生程度与β-catenin阳性率呈正相关, 差异有统计学意义(TSA: P<0.01; TA/VTA: P<0.05). 基因测序结果显示TSA、TA/VTA、CRC均未检测到外显子3的突变.
结论: β-catenin在TSA的异常表达随异型增生程度增加而表达增加. β-catenin蛋白水平的异常表达与外显子3基因突变不同步. β-catenin在锯齿状腺瘤癌变的过程中有促进肿瘤进展的作用.
引文著录: 代小娟, 王鲁平, 韩英, 王瑾. β-catenin在锯齿状腺瘤中的蛋白表达及基因突变. 世界华人消化杂志 2011; 19(3): 262-267
Revised: November 25, 2010
Accepted: December 1, 2010
Published online: January 28, 2011
AIM: To investigate the protein expression of β-catenin and the mutations in exon 3 of the β-catenin gene in colorectal traditional serrated adenoma (TSA), conventional adenoma (TA/VTA) and colorectal carcinoma (CRC), and to analyze the relationship between β-catenin expression and the carcinogenesis of TSA.
METHODS: Thirty TSA specimens, 20 TA/VTA specimens, and 21 CRC specimens were collected. The protein expression of β-catenin was detected by immunohistochemical staining. β-catenin exon 3 mutations were detected by sequencing DNA from β-catenin-positive TSA (8 cases), TA (6 cases), VTA (5 cases), and CRC (10 cases) specimens.
RESULTS: There are significant differences in the positive rates of β-catenin expression among TSA, TA/VTA and CRC (P = 0.000). No significant difference was noted in the positive rate of β-catenin expression between TSA and TA/VTA (P > 0.05) though a significant difference was found between TSA and CRC (P < 0.05). The degree of dysplasia in both TSA and TA/VTA was correlated with the positive rate of β-catenin expression (TSA: P < 0.01; TA/VTA: P < 0.05). No β-catenin exon 3 mutations were detected in TSA, TA/VTA or CRC.
CONCLUSION: Abnormal expression of β-catenin is related to the degree of dysplasia in TSA. β-catenin may play a role in the neoplastic progression of TSA.
- Citation: Dai XJ, Wang LP, Han Y, Wang J. Protein expression and gene mutations of β-catenin in colorectal serrated adenoma. Shijie Huaren Xiaohua Zazhi 2011; 19(3): 262-267
- URL: https://www.wjgnet.com/1009-3079/full/v19/i3/262.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i3.262
继结直肠腺瘤-癌顺序癌变(adenoma-carcinoma procedure of carcinogenesis, APC)通路外, 近年来锯齿状癌变通道已为结直肠癌第二通路. 一般认为锯齿状癌变通路主要分子遗传学改变包括: (1)BRAF基因突变; (2)CpG岛甲基化现象(island methylation phenomenon, CIMP); (3)微卫星不稳定性(microsatellite instability, MSI)表达[1-3]. 新近在研究锯齿状腺瘤癌变的途径中发现结肠癌突变基因(mutation gene of colon cancer, MCC)联合β-catenin, 抑制Wnt信号转导的新结直肠癌变通路, 目前该通路与锯齿状病变癌变的关系尚不很清楚[4-7]. 本文观察30例传统锯齿状腺瘤(traditional serrated adenoma, TSA), 20例普通腺瘤及21例浸润性腺癌β-catenin的免疫组织化学表达及其外显子3突变的情况, 重点观察β-catenin在TSA中的表达和突变情况以及与异型增生分级的关系, 并比较TSA与普通腺瘤及腺癌有否差异, 旨在探讨β-catenin与锯齿状癌变的关系.
收集中国人民解放军252医院、河北省巨鹿县医院病理科2003-01/2008-01病理诊断为结直肠腺瘤及息肉的切片共1 685例, 从中筛选出腺体以锯齿状结构为特征的病变91例; 由专长胃肠病理诊断的高年资医师根据WHO及文献[8-11]标准进行2-3轮病理组织学诊断分类, 将锯齿状病变分为增生性息肉(hyperplastic polyps, HP)、广基锯齿状腺瘤(sessile serrated adenoma, SSA)、传统锯齿状腺瘤(traditional serrated adenoma, TSA)、混合性锯齿状息肉/腺瘤、混合性锯齿状/管状腺瘤. 从中筛选出TSA 30例. 随机抽取病理诊断为结直肠管状腺瘤(tubular adenoma, TA), 绒毛管状腺瘤(tubulovillous adenoma, VTA)20例, 结直肠腺癌(colorectal carcinoma, CRC)21例, 将各类腺瘤按异型增生程度分为轻中重度异型增生. 应用β-catenin单克隆抗体(CAT-5H10)对30例TSA、20例TA及VTA、21例CRC进行免疫组织化学染色. 并对8例TSA、6例TA、5例VTA及10例CRC进行β-catenin基因外显子3的突变检测.
1.2.1 免疫组织化学方法: 标本经40 g/L中性甲醛固定, 常规石蜡包埋, 行4 μm厚的连续切片, 免疫组织化学采用MaxVision即用型染色方法: 常规脱蜡、脱水, 加入一抗后室温放置2 h, PBS液浸泡3次, 加二抗(通用型)室温孵育20 min, DAB显色, 苏木素染色. β-catenin单克隆抗体购自福州迈新生物技术有限公司.
1.2.2 β-catenin基因的提取及外显子3的突变检测: (1)DNA提取: 采用德国QIAamp DNA FFPE试剂盒从石蜡包埋的组织中按说明书提取DNA, 具体步骤: 将蜡块切成10 μm的切片(3片), 加入1 mL的二甲苯, 封闭并剧烈摇晃10 s, 室温放置15 min, 重复1次; 高速离心2 min, 用吸管移除上清液, 加入1 mL的酒精(96%-100%), 摇晃, 室温放置5 min, 重复1次; 室温下高速离心2 min, 用吸管移除上清液; 37 ℃孵育10 min, 直到残留的酒精全部蒸发; 加入180 μL的ATL缓冲液并加入20 μL的蛋白酶K, 剧烈摇晃混匀; 56 ℃孵育1 h; 90 ℃孵育1 h; 将滴液转移到1.5 mL的离心管中, 在样品中加入200 μL的AL缓冲液, 振荡并充分混匀, 再加入200 μL的酒精(100%), 振荡并充分混匀; 将滴液转移到1.5 mL的离心管中; 将整个溶解产物转移到QIAamp MinElute柱中(2 mL的管), 以6 000-8 000 r/min离心1 min; 将QIAamp MinElute柱放置到2 mL的管中, 弃去包含有液体的收集管, 加入500 μL的AW1缓冲液, 6 000-8 000 r/min离心1 min; 将QIAamp MinElute柱放置到2 mL的管中, 弃去包含有液体的收集管. 小心打开离心柱, 加入500 μL的AW2缓冲液, 6 000-8 000 r/min离心1 min, 将QIAamp MinElute 柱放置到2 mL的管中; 高速离心(20 000-14 000 r/min)3 min使膜完全烘干, 将离心柱放置到1.5 mL的离心管中, 弃去含有液体的收集管; 小心打开离心柱并向膜的中心加入20-100 μL的ATE缓冲液, 室温下孵育1 min, 高速20 000-14 000 r/min离心1 min; 离心后的液体即为提取的DNA, 并用紫外分光光度仪测其浓度; (2)引物序列及引物合成: 引物根据参考文献[12]获取引物序列: 上游引物5'-TAACATTTCCAATCTACTAATGC-3', 下游引物5'-AGCTACTTGTTCTTGAGTGAAG-3', 扩增的片段长度为272 bp; 引物由上海英俊生物有限技术公司合成; (3)PCR反应及电泳: PCR反应试剂盒PrimeSTARTM HS(Premix)购自日本TaKaRa公司. 反应体系为50 μL, Premix 25 μL, 模板DNA 1 μL, 引物1 1 μL, 引物2 1 μL, 灭菌蒸馏水22 μL. 反应条件: 热启动95 ℃ 5 min; 变性: 94 ℃ 1 min; 退火: 57.6 ℃ 1 min; 延伸: 72 ℃ 1 min, 共35个循环; 继续延伸: 72 ℃ 7 min. 取扩增产物7.5 μL与1.5 μL上样缓冲液混合, 在2%琼脂糖胶上电泳, 电压80 V, 30 min后在凝胶成像仪上扫描, 记录结果, 凝胶电泳在270 bp处可见一亮条带, 与引物序列一致, 扩增成功; (3)测序: 将PCR产物送上海英俊生物技术公司进行测序. 测序引物序列与PCR反应的引物序列相同, 方法是终止法, 测序仪器为ABI公司的3730, 用axygen胶回收试剂盒经过切胶纯化, 测序的试剂盒是ABI公司的BigDyerRXTerminTMV3.1. 测序图通过Chromas软件打开, 并通过PubMed的BLAST功能与GenBank的全基因序列进行对照.
1.2.3 免疫组织化学及基因突变结果判断: (1)免疫组织化学结果判定: 按照Maruyama等[13]方法, 分别从细胞膜、细胞质、细胞核3方面判断β-catenin在细胞内的分布特征: 细胞膜阳性表达细胞率>70%为正常表达, 反之为表达减弱或缺失; 胞质或胞核阳性表达细胞率>10%定为异位表达; 细胞膜表达减弱或缺失及异位表达统称为异常表达. 其中正常表达记作阴性(-), 异常表达记作阳性(+); 异常表达进一步根据其染色强度分为3个等级: 染色呈淡黄色为染色弱, 记作(+); 染色呈黄色者为染色中等, 记作(++); 染色呈棕黄色者为染色强, 记作(+++); (2)β-catenin基因外显子3的突变检测测序结果判断: 观察测序的峰图有无双峰, 对于基线无杂波, 看见明显的呈双峰的图像即为突变, 通过PubMed的基因库, 对所测序列进行BLAST, 如有突变进一步分析突变的位点及突变的具体类型.
统计学处理 采用SPSS16.0统计软件进行统计分析, 免疫组织化学的结果采用Fisher确切概率法进行统计, P<0.05差异有显著性.
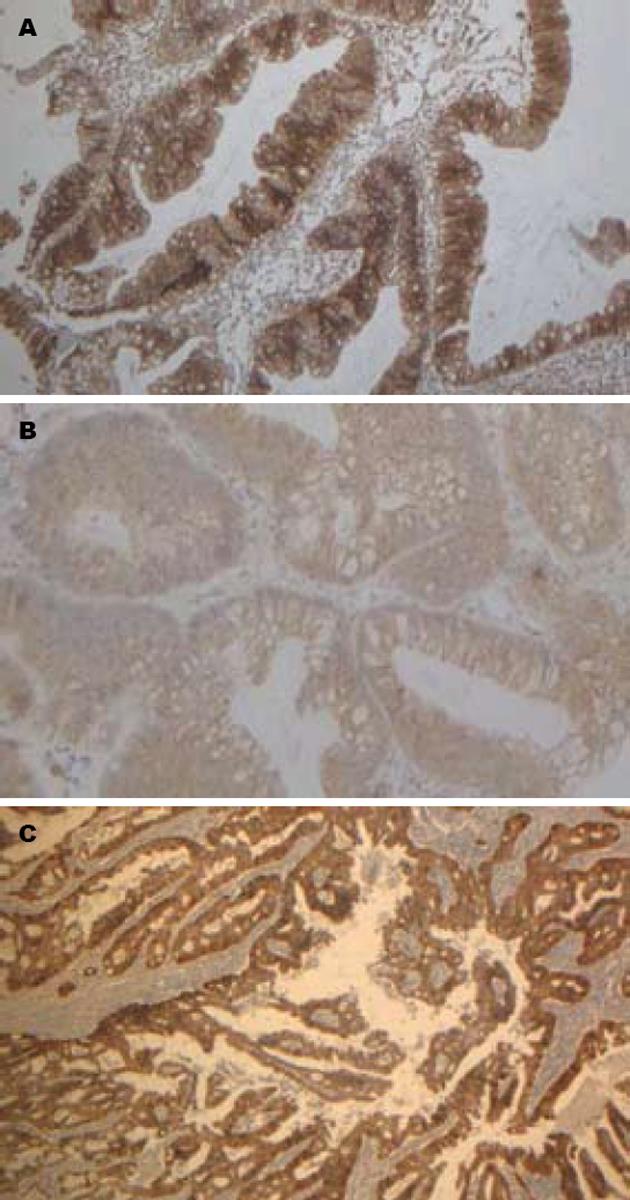
β-catenin在TSA中的表达阳性率为76.6%, TA/VTA中70.0%, CRC中为95.2%; β-catenin在3种病变中的表达具有显著差异(P = 0.000), TSA与TA/VTA之间无显著性差异(P>0.05), 与CRC之间有显著性差异(P<0.05), TSA及TA/VTA的阳性表达率明显低于CRC(图1). 并且观察到随着恶性程度增加, 免疫组织化学染色强度明显增加, TSA及普通腺瘤中没有+++染色, 而在癌组织中42.8%为+++. 本文观察到1例TSA存在部分核表达异常, 3例CRC存在部分核表达异常, 而TA/VTA均未见核表达异常(表1).
| 类别 | n | -(n) | + n(%) | ++ n(%) | +++ n(%) | 阳性n(%) |
| TSA | 30 | 7 | 21(63.3) | 2(10.0) | 0(0.0) | 23(76.6) |
| TA/VTA | 20 | 6 | 9(45.0) | 5(25.0) | 0(0.0) | 14(70.0) |
| CRC | 21 | 1 | 5(23.8) | 6(28.5) | 9(42.8) | 20(95.2) |
| χ2值 | 22.805 | |||||
| P值 | 0.000 |
将TSA、TA/VTA腺体分为轻度、轻-中度及中度、重度异型增生3组, 所有CRC均为浸润性癌共4组, 比较β-catenin的表达有否差异. 其中TSA伴轻度异型增生β-catenin 53.8%表达阳性, TSA伴中度异型增生100%阳性, TSA伴重度异型增生80.0%阳性; 相比之下, TA/VTA伴轻度、轻-中及中度、重度异型增生阳性率分别为50%、83.3%、100%, 其中4例伴重度异型增生者均为VTA, 经统计学处理差异有显著性(表2). β-catenin表达阳性率与两组腺瘤异型增生程度均呈正相关.
| 类型 | n | 轻度异型增生n(%) | 轻-中及中度异性n(%) | 重度异型增生n(%) | 浸润癌n(%) | P值 |
| TSA | 30 | 13(43.3) | 12(33.3) | 5(16.6) | ||
| 阳性 | 23 | 7(53.8) | 12(100.0) | 4(80.0) | ||
| 阴性 | 7 | 6(46.1) | 0(0.0) | 1(20.0) | <0.01 | |
| TA/VTA | 20 | 10(50.0) | 6(30.0) | 4(20.0) | ||
| 阳性 | 14 | 5(50.0) | 5(83.3) | 4(100.0) | ||
| 阴性 | 6 | 5(50.0) | 1(16.6) | 0(0.0) | <0.05 | |
| CRC | 21 | - | - | - | 21 | |
| 阳性 | 20 | - | - | - | 20(95.2) | |
| 阴性 | 1 | - | - | - | 1(4.7) |
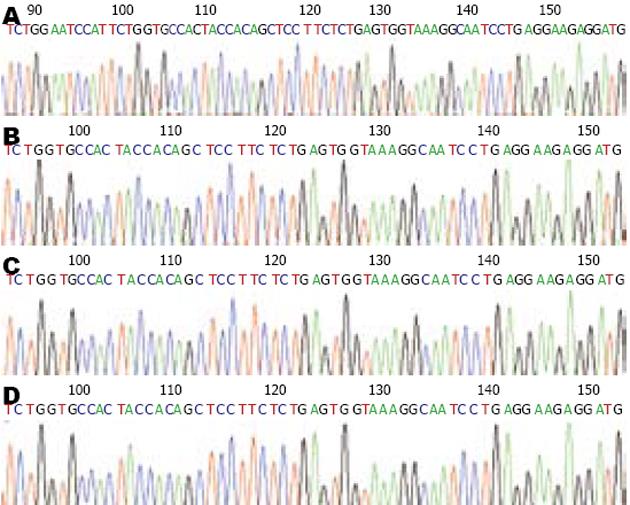
根据免疫组织化学的结果选取了异常表达的8例TSA、6例TA、5例VTA及10例CRC进行了外显子3的突变检测, 发现无一例病变存在外显子3的突变, 1例部分核表达阳性的TSA及3例核表达阳性的CRC均未发现β-catenin外显子3的突变(图2).
现已发现Wnt信号途径的多种成分在人类肿瘤发生过程中存在突变, 且所有突变结果多表现为游离β-catenin增多, 形成β-catenin-T细胞因子(T cell factor, Tcf)/LEF转录复合体, 激活下游原癌基因, 这些原癌基因所表达的癌蛋白决定了肿瘤组织的恶性表型. 使Wnt途径异常激活的最常见因素便是APC基因及β-catenin基因的突变, 二者的突变都会使胞质内游离的β-catenin增多, 在结直肠肿瘤中这两个基因的突变是经常出现的. β-catenin作为一种抑癌基因, 其作用涉及两个相对独立的过程, 既是细胞间黏附连接的主要结构成分, 又是APC β-catenin-T细胞因子信号通路(Wnt信号通路)的中枢成分. 在正常分化成熟的细胞中, β-catenin主要与膜表面E黏蛋白结合, 参与同质性黏附. 而胞质内游离的β-catenin因被磷酸泛素化, 可被蛋白酶体降解始终保持在低水平[14]. 但当β-catenin降解障碍时, 胞质内β-catenin水平升高, 导致β-catenin大量聚集进入细胞核内与T细胞转录因子结合启动下游靶基因的转录, 从而启动肿瘤的生长程序.
有文献报道[15,16]在结直肠癌组织中β-catenin细胞质和细胞核表达增加是提示患者发生转移和不良预后的良好指标, 国内[17]研究发现β-catenin的异常表达与结直肠癌分化程度、Duke's分期、淋巴结转移有关, 提示β-catenin的异常表达与细胞恶性转化及疾病进展紧密联系. 还有研究[4]表明β-catenin在正常黏膜均为膜表达, 而大肠腺瘤和腺瘤癌变存在不同程度的细胞核异位表达增加和细胞膜表达下降, 异位表达的程度随大肠腺瘤上皮不典型增生程度增高而增强, 故认为β-catenin的膜表达下降和核表达增加与大肠腺瘤向腺癌转变有关. 然而目前对于结直肠肿瘤β-catenin基因突变情况的研究结果差异较大, 一些学者认为结直肠肿瘤中β-catenin基因突变极少, 只有10%左右[5,6], 也有人认为较为普遍, 约占40-50%[7]. 本文中测得的β-catenin在CRC中的突变率为0%(0/10).
在大肠癌发生发展的多阶段、多步骤过程中, 腺瘤恶变是腺瘤由良性向恶性转化的最早期阶段, 大量研究发现β-catenin异位表达率在腺瘤恶变组织中显著增高, 提示β-catenin的胞质积聚并进入核内, 导致β-catenin的肿瘤性活化并激活下游靶癌基因, 可能在腺瘤恶变过程中发挥关键作用. Wong等[16]依次对正常结直肠组织、结直肠息肉组织, 腺瘤组织及癌组织的β-catenin表达进行研究发现: β-catenin的胞质/核表达率在这4种组织中分别为0、8%、92%、100%, 且发现β-catenin的异位表达与患者淋巴结转移及其不良预后存在显著相关. Hugh等[18]也发现β-catenin的广泛的核表达及胞质表达揭示了肿瘤生长的异常性, 且在对患者生存预后的判断上有统计学意义. 本研究亦发现β-catenin的异位表达率在伴高度异型增生的TSA、普通腺瘤及CRC中明显增高, 且差异有统计学意义. 因此β-catenin胞膜至胞质表达异位的情况可作为结直肠上皮性肿瘤恶变的评估指标.
Wu等[19]对22例SSA和19例HP进行了β-catenin免疫组织化学染色观察, 发现β-catenin在SSA中主要分布在基底部, 而在HP中呈广泛阳性分布, 其中发现9例SSA核表达阳性, 无1例HP核表达阳性. Yachida等[20]观察到54例SSA中, 35例(67%)存在β-catenin核异常表达, 而HP 12例均无异常核表达(0/12), 推测β-catenin在锯齿状病变的演变过程中起着重要作用, Wnt信号参与SSA的肿瘤进展过程.
本研究应用免疫组织化学方法发现β-catenin在TSA的阳性表达率为76.6%, 普通腺瘤中70.0%, CRC中为95.2%; TSA与普通腺瘤之间差异无显著性, 但与CRC之间差异具有统计学意义. 观察发现β-catenin表达与异型增生程度密切相关, 其中β-catenin在TSA伴轻、中、重度异型增生的阳性率分别为53.8%、100%、80%; 在普通腺瘤伴轻、中、重度异型增生的阳性率分别为50.0%、83%、100%; CRC的阳性率为95.2%, 与文献结果一致, 提示Wnt信号同时参与锯齿状腺瘤与普通腺瘤癌变通路进程, 同时与恶变程度相关.
根据免疫组织化学的结果, 我们选取了具有细胞质异位表达的8例TSA、6例TA、5例VTA组织进行了测序, 未发现一例病变存在β-catenin外显子3的突变, 本研究中选取10例CRC作为对照, 均无外显子3的突变. 在本文中发现3例CRC局部核表达阳性, 1例TSA局部核表达阳性, 而TA及VTA无一例核表达阳性. 因APC基因的突变亦会导致胞质内β-catenin的积聚, 不能除外存在APC基因的突变, 还有待于进一步进行APC基因突变的测定, Fukuchi等[21]亦发现CRC有β-catenin细胞质或细胞核聚集而无基因突变的情况, 并分析其可能机制为: (1)存在第3外显子以外的基因突变; (2)轻微的APC改变; (3)Wnt家族蛋白的参与. 因此 β-catenin细胞质或核的聚集可能还有其他分子事件发生, 有待于进一步的研究.
中国人民解放军252医院陈健医师、河北省巨鹿县医院张新忠医师收集提供病理切片及蜡块, 对课题给予大力帮助, 在此衷心感谢.
新近在研究锯齿状腺瘤癌变的途径中发现结肠癌突变基因(MCC)联合β-catenin, 抑制Wnt信号转导的新结直肠癌变通路, 目前该通路与锯齿状病变癌变的关系尚不很清楚.
李瑗, 教授, 广西肿瘤研究所
Hugh等也发现β-catenin的广泛的核表达及胞质表达揭示了肿瘤生长的异常性, 且在对患者生存预后的判断上有统计学意义.
β-catenin在TSA的异常表达随异型增生程度增加而表达增加. β-catenin蛋白水平的异常表达与外显子3基因突变不同步. β-catenin在锯齿状腺瘤癌变的过程中有促进肿瘤进展的作用.
本文学术性较好, 具有较高的临床参考价值.
编辑: 李薇 电编:李薇
| 1. | Kambara T, Simms LA, Whitehall VL, Spring KJ, Wynter CV, Walsh MD, Barker MA, Arnold S, McGivern A, Matsubara N. BRAF mutation is associated with DNA methylation in serrated polyps and cancers of the colorectum. Gut. 2004;53:1137-1144. [PubMed] |
| 2. | O'Brien MJ, Yang S, Clebanoff JL, Mulcahy E, Farraye FA, Amorosino M, Swan N. Hyperplastic (serrated) polyps of the colorectum: relationship of CpG island methylator phenotype and K-ras mutation to location and histologic subtype. Am J Surg Pathol. 2004;28:423-434. [PubMed] |
| 3. | O'Brien MJ, Yang S, Mack C, Xu H, Huang CS, Mulcahy E, Amorosino M, Farraye FA. Comparison of microsatellite instability, CpG island methylation phenotype, BRAF and KRAS status in serrated polyps and traditional adenomas indicates separate pathways to distinct colorectal carcinoma end points. Am J Surg Pathol. 2006;30:1491-1501. [PubMed] [DOI] |
| 4. | Hao X, Tomlinson I, Ilyas M, Palazzo JP, Talbot IC. Reciprocity between membranous and nuclear expression of beta-catenin in colorectal tumours. Virchows Arch. 1997;431:167-172. [PubMed] [DOI] |
| 5. | Kinzler KW, Vogelstein B. Lessons from hereditary colorectal cancer. Cell. 1996;87:159-170. [PubMed] |
| 7. | Wong SC, Lo SF, Cheung MT, Ng KO, Tse CW, Lai BS, Lee KC, Lo YM. Quantification of plasma beta-catenin mRNA in colorectal cancer and adenoma patients. Clin Cancer Res. 2004;10:1613-1617. [PubMed] [DOI] |
| 8. | Farris AB, Misdraji J, Srivastava A, Muzikansky A, Deshpande V, Lauwers GY, Mino-Kenudson M. Sessile serrated adenoma: challenging discrimination from other serrated colonic polyps. Am J Surg Pathol. 2008;32:30-35. [PubMed] [DOI] |
| 9. | Torlakovic EE, Gomez JD, Driman DK, Parfitt JR, Wang C, Benerjee T, Snover DC. Sessile serrated adenoma (SSA) vs. traditional serrated adenoma (TSA). Am J Surg Pathol. 2008;32:21-29. [PubMed] [DOI] |
| 10. | East JE, Saunders BP, Jass JR. Sporadic and syndromic hyperplastic polyps and serrated adenomas of the colon: classification, molecular genetics, natural history, and clinical management. Gastroenterol Clin North Am. 2008;37:25-46, v. [PubMed] [DOI] |
| 12. | Xia J, Urabe K, Moroi Y, Koga T, Duan H, Li Y, Furue M. beta-Catenin mutation and its nuclear localization are confirmed to be frequent causes of Wnt signaling pathway activation in pilomatricomas. J Dermatol Sci. 2006;41:67-75. [PubMed] [DOI] |
| 13. | Maruyama K, Ochiai A, Akimoto S, Nakamura S, Baba S, Moriya Y, Hirohashi S. Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer. Oncology. 2000;59:302-309. [PubMed] [DOI] |
| 14. | Peifer M, Polakis P. Wnt signaling in oncogenesis and embryogenesis--a look outside the nucleus. Science. 2000;287:1606-1609. [PubMed] [DOI] |
| 15. | Cheah PY, Choo PH, Yao J, Eu KW, Seow-Choen F. A survival-stratification model of human colorectal carcinomas with beta-catenin and p27kip1. Cancer. 2002;95:2479-2486. [PubMed] [DOI] |
| 16. | Wong SC, Lo ES, Lee KC, Chan JK, Hsiao WL. Prognostic and diagnostic significance of beta-catenin nuclear immunostaining in colorectal cancer. Clin Cancer Res. 2004;10:1401-1408. [PubMed] [DOI] |
| 18. | Hugh TJ, Dillon SA, Taylor BA, Pignatelli M, Poston GJ, Kinsella AR. Cadherin-catenin expression in primary colorectal cancer: a survival analysis. Br J Cancer. 1999;80:1046-1051. [PubMed] [DOI] |
| 19. | Wu JM, Montgomery EA, Iacobuzio-Donahue CA. Frequent beta-catenin nuclear labeling in sessile serrated polyps of the colorectum with neoplastic potential. Am J Clin Pathol. 2008;129:416-423. [PubMed] [DOI] |
| 20. | Yachida S, Mudali S, Martin SA, Montgomery EA, Iacobuzio-Donahue CA. Beta-catenin nuclear labeling is a common feature of sessile serrated adenomas and correlates with early neoplastic progression after BRAF activation. Am J Surg Pathol. 2009;33:1823-1832. [PubMed] [DOI] |
| 21. | Fukuchi T, Sakamoto M, Tsuda H, Maruyama K, Nozawa S, Hirohashi S. Beta-catenin mutation in carcinoma of the uterine endometrium. Cancer Res. 1998;58:3526-3528. [PubMed] |