修回日期: 2011-10-07
接受日期: 2011-10-12
在线出版日期: 2011-10-18
目的: 评估Peutz-Jeghers综合征(Peutz-Jeghers syndrome, PJS)患者并发恶性肿瘤的风险, 提出监测建议.
方法: 通过Pubmed检索PJS并发恶性肿瘤的群组研究文献, 并摘录符合条件的20篇文献中的相关资料进行分析.
结果: 共纳入3 302例PJS患者, 其中573人(17.35%)并发619例恶性肿瘤, 包括消化系肿瘤368例(60.23%), 非消化系肿瘤243例(39.77%). 并发的常见恶性肿瘤中, 依次为结直肠癌、小肠癌、乳腺癌、胃食管癌、妇科癌、胰腺癌、肺癌, 且国内外发病频率具有一致性; PJS患者恶性肿瘤高发年龄段为11-70岁, 国内患者有较年轻化的趋势. PJS并发任意癌的相对风险为9.0-18, 并发消化系肿瘤的相对风险为13-50.5, 并发乳腺癌的相对风险为13.9-20.3, 并发妇科癌的相对风险为20.3, 各年龄段癌症累积风险明显增高. 有无STK11/LKB1基因突变对PJS并发恶性肿瘤风险无明显影响(P>0.05).
结论: PJS患者为恶性肿瘤的高风险人群, 其并发消化系肿瘤及消化系外癌的风险明显增高, 应加强随诊筛查恶性肿瘤.
引文著录: 袁柏思, 路又可, 金鑫鑫, 万海军, 周淑萍, 汪芳裕. Peutz-Jeghers综合征: 恶性肿瘤高风险人群. 世界华人消化杂志 2011; 19(29): 3094-3099
Revised: October 7, 2011
Accepted: October 12, 2011
Published online: October 18, 2011
AIM: To assess cancer risk in patients with Peutz-Jeghers syndrome (PJS) and to develop a surveillance recommendation.
METHODS: A systematic PubMed search was performed to analyze related data of cancer in patients with PJS described in 20 cohort studies.
RESULTS: The cohort studies included 3 302 patients in total, and 573 (17.35%) of them developed 619 cases of cancer, including 368 (60.23%) cases of gastrointestinal and 243 (39.77%) cases of non-gastrointestinal cancers. The most common malignancy was colorectal cancer, followed by small bowel, breast, gastroesophageal, gynecological, pancreatic, and lung cancers. The age range of the high incidence rate of cancer was 11-70 years old, and seemed younger among Chinese patients than that in other countries. The lifetime relative risks for any cancer ranged from 9.9 to 18, for gastrointestinal cancer was 13 to 50.5, breast cancer 13.9 to 20.3, and gynecological cancer was 20.3 compared with the general population. Obviously, the age-related cumulative risks are increasing. The STK11/LKB1 mutation did not significantly influence cancer risk (P > 0.05).
CONCLUSION: Patients with PJS have markedly increased relative and absolute risk for gastrointestinal and non-gastrointestinal cancers. In order to improve the outcome for PJS patients, it is very important to strengthen cancer surveillance and closer follow-up in an early phase.
- Citation: Yuan BS, Lu YK, Jin XX, Wan HJ, Zhou SP, Wang FY. High risk of cancer in Peutz-Jeghers syndrome. Shijie Huaren Xiaohua Zazhi 2011; 19(29): 3094-3099
- URL: https://www.wjgnet.com/1009-3079/full/v19/i29/3094.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i29.3094
Peutz-Jeghers综合征(Peutz-Jeghers syndrome, PJS)又称黑斑息肉综合征, 由荷兰医生Peutz和美国医生Jeghers分别于1921年和1949年首先报道, 因而命名为PJS, 本征是一种常染色体显性遗传病, 特征性的表现为皮肤、黏膜特定部位色素斑和胃肠道多发性息肉. 1998年发现肿瘤抑制基因STK11/LKB1为PJS的相关致病基因[1,2]. 虽然本征的发病机制仍未阐明, 但目前的文献报道[3-8]多认为PJS并发恶性肿瘤的风险有所增加. 许多研究中心根据已掌握的资料去评估恶性肿瘤风险, 但因受限于较少的病例资料而使恶性肿瘤风险变化较大, 据此, 我们通过检索国内外的群组研究资料, 以期对PJS的恶性肿瘤风险进行更好的评估, 从而指导治疗和恶性肿瘤监测.
检索Pubmed数据库, 时间为1947-01-01/2010-12-31, 检索方法为: (Peutz OR Jeghers) AND(cancer OR carcinoma OR tumor). 文献入选标准: (1)诊断符合PJS; (2)并发恶性肿瘤; (3)群组研究资料. 根据入选标准, 共检出1 183篇英文文献, 剔除不符合条件的文献1 164篇, 最终列入统计范围的英文文献共19篇, 加上1篇国内文献荟萃分析资料, 共计20篇文献[4-23].
根据参考文献追溯符合条件的文章, 剔除综述类文献、个案报道、资料不全的文献及社论文章. 摘录纳入文献的有效信息: 病例数、性别、年龄、报道地区、并发恶性肿瘤类型及病例数、恶性肿瘤累积风险、相对风险.对所获取资料进行汇总, 采用Excel 2007、Origin 8、SPSS18.0等软件进行统计分析及图表制作, 率的比较用χ2检验, 以P<0.05为差异有统计学意义.
在检索时间范围内, 共纳入3 302例PJS患者, 能够确定性别的病例中男1 304例, 女1 342例, 男女比例约为1:1. 其中573人并发恶性肿瘤, 发病率为17.35%, 其中国外为20.36%(366/1 798), 国内为13.76%(207/1 504); 并发恶性肿瘤病例共619例(有40人合并两种或两种以上的癌), 其中消化系肿瘤(包括食管癌、胃癌、小肠癌、结直肠癌、胰腺癌和胆道癌)共368例, 占60.23%, 非消化系肿瘤共243例, 占39.77%, 两者之比约为1.5:1, 从病例资料的分布看各大洲均有报道, 以欧美报道的文献较多, 但无明显的地区特异性(表1).
| 作者 | 发表年份 | 地区 | n | 男/女 | 患者数 | 恶性肿瘤数 | 消化系肿瘤 | 非消化系肿瘤 |
| Utsunomiya等[9] | 1975 | 日本 | 202 | - | 28 | 28 | 27 | 1 |
| Linos等[10] | 1981 | 美国 | 48 | 28/20 | 11 | 12 | 2 | 10 |
| Burdick等[11] | 1982 | 美国 | 10 | 3/7 | 3 | 4 | 0 | 4 |
| Giardiello等[12] | 1987 | 美国 | 31 | - | 15 | 16 | 8 | 8 |
| Foley等[13] | 1988 | 美国 | 12 | 7/5 | 3 | 3 | 2 | 1 |
| Spigelman等[14] | 1989 | 英国 | 72 | 33/39 | 16 | 17 | 10 | 7 |
| Hizawa等[15] | 1993 | 日本 | 8 | 4/4 | 4 | 4 | 3 | 1 |
| Boardman等[16] | 1998 | 美国 | 34 | 18/16 | 18 | 26 | 10 | 16 |
| Westerman等[17] | 1999 | 荷兰 | 22 | 13/9 | 7 | 7 | 5 | 2 |
| Choi等[18] | 2000 | 韩国 | 30 | 14/16 | 5 | 7 | 6 | 1 |
| Olschwang等[19] | 2001 | 法国 | 63 | - | 19 | 19 | 11 | 8 |
| Scott等[20] | 2002 | 澳大利亚 | 36 | - | 9 | 9 | 4 | 5 |
| Lim等[21] | 2003 | 英国 | 71 | - | 15 | 15 | 7 | 8 |
| Amos等[22] | 2004 | 美国 | 93 | - | 8 | 8 | - | - |
| Lim等[4] | 2004 | 欧美多中心 | 240 | 109/131 | 47 | 54 | 26 | 28 |
| Schumacher等[5] | 2005 | 德国 | 88 | - | 19 | 21 | 9 | 12 |
| Mehenni等[6] | 2006 | 瑞士 | 149 | 76/73 | 29 | 32 | 22 | 10 |
| Hearle等[7] | 2006 | 欧美多中心 | 419 | 193/226 | 85 | 96 | 44 | 52 |
| Mehenni等[8] | 2007 | 欧美多中心 | 170 | 73/97 | 25 | 27 | 17 | 10 |
| Yuan等[23] | 2009 | 中国 | 1504 | 770/734 | 207 | 214 | 155 | 59 |
| 合计 | 3302 | 1304/1342 | 573 | 619 | 368 | 243 |
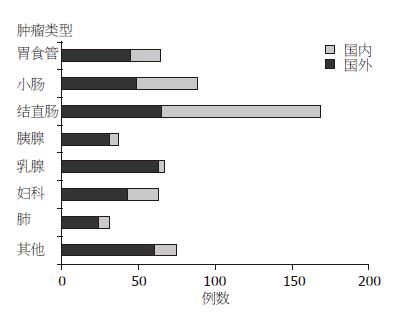
对可明确肿瘤类型的资料进行统计分析发现, PJS合并的恶性肿瘤中以胃食管癌、小肠癌、结直肠癌、胰腺癌、妇科癌(子宫癌、卵巢癌、输卵管癌和卵巢环状小管性索肿瘤)、乳腺癌和肺癌多见, 亦可合并其他较少见的癌(甲状腺癌、前列腺癌、多发性骨髓瘤、肝癌、鼻咽癌、肾癌、睾丸癌、wilm's瘤、急性粒细胞白血病及不确定组织类型的癌等), 统计的各种恶性肿瘤例数详见图1, 由此可见国内外报道的PJS并发恶性肿瘤的分布趋势具有一致性.
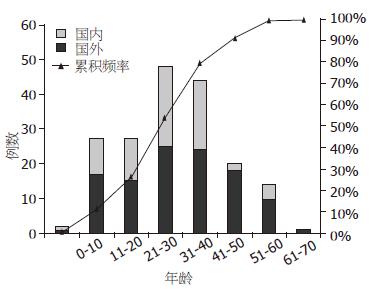
对可得到具体年龄资料患者的年龄作一统计分析发现, PJS并发恶性肿瘤的年龄段分布主要在11-70之间, 累积频率为98.3%, 在21-50岁间国内外报道的例数基本一致, 而在11-20岁间国内报道明显多于国外(15/2), 在51-70岁间国内报道明显少于国外(6/28), 可见国内PJS患者并发恶性肿瘤有较年轻化的趋势(图2).
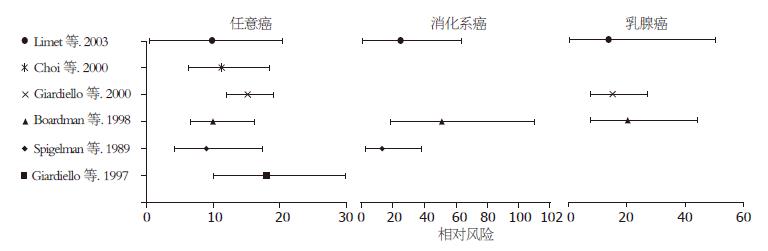
PJS并发恶性肿瘤较普通人群的相对风险明显增高, 我们检索到6篇对此进行评价的文献[3,12,14,16,18,21], 年份介于1987-2003. 数据显示PJS并发任意癌的相对风险为9.0-18, 并发消化系肿瘤的相对风险为13-50.5, 并发乳腺癌的相对风险为13.9-20.3, 并发妇科癌的相对风险为20.3[21](图3).
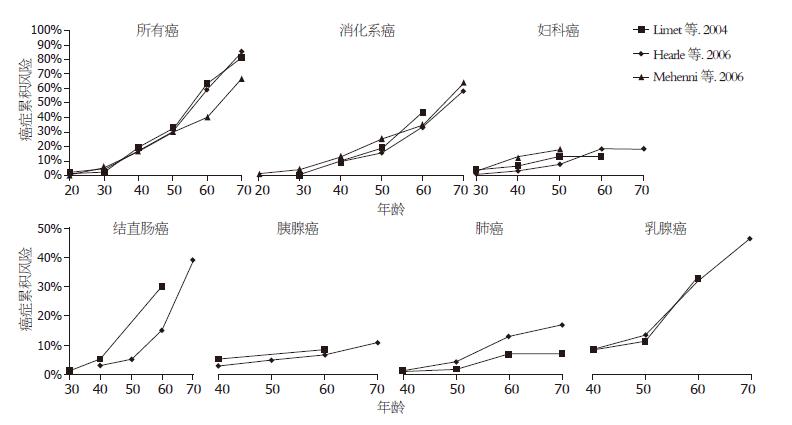
对涉及PJS并发常见恶性肿瘤, 如消化系肿瘤(胃食管癌、小肠癌、结直肠癌、胰腺癌)、妇科癌、乳腺癌和肺癌年龄相关的癌症累积风险的文献[4,6,7]发现, 随着年龄的增长PJS并发各种恶性肿瘤的累积风险明显增加(图4).
进一步评价STK11/LKB1基因突变对PJS并发恶性肿瘤风险的影响, 我们对能够明确基因突变及相应肿瘤类型的文献资料[5,7,8,19-21]进行比较, 发现两组间的差别并无统计学意义(P>0.05, 表2), 因此, STK11/LKB1基因突变对肿瘤风险的影响无统计学意义.
| 并发癌(n) | 无癌(n) | 合计(n) | 并发癌率(%) | 统计学分析 | |
| 有基因突变 | 113 | 417 | 530 | 21.32 | χ2 = 0.145 |
| 无基因突变 | 53 | 210 | 263 | 20.15 | P = 0.703 |
| 合计 | 166 | 627 | 793 | 20.93 |
我们的研究结果和先前的报道[3-8]均证实PJS并发恶性肿瘤的风险明显增高. 在本研究涉及的20个群组病例研究的3 302例PJS患者中, 有573例PJS患者合并恶性肿瘤, 发生率为17.35%, 明显高于普通人群的发病率[24]. 对比国内外报道的数据发现, 国外略高于国内(20.36%/13.76%), 这可能是由于纳入研究的人群不同所致, 合并的恶性肿瘤中, 以消化系肿瘤最常见, 其次为女性相关肿瘤(乳腺癌和妇科癌)和肺癌, 这些并发的常见肿瘤类型, 国内外报道的频率趋势基本一致. 对PJS并发恶性肿瘤的风险统计发现, 相对普通人群, PJS并发恶性肿瘤的相对风险为9-18倍, 其中以并发消化系肿瘤(13-50.5倍)、乳腺癌(13.9-20.3倍)和妇科癌(20.3倍)为高, 据此, 我们认为PJS是恶性肿瘤的高发人群.
目前, 对PJS患者合并恶性肿瘤的危险因素尚未阐明, 我们的研究结果提示年龄是一个重要危险因素, 从并发的恶性肿瘤中可见, 以11-70岁为年龄的多发时间段, 但国内外报道的情况略有差异, 国内报道的病例有相对年轻化的趋势, 而且随着年龄增加, PJS并发各种恶性肿瘤的累积频率和累积风险亦明显增加; PJS全世界均有报道, 但未见它们的发病率及并发恶性肿瘤和地域有明显关系; PJS患者63%-70%[7,8]有家族史, 对于有无家族史患者并发恶性肿瘤的比较, 因数据缺乏而无法进行, 但国外早期一篇荟萃分析[3]的结果提示具有家族性病史的PJS患者合并恶性肿瘤的发病率为30.14%(66/210), 明显高于我们统计的结果, 可见有家族史者发生恶性肿瘤的危险性明显增高; 在性别方面, 女性患者并发乳腺癌和妇科癌的相对风险及频率明显增高, 其他部位肿瘤与性别的关系无法进行比较, 但国外荟萃分析的文献报道[3]并无明显关系; 尚不能确定与胃肠道息肉的部位、数量、大小的关系. 关于PJS息肉的癌变问题, 应该严格区分是错构瘤性息肉恶变还是合并与息肉无关的胃肠道原发性癌症. 已有研究报道[14,25-28]PJS息肉存在错构瘤-腺瘤-腺癌的演变, 但所涉及的病例数较少, 也有认为癌变很可能是由腺瘤演变而来, 不一定来自本征的息肉, 此外, 本征息肉的癌变, 其恶性程度与原发的胃肠道癌症的比较也未见报道; 作为PJS典型表现的皮肤黏膜黑斑, 出现于大多数PJS患者, 但其与肿瘤的关系未见报道, 上述问题都需要多中心、大样本的研究去进一步证实.
1998年Hemminki和Jenne同时发现STK11/LKB1基因为PJS的相关致病基因[1,2], 该基因在人体几乎所有组织中表达, 是一种肿瘤抑制基因, 编码一种新的丝氨酸/苏氨酸激酶, 通过磷酸化作用来调控细胞分化. PJS患者STK11/LKB1基因突变可导致氨基酸改变和终止信号提前出现, 翻译和转录发生异常, 使激酶失活, 导致疾病的发生、发展. 目前对PJS患者STK11/LKB1基因突变的研究逐渐增多, 文献报道[1,8,19-21]50%-90%的PJS患者有STK11/LKB1基因的突变, 对STK11/LKB1基因突变能否导致PJS并发恶性肿瘤的风险增加, 国外报道的结论并不完全一致[7,21], 我们对有无STK11/LKB1基因突变的PJS进行比较发现, 突变与否与并发恶性肿瘤的风险无明显关系, 而且国外较大样本资料的研究[4,7]表明, STK11/LKB1基因突变位点及突变类型亦与并发恶性肿瘤的风险无明显关系, 这可能是由于基因型和表现型的不同所致, 因此, 需要对PJS并发癌的机制进行更深入的研究.
本研究尚有以下不足, 首先是文献选择偏倚, 文献的选择均为群组研究资料, PJS并发恶性肿瘤的病例被报道的可能性将更大, 反之则较小, 而且较少病例资料的报道未被纳入, 因此有可能使得出的肿瘤风险与实际有所差别; 其次是文献中部分数据的缺失(如部分文献中未提供具体的年龄、肿瘤的类型及例数), 使我们的统计结果与实际产生偏倚. 但我们选择的文献较多, 范围广, 进行统计的病例数较大, 每项结果的统计均有较大样本(>100例)为基础的多篇文献数据, 因此, 本研究的结果应能够较接近地反映PJS并发恶性肿瘤的实际情况.
由于本征是恶性肿瘤高风险人群, 而目前对并发的恶性肿瘤尚无好的治疗办法, 因此监测和随访PJS患者, 采取有效的治疗方法以减少恶性肿瘤的发生很重要. 此外, PJS患者具有一定遗传性, 而且文献报道[21]中PJS一级亲属中虽无PJS的典型表现, 但亦可见到发生恶性肿瘤的风险有所增加, 因此我们建议对PJS患者一级亲属亦需加强随诊, 以期能早发现、早治疗合并的恶性肿瘤, 从而降低死亡率. 居于我们的诊疗实践、对本病的进一步认识以及诊疗技术的进步, 我们参照国外相关文献, 对先前提出的随诊建议[23]加以补充及修改, 总结PJS患者常见恶性肿瘤的随诊建议.
总之, 本研究的结果表明PJS患者为恶性肿瘤的高风险人群, 其并发消化系肿瘤及消化系外癌的风险明显增高, 应积极治疗胃肠道息肉及筛查全身肿瘤.
Peutz-Jeghers综合征是一种常染色体显性遗传病, 典型的临床特征为皮肤、黏膜特定部位色素斑和胃肠道多发错构瘤性息肉, STK11/LKB1基因为其主要突变基因, 本征并发恶性肿瘤的风险明显高于普通人群.
何松, 教授, 重庆医科大学附属第二医院消化内科; 万军, 主任医师, 中国人民解放军总医院南楼老年消化科
Peutz-Jeghers综合征并发恶性肿瘤的原因及相关的致病危险因素仍未阐明, 有效的治疗药物缺乏, 需要大样本多中心的临床研究及流行病学调查对本征进一步研究.
Peutz-Jeghers综合征并发恶性肿瘤风险高, 而且容易出现肠梗阻、肠套叠及消化系出血等并发症, 目前尚缺乏有效的治疗药物去预防及控制, 潜在的有希望控制本征息肉的药物有COX-2抑制剂塞来昔布及新型大环内酯类抗真菌药, 并可作为免疫抑制剂的雷帕霉素(Rapamycin), 但仍处于临床试验阶段, 确切的疗效有待进一步证实.
本文以大量详实的文献数据为基础, 从肿瘤类型、发病年龄、风险比较、基因突变与癌变的关系以及国内外数据的比较等方面来分析PJS并发恶性肿瘤的情况, 并在此基础上提出随访及监测建议.
本文在总结国内外文献报道中Peutz-Jeghers 综合征并发恶性肿瘤的各种相关危险因素, 对进一步指导临床治疗和恶性肿瘤监测具有重要的指导价值.
本项研究有积极的临床意义, 使临床医师对Peutz-Jeghers综合征这种相对少见的疾病有了一个更深入的认识, 有利于临床上更加重视这种疾病.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Hemminki A, Markie D, Tomlinson I, Avizienyte E, Roth S, Loukola A, Bignell G, Warren W, Aminoff M, Höglund P. A serine/threonine kinase gene defective in Peutz-Jeghers syndrome. Nature. 1998;391:184-187. [PubMed] [DOI] |
| 2. | Jenne DE, Reimann H, Nezu J, Friedel W, Loff S, Jeschke R, Müller O, Back W, Zimmer M. Peutz-Jeghers syndrome is caused by mutations in a novel serine threonine kinase. Nat Genet. 1998;18:38-43. [PubMed] [DOI] |
| 3. | Giardiello FM, Brensinger JD, Tersmette AC, Goodman SN, Petersen GM, Booker SV, Cruz-Correa M, Offerhaus JA. Very high risk of cancer in familial Peutz-Jeghers syndrome. Gastroenterology. 2000;119:1447-1453. [PubMed] [DOI] |
| 4. | Lim W, Olschwang S, Keller JJ, Westerman AM, Menko FH, Boardman LA, Scott RJ, Trimbath J, Giardiello FM, Gruber SB. Relative frequency and morphology of cancers in STK11 mutation carriers. Gastroenterology. 2004;126:1788-1794. [PubMed] [DOI] |
| 5. | Schumacher V, Vogel T, Leube B, Driemel C, Goecke T, Möslein G, Royer-Pokora B. STK11 genotyping and cancer risk in Peutz-Jeghers syndrome. J Med Genet. 2005;42:428-435. [PubMed] [DOI] |
| 6. | Mehenni H, Resta N, Park JG, Miyaki M, Guanti G, Costanza MC. Cancer risks in LKB1 germline mutation carriers. Gut. 2006;55:984-990. [PubMed] [DOI] |
| 7. | Hearle N, Schumacher V, Menko FH, Olschwang S, Boardman LA, Gille JJ, Keller JJ, Westerman AM, Scott RJ, Lim W. Frequency and spectrum of cancers in the Peutz-Jeghers syndrome. Clin Cancer Res. 2006;12:3209-3215. [PubMed] [DOI] |
| 8. | Mehenni H, Resta N, Guanti G, Mota-Vieira L, Lerner A, Peyman M, Chong KA, Aissa L, Ince A, Cosme A. Molecular and clinical characteristics in 46 families affected with Peutz-Jeghers syndrome. Dig Dis Sci. 2007;52:1924-1933. [PubMed] [DOI] |
| 9. | Utsunomiya J, Gocho H, Miyanaga T, Hamaguchi E, Kashimure A. Peutz-Jeghers syndrome: its natural course and management. Johns Hopkins Med J. 1975;136:71-82. [PubMed] |
| 10. | Linos DA, Dozois RR, Dahlin DC, Bartholomew LG. Does Peutz-Jeghers syndrome predispose to gastrointestinal malignancy? A later look. Arch Surg. 1981;116:1182-1184. [PubMed] [DOI] |
| 11. | Burdick D, Prior JT. Peutz-Jeghers syndrome. A clinicopathologic study of a large family with a 27-year follow-up. Cancer. 1982;50:2139-2146. [PubMed] [DOI] |
| 12. | Giardiello FM, Welsh SB, Hamilton SR, Offerhaus GJ, Gittelsohn AM, Booker SV, Krush AJ, Yardley JH, Luk GD. Increased risk of cancer in the Peutz-Jeghers syndrome. N Engl J Med. 1987;316:1511-1514. [PubMed] [DOI] |
| 13. | Foley TR, McGarrity TJ, Abt AB. Peutz-Jeghers syndrome: a clinicopathologic survey of the "Harrisburg family" with a 49-year follow-up. Gastroenterology. 1988;95:1535-1540. [PubMed] |
| 14. | Spigelman AD, Murday V, Phillips RK. Cancer and the Peutz-Jeghers syndrome. Gut. 1989;30:1588-1590. [PubMed] [DOI] |
| 15. | Hizawa K, Iida M, Matsumoto T, Kohrogi N, Kinoshita H, Yao T, Fujishima M. Cancer in Peutz-Jeghers syndrome. Cancer. 1993;72:2777-2781. [PubMed] [DOI] |
| 16. | Boardman LA, Thibodeau SN, Schaid DJ, Lindor NM, McDonnell SK, Burgart LJ, Ahlquist DA, Podratz KC, Pittelkow M, Hartmann LC. Increased risk for cancer in patients with the Peutz-Jeghers syndrome. Ann Intern Med. 1998;128:896-899. |
| 17. | Westerman AM, Entius MM, de Baar E, Boor PP, Koole R, van Velthuysen ML, Offerhaus GJ, Lindhout D, de Rooij FW, Wilson JH. Peutz-Jeghers syndrome: 78-year follow-up of the original family. Lancet. 1999;353:1211-1215. [PubMed] [DOI] |
| 18. | Choi HS, Park YJ, Youk EG, Yoon KA, Ku JL, Kim NK, Kim SM, Kim YJ, Moon DJ, Min JS. Clinical characteristics of Peutz-Jeghers syndrome in Korean polyposis patients. Int J Colorectal Dis. 2000;15:35-38. [PubMed] [DOI] |
| 19. | Olschwang S, Boisson C, Thomas G. Peutz-Jeghers families unlinked to STK11/LKB1 gene mutations are highly predisposed to primitive biliary adenocarcinoma. J Med Genet. 2001;38:356-360. [PubMed] [DOI] |
| 20. | Scott RJ, Crooks R, Meldrum CJ, Thomas L, Smith CJ, Mowat D, McPhillips M, Spigelman AD. Mutation analysis of the STK11/LKB1 gene and clinical characteristics of an Australian series of Peutz-Jeghers syndrome patients. Clin Genet. 2002;62:282-287. [PubMed] [DOI] |
| 21. | Lim W, Hearle N, Shah B, Murday V, Hodgson SV, Lucassen A, Eccles D, Talbot I, Neale K, Lim AG. Further observations on LKB1/STK11 status and cancer risk in Peutz-Jeghers syndrome. Br J Cancer. 2003;89:308-313. [PubMed] [DOI] |
| 22. | Amos CI, Keitheri-Cheteri MB, Sabripour M, Wei C, McGarrity TJ, Seldin MF, Nations L, Lynch PM, Fidder HH, Friedman E. Genotype-phenotype correlations in Peutz-Jeghers syndrome. J Med Genet. 2004;41:327-333. [PubMed] [DOI] |
| 24. | Siegel R, Ward E, Brawley O, Jemal A. Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths. CA Cancer J Clin. 2011;61:212-236. [PubMed] [DOI] |
| 25. | Perzin KH, Bridge MF. Adenomatous and carcinomatous changes in hamartomatous polyps of the small intestine (Peutz-Jeghers syndrome): report of a case and review of the literature. Cancer. 1982;49:971-983. [PubMed] [DOI] |
| 26. | Hizawa K, Iida M, Matsumoto T, Kohrogi N, Yao T, Fujishima M. Neoplastic transformation arising in Peutz-Jeghers polyposis. Dis Colon Rectum. 1993;36:953-957. [PubMed] [DOI] |
| 27. | Wang ZJ, Ellis I, Zauber P, Iwama T, Marchese C, Talbot I, Xue WH, Yan ZY, Tomlinson I. Allelic imbalance at the LKB1 (STK11) locus in tumours from patients with Peutz-Jeghers' syndrome provides evidence for a hamartoma-(adenoma)-carcinoma sequence. J Pathol. 1999;188:9-13. [PubMed] [DOI] |
| 28. | Nakamura T, Suzuki S, Yokoi Y, Kashiwabara H, Maruyama K, Baba S, Nakagawa H, Nakamura S. Duodenal cancer in a patient with Peutz-Jeghers syndrome: molecular analysis. J Gastroenterol. 2002;37:376-380. [PubMed] [DOI] |