修回日期: 2011-10-08
接受日期: 2011-10-12
在线出版日期: 2011-10-18
iceA基因是近年来发现的一种幽门螺杆菌(Helicobacter pylori, H. pylori)毒力相关基因. H. pylori与胃黏膜上皮接触后可引起iceA1基因表达上调, 该基因与nlaIIIR基因(位于乳糖奈瑟氏菌)具有相似性, 其编码的蛋白质产物具有NlaIIIR样限制性核酸内切酶活性. 研究表明, iceA1阳性菌株能引起上皮细胞炎症因子表达水平增高, 与胃黏膜炎症程度的发生关系密切. 在某些H. pylori菌株中iceA1基因可因存在框移突变而失活或者被iceA2基因取代. 在亚洲和非洲的菌株主要表达iceA1基因, 美洲大陆则以iceA2多见, 而欧洲的iceA基因与亚洲和美洲菌株均具有相似性. H. pylori iceA1基因的地域分布特征很可能反映出不同地区的疾病转归差异性.
引文著录: 黄敬敬, 战淑慧, 董全江, 董开芯. 幽门螺杆菌iceA1基因地域分布特征. 世界华人消化杂志 2011; 19(29): 3058-3063
Revised: October 8, 2011
Accepted: October 12, 2011
Published online: October 18, 2011
The iceA gene has been recently identified as a virulence-related gene of Helicobacter pylori (H. pylori). The expression of iceA1 is up-regulated in H. pylori contacted with epithelial cells. The iceA1 gene shows a significant homology to the nlaIIIR gene of Neisseria lactamica, which encodes a NlaIII-like restriction endonuclease. iceA1-positive H. pylori strains enhance the expression of inflammatory factors in epithelial cells and are closely associated with the severity of gastric mucosal inflammation. In some strains, the iceA1 gene may be inactivated due to frame shift, or replaced by iceA2. The strains from Asia and Africa mainly express the iceA1, while iceA2 is predominant in American strains. H. pylori strains from Europe show genetic affinity towards both Asia and Europe strains. This pattern of geographical distribution of the H. pylori iceA1 gene possibly reflects different disease profiles of different geographical regions.
- Citation: Huang JJ, Zhan SH, Dong QJ, Dong KX. Characteristics of geographical distribution of the Helicobacter pylori iceA1 gene. Shijie Huaren Xiaohua Zazhi 2011; 19(29): 3058-3063
- URL: https://www.wjgnet.com/1009-3079/full/v19/i29/3058.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i29.3058
幽门螺杆菌(Helicobacter pylori, H. pylori)是一种微需氧、螺旋状的革兰氏阴性杆菌, 定居于胃内, 可引起消化系炎症及溃疡病的发生, 最终发展为胃癌[1-4]. 世界卫生组织已于1994年将H. pylori列为一类致癌原[5]. 全世界约有一半以上人口感染H. pylori, 并终身携带. 大部分感染者终身无消化系症状产生, 但少数人最终发展为消化性溃疡病或胃癌[6,7], 这与H. pylori基因组的高度多样性和异质性密切相关. 第一个被检测出的H. pylori毒力相关基因cagA(cytotoxin-associated gene)位于cag致病岛, 其编码产物cagA能促进黏膜炎症反应, 感染cagA阳性H. pylori的个体更易发生消化性溃疡病[8-12]. 与cagA不同, vacA(vacuolating cytotoxin gene)毒力基因存在于所有的H. pylori中. 该基因含有s区、i区和m区[13-16], 各区又可分为2个亚型. vacA基因编码的毒素能特异性作用于宿主细胞并产生空泡活性, 含有vacAs1/i1/m1基因型的H. pylori毒力最强[17-20]. 近年研究发现, H. pylori基因组中存在的高度变异的iceA基因也是一种潜在的毒力相关因素. 当H. pylori与宿主上皮细胞接触后可诱导iceA1表达上调. iceA1与乳糖奈瑟氏菌nlaIIIR基因有同源性, 其表达具有NlaIIIR样限制性核酸内切酶活性. 表达该产物的H. pylori与临床疾病发生的严重程度关系密切[21-23], 但各家报道并不完全一致[24-27]. 本文就iceA基因研究最新进展作一综述.
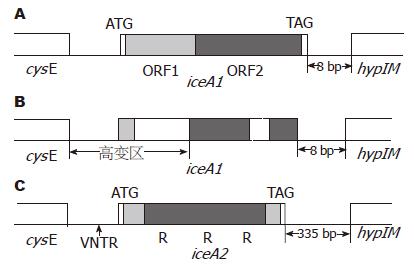
当H. pylori与黏膜上皮细胞接触后可诱导菌株的一个基因表达上调, 转录产物mRNA增多, 称该基因为iceA(induced by contact with epithelium). 该基因位于H. pylori基因链上保守的cysE和hpyIM基因之间, 根据基因结构和编码产物的不同, 将iceA基因分为2大类, 即iceA1和iceA2, 二者的序列结构相差极大(图1).
完整的iceA1基因(图1A)全长约为684 bp, 与奈瑟菌属的nlaIIIR基因有相似性(约60%)[22,23], nlaIIIR编码的蛋白质NlaIIIR由230个氨基酸组成, 是一种限制性核酸内切酶, 能特异性作用于DNA链上的CATG序列[28]. 完整的iceA1基因编码的产物由228个氨基酸组成. 研究表明该蛋白质亦有NlaIIIR样的CATG剪切活性[29,30]. 构成iceA1的核苷酸序列可分为高度多变的ORF1区和相对保守的ORF2区两部分, 通过序列分析及蛋白质表达研究发现[30-33], 该基因转录起始位点为ORF1区起始处的ATG密码子, 终止密码子为基因末端的TAG序列. 由于iceA基因的碱基序列高度多变, 并且将近80%菌株在该基因上存在框移突变(主要发生在ORF1区), 导致转录提前终止, 因此不能表达出有功能的蛋白质产物, 属于假基因(图1B), 只有完整的iceA1序列才能表达出具有NlaIIIR样限制性核酸内切酶活性的蛋白质. iceA2基因序列与iceA1约有40%相似性[22,23], 但基因结构完全不同(图1C). 位于iceA2基因两端编码14个氨基酸和10个氨基酸的碱基序列较为保守, 中间区序列高度多变, 含有0-3个重复片段, 该片段由105 bp构成, 因此iceA2基因长度可分为4种(124 bp, 229 bp, 334 bp, 439 bp)[31]. 该基因上游区域中含有一段可变数量的串联重复序列(VNTR序列), 转录起始密码子ATG位于VNTR序列末端的保守区域内. 由于iceA2基因主要由无意义的重复片段构成, 不能编码有功能蛋白质, 因此该基因亦属于无功能基因.
iceA1基因末端与下游的hpyIM基因起始端之间有8 bp组成的高度保守区相连, H. pylori hpyIM基因长约990 bp, 有2个转录起始位点, 其转录水平受iceA1基因的调控[34]. hpyIM基因产物蛋白为腺嘌呤甲基化酶, 能特异性识别CATG序列, 有效防止自身DNA链被限制性核酸内切酶降解. 该蛋白与完整的iceA1基因产物可能形成II型限制-修饰系统, 这一系统已在多种细菌中发现[35-38]. 由于绝大多数iceA1基因编码的蛋白产物不具有NlaIIIR样的核酸内切酶活性, 故H. pylori iceA1- hpyIM基因形成的限制-修饰系统是无功能的[39]. iceA1基因的ORF1区域含有大量框移突变, 因此在ORF2转录起始区与上游的cysE基因末端之间存在一段由315-394 bp组成的高变区. cysE基因编码产物为丝氨酸乙酰转移酶同系物, 该基因含有516 bp,其中G+C含量约50%, 远远高于iceA1与hpyIM基因的G+C含量(约36%)[32]. iceA2基因末端与下游hpyIM基因起始端之间含有约335 bp的相对保守区, 其中将近77%核苷酸序列一致[31]. iceA2菌株的hpyIM基因只有一个转录起始点, 该基因的转录水平较iceA1链hpyIM基因低[34]. iceA2转录起始位点与cysE基因末端之间的碱基数量不等(224-338 bp), 其中含有高度保守的VNTR序列(可变数量的串联重复序列), 该序列由1-15个8 bp重复片段组成, iceA2基因的转录起始密码子位于VNTR序列下游的90 bp中[32].
iceA阳性H. pylori导致宿主临床疾病的发生是多因素共同作用的结果. 人们对iceA基因编码产物所引发临床疾病的具体致病机制的研究还处于初级阶段. 研究显示, 当H. pylori与宿主胃黏膜上皮接触后iceA1基因表达上调, 完整的iceA1转录产物有NlaIIIR蛋白样的限制性核酸内切酶活性, 能特异性剪切DNA片段上的CATG序列, 其下游的hpyIM基因产物能有效识别并防止自身DNA序列被降解, 但该种iceA1基因产物不能被分泌到细胞外, 因此可能不直接参与细胞损伤的病理过程. iceA1阳性菌株最终可引起胃黏膜上皮内中性粒细胞浸润, 产生的IL-8浓度增高, 导致黏膜炎症程度加重及消化性溃疡病的发生, 其具体致病机制仍需做进一步研究[22,23,31,33,40,41]. iceA2阳性菌株与临床疾病的发生无相关性. 在Caner等[42]的研究中发现, 从患有消化性溃疡病的患者胃黏膜中分离出的H. pylori菌株, 大多数(68.8%)含有iceA1基因, 统计学分析后表明, iceA1菌株的感染与消化性溃疡病的发生有显著相关性, 这与之前Peek等[22]的观点一致, 但东亚国家[24,25,43-45]的此类研究并未发现iceA1菌株的感染与临床病变的严重程度相关, 认为iceA1基因不能作为预测H. pylori导致临床疾病发生的标志. 目前的研究大多是通过统计学方法来分析iceA1毒力菌株的感染与消化性疾病发生的相关性, 在该毒力因素引发临床疾病发生的具体分子生物学机制方面仍需进行深入的探索. 细菌的毒力因素包括蛋白介质的形成和入侵, 细菌的持续感染及对宿主的长期损害[46]. 因此, iceA1阳性菌株感染导致临床疾病的发生, 除了与菌株自身基因型的多样性和异质性有关外, 与H. pylori持续感染时间(宿主年龄因素)以及不同地区不同种族宿主对外界刺激的反应及防御能力也具有相关性.
世界七大板块中, 除南极洲无常驻人口外, 其他各大洲均有人类定居几百年甚至上千年, 而H. pylori定植人体也有数百至上千年历史. H. pylori的基因组具有高度多样性和异质性, 这是与宿主长期共同演变进化的结果. 不同地区流行的H. pylori基因组结构明显不同, 而基因组多样性则影响细菌毒力因子的功能及抗原形成, 即在细菌进化过程中, 毒力因素也存在生物-地理变异[47]. 例如, 在西方欧美国家, 有将近60%的H. pylori菌株含有cagA基因, 并且有证据表明, 该毒力因素与消化性溃疡病及胃癌的发生关系密切; 而在东亚国家, cagA基因几乎存在于所有的H. pylori中[48,49], 但绝大多数携带者并没有产生临床症状. vacA基因也是如此, 如vacAs1a常见于美国、欧洲北部等国家, vacAs1b多见于拉丁美洲、葡萄牙及西班牙人口中, 而vacAs1c则几乎只在东亚人群中发现[50-53].
iceA基因在各大洲也存在地域性分布差异. 在亚洲(中国、韩国、日本、泰国、印度、马来西亚、新加坡), iceA1基因占主导地位, 各地区的统计学调查显示, 在东亚、南亚绝大多数国家, iceA1菌株与临床疾病的发生无相关性[24,25,43,44,54-59]. 但在亚洲西部(土耳其、沙特阿拉伯)国家的研究表明, iceA1阳性菌株能导致临床病理结局的发生, 并且该地区iceA2基因的表达率也显著高于东南亚地区[42,60]. 在美洲(美国、哥伦比亚、巴西)则以iceA2基因为主[22,24,61], 并且不同地区的iceA2基因序列构成不同, 在北美洲(美国)iceA2主要由229 bp构成, 而南美洲(哥伦比亚)的基因多含有334 bp. 在美国进行的一项研究指出, iceA1阳性菌株能够导致宿主黏膜上皮细胞发生炎症反应, 加重中性粒细胞的浸润程度, 引起严重临床疾病发生[22]. 但在其他地区的调查尚不支持此观点[24,61]. 欧洲大陆东北部与亚洲相连, 西部则靠近美洲大陆, 欧洲的H. pylori菌株与亚洲和美洲印第安人菌株均表现出亲缘性[47,62]. 欧洲东北部各国(荷兰、保加利亚、英国)大部分地区以iceA1基因为主导[23,47,63], 这与亚洲大陆表现较为一致, 在荷兰有学者认为iceA1毒力菌株的感染与消化性溃疡病的发生有相关性[23]. 欧洲西南部地区(葡萄牙、西班牙)则以iceA2基因为主[64,65], 在葡萄牙进行的研究中发现iceA1毒力因素的表达与临床疾病的发生之间有统计学意义, 这与北美洲研究结果一致. 与亚洲大陆相比, 欧洲东北部虽以iceA1基因为主导, 但iceA1的表达率明显低于亚洲, 而iceA2阳性菌株相对较多; 同时与美洲大陆相比, 欧洲西南部国家基因型虽以iceA2为主, 但阳性率远低于美洲地区, 而iceA1表达较高. 这一现象表明, 欧洲流行的H. pylori菌株与亚洲及美洲菌株均表现出相似性, 其表达的iceA基因序列介于亚洲和欧洲之间. 非洲中北部地区(尼日利亚、突尼斯)以iceA1为主导[66,67], iceA1表达率显著高于iceA2基因, 对分离的H. pylori菌株进行统计学分析得出结论, 该地区iceA1菌株感染与临床疾病的发生无相关性, 且iceA1基因与亚洲菌株有流行病学相似之处. 但在南非地区iceA1、iceA2基因型的表达率均很高[68], 以iceA2为主, 同时有较高水平的iceA1、iceA2基因混合感染.
总体来说, iceA基因的分布存在地域性差异, 在亚洲、非洲主要表达为iceA1基因, 在美洲大陆则以iceA2为主导, 而欧洲大陆的iceA基因则表现出与亚洲、美洲菌株的相似性. 在大多数地区的研究中未发现iceA1毒力菌株感染与临床疾病发生的因果联系, 但在美国、荷兰、南非等少数研究中指出, iceA1是H. pylori致病的毒力因素之一, 认为iceA1菌株能加重胃壁黏膜细胞的炎症程度, 与消化性溃疡病的发生关系密切.
人类发现H. pylori已有二十多年历史, 对其毒力基因(如cagA、vacA)的致病机制已进行了较为系统全面的研究和阐述, 但对新的毒力因素iceA1的研究还处于初级阶段, 该毒力菌株与临床疾病的相关性仍存在争议. 因此, 对其致病机理进行更为深入的研究能更好地解释iceA1菌株感染与临床疾病发生的因果联系. 目前, 还没有获得完整的iceA基因地域差异性分布资料, 如大洋洲、亚洲及北美洲以北广大地区iceA基因分布及该毒力因素与当地人口临床疾病发生的相关性还未知, 有待做进一步调查研究以阐明地域分布差异的原因. 随着这些问题的解决, 我们将更全面深刻的认识H. pylori对人类的致病作用, 为研究微生物的地域问题提供参考.
幽门螺杆菌(H. pylori)感染与胃癌的发生密切相关, 其毒力相关基因cagA、vacA的致病机制已被分子生物学、组织学和流行病学证实. 近年研究发现H. pylori iceA基因也是一种潜在的毒力相关因素, 但其确切的致病机制仍未明, 有待进一步解决.
白爱平, 副教授, 南昌大学第一附属医院消化内科
目前已通过分子生物学技术阐明iceA基因的结构特征, 但对其具体致病机制的研究仍处于初级阶段, 主要通过流行病学统计方法分析该毒力因素与消化系疾病发生的相关性.
近年来许多学者都对iceA基因的结构特征、发病机制进行了研究, 认为该毒力因素与临床疾病发生的严重程度密切相关, 但各家报道对该结论仍存在争议.
本文全面地阐述了H. pylori iceA基因的结构特征, 对iceA毒力菌株与临床疾病的相关性特别是该基因的地域分布规律进行了描述.
iceA阳性H. pylori与消化性疾病的发生有相关性.对iceA基因具体致病机制及地域分布规律进行进一步研究对胃癌的预防及治疗提供思路.
本综述内容较为新颖, 全面阐述了H. pylori iceA基因的研究现状和最新进展, 具有较好的参考价值.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Covacci A, Telford JL, Del Giudice G, Parsonnet J, Rappuoli R. Helicobacter pylori virulence and genetic geography. Science. 1999;284:1328-1333. [PubMed] |
| 2. | Graham DY, Yamaoka Y. H.pylori and cagA: relationships with gastric cancer, duodenal ulcer, and reflux esophagitis and its complications. Helicobacter. 1998;3:145-151. [PubMed] |
| 3. | Wen S, Moss SF. Helicobacter pylori virulence factors in gastric carcinogenesis. Cancer Lett. 2009;282:1-8. [PubMed] |
| 4. | Parkin DM. The global health burden of infection-associated cancers in the year 2002. Int J Cancer. 2006;118:3030-3044. [PubMed] |
| 5. | Venkateshwari A, Krishnaveni D, Venugopal S, Shashikumar P, Vidyasagar A, Jyothy A. Helicobacter pylori infection in relation to gastric cancer progression. Indian J Cancer. 2011;48:94-98. [PubMed] |
| 6. | Sachs G, Wen Y, Scott DR. Gastric infection by Helicobacter pylori. Curr Gastroenterol Rep. 2009;11:455-461. [PubMed] |
| 7. | Hatakeyama M. Helicobacter pylori and gastric carcinogenesis. J Gastroenterol. 2009;44:239-248. [PubMed] |
| 8. | Blaser MJ, Perez-Perez GI, Kleanthous H, Cover TL, Peek RM, Chyou PH, Stemmermann GN, Nomura A. Infection with Helicobacter pylori strains possessing cagA is associated with an increased risk of developing adenocarcinoma of the stomach. Cancer Res. 1995;55:2111-2115. [PubMed] |
| 9. | Gerhard M, Lehn N, Neumayer N, Borén T, Rad R, Schepp W, Miehlke S, Classen M, Prinz C. Clinical relevance of the Helicobacter pylori gene for blood-group antigen-binding adhesin. Proc Natl Acad Sci U S A. 1999;96:12778-12783. [PubMed] |
| 10. | Parsonnet J, Friedman GD, Orentreich N, Vogelman H. Risk for gastric cancer in people with CagA positive or CagA negative Helicobacter pylori infection. Gut. 1997;40:297-301. [PubMed] |
| 11. | Hamlet A, Thoreson AC, Nilsson O, Svennerholm AM, Olbe L. Duodenal Helicobacter pylori infection differs in cagA genotype between asymptomatic subjects and patients with duodenal ulcers. Gastroenterology. 1999;116:259-268. [PubMed] |
| 12. | Hatakeyama M. SagA of CagA in Helicobacter pylori pathogenesis. Curr Opin Microbiol. 2008;11:30-37. [PubMed] |
| 13. | Rhead JL, Letley DP, Mohammadi M, Hussein N, Mohagheghi MA, Eshagh Hosseini M, Atherton JC. A new Helicobacter pylori vacuolating cytotoxin determinant, the intermediate region, is associated with gastric cancer. Gastroenterology. 2007;133:926-936. [PubMed] |
| 14. | Ogiwara H, Graham DY, Yamaoka Y. vacA i-region subtyping. Gastroenterology. 2008;134:1267; author reply 1268. [PubMed] |
| 15. | Jang S, Jones KR, Olsen CH, Joo YM, Yoo YJ, Chung IS, Cha JH, Merrell DS. Epidemiological link between gastric disease and polymorphisms in VacA and CagA. J Clin Microbiol. 2010;48:559-567. [PubMed] |
| 16. | Jones KR, Whitmire JM, Merrell DS. A Tale of Two Toxins: Helicobacter Pylori CagA and VacA Modulate Host Pathways that Impact Disease. Front Microbiol. 2010;1:115. [PubMed] |
| 17. | Atherton JC, Cao P, Peek RM, Tummuru MK, Blaser MJ, Cover TL. Mosaicism in vacuolating cytotoxin alleles of Helicobacter pylori. Association of specific vacA types with cytotoxin production and peptic ulceration. J Biol Chem. 1995;270:17771-17777. [PubMed] |
| 18. | Atherton JC, Peek RM, Tham KT, Cover TL, Blaser MJ. Clinical and pathological importance of heterogeneity in vacA, the vacuolating cytotoxin gene of Helicobacter pylori. Gastroenterology. 1997;112:92-99. [PubMed] |
| 19. | Basso D, Zambon CF, Letley DP, Stranges A, Marchet A, Rhead JL, Schiavon S, Guariso G, Ceroti M, Nitti D. Clinical relevance of Helicobacter pylori cagA and vacA gene polymorphisms. Gastroenterology. 2008;135:91-99. [PubMed] |
| 20. | Miehlke S, Kirsch C, Agha-Amiri K, Günther T, Lehn N, Malfertheiner P, Stolte M, Ehninger G, Bayerdörffer E. The Helicobacter pylori vacA s1, m1 genotype and cagA is associated with gastric carcinoma in Germany. Int J Cancer. 2000;87:322-327. [PubMed] |
| 21. | Sheu SM, Sheu BS, Yang HB, Li C, Chu TC, Wu JJ. Presence of iceA1 but not cagA, cagC, cagE, cagF, cagN, cagT, or orf13 genes of Helicobacter pylori is associated with more severe gastric inflammation in Taiwanese. J Formos Med Assoc. 2002;101:18-23. [PubMed] |
| 22. | Peek RM, Thompson SA, Donahue JP, Tham KT, Atherton JC, Blaser MJ, Miller GG. Adherence to gastric epithelial cells induces expression of a Helicobacter pylori gene, iceA, that is associated with clinical outcome. Proc Assoc Am Physicians. 1998;110:531-544. [PubMed] |
| 23. | van Doorn LJ, Figueiredo C, Sanna R, Plaisier A, Schneeberger P, de Boer W, Quint W. Clinical relevance of the cagA, vacA, and iceA status of Helicobacter pylori. Gastroenterology. 1998;115:58-66. [PubMed] |
| 24. | Yamaoka Y, Kodama T, Gutierrez O, Kim JG, Kashima K, Graham DY. Relationship between Helicobacter pylori iceA, cagA, and vacA status and clinical outcome: studies in four different countries. J Clin Microbiol. 1999;37:2274-2279. [PubMed] |
| 25. | Ito Y, Azuma T, Ito S, Suto H, Miyaji H, Yamazaki Y, Kato T, Kohli Y, Keida Y, Kuriyama M. Sequence analysis and clinical significance of the iceA gene from Helicobacter pylori strains in Japan. J Clin Microbiol. 2000;38:483-488. [PubMed] |
| 26. | Amjad N, Osman HA, Razak NA, Kassian J, Din J, bin Abdullah N. Clinical significance of Helicobacter pylori cagA and iceA genotype status. World J Gastroenterol. 2010;16:4443-4447. [PubMed] |
| 27. | Ciftci IH, Uslan I, Dilek FH, Aşık G, Ozgür MA, Dilek ON. [Investigation of Helicobacter pylori iceA1 and iceA2 genes in patients with chronic gastritis and gastric cancer]. Mikrobiyol Bul. 2011;45:228-233. [PubMed] |
| 28. | Morgan RD, Camp RR, Wilson GG, Xu SY. Molecular cloning and expression of NlaIII restriction-modification system in E. coli. Gene. 1996;183:215-218. [PubMed] |
| 29. | Xu Q, Peek RM, Miller GG, Blaser MJ. The Helicobacter pylori genome is modified at CATG by the product of hpyIM. J Bacteriol. 1997;179:6807-6815. [PubMed] |
| 30. | Xu Q, Morgan RD, Roberts RJ, Xu SY, van Doorn LJ, Donahue JP, Miller GG, Blaser MJ. Functional analysis of iceA1, a CATG-recognizing restriction endonuclease gene in Helicobacter pylori. Nucleic Acids Res. 2002;30:3839-3847. [PubMed] |
| 31. | Figueiredo C, Quint WG, Sanna R, Sablon E, Donahue JP, Xu Q, Miller GG, Peek RM, Blaser MJ, van Doorn LJ. Genetic organization and heterogeneity of the iceA locus of Helicobacter pylori. Gene. 2000;246:59-68. [PubMed] |
| 32. | Donahue JP, Peek RM, Van Doorn LJ, Thompson SA, Xu Q, Blaser MJ, Miller GG. Analysis of iceA1 transcription in Helicobacter pylori. Helicobacter. 2000;5:1-12. [PubMed] |
| 33. | Peek RM, van Doorn LJ, Donahue JP, Tham KT, Figueiredo C, Blaser MJ, Miller GG. Quantitative detection of Helicobacter pylori gene expression in vivo and relationship to gastric pathology. Infect Immun. 2000;68:5488-5495. [PubMed] |
| 34. | Xu Q, Blaser MJ. Promoters of the CATG-specific methyltransferase gene hpyIM differ between iceA1 and iceA2 Helicobacter pylori strains. J Bacteriol. 2001;183:3875-3884. [PubMed] |
| 35. | Saunders NJ, Jeffries AC, Peden JF, Hood DW, Tettelin H, Rappuoli R, Moxon ER. Repeat-associated phase variable genes in the complete genome sequence of Neisseria meningitidis strain MC58. Mol Microbiol. 2000;37:207-215. [PubMed] |
| 36. | Dybvig K, Sitaraman R, French CT. A family of phase-variable restriction enzymes with differing specificities generated by high-frequency gene rearrangements. Proc Natl Acad Sci U S A. 1998;95:13923-13928. [PubMed] |
| 37. | Wilson GG, Organization of restriction-modification systems. Nucleic Acids Res. 1991;19:2539-2566. [PubMed] |
| 38. | Hood DW, Deadman ME, Jennings MP, Bisercic M, Fleischmann RD, Venter JC, Moxon ER. DNA repeats identify novel virulence genes in Haemophilus influenzae. Proc Natl Acad Sci U S A. 1996;93:11121-11125. [PubMed] |
| 39. | Xu Q, Morgan RD, Roberts RJ, Blaser MJ. Identification of type II restriction and modification systems in Helicobacter pylori reveals their substantial diversity among strains. Proc Natl Acad Sci U S A. 2000;97:9671-9676. [PubMed] |
| 40. | Ramis IB, Fonseca TL, de Moraes EP, Fernandes MS, Mendoza-Sassi R, Rodrigues O, Juliano CR, Scaini CJ, da Silva PE. Molecular Basis of pathogenicity in Helicobacter pylori clinical isolates. J Clin Microbiol. 2010;48:3776-3778. [PubMed] |
| 41. | Ma YJ, Duan GC, Zhang RG, Fan QT, Zhang WD. Mutation of iceA in Helicobacter pylori compromised IL-8 induction from human gastric epithelial cells. J Basic Microbiol. 2010;50 Suppl 1:S83-S88. [PubMed] |
| 42. | Caner V, Yilmaz M, Yonetci N, Zencir S, Karagenc N, Kaleli I, Bagci H. H pylori iceA alleles are disease-specific virulence factors. World J Gastroenterol. 2007;13:2581-2585. [PubMed] |
| 43. | Han YH, Liu WZ, Zhu HY, Xiao SD. Clinical relevance of iceA and babA2 genotypes of Helicobacter pylori in a Shanghai population. Chin J Dig Dis. 2004;5:181-185. [PubMed] |
| 44. | Wong BC, Yin Y, Berg DE, Xia HH, Zhang JZ, Wang WH, Wong WM, Huang XR, Tang VS, Lam SK. Distribution of distinct vacA, cagA and iceA alleles in Helicobacter pylori in Hong Kong. Helicobacter. 2001;6:317-324. [PubMed] |
| 45. | Zheng PY, Hua J, Yeoh KG, Ho B. Association of peptic ulcer with increased expression of Lewis antigens but not cagA, iceA, and vacA in Helicobacter pylori isolates in an Asian population. Gut. 2000;47:18-22. [PubMed] |
| 46. | Merrell DS, Falkow S. Frontal and stealth attack strategies in microbial pathogenesis. Nature. 2004;430:250-256. [PubMed] |
| 47. | Kauser F, Hussain MA, Ahmed I, Srinivas S, Devi SM, Majeed AA, Rao KR, Khan AA, Sechi LA, Ahmed N. Comparative genomics of Helicobacter pylori isolates recovered from ulcer disease patients in England. BMC Microbiol. 2005;5:32. [PubMed] |
| 48. | Mizushima T, Sugiyama T, Komatsu Y, Ishizuka J, Kato M, Asaka M. Clinical relevance of the babA2 genotype of Helicobacter pylori in Japanese clinical isolates. J Clin Microbiol. 2001;39:2463-2465. [PubMed] |
| 49. | Yamaoka Y. Mechanisms of disease: Helicobacter pylori virulence factors. Nat Rev Gastroenterol Hepatol. 2010;7:629-641. [PubMed] |
| 50. | van Doorn LJ, Figueiredo C, Sanna R, Pena S, Midolo P, Ng EK, Atherton JC, Blaser MJ, Quint WG. Expanding allelic diversity of Helicobacter pylori vacA. J Clin Microbiol. 1998;36:2597-2603. [PubMed] |
| 51. | Yamaoka Y. Helicobacter pylori typing as a tool for tracking human migration. Clin Microbiol Infect. 2009;15:829-834. [PubMed] |
| 52. | Yamaoka Y, Orito E, Mizokami M, Gutierrez O, Saitou N, Kodama T, Osato MS, Kim JG, Ramirez FC, Mahachai V. Helicobacter pylori in North and South America before Columbus. FEBS Lett. 2002;517:180-184. [PubMed] |
| 53. | Sugimoto M, Yamaoka Y. The association of vacA genotype and Helicobacter pylori-related disease in Latin American and African populations. Clin Microbiol Infect. 2009;15:835-842. [PubMed] |
| 54. | Perng CL, Lin HJ, Sun IC, Tseng GY. Helicobacter pylori cagA, iceA and vacA status in Taiwanese patients with peptic ulcer and gastritis. J Gastroenterol Hepatol. 2003;18:1244-1249. [PubMed] |
| 55. | Nishiya D, Shimoyama T, Fukuda S, Yoshimura T, Tanaka M, Munakata A. Evaluation of the clinical relevance of the iceA1 gene in patients with Helicobacter pylori infection in Japan. Scand J Gastroenterol. 2000;35:36-39. [PubMed] |
| 56. | Chomvarin C, Namwat W, Chaicumpar K, Mairiang P, Sangchan A, Sripa B, Tor-Udom S, Vilaichone RK. Prevalence of Helicobacter pylori vacA, cagA, cagE, iceA and babA2 genotypes in Thai dyspeptic patients. Int J Infect Dis. 2008;12:30-36. [PubMed] |
| 57. | Mukhopadhyay AK, Kersulyte D, Jeong JY, Datta S, Ito Y, Chowdhury A, Chowdhury S, Santra A, Bhattacharya SK, Azuma T. Distinctiveness of genotypes of Helicobacter pylori in Calcutta, India. J Bacteriol. 2000;182:3219-3227. [PubMed] |
| 58. | Wu CC, Chou PY, Hu CT, Liu ZC, Lin CY, Tseng YH, Lin NT. Clinical Relevance of the vacA, iceA, cagA, and flaA genes of Helicobacter pylori strains isolated in Eastern Taiwan. J Clin Microbiol. 2005;43:2913-2915. [PubMed] |
| 59. | Kim SY, Woo CW, Lee YM, Son BR, Kim JW, Chae HB, Youn SJ, Park SM. Genotyping CagA, VacA subtype, IceA1, and BabA of Helicobacter pylori isolates from Korean patients, and their association with gastroduodenal diseases. J Korean Med Sci. 2001;16:579-584. [PubMed] |
| 60. | Momenah AM, Tayeb MT. Helicobacter pylori cagA and iceA genotypes status and risk of peptic ulcer in Saudi patients. Saudi Med J. 2007;28:382-385. [PubMed] |
| 61. | Ashour AA, Collares GB, Mendes EN, de Gusmão VR, Queiroz DM, Magalhães PP, de Carvalho AS, de Oliveira CA, Nogueira AM, Rocha GA. iceA genotypes of Helicobacter pylori strains isolated from Brazilian children and adults. J Clin Microbiol. 2001;39:1746-1750. [PubMed] |
| 62. | Ghose C, Perez-Perez GI, Dominguez-Bello MG, Pride DT, Bravi CM, Blaser MJ. East Asian genotypes of Helicobacter pylori strains in Amerindians provide evidence for its ancient human carriage. Proc Natl Acad Sci U S A. 2002;99:15107-15111. [PubMed] |
| 63. | Boyanova L, Yordanov D, Gergova G, Markovska R, Mitov I. Association of iceA and babA genotypes in Helicobacter pylori strains with patient and strain characteristics. Antonie Van Leeuwenhoek. 2010;98:343-350. [PubMed] |
| 64. | Nogueira C, Figueiredo C, Carneiro F, Gomes AT, Barreira R, Figueira P, Salgado C, Belo L, Peixoto A, Bravo JC. Helicobacter pylori genotypes may determine gastric histopathology. Am J Pathol. 2001;158:647-654. [PubMed] |
| 65. | Araya JC, Anabalón L, Roá I, Bravo M, Villaseca MA, Guzmán P, Roa JC. [Association between Helicobacter pylori genotype and the severity of gastritis in infected adults]. Rev Med Chil. 2004;132:1345-1354. [PubMed] |
| 66. | Smith SI, Kirsch C, Oyedeji KS, Arigbabu AO, Coker AO, Bayerdöffer E, Miehlke S. Prevalence of Helicobacter pylori vacA, cagA and iceA genotypes in Nigerian patients with duodenal ulcer disease. J Med Microbiol. 2002;51:851-854. [PubMed] |
| 67. | Ben Mansour K, Fendri C, Zribi M, Masmoudi A, Labbene M, Fillali A, Ben Mami N, Najjar T, Meherzi A, Sfar T. Prevalence of Helicobacter pylori vacA, cagA, iceA and oipA genotypes in Tunisian patients. Ann Clin Microbiol Antimicrob. 2010;9:10. [PubMed] |