修回日期: 2011-10-11
接受日期: 2011-10-14
在线出版日期: 2011-10-18
miR-200家族(miR-200a、miR-200b、miR-200c、miR-141、miR-429)是众多已被发现的microRNA中的一员, 其在上皮来源肿瘤的增殖、侵袭、转移中的作用成为近年来的研究热点之一, 本文对miR-200家族在同为上皮来源的消化系肿瘤中的研究进展进行了综述.
引文著录: 杜平, 张庆瑜. miR-200家族在消化系肿瘤中的研究进展. 世界华人消化杂志 2011; 19(29): 3053-3057
Revised: October 11, 2011
Accepted: October 14, 2011
Published online: October 18, 2011
The miR-200 family (including miR-200a, miR-200b, miR-200c, miR-141, and miR-429) play important roles in proliferation, invasion and metastasis of tumors of epithelial origin. Gastrointestinal tumors belong to a group of tumors of epithelial origin. This article reviews the latest advances in understanding the relationship between the miR-200 family and gastrointestinal tumors.
- Citation: Du P, Zhang QY. miR-200 family and gastrointestinal tumors. Shijie Huaren Xiaohua Zazhi 2011; 19(29): 3053-3057
- URL: https://www.wjgnet.com/1009-3079/full/v19/i29/3053.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i29.3053
microRNA是一类长度约22个核苷酸左右的小分子非编码RNA, 以转录后调节的方式改变靶基因的表达水平. miRNA通常由RNA聚合酶Ⅱ转录生成双链pri-miRNA, 后者经Drosha酶在核中切割形成70个核苷酸左右的双链pre-miRNA[1,2]. 并在exportin-5等分子的作用下转运出核, 在细胞质中由Dicer酶等加工为成熟的miRNA[3,4], 最后成熟的单链miRNA分子与Argonaute蛋白等形成RNA诱导的沉默复合体(RNA-induced silencing complex, RISC), 并作用于特异mRNA的3'UTR(非编码区)从而抑制翻译过程的进行或直接降解mRNA[5,6]. miRNA对靶基因的作用方式分为2种, 一种是通过与靶基因的完全互补配对而直接导致mRNA的降解; 一种是通过与靶基因的不完全互补结合, 抑制翻译过程. miRNA通过调节靶基因的表达, 在多种细胞进程(如细胞的分化、增殖、生长、迁移、存活等)中具有重要作用, 进而调节机体内多种病理和生理过程[7].
miR-200家族包括miR-200a、miR-200b、miR-200c、miR-141和miR-429五个成员. 根据不同的功能及"种子区"序列(第2-7位核酸)的差异, miR-200家族可分为2个亚家族: 分别为miR-200a/miR-141和miR-200b/miR-200c/miR-429; 而根据不同的基因组定位, miR-200家族又可分为2个簇: miR-200a/miR-200b/miR-429基因簇定位于1号染色体, 而miR-200c/miR-141基因簇定位于12号染色体[8]. miR-200家族成员在多种上皮来源肿瘤中的表达及功能成为目前研究热点, 在不同的肿瘤细胞系及组织中, miR-200家族成员的表达并不完全相同.
上皮间质转化(epithelial-mesenchymal transition, EMT)是上皮细胞失去其极性和细胞间连结, 重组其细胞骨架, 表达间质细胞标志物, 并显示出侵袭特性的横向分化过程[9]. EMT在胚胎发育, 创伤修复与组织再生, 上皮来源肿瘤的转移与侵袭过程中均发挥着重要作用[8-11]. 多种因子可诱导肿瘤细胞发生EMT, 如转化生长因子β(TGF-β)[12], Met(一种酪氨酸激酶受体), BCL9-2[10]等. 发生EMT的肿瘤细胞, 除了形态学上的变化, 功能上也发生相应变化, 如更强的侵袭性和迁移能力, 对失巢凋亡的抵抗[13]等. 在分子水平上, 通常作为发生EMT标志的有表达降低的上皮钙粘素(E-cadherin), 含量升高的波形蛋白(vimentin)和神经钙黏素(N-cadherin), β-连环素(β-catenin)的细胞核定位, 同时还有促进EMT发生的转录因子如Snail1(Snail), Snail2(Slug), Twist, EF1/ZEB1, SIP1/ZEB2表达升高等[10]. Park等[8]通过对60种不同肿瘤细胞系的研究, 认为miR-200家族成员是肿瘤细胞中EMT过程的关键调控因子, 与维持细胞的上皮特性密切相关, miR-200低表达可引起EMT发生[8,14]. Chen等[15]也报道了在卵巢癌中, 过度表达的miR-429可以逆转EMT过程而诱导间质上皮转化(mesenchymal-epithelial transition, MET).
E-cadherin(CDH1)是依赖钙离子的跨膜糖蛋白, 与上皮细胞间的黏附相关, 同时还可与α-catenin, β-catenin等相互作用, 是上皮细胞的分子标志物之一. E-cadherin表达降低是EMT的重要标志之一[10]. 多种促进EMT发生的转录因子如ZEB1, Snail等通过结合到其启动子区的E-box来抑制其转录[16,17]. Matsumura等[18]证实肝癌、胃癌等多种肿瘤中E-cadherin表达减弱与侵袭转移相关. miR-200家族表达升高可使多种肿瘤细胞系E-cadherin表达升高并降低其侵袭性[8,14,19].
ZEB1和ZEB2(SIP1)同为含有锌指结构, 能结合到靶基因启动子区E-box的转录因子. 二者通过与E-caherin基因启动子区结合, 抑制其转录, 从而降低E-caherin蛋白表达, 促进EMT的发生[16,20]. Bindels等[21]报道ZEB2可激活vimentin的启动子, 引起vimentin的过表达. miR-200家族主要通过结合二者mRNA的3'非编码区(3'UTR)来抑制ZEB1和ZEB2的表达, 进而提高E-caherin水平, 从而逆转EMT过程, 降低瘤细胞的侵袭和迁移能力[8]. Hurteau等[22]以及Christoffersen等[23]分别报道, miR-200家族主要促使ZEB1和ZEB2 mRNA降解来抑制二者表达. Bracken等[20]在犬肾MDCK细胞系和人类乳腺癌细胞系中报道了ZEB1-SIP1可抑制miR-200a、miR-200b和miR-429的表达. Burk等[24]也在乳腺癌, 直肠癌, 胰腺癌细胞系中证实了ZEB1可抑制miR-141, miR-200c的转录. 以上研究表明, miR-200家族与ZEB1/SIP1间存在着一个双向负反馈调节的环路.
Wnt/β-catenin通路与包括直肠癌在内的多种肿瘤的发生发展密切相关[27], 正常情况下由GSK3β, APC, Axin, CK1组成的复合物使β-catenin的氨基末端磷酸化, 从而促使β-catenin在胞浆中的泛素化蛋白酶体降解[28]. 当Wnt配体存在时, 并在其受体卷曲蛋白(Fzd)及低密度脂蛋白受体相关蛋白5/6(LRP5/6)的共同作用下, 或者降解复合物的组分发生基因突变或失活时, 非磷酸化的β-catenin在细胞浆聚集并进入细胞核, 与TCF/LEF家族成员形成复合物, 在其他共激活因子的协同下, 激活下游基因的转录[29], 如c-Myc[30], 细胞周期蛋白D1(cyclin D1)基因[31]等. 这些基因的产物与细胞增殖, 肿瘤发生密切相关[30,31]. Saydam等[32]报道, 在人脑脊膜瘤细胞中, miR-200a的下调导致β-catenin和cyclin D1表达的升高, 同时β-catenin的mRNA是miR-200a的直接靶点, miR-200a可抑制其翻译, 进而抑制Wnt通路激活, 抑制细胞增殖. 他们还认为, 升高的E-caherin与β-catenin在细胞膜上结合, 参与细胞间黏附, 减少了β-catenin在胞浆内的聚集及其核转移, 进而抑制Wnt/β-catenin通路的活性.
众所周知, Barrett's食管为食管癌的癌前病变. Smith等[33]报道, Barrett's食管上皮细胞中的miR-200家族成员表达低于正常的胃黏膜或十二指肠黏膜上皮, 同时miR-200家族的异常表达与食管上皮异型增生以及腺癌的发生密切相关.
4.2 胃癌
Du等[34]证实在胃癌组织和胃癌细胞系中miR-141表达下降, 并且过表达的miR-141可明显抑制胃癌细胞系MGC-803的生长. Shinozaki等[35]最近报道在手术切除的胃癌组织中, miR-200a和miR-200b表达水平下调, 同时证实了EB病毒相关胃癌组织中miR-200a和miR-200b含量下降. 王驰等[36]也报道miR-200b对胃癌细胞系MGC-803的生长有调节作用, 提高miR-200b含量可抑制其生长, 他们还认为这种抑制作用可能与Bcl-2蛋白表达减少有关.
Li等[37]报道, 在大部分胰腺癌细胞系中, 检测到了miR-200a和miR-200b基因甲基化减少以及二者的过度表达, SIP1基因启动子甲基化导致的表达下调, 同时伴随有E-cadherin的表达下调.
Meng等[38]报道, 在胆管癌细胞系中, miR-21、miR-200b、miR-141过度表达, 并发现抑制miR-200b、miR-21可提高癌细胞对化疗药吉西他滨的敏感性. 而降低miR-141的表达可抑制肿瘤细胞的增殖. 经吉西他滨处理的肿瘤细胞, miR-200b、miR-21在体内外试验中均有明显升高, 然而在裸鼠移植瘤模型上, miR-141表达减少.
多个实验室的体内外试验均证实, miR-200家族的高表达可降低多种肿瘤初期的增殖, 侵袭和转移能力[15,16,19,26]. 然而Dykxhoorn等[41]也报道了在裸鼠移植瘤模型中, 高表达miR-200家族成员的鼠乳腺癌细胞, 拥有更强的肺转移和成瘤能力, 同时此类细胞中E-cadherin高表达. 说明至少在某些类型的肿瘤细胞中, miR-200家族可能促进其远端转移.
Li等[37]报道, 与健康人相比, 胰腺癌患者血清中的miR-200a和miR-200b含量显著升高, 提示了miR-200家族在某些肿瘤诊断中的潜在价值, 为其早期诊断提供了线索.
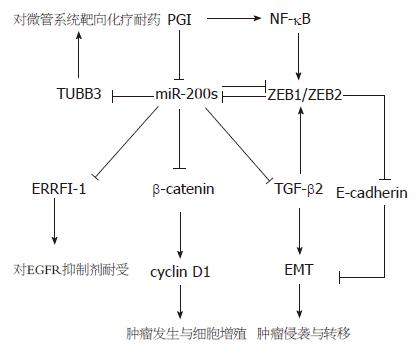
Cochrane等[26]报道, 在低分化子宫内膜癌, 卵巢癌, 乳腺癌细胞系中, miR-200c可通过抑制β-微管蛋白Ⅲ(class III beta-tubulin TUBB3)基因的表达提高作用于细胞微管系统化疗药的敏感性, 如紫杉醇, 长春新碱等. 陈勇等[42]证实了miR-200c可逆转胃癌细胞系对顺铂的耐药性. Adam等[19]也报道在膀胱癌细胞系中, miR-200家族成员可通过抑制ERRFI-1/Mig-6基因表达提高瘤细胞对以表皮生长因子受体(EGFR)为靶点的治疗的敏感性. 以上研究均揭示了miR-200家族成员在肿瘤治疗中的应用价值(图1).
miR-200家族对上皮来源肿瘤, 尤其是对消化系肿瘤的细胞表型、增殖、侵袭、转移有着重要的调节作用, 同时对其诊断与治疗也有着重要价值. 然而, miR-200家族成员在不同组织中的表达水平和作用有所不同, 未来除了进一步研究各成员在不同癌组织和肿瘤不同阶段中的作用外, 还要继续寻找其潜在靶点, 为消化系肿瘤的联合治疗、基因治疗、靶向治疗提供更多的依据和指导.
microRNA是一类长约22个核苷酸左右、进化保守的内源性非编码小分子RNA. 自1993年在线虫中发现第一种microRNA(命名为lin-4)以来, 研究者对microRNA的生物合成, 功能及作用机制进行了大量研究. 多项研究表明, microRNA以转录后调节的方式调节目的基因的表达, 在个体发育, 细胞增殖和分化, 细胞凋亡以及肿瘤的发生发展过程中都有一定的调控作用.
朴云峰, 教授, 吉林大学第一临床医院消化科
miR-200家族在上皮来源肿瘤(如消化系肿瘤, 乳腺癌、子宫内膜癌、卵巢癌、前列腺癌等)中的作用成为近年来的研究热点. 如研究其在肿瘤的发生发展、侵袭转移、化疗耐药等方面的作用靶点与调控机制. 目前亟待研究miR-200家族内各成员在不同肿瘤, 以及同一类肿瘤不同阶段中的表达水平变化和作用, 同时还要寻找更多具有应用价值的靶点.
Korpal等报道miR-200家族在乳腺癌动物模型中可促进其肺部转移瘤的形成, 并进一步发现这与miR-200家族直接靶点Sec23a表达降低有关, Sec23a蛋白可促进细胞分泌Igfbp4和Tinagl1蛋白, 这2种蛋白均有抑制肿瘤远端转移的作用. 以上研究表明miR-200家族在肿瘤发生发展的不同阶段中的作用是不同的.
随着越来越多miR-200家族成员的靶点被发现, 其在上皮来源肿瘤特别是在消化系肿瘤中的作用将被进一步阐释. 对miR-200家族的深入研究将为消化系肿瘤的早期诊断、预后评估, 与其他药物联合治疗, 基因靶向治疗等提供更多的指导和依据
miR-200家族在上皮来源肿瘤, 尤其是对消化系肿瘤的细胞表型, 增殖、侵袭、转移有着重要的调节的作用, 同时对其诊断与治疗也有着重要价值. 该文综述了近年miR-200与肿瘤发生机制的研究进展, 为治疗提供了新的靶点.
编辑: 李军亮 电编:闫晋利
| 1. | Lee Y, Kim M, Han J, Yeom KH, Lee S, Baek SH, Kim VN. MicroRNA genes are transcribed by RNA polymerase II. EMBO J. 2004;23:4051-4060. [PubMed] [DOI] |
| 2. | Lee Y, Ahn C, Han J, Choi H, Kim J, Yim J, Lee J, Provost P, Rådmark O, Kim S. The nuclear RNase III Drosha initiates microRNA processing. Nature. 2003;425:415-419. [PubMed] [DOI] |
| 3. | Yi R, Qin Y, Macara IG, Cullen BR. Exportin-5 mediates the nuclear export of pre-microRNAs and short hairpin RNAs. Genes Dev. 2003;17:3011-3016. [PubMed] [DOI] |
| 4. | Lund E, Güttinger S, Calado A, Dahlberg JE, Kutay U. Nuclear export of microRNA precursors. Science. 2004;303:95-98. [PubMed] [DOI] |
| 5. | Gregory RI, Chendrimada TP, Cooch N, Shiekhattar R. Human RISC couples microRNA biogenesis and posttranscriptional gene silencing. Cell. 2005;123:631-640. [PubMed] [DOI] |
| 6. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] |
| 7. | Mongroo PS, Rustgi AK. The role of the miR-200 family in epithelial-mesenchymal transition. Cancer Biol Ther. 2010;10:219-222. [PubMed] [DOI] |
| 8. | Park SM, Gaur AB, Lengyel E, Peter ME. The miR-200 family determines the epithelial phenotype of cancer cells by targeting the E-cadherin repressors ZEB1 and ZEB2. Genes Dev. 2008;22:894-907. [PubMed] [DOI] |
| 9. | Castilla MÁ, Moreno-Bueno G, Romero-Pérez L, Van De Vijver K, Biscuola M, López-García MÁ, Prat J, Matías-Guiu X, Cano A, Oliva E. Micro-RNA signature of the epithelial-mesenchymal transition in endometrial carcinosarcoma. J Pathol. 2011;223:72-80. [PubMed] [DOI] |
| 10. | Acloque H, Adams MS, Fishwick K, Bronner-Fraser M, Nieto MA. Epithelial-mesenchymal transitions: the importance of changing cell state in development and disease. J Clin Invest. 2009;119:1438-1449. [PubMed] [DOI] |
| 11. | Lee JM, Dedhar S, Kalluri R, Thompson EW. The epithelial-mesenchymal transition: new insights in signaling, development, and disease. J Cell Biol. 2006;172:973-981. [PubMed] [DOI] |
| 12. | Zavadil J, Böttinger EP. TGF-beta and epithelial-to-mesenchymal transitions. Oncogene. 2005;24:5764-5774. [PubMed] [DOI] |
| 13. | Micalizzi DS, Farabaugh SM, Ford HL. Epithelial-mesenchymal transition in cancer: parallels between normal development and tumor progression. J Mammary Gland Biol Neoplasia. 2010;15:117-134. [PubMed] [DOI] |
| 14. | Gregory PA, Bert AG, Paterson EL, Barry SC, Tsykin A, Farshid G, Vadas MA, Khew-Goodall Y, Goodall GJ. The miR-200 family and miR-205 regulate epithelial to mesenchymal transition by targeting ZEB1 and SIP1. Nat Cell Biol. 2008;10:593-601. [PubMed] [DOI] |
| 15. | Chen J, Wang L, Matyunina LV, Hill CG, McDonald JF. Overexpression of miR-429 induces mesenchymal-to-epithelial transition (MET) in metastatic ovarian cancer cells. Gynecol Oncol. 2011;121:200-205. [PubMed] [DOI] |
| 16. | Aigner K, Dampier B, Descovich L, Mikula M, Sultan A, Schreiber M, Mikulits W, Brabletz T, Strand D, Obrist P. The transcription factor ZEB1 (deltaEF1) promotes tumour cell dedifferentiation by repressing master regulators of epithelial polarity. Oncogene. 2007;26:6979-6988. [PubMed] [DOI] |
| 17. | Nieto MA. The snail superfamily of zinc-finger transcription factors. Nat Rev Mol Cell Biol. 2002;3:155-166. [PubMed] [DOI] |
| 18. | Matsumura T, Makino R, Mitamura K. Frequent down-regulation of E-cadherin by genetic and epigenetic changes in the malignant progression of hepatocellular carcinomas. Clin Cancer Res. 2001;7:594-599. [PubMed] |
| 19. | Adam L, Zhong M, Choi W, Qi W, Nicoloso M, Arora A, Calin G, Wang H, Siefker-Radtke A, McConkey D. miR-200 expression regulates epithelial-to-mesenchymal transition in bladder cancer cells and reverses resistance to epidermal growth factor receptor therapy. Clin Cancer Res. 2009;15:5060-5072. [PubMed] [DOI] |
| 20. | Bracken CP, Gregory PA, Kolesnikoff N, Bert AG, Wang J, Shannon MF, Goodall GJ. A double-negative feedback loop between ZEB1-SIP1 and the microRNA-200 family regulates epithelial-mesenchymal transition. Cancer Res. 2008;68:7846-7854. [PubMed] [DOI] |
| 21. | Bindels S, Mestdagt M, Vandewalle C, Jacobs N, Volders L, Noël A, van Roy F, Berx G, Foidart JM, Gilles C. Regulation of vimentin by SIP1 in human epithelial breast tumor cells. Oncogene. 2006;25:4975-4985. [PubMed] [DOI] |
| 22. | Hurteau GJ, Spivack SD, Brock GJ. Potential mRNA degradation targets of hsa-miR-200c, identified using informatics and qRT-PCR. Cell Cycle. 2006;5:1951-1956. [PubMed] [DOI] |
| 23. | Christoffersen NR, Silahtaroglu A, Orom UA, Kauppinen S, Lund AH. miR-200b mediates post-transcriptional repression of ZFHX1B. RNA. 2007;13:1172-1178. [PubMed] [DOI] |
| 24. | Burk U, Schubert J, Wellner U, Schmalhofer O, Vincan E, Spaderna S, Brabletz T. A reciprocal repression between ZEB1 and members of the miR-200 family promotes EMT and invasion in cancer cells. EMBO Rep. 2008;9:582-589. [PubMed] [DOI] |
| 25. | Ahmad A, Aboukameel A, Kong D, Wang Z, Sethi S, Chen W, Sarkar FH, Raz A. Phosphoglucose isomerase/autocrine motility factor mediates epithelial-mesenchymal transition regulated by miR-200 in breast cancer cells. Cancer Res. 2011;71:3400-3409. [PubMed] [DOI] |
| 26. | Cochrane DR, Spoelstra NS, Howe EN, Nordeen SK, Richer JK. MicroRNA-200c mitigates invasiveness and restores sensitivity to microtubule-targeting chemotherapeutic agents. Mol Cancer Ther. 2009;8:1055-1066. [PubMed] [DOI] |
| 28. | MacDonald BT, Tamai K, He X. Wnt/beta-catenin signaling: components, mechanisms, and diseases. Dev Cell. 2009;17:9-26. [PubMed] [DOI] |
| 29. | Barker N, Clevers H. Mining the Wnt pathway for cancer therapeutics. Nat Rev Drug Discov. 2006;5:997-1014. [PubMed] [DOI] |
| 30. | He TC, Sparks AB, Rago C, Hermeking H, Zawel L, da Costa LT, Morin PJ, Vogelstein B, Kinzler KW. Identification of c-MYC as a target of the APC pathway. Science. 1998;281:1509-1512. [PubMed] [DOI] |
| 31. | Tetsu O, McCormick F. Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells. Nature. 1999;398:422-426. [PubMed] [DOI] |
| 32. | Saydam O, Shen Y, Würdinger T, Senol O, Boke E, James MF, Tannous BA, Stemmer-Rachamimov AO, Yi M, Stephens RM. Downregulated microRNA-200a in meningiomas promotes tumor growth by reducing E-cadherin and activating the Wnt/beta-catenin signaling pathway. Mol Cell Biol. 2009;29:5923-5940. [PubMed] [DOI] |
| 33. | Smith CM, Watson DI, Leong MP, Mayne GC, Michael MZ, Wijnhoven BP, Hussey DJ. miR-200 family expression is downregulated upon neoplastic progression of Barrett's esophagus. World J Gastroenterol. 2011;17:1036-1044. [PubMed] |
| 34. | Du Y, Xu Y, Ding L, Yao H, Yu H, Zhou T, Si J. Down-regulation of miR-141 in gastric cancer and its involvement in cell growth. J Gastroenterol. 2009;44:556-561. [PubMed] [DOI] |
| 35. | Shinozaki A, Sakatani T, Ushiku T, Hino R, Isogai M, Ishikawa S, Uozaki H, Takada K, Fukayama M. Downregulation of microRNA-200 in EBV-associated gastric carcinoma. Cancer Res. 2010;70:4719-4727. [PubMed] [DOI] |
| 36. | 王 驰, 钟 鹰, 粟 滔, 黄 靓, 毛 振江, 肖 祥. miR-200b对胃癌MGC-803细胞增殖的影响以及对Bcl-2表达的调节. 世界华人消化杂志. 2010;18:2077-2083. [DOI] |
| 37. | Li A, Omura N, Hong SM, Vincent A, Walter K, Griffith M, Borges M, Goggins M. Pancreatic cancers epigenetically silence SIP1 and hypomethylate and overexpress miR-200a/200b in association with elevated circulating miR-200a and miR-200b levels. Cancer Res. 2010;70:5226-5237. [PubMed] [DOI] |
| 38. | Meng F, Henson R, Lang M, Wehbe H, Maheshwari S, Mendell JT, Jiang J, Schmittgen TD, Patel T. Involvement of human micro-RNA in growth and response to chemotherapy in human cholangiocarcinoma cell lines. Gastroenterology. 2006;130:2113-2129. [PubMed] [DOI] |
| 39. | Bandrés E, Cubedo E, Agirre X, Malumbres R, Zárate R, Ramirez N, Abajo A, Navarro A, Moreno I, Monzó M. Identification by Real-time PCR of 13 mature microRNAs differentially expressed in colorectal cancer and non-tumoral tissues. Mol Cancer. 2006;5:29. [PubMed] [DOI] |
| 40. | Rossi L, Bonmassar E, Faraoni I. Modification of miR gene expression pattern in human colon cancer cells following exposure to 5-fluorouracil in vitro. Pharmacol Res. 2007;56:248-253. [PubMed] [DOI] |