修回日期: 2011-10-08
接受日期: 2011-10-10
在线出版日期: 2011-10-18
目的: 探讨绿茶提取物表没食子儿茶素没食子酸酯(EGCG)对结肠癌细胞株LoVo细胞和SW480细胞增殖的抑制作用, 研究其对Notch1与Notch2的基因表达的影响.
方法: 体外培养LoVo细胞和SW480细胞, 采用不同浓度的EGCG(10、20、35 mg/L)对其进行干预, MTT法检测EGCG对LoVo细胞和SW480细胞增殖的抑制作用; 用流式细胞仪检测EGCG对LoVo细胞和SW480细胞细胞凋亡和细胞周期的影响. 实时荧光定量PCR检测EGCG干预后的LoVo细胞和SW480细胞的Notch1与Notch2基因的表达情况.
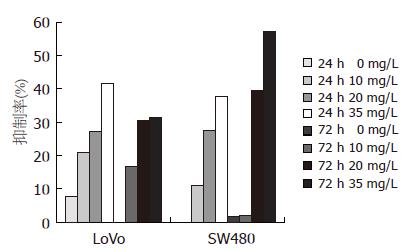
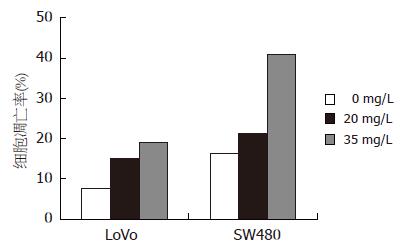
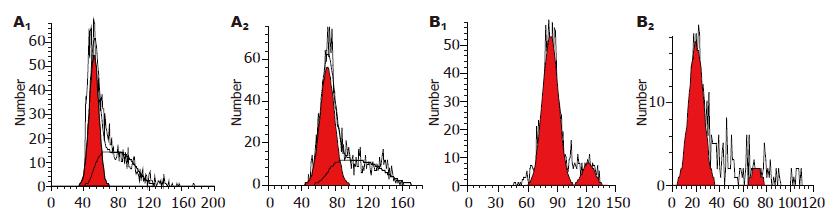
结果: MTT法检测EGCG对LoVo细胞和SW480细胞增殖均具有抑制作用, 且呈浓度依赖性, 不具有时间依赖性. 流式细胞仪检测EGCG能增强LoVo细胞和SW480细胞的凋亡率, 且剂量与凋亡率呈正相关. EGCG能将SW480细胞和LoVo细胞周期阻滞在G0/G1期, 阻碍其向S期转换, 抑制其细胞增殖. 实时荧光定量PCR检测EGCG能下调两株细胞Notch2的基因表达, 而SW480细胞的Notch1基因表达有下调的趋势, LoVo细胞的Notch1基因表达有上调的趋势, 但差异均无显著意义.
结论: EGCG对体外培养的LoVo细胞和SW480细胞的增殖有明显抑制作用, 且能诱导细胞凋亡和影响细胞周期, 其作用机制可能与下调Notch2的基因表达及激活Notch信号转导途径有关, 但是EGCG对Notch1基因表达的影响尚需要做进一步探讨.
引文著录: 张春霞, 王水明, 何勇山, 周阿成, 金黑鹰. EGCG对LoVo和SW480结肠癌细胞株的作用及对Notch1与Notch2基因表达的影响. 世界华人消化杂志 2011; 19(29): 3023-3027
Revised: October 8, 2011
Accepted: October 10, 2011
Published online: October 18, 2011
AIM: To investigate the inhibitory effect of epigallocatechin-3-gallate (EGCG) on the proliferation of human colorectal cancer cell lines LoVo and SW480 and to explore the possible mechanisms involved.
METHODS: Cultured LoVo and SW480 cells were used to examine the impact of different concentrations of EGCG (10, 20 and 35 mg/L) on cell proliferation by MTT assay and on cell apoptosis and cell cycle progression by flow cytometry. The expressing of Notch1 and Notch2 in cultured LoVo and SW480 cells was detected by real-time PCR.
RESULTS: EGCG inhibited the proliferation of LoVo cells and SW480 cells in a dose-dependent, time-independent manner. EGCG enhanced the apoptosis of LoVo cells and SW480 cells and blocked the cell cycle at G0/G1 phase. Moreover, EGCG down-regulated Notch2 gene expression but had no significant impact on Notch1 gene expression in LoVo cells and SW480 cells.
CONCLUSION: EGCG can significantly inhibit the proliferation of SW480 and LoVo cells by altering cell cycle and inducing cell apoptosis via mechanisms associated with down-regulating Notch2 gene expression.
- Citation: Zhang CX, Wang SM, He YS, Zhou AC, Jin HY. Effect of epigallocatechin-3-gallate on Notch1 and Notch2 expression in human colorectal cancer cell lines SW480 and LoVo. Shijie Huaren Xiaohua Zazhi 2011; 19(29): 3023-3027
- URL: https://www.wjgnet.com/1009-3079/full/v19/i29/3023.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i29.3023
表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)是绿茶提取物, 是茶多酚中含量最高、活性最强的单体[1]. 我们的前期研究表明茶多酚对结直肠癌有明显抑制作用[2], EGCG对结肠癌皮下原位荧光动物模型结肠肿瘤的生长有明显的抑制作用[3]. 目前对于EGCG对Notch信号转导途径的靶向基因Notch1与Notch2的报道较少, 本研究旨在探讨EGCG对结直肠癌细胞株LoVo细胞和SW480细胞增殖的抑制作用及对Notch1与Notch2基因的影响, 研究其对结直肠癌的抑癌机制.
LoVo细胞、SW480细胞和EGCG购自中科院细胞所. MTT试剂盒购自日本dojindo公司; 胎牛血清购于美国Invitrogen公司; Annexin V-FITC细胞凋亡检测试剂盒购于碧云天公司; 碘化丙啶(PI)购于碧云天公司, 以PBS配成1 mg/mL浓度, 4 ℃保存; Notch1与Notch2基因引物购于上海生工生物工程技术服务有限公司.
1.2.1 MTT法检测EGCG对LoVo细胞和SW480细胞增殖的抑制作用: 将LoVo细胞、SW480细胞分别以5×103的数目分别接种于96板中, 每种细胞种12个孔, 分别将孔中的培养基添加至200 μL分别含终浓度为0 mg/L(对照组), 10、20、35 mg/L EGCG(实验组)的完全培养基, 放置于37 ℃、50 mL/L CO2细胞培养箱, 孵育24、72 h. 细胞孵育到达24、72 h时, 按照100 μL加入10 μL MTT溶液的比例, 在孔中加入MTT反应液. 在37 ℃培养箱中放置1 h后, 利用酶标仪读取450 nm波长处的吸光度(A值). 抑制率 = [1-(实验组-空白对照的MTTA值)/(对照组-空白对照的MTTA值)]×100%.
1.2.2 流式细胞仪检测EGCG对LoVo细胞和SW480细胞凋亡和细胞周期的影响: (1)流式细胞仪检测细胞凋亡. 把细胞培养液吸出至适当的15 mL离心管内, PBS洗涤贴壁细胞一次, 加入消化后细胞, 稍混匀, 转移到离心管内, 1 000 g离心5 min, 弃上清, 收集细胞, 用PBS轻轻重悬细胞并计数. 取0.5×106重悬的细胞, 1 000 g离心5 min, 弃上清, 加入195 μL Annexin V-FITC结合液轻轻重悬细胞. 加入5 μL Annexin V-FITC, 轻轻混匀. 室温避光孵育10 min. 1 000 g离心5 min, 弃上清, 加入190 μL Annexin V-FITC结合液轻轻重悬细胞. 加入10 μL碘化丙啶(PI)染色液, 轻轻混匀, 冰浴避光放置72 h. 随即进行流式细胞仪检测, Annexin V-FITC为绿色荧光, PI为红色荧光. (2)流式细胞仪分析细胞周期. 收集细胞, 4 ℃、1 000 r/min离心5 min. 用预冷PBS缓冲液洗两遍. 充分悬浮细胞, 4 ℃、1 000 r/min离心5 min后弃上清. 细胞沉淀加入1 mL预冷700 mL/L乙醇, 吹打均匀, 4 ℃固定过夜. PBS洗涤去乙醇, 1 000 r/min离心5 min, 洗两遍. 0.5 mL PBS含50 mg/L PI, 100 mg/L RNase A重悬细胞, 37 ℃避光孵育30 min. 以标准程序用流式细胞仪检测, 结果用细胞周期拟和软件ModFit分析.
1.2.3 实时荧光定量PCR检测EGCG对LoVo细胞和SW480细胞的Notch1与Notch2的基因表达: (1)PCR扩增引物: Notch1上游引物: 5'-CAATGTGGATGCCGCAGTTGTG-3',下游引物: 5'-CAGCACCTTGGCGGTCTCGTA-3'; Notch2上游引物: 5'-AAAAATGGGGCCAACCGAGAC-3', 下游引物: 5'-TTCATCCAGAAGGCGCACAA-3'. (2)培养细胞总RNA的提取及cDNA的制备: 按照Qiagen试剂盒说明书进行所有样本总RNA的抽提. 用260 nm波长分光测定RNA浓度, 根据A260/A280的比值计算RNA的纯度. 将RNA反转录为cDNA, Total RNA 2 μg, 20 μm Oligo(dT)15 Primer 1 μL, 补DEPC H2O至15 μL, 70 ℃加热5 min, 冰上放置2 min, 补充5×M-MLV Reaction Buffer 5 μL, 10 mmol/L dNTP 1.25 μL, RNasin RNase Inhibitor 25 U, M-MLV RT Rnase H- 200 U, 补DEPC H2O至 25 μL. 轻轻混匀上述反应液, 放置于42℃反应60 min后, 于-20 ℃保存. (3)实时荧光定量RT-PCR: 反应体系包括: 2×SYBR Premix Ex Taq, 1 μmol/L上游引物0.5 μL, 1 μmol/L下游引物0.5 μL, ROX0.4 μL, cDNA样本2 μL, 补ddH2O至20 μL . 反应条件为: 95 ℃ 30s, 然后95 ℃ 5 s, 共40个循环. 95 ℃ 15 s , 60 ℃ 1 min, 95 ℃ 30 s, 60 ℃ 15 s 绘制溶解曲线. 反应均在ABI prism 7 300 PCR仪上进行. 仪器荧光检测通道选择SYBR GREEN. (4)数据处理: 以PCR反应的前15个循环的荧光信号作为荧光本底信号, 以6-15个循环的荧光信号的标准差的10倍为荧光阈值, 每个扩增管内的荧光信号达到设定的荧光阈值所经历的循环数, 就是循环阈值Ct. 完成荧光阈值的设定及标准曲线的建立, 获得相对原始浓度, 比较Notch1与Notch2的基因表达情况.
统计学处理 应用SPSS17.0统计软件处理数据, 结果用实验数据以mean±SD表示, 采用独立样本t检验, P<0.05为差异有统计学意义.
随着EGCG浓度的增加, 24 h与72 h时LoVo细胞、SW480细胞的增殖抑制率均逐渐升高, 均在EGCG浓度为35 mg/L时抑制率达到最高. 但随着时间的延长, LoVo细胞、SW480细胞的增殖抑制率却无明显规律性. 说明EGCG对两株细胞增殖的抑制作用均具有浓度依赖性, 却不具有时间依赖性(图1).
浓度为20 mg/L和35 mg/L的ECCG对LoVo细胞、SW480细胞的凋亡均有明显增强, 且剂量与凋亡率呈正相关. 说明EGCG能增强LoVo细胞、SW480细胞的凋亡率, 随着EGCG剂量的增加, 凋亡率升高(图2).
EGCG能将SW480细胞和LoVo细胞细胞周期阻滞在G0/G1期, 阻碍其向S期转换, 抑制其细胞增殖(图3).
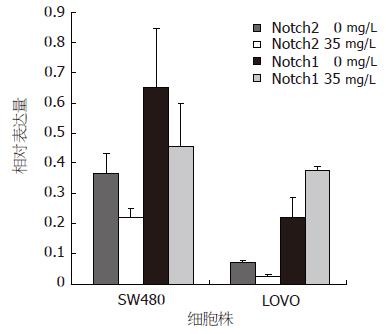
EGCG能下调SW480细胞和LoVo细胞Notch2的基因表达(P = 0.039, 0.001), 而SW480细胞的Notch1基因表达有下调的趋势, LoVo细胞的Notch1基因表达有上调的趋势, 但差异均无显著意义(P>0.05, 图4).
EGCG的抗癌作用目前报道很多, 但其作用机制尚不明确[4-6]. 本实验通过研究细胞Notch信号转导途径相关基因来分析探索其作用机制. LoVo细胞是错配修复基因缺失的微卫星不稳定结肠癌细胞, 对CEA高表达[7], 而SW480细胞是错配修复基因表达正常的结肠癌细胞. MTT实验结果显示EGCG对LoVo细胞和SW480细胞增殖均具有抑制作用, 且呈浓度依赖性, 不具有时间依赖性. 流式细胞仪检测EGCG能诱导LoVo细胞和SW480细胞的凋亡, 其剂量与凋亡率呈正相关; 且能改变细胞周期, 将两株细胞均阻滞在G1期, 阻滞其DNA复制.
本课题组在前期研究中发现, 茶多酚处理后的细胞株可以导致HES1和JAG1基因下调, 而这些基因是Notch信号转导途径的靶基因, 提示茶多酚中的成分是否具有调节Notch信号转导途径的作用[2,8-10]. EGCG是茶多酚中含量最高、活性最强的单体, 研究表明其作用机制与诱导肿瘤细胞凋亡和阻滞细胞周期及影响相关蛋白、基因的表达有关[11-15]. 正常Notch信号转导系统与细胞正常增殖和分化、器官和组织的更新有重要的关系, 当Notch信号发生异常时, 细胞增殖增加, 可以进一步转化为癌. 哺乳动物的细胞Notch系统具有4个Notch蛋白(Notch1-4)和5个相应的配体(DLL1、DLL3、DLL4、JAG1和JAG2), Notch信号可以被2个细胞之间的配体结合激活, 导致蛋白裂解而使细胞质内的Notch蛋白部分(Notch-IC)被释放, Notch-IC直接进入细胞核结合到转录因子CSL, 从而导致转录被抑制[16]. 结肠是一个反复更新的器官, 因此在结肠壁内隐窝存在着前体细胞和干细胞、移行增大(transit amplifying, TA)细胞和最终分化的细胞, 结肠干细胞存在于隐窝基底部, 增殖形成TA细胞, TA细胞逐渐上移增殖形成各种结肠细胞并停止增殖[17]. 干细胞在适合的微环境下可以调节细胞的增殖、分化和凋亡, 但是在各种外来因素的干扰下, 这种微环境就会发生改变, 导致Notch信号表达增加, 从而导致肿瘤发生[18].
Notch1与Notch2基因是Notch信号转导途径的两个靶基因[19], 本组研究了EGCG处理后的LoVo和SW480细胞株的Notch1与Notch2基因的基因表达的变化. 结果显示, EGCG能下调结直肠癌细胞SW480细胞和LoVo细胞Notch2的基因表达, 两细胞之间具有明显差异, 能下调SW480细胞的Notch1基因表达, 上调LoVo细胞的Notch1基因表达, 但差异无显著意义. 表明EGCG可能通过下调Notch2基因的表达, 影响细胞周期的移行, 诱导细胞的凋亡.
近年来的研究表明[20-22], Notch信号途径和多种肿瘤的发生有关, 其主要的原因是影响了肿瘤干细胞的分化, 从而导致肿瘤发生. 在结直肠癌的研究中发现, Notch信号途径的基因呈现高表达状态, 提示在结直肠癌的发生中, Notch信号途径作为抑癌基因来发挥作用[19]. Reedijk等[23]在一个队列研究中发现Notch信号转导途径的基因NOTCH1, LFNG和HES1在肿瘤中出现高表达. Tanaka等[24]研究发现可通过Notch2基因的过度表达及Notch1基因的下调抑制骨肉瘤的体外生长. Chen等[25]研究发现下调Notch2与Notch1均可抑制成胶质细胞瘤的生长, 但Notch2发挥了更大的作用. Notch信号转导途径对结直肠肿瘤细胞的生长调控起关键作用[23]. 但Notch信号转导途径的基因到底发挥致癌基因的作用还是抑癌基因的作用, 目前仍有争议[26,27]. 有研究表明Notch1, Notch2可作为抑癌基因抑制肿瘤生长, 可能通过阻滞细胞周期来抑制细胞分化[16,25].
本研究发现EGCG对体外培养的LoVo细胞和SW480细胞的增殖有明显抑制作用, 且能诱导细胞凋亡和影响细胞周期. 其作用机制可能与下调Notch2的基因表达及激活Notch信号转导途径有关, 但是EGCG对Notch1基因表达的影响尚需要做进一步探讨.
表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)是绿茶提取物, 是茶多酚中含量最高、活性最强的单体. 本课题组的前期研究表明茶多酚对结直肠癌有明显抑制作用.
李刚, 教授, 北京大学医学部生物化学与分子生物学系; 陈光, 教授, 吉林大学第一医院消化器官外科
前期研究表明茶多酚对结直肠癌有明显抑制作用, EGCG对结肠癌皮下原位荧光动物模型结肠肿瘤的生长有明显的抑制作用, 目前对于EGCG对Notch信号转导途径的靶向基因Notch1与Notch2的报道较少.
Chen等研究发现下调Notch2与Notch1均可抑制成胶质细胞瘤的生长, 但Notch2发挥了更大的作用. Notch信号转导途径对结直肠肿瘤细胞的生长调控起关键作用.
本研究发现EGC-G对体外培养的LoVo细胞和SW480细胞的增殖有明显抑制作用, 且能诱导细胞凋亡和影响细胞周期. 其作用机制可能与下调Notch2的基因表达及激活Notch信号转导途径有关.
本研究结果表明大鼠胰十二指肠移植中存在I/RI和细胞凋亡, 再灌注早期产生的NO对I/RI和细胞凋亡有双重的调节作用, 但NO的确切的分子机制仍有待于进一步的深入研究, 如何有效地在恰当的时间进行干预以最大的发挥NO的保护作用而避免损害作用, 也将成为进一步的内容.
本研究从细胞学角度证明EGCG的抗肿瘤作用, 并借助Notch信号转导途径相关基因探索其作用机制, 有一定科研价值.
编辑: 李军亮 电编:闫晋利
| 1. | Ahmad N, Feyes DK, Nieminen AL, Agarwal R, Mukhtar H. Green tea constituent epigallocatechin-3-gallate and induction of apoptosis and cell cycle arrest in human carcinoma cells. J Natl Cancer Inst. 1997;89:1881-1886. [PubMed] [DOI] |
| 2. | Jin H, Tan X, Liu X, Ding Y. The study of effect of tea polyphenols on microsatellite instability colorectal cancer and its molecular mechanism. Int J Colorectal Dis. 2010;25:1407-1415. [PubMed] [DOI] |
| 3. | 王 水明, 金 黑鹰, 张 春霞, 孙 宇, 杨 志坚, 丁 义江. 表没食子儿茶素没食子酸酯对结肠癌皮下易位的原位荧光动物模型肿瘤生长和转移的作用. 世界华人消化杂志. 2010;18:3016-3019. [DOI] |
| 4. | Sadava D, Whitlock E, Kane SE. The green tea polyphenol, epigallocatechin-3-gallate inhibits telomerase and induces apoptosis in drug-resistant lung cancer cells. Biochem Biophys Res Commun. 2007;360:233-237. [PubMed] [DOI] |
| 5. | Ju J, Hong J, Zhou JN, Pan Z, Bose M, Liao J, Yang GY, Liu YY, Hou Z, Lin Y. Inhibition of intestinal tumorigenesis in Apcmin/+ mice by (-)-epigallocatechin-3-gallate, the major catechin in green tea. Cancer Res. 2005;65:10623-10631. [PubMed] [DOI] |
| 6. | Shimizu M, Deguchi A, Lim JT, Moriwaki H, Kopelovich L, Weinstein IB. (-)-Epigallocatechin gallate and polyphenon E inhibit growth and activation of the epidermal growth factor receptor and human epidermal growth factor receptor-2 signaling pathways in human colon cancer cells. Clin Cancer Res. 2005;11:2735-2746. [PubMed] [DOI] |
| 8. | 戴 功建, 金 黑鹰, 丁 义江, 夏 建国, 刘 秀芳, 刘 飞, 谈 瑄忠, 耿 建祥. 茶多酚对微卫星不稳定结直肠癌裸小鼠的抗肿瘤作用及其作用机制. 中西医结合学报. 2008;12:1263-1266. |
| 9. | 刘 秀芳, 金 黑鹰, 丁 义江, 丁 曙晴, 刘 飞, 倪 敏, 王 静. 抗突变中药对错配修复基因缺失结直肠癌细胞的抑制作用. 世界华人消化杂志. 2007;15:2201-2204. [DOI] |
| 10. | Xu YY, Jin HY, Tan XZ, Liu XF, Ding YJ. [Tea polyphenol inhibits colorectal cancer with microsatellite instability by regulating the expressions of HES1, JAG1, MT2A and MAFA]. Zhongxiyi Jiehe Xuebao. 2010;8:870-876. [PubMed] |
| 11. | Sukhthankar M, Alberti S, Baek SJ. (-)-Epigallocatechin-3-gallate (EGCG) post-transcriptionally and post-translationally suppresses the cell proliferative protein TROP2 in human colorectal cancer cells. Anticancer Res. 2010;30:2497-2503. [PubMed] |
| 12. | Adachi S, Shimizu M, Shirakami Y, Yamauchi J, Natsume H, Matsushima-Nishiwaki R, To S, Weinstein IB, Moriwaki H, Kozawa O. (-)-Epigallocatechin gallate downregulates EGF receptor via phosphorylation at Ser1046/1047 by p38 MAPK in colon cancer cells. Carcinogenesis. 2009;30:1544-1552. [PubMed] [DOI] |
| 13. | Adachi S, Nagao T, To S, Joe AK, Shimizu M, Matsushima-Nishiwaki R, Kozawa O, Moriwaki H, Maxfield FR, Weinstein IB. (-)-Epigallocatechin gallate causes internalization of the epidermal growth factor receptor in human colon cancer cells. Carcinogenesis. 2008;29:1986-1993. [PubMed] [DOI] |
| 14. | Qin J, Xie LP, Zheng XY, Wang YB, Bai Y, Shen HF, Li LC, Dahiya R. A component of green tea, (-)-epigallocatechin-3-gallate, promotes apoptosis in T24 human bladder cancer cells via modulation of the PI3K/Akt pathway and Bcl-2 family proteins. Biochem Biophys Res Commun. 2007;354:852-857. [PubMed] [DOI] |
| 15. | Shimizu M, Shirakami Y, Sakai H, Yasuda Y, Kubota M, Adachi S, Tsurumi H, Hara Y, Moriwaki H. (-)-Epigallocatechin gallate inhibits growth and activation of the VEGF/VEGFR axis in human colorectal cancer cells. Chem Biol Interact. 2010;185:247-252. [PubMed] [DOI] |
| 16. | Radtke F, Raj K. The role of Notch in tumorigenesis: oncogene or tumour suppressor? Nat Rev Cancer. 2003;3:756-767. [PubMed] |
| 17. | Bolós V, Grego-Bessa J, de la Pompa JL. Notch signaling in development and cancer. Endocr Rev. 2007;28:339-363. [PubMed] [DOI] |
| 18. | Li L, Neaves WB. Normal stem cells and cancer stem cells: the niche matters. Cancer Res. 2006;66:4553-4557. [PubMed] [DOI] |
| 19. | Sitnik K, Cichy J. [Role of Cre-loxP-mediated conditional gene targeting in understanding the function of Notch receptors]. Postepy Biochem. 2006;52:49-55. [PubMed] |
| 20. | de Antonellis P, Medaglia C, Cusanelli E, Andolfo I, Liguori L, De Vita G, Carotenuto M, Bello A, Formiggini F, Galeone A. MiR-34a targeting of Notch ligand delta-like 1 impairs CD15+/CD133+ tumor-propagating cells and supports neural differentiation in medulloblastoma. PLoS One. 2011;6:e24584. [PubMed] |
| 21. | Pandya K, Meeke K, Clementz AG, Rogowski A, Roberts J, Miele L, Albain KS, Osipo C. Targeting both Notch and ErbB-2 signalling pathways is required for prevention of ErbB-2-positive breast tumour recurrence. Br J Cancer. 2011;105:796-806. [PubMed] [DOI] |
| 22. | Allen TD, Rodriguez EM, Jones KD, Bishop JM. Activated Notch1 induces lung adenomas in mice and cooperates with Myc in the generation of lung adenocarcinoma. Cancer Res. 2011;71:6010-6018. [PubMed] [DOI] |
| 23. | Reedijk M, Odorcic S, Zhang H, Chetty R, Tennert C, Dickson BC, Lockwood G, Gallinger S, Egan SE. Activation of Notch signaling in human colon adenocarcinoma. Int J Oncol. 2008;33:1223-1229. [PubMed] |
| 24. | Tanaka M, Setoguchi T, Hirotsu M, Gao H, Sasaki H, Matsunoshita Y, Komiya S. Inhibition of Notch pathway prevents osteosarcoma growth by cell cycle regulation. Br J Cancer. 2009;100:1957-1965. [PubMed] [DOI] |
| 25. | Chen J, Kesari S, Rooney C, Strack PR, Chen J, Shen H, Wu L, Griffin JD. Inhibition of notch signaling blocks growth of glioblastoma cell lines and tumor neurospheres. Genes Cancer. 2010;1:822-835. [PubMed] [DOI] |
| 26. | Maillard I, Pear WS. Notch and cancer: best to avoid the ups and downs. Cancer Cell. 2003;3:203-205. [PubMed] [DOI] |
| 27. | Yang CS, Lambert JD, Sang S. Antioxidative and anti-carcinogenic activities of tea polyphenols. Arch Toxicol. 2009;83:11-21. [PubMed] [DOI] |