修回日期: 2011-09-15
接受日期: 2011-10-02
在线出版日期: 2011-10-08
目的: 应用反义锁核酸与拉米夫定作用HepG2.2.15细胞, 对他们抗乙型肝炎病毒(hepatitis B virus, HBV)效果进行比较.
方法: 设计针对HBV翻译起始区S基因mRNA的反义寡核苷酸, 并进行锁核酸修饰, 以阳离子脂质体介导反义锁核酸转染HepG2.2.15细胞; 拉米夫定组直接作用HepG2.2.15细胞; 分别于用药后第2、4、6、8、10天收集细胞培养上清液. 用ELISA法和FQ-PCR法检测收集上清液HBsAg、HBeAg和HBV DNA的含量. MTT法分别检测反义锁核酸与拉米夫定对细胞存活率的影响.
结果: 拉米夫定对HBV DNA具有明显抑制作用, 最高可达46.52%, 但对HBsAg、HBeAg影响较小; 反义锁核酸对HBsAg、HBeAg及HBV DNA均有较强抑制作用, 对HBsAg、HBeAg和HBV DNA的最高抑制率分别达67.69%、59.71%和62.96%(P<0.05), 且抑制随时间呈增高趋势. 反义锁核酸与拉米夫定对细胞代谢均无明显影响.
结论: 反义锁核酸抗HBV作用机制与拉米夫定不同, 反义锁核酸抗HBV作用明显优于拉米夫定.
引文著录: 朱晓莹, 王燕菲. 反义锁核酸与拉米夫定在HepG2.2.15细胞中抗HBV作用的比较. 世界华人消化杂志 2011; 19(28): 2953-2957
Revised: September 15, 2011
Accepted: October 2, 2011
Published online: October 8, 2011
AIM: To compare the inhibitory effect of locked nucleic acid antisense oligonucleotides (antisense-LNA) and lamivudine on HBV replication in HepG2.2.15 cells.
METHODS: Antisense-LNA was introduced into HepG2.2.15 cells by cationic liposome-mediated transfection. Supernatants were collected 2, 4, 6, 8, 10 days after medication. The concentrations of HBsAg and HBeAg in cell supernatants were tested by ELISA. HBV DNA levels in cell supernatants were determined by FQ-PCR. Cell toxicity of antisense-LNA and lamivudine was detected by MTT assay.
RESULTS: Lamivudine only inhibited viral DNA synthesis. Antisense-LNA effectively inhibited the expression of HBsAg and HBeAg and the replication of HBV DNA (67.69%, 59.71%, 62.96%, P < 0.05) in a time-dependent manner. Both antisense-LNA and lamivudine showed no obvious cell toxicity.
CONCLUSION: The anti-HBV effect of antisense-LNA is more effective than that of lamivudine in HepG2.2.15 cells.
- Citation: Zhu XY, Wang YF. Inhibitory effect of locked nucleic acid antisense oligonucleotides versus lamivudine on HBV replication in HepG2.2.15 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(28): 2953-2957
- URL: https://www.wjgnet.com/1009-3079/full/v19/i28/2953.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i28.2953
反义寡核苷酸(antisense oligodeoxy Nucleotide, ASODN)是近年来研究较广泛的一种基因治疗手段, 他通过碱基互补作用, 特意地结合靶基因形成杂交分子, 从而阻断靶基因的表达[1,2]. 未经任何修饰的ASODN在机体内稳定性较差, 易被核酸酶降解而不能发挥治疗作用. 锁核酸(locked nucleic acid, LNA)是一种带环状结构的核苷酸衍生物, 他与ASODN相比具有良好的热稳定性、较强的分子杂交能力和抗核酸酶降解能力[3-5], 作为一种新型的ASODN具有广阔的应用前景. 乙型病毒性肝炎是我国常见的传染性疾病, 严重危害着人们的健康. 乙肝治疗目前尚无特效药物[6-8], 拉米夫定(lamivudine, 3TC)是公认的能够抑制HBV复制的药物[9,10]. 我们前期研究结果表明, 针对HBV DNA S基因设计的反义LNA在体外具有良好的抗HBV基因复制与表达的能力[11,12]. 为了更好地理解和应用反义LNA的抗HBV作用, 本研究将从HBsAg、HBeAg及HBV DNA等方面对反义LNA与3TC的抗HBV作用进行比较.
HepG2.2.15细胞由本室保存. 常规培养于含200 µg/mL G418、10%胎牛血清的高糖型DMEM中, 37 ℃、50 mL/L CO2条件下, 6-7 d常规传代一次. 高糖型DMEM培养基购自Gibco公司; G418购自Merck公司; 胎牛血清购自HyClone公司; HBsAg、HBeAg检测试剂盒购自丽珠生物技术有限公司产品; 乙肝病毒核酸扩增荧光定量试剂盒购自科华生物工程股份有限公司; 阳离子脂质体(LipofectamineTM2000)、Opti-MEN(脂质体溶媒)购自InvitrogenTM公司; 四甲基偶氮唑蓝(MTT)购自Amersco公司; 反义LNA由美国GENELINK公司合成; 3TC购自葛兰素史克制药(苏州)有限公司.
1.2.1 反义LNA片段合成与修饰: 以Genebank U95551 HBV全基因作为靶序列,设计针对HBV S基翻译起始区(155-165 nt)的11-聚反义寡脱氧核苷酸片段: GtTcTccAtGt(大写字母代表碱基经过LNA修饰).
1.2.2 反义LNA-阳离子脂质体转染混合物的制备: 经过预实验得出反义LNA:阳离子脂质体最佳剂量比例为3 μg:5 μL/mL. 取适量DMEM稀释反义LNA, 室温静置5 min; 取适量Opti-MEM稀释的阳离子脂质体溶液, 室温静置5 min; 将上述两种液体混合, 室温静置20 min形成稳定的反义LNA-阳离子脂质体混合物.
1.2.3 HepG2.2.15细胞的转染、给药与细胞上清液收集: 取指数生长期细胞,常规消化调整细胞密度为1.0×105个/mL, 接种96孔板, 每孔100 μL, 实验设3个组(即反义LNA组、3TC组和不加药的空白对照组), 每组设6个复孔, 当细胞贴壁并融合度约达60%时, 分别给药. 反义LNA组, 将反义LNA-阳离子脂质体混合物加入实验孔中, 每孔100 μL, 转染细胞, 6 h后向实验孔加含20%胎牛血清的DMEM 50 μL继续培养至48 h; 收集细胞培养上清, 重复转染4次, 连续10 d. 3TC组, 3TC浓度参照文献最佳剂量, 在常规培养基中加入3TC(终浓度为5 μg/mL)[9], 每2 d收集细胞培养上清并重新给药一次, 连续10 d. 收集各组细胞上清液于-20 ℃保存, 统一检测.
1.2.4 上清液HBsAg、HBeAg含量的测定: 采用ELISA法, 严格按试剂盒说明书操作, 重复测3次, 取均值. HBsAg、HBeAg浓度用S/N表示, 抑制率用公式计算: 抑制率(%) = [1-(S/N实验组)/(S/N实验组]×100%.
1.2.5 上清液HBV DNA含量的测定: 采用FQ-PCR法检测, 严格按照试剂盒说明书操作. 扩增条件: 50 ℃ 2 min, 94 ℃预变性2 min, 94 ℃变性10 s, 60 ℃退火30 s, 60 ℃延伸30 s, 共40个循环. 由计算机软件自动分析所收集的荧光信号并计算出HBV DNA平均拷贝数.
1.2.6 反义LNA与3TC对细胞的毒性检测: 采用MTT法检测反义LNA、3TC对细胞代谢活性的影响.
统计学处理 数据以mean±SD表示, 采用SPSS13.0软件处理, 各组间均数比较采用双因素方差分析结果, P<0.05为差异具有显著意义.
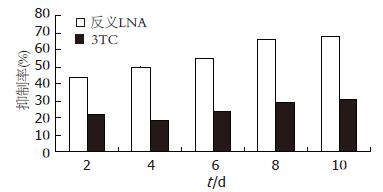
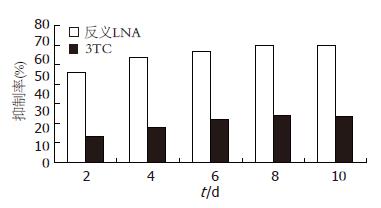
反义LNA、3TC加入2 d后, 细胞分泌的HBsAg、HBeAg均受抑制. 其中3TC对HBsAg、HBeAg抑制作用较弱, 而反义LNA的抑制作用较强; 并随时间增加呈递增趋势(表1, 2, 图1, 2).
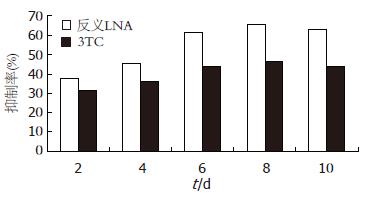
反义LNA和3TC均能抑制细胞HBV DNA的复制, 并随时间增加呈递增趋势(表3, 图3), 反义LNA抗HBV DNA作用优于3TC, 其抑制率最高达65.76%.
用药2 d, 经MTT法测得反义LNA、3TC组OD值如下: 0.987±0.132、1.124±0.045, 与空白对照(1.216±0.042)比较(P>0.05), 在实验剂量下反义LNA与3TC对HepG2.2.15细胞的生长无明显抑制作用.
HepG2.2.15细胞是由头尾相接的ayw型HBV双拷贝基因组转染人肝癌细胞株HepG2细胞而建立的, 该细胞株能长期稳定地向培养上清液中分泌病毒蛋白HBsAg、HBeAg、完整的病毒颗粒及大量的病毒复制中间体[13]. 他模拟肝细胞被HBV感染, 病毒基因组整合入肝细胞的状态, 因此以他作为研究对象, 接近于疾病的治疗过程.
HBV属嗜肝DNA 病毒科, 基因组由结构紧凑的3.2 kb的双链DNA 组成, 具有逆转录病毒的特性. S基因是HBV基因组中4个开发读码框架之一, S基因编码的蛋白是构成HBV外壳蛋白及HBsAg的主要组成部分, 参与HBV Dane颗粒的装配、成熟. 成熟的Dane颗粒能向细胞外分泌, 再感染其他正常肝细胞[14]. 而HBsAg组成的亚病毒颗粒在机体内含量远超过Dane颗粒, 大量的HBsAg持续表达将造成机体炎性浸润、免疫损伤、在肝癌的发生起重要作用[15-18].
研究结果表明, 针对HBV翻译起始区S基因的反义LNA能有效的抗HBV基因的表达, 对HBsAg、HBeAg和HBV DNA的抑制率最高分别达67.69%、59.71%和62.96%(P<0.05); 且抑制随时间呈增高趋势. 说明反义LNA能有效的进入HepG2.2.15细胞, 特异识别并结合HBV S基因及其mRNA, 并封闭HBV S基因的表达, 清除mRNA; 从转录、翻译环节抑制病毒的复制, 破坏病毒的生活结构, 阻断了HBsAg的翻译, 进而影响HBsAg、HBeAg翻译及Dane颗粒的装配、成熟. 而HBsAg、HBeAg的低表达将有利于机体免疫调整, 提高肝细胞的存活, 减少肝硬化等慢性肝病的发生[19]. 此外, 反义LNA对HBV DNA的抑制, 原因可能与LNA良好的抗核酸酶降解能力能使他在细胞内稳定存在, 并通过他良好的脂溶性能透过细胞核, 发挥超强的分子杂交能力结合到HBV S基因上有关.
相比反义LNA, 3TC抗HBV的作用机制主要是阻止病毒逆转录酶的复制作用, 从而减少HBV DNA复制, 使Dane颗粒的装配受抑制, 但对HBV病毒表达HBsAg、HBeAg影响较小. 研究结果表明3TC对HBsAg、HBeAg和HBV DNA的抑制率最高分别达30.86%、24.37%和46.5%, 抑制作用低于反义LNA. 反义LNA抗HBV作用更全面, 明显优于3TC. 此外, 与3TC抗HBV作用相比, 反义LNA有以下优势: 1. 反义LNA具有特异性和高效性; 2. HBV基因组S基因保守序列限制了病毒变异株的形成, 不易耐药; 3. 反义LNA抗HBV不依赖于病毒复制, 将更有利于清除病毒. 基于以上优势, 可以考虑将来将反义锁核酸作为拉米夫定的辅助治疗, 将更有利于清除机体内的乙肝病毒.
反义LNA以良好的抗乙肝病毒的活性, 低毒副作用, 显示出广阔的应用前景, 这为根除HBV感染带来了新希望, 同时也为其他疾病的基因治疗带来新的前景. 但如何更有效的将反义LNA传递到细胞内, 反义LNA在机体内的生物分布及安全性还需进一步研究.
近期,锁核酸(LNA)作为一种新型的寡核酸衍生物, 其结构中β-D-呋喃核糖的2'-O, 4'-C位通过缩水作用形成刚性的核苷酸衍生物. LNA具有强的抗核酸酶水解能力, 与DNA/RNA强大的杂交亲和力、反义活性、水溶性好及体内无毒性等优点. 因此具有广阔的应用研究前景.
杨江华, 副教授, 安徽省芜湖市皖南医学院弋矶山医院感染科; 张占卿, 主任医师, 上海市公共卫生中心
由于锁核酸优越的性能和安全性, 他被广泛用于基因研究的各个领域及疾病的诊断和治疗研究中, 目前研究的热点是三螺旋构象寡核苷酸技术.
锁核酸(LNA)具有强的抗核酸酶水解能力, 与DNA/RNA强大的杂交亲和力、反义活性、水溶性好及体内无毒性等优点. 因此具有广阔的应用研究前景. 本研究在前期工作的基础上, 比较反义LNA与拉米夫定的抗乙肝病毒的活性, 为反义LNA抗乙肝病毒提供可行性报告, 为下一步研究奠定基础.
反义LNA以良好的抗乙肝病毒的活性, 低不良反应, 显示出广阔的应用前景, 可以考虑将反义锁核酸作为拉米夫定的辅助治疗, 将更有利于清除机体内的乙肝病毒.
本研究的内容较有意义, 研究有一定程度新颖性, 具有较好的参考价值.
编辑: 李军亮 电编:闫晋利
| 1. | Patil SD, Rhodes DG, Burgess DJ. DNA-based therapeutics and DNA delivery systems: a comprehensive review. AAPS J. 2005;7:E61-E77. [PubMed] [DOI] |
| 2. | Gruegelsiepe H, Brandt O, Hartmann RK. Antisense inhibition of RNase P: mechanistic aspects and application to live bacteria. J Biol Chem. 2006;281:30613-30620. [PubMed] [DOI] |
| 3. | Wengel J, Petersen M, Frieden M, Koch T. Chemistry of locked nucleic acids (LNA): Design, synthesis, and bio-physical properties. Lett Pept Sci. 2003;10:237-253. [DOI] |
| 4. | Inohara H, Obika S, Imanishi T. 2',4'-BNA derivatives bearing an unnatural nucleobase: synthesis and application to triplex-forming oligonucleotides. Nucleic Acids Symp Ser (Oxf). 2004;63-64. [PubMed] [DOI] |
| 5. | Braasch DA, Liu Y, Corey DR. Antisense inhibition of gene expression in cells by oligonucleotides incorporating locked nucleic acids: effect of mRNA target sequence and chimera design. Nucleic Acids Res. 2002;30:5160-5167. [PubMed] [DOI] |
| 6. | Zoulim F. Therapy of chronic hepatitis B virus infection: inhibition of the viral polymerase and other antiviral strategies. Antiviral Res. 1999;44:1-30. [PubMed] [DOI] |
| 7. | Lau DT, Khokhar MF, Doo E, Ghany MG, Herion D, Park Y, Kleiner DE, Schmid P, Condreay LD, Gauthier J. Long-term therapy of chronic hepatitis B with lamivudine. Hepatology. 2000;32:828-834. [DOI] |
| 8. | Jonas MM, Mizerski J, Badia IB, Areias JA, Schwarz KB, Little NR, Greensmith MJ, Gardner SD, Bell MS, Sokal EM. Clinical trial of lamivudine in children with chronic hepatitis B. N Engl J Med. 2002;346:1706-1713. [PubMed] [DOI] |
| 9. | Ying C, De Clercq E, Neyts J. Lamivudine, adefovir and tenofovir exhibit long-lasting anti-hepatitis B virus activity in cell culture. J Viral Hepat. 2000;7:79-83. [PubMed] [DOI] |
| 13. | Sells MA, Chen ML, Acs G. Production of hepatitis B virus particles in Hep G2 cells transfected with cloned hepatitis B virus DNA. Proc Natl Acad Sci U S A. 1987;84:1005-1009. [PubMed] [DOI] |
| 16. | Tian X, Zhao C, Zhu H, She W, Zhang J, Liu J, Li L, Zheng S, Wen YM, Xie Y. Hepatitis B virus (HBV) surface antigen interacts with and promotes cyclophilin a secretion: possible link to pathogenesis of HBV infection. J Virol. 2010;84:3373-3381. [PubMed] [DOI] |
| 17. | Tian X, Li J, Ma ZM, Zhao C, Wan DF, Wen YM. Role of hepatitis B surface antigen in the development of hepatocellular carcinoma: regulation of lymphoid enhancer-binding factor 1. J Exp Clin Cancer Res. 2009;28:58. [PubMed] [DOI] |
| 18. | Hajjou M, Norel R, Carver R, Marion P, Cullen J, Rogler LE, Rogler CE. cDNA microarray analysis of HBV transgenic mouse liver identifies genes in lipid biosynthetic and growth control pathways affected by HBV. J Med Virol. 2005;77:57-65. [PubMed] [DOI] |