修回日期: 2011-09-15
接受日期: 2011-10-02
在线出版日期: 2011-10-08
目的: 研究JDP2与TGF-β1诱导的人胰腺癌细胞系Panc-1上皮向间质转化之间的关系.
方法: 实验分为空白对照组、JDP2转染组、空质粒转染组3组, 并分别用P、P-J-T、P-V-T缩写代表. 用pCEFL-HA-JDP2质粒和pCEFL空质粒瞬时转染人胰腺癌细胞系Panc-1, 48 h之后应用TGF-β1分别刺激JDP2转染和空质粒转染组细胞48 h. 以正常的Panc-1细胞为空白对照组, 仅加等量的PSB. 倒置显微镜下观察各组细胞的形态学变化的差异; 应用RT-PCR及Western blot的方法检测E-cadherin及vimentin的蛋白及mRNA表达变化; 应用Transwell侵袭实验观察各组细胞的迁移能力.
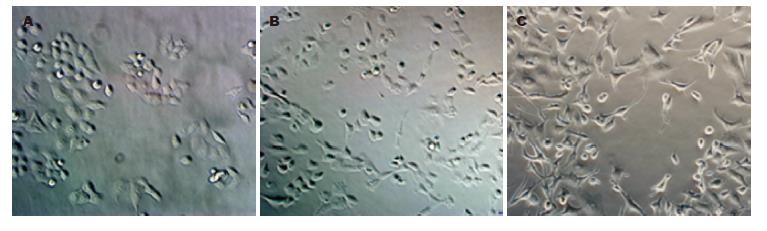
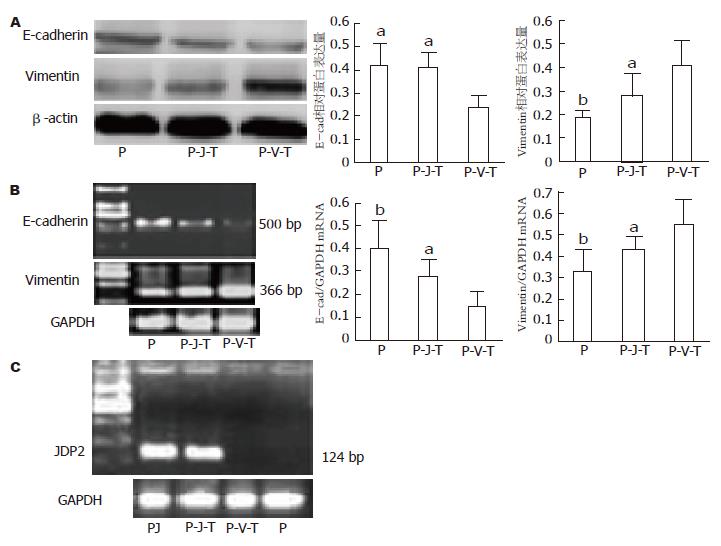
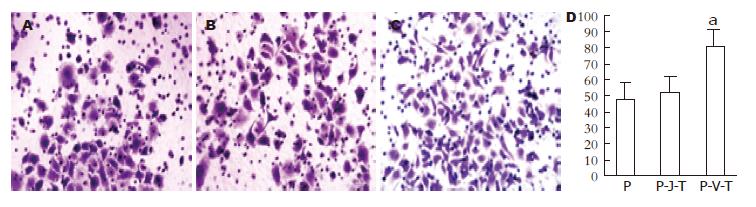
结果: P-J-T组能够明显抑制由TGF-β1诱导产生的EMT. 与P组相比, P-J-T组大部分细胞没有明确的形态学上的变化, E-cadherin及vimentin蛋白及mRNA表达变化不明显, 迁移能力亦无明确差异(48.0±5.3 vs 52.0±7.2), 未成功诱导EMT; 而P-V-T组Panc-1细胞大多数变成长梭形, 细胞间紧密连接丢失, E-cadherin表达明显降低(mRNA表达: P<0.01; 蛋白表达: P<0.05), vimentin蛋白及mRNA表达明显升高(P<0.01), 侵袭至小室下室的细胞明显增加(48.0±5.3 vs 81.0±10.7, P<0.01), 出现非常显著的上皮向间质转化特征.
结论: JDP2具有明显抑制EMT的作用, JDP2转染后的胰腺癌细胞系可以明显抑制由TGF-β1诱导的EMT, 这使得JDP2有可能成为新的胰腺癌的靶向治疗因子.
引文著录: 许元鸿, 刘哲, 郭克建, 杜瑞霞, 王春雁. JDP2在TGF-β1诱导的人胰腺癌细胞系Panc-1上皮向间质转化中的作用. 世界华人消化杂志 2011; 19(28): 2931-2936
Revised: September 15, 2011
Accepted: October 2, 2011
Published online: October 8, 2011
AIM: To determine the correlation between overexpression of Jun dimerization protein 2 (JDP2) and epithelial-mesenchymal transition (EMT) in human pancreatic cancer cell line Panc-1.
METHODS: Panc-1 cells were divided into three groups: negative control group, JDP2-transfected group, and empty vector-transfected group. The JDP2-transfected group and empty vector-transfected group were transiently transfected with PCEFL-HA-JDP2 vector and pCEFL vector, respectively. Untreated Panc-1 cells were used as normal controls. Forty-eight hours after transfection, cells were treated with TGF-β1 (10 ng/mL). Cell morphological alternations were examined by phase-contrast microscopy. The expression of mesenchymal marker vimentin and epithelial marker E-cadherin was detected by RT-PCR and Western blot. Cell migration was determined by Transwell motility assay.
RESULTS: TGF-β1-induced EMT was inhibited in the JDP2-transfected group. Compare to the negative control group, cells in the JDP2-transfected group showed no fibroblastic morphology and no significant changes in the levels of E-cadherin and vimentin and in migration ability (48.0 ± 5.3 vs 52.0 ± 7.2). However, cells in the vector-transfected group showed loss of cell-cell contacts, fibroblastic morphology, decreased expression of E-cadherin (mRNA: P < 0.01; protein: P < 0.05), increased expression of vimentin (P < 0.01) and migration ability (48.0 ± 5.3 vs 81.0 ± 10.7, P < 0.01) when compared to the negative control group.
CONCLUSION: JDP2 can inhibit TGF-β1-induced EMT in Panc-1 cells and may be a molecular target for pancreatic carcinoma therapy.
- Citation: Xu YH, Liu Z, Guo KJ, Du RX, Wang CY. JDP2 suppresses transforming growth factor-β1-induced epithelial-mesenchymal transition in human pancreatic cancer cell line Panc-1. Shijie Huaren Xiaohua Zazhi 2011; 19(28): 2931-2936
- URL: https://www.wjgnet.com/1009-3079/full/v19/i28/2931.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i28.2931
胰腺癌, 是侵袭、转移能力最强的消化系常见恶性肿瘤之一. 其较早便出现微转移, 大多数患者早期无显著临床症状, 故而一般就诊较晚, 5年生存率不足5%[1]. Jun二聚化蛋白2(Jun dimerization protein 2, JDP2), 是以转录活化因子蛋白1(activator protein-1, AP-1)成员之一的c-Jun的结合蛋白分离出来的[2]. 其由163个氨基酸组成, 并含有一个碱性亮氨酸拉链(basic leucine zipper, bZIP)结构. 目前已经有越来越多的证据表明, JDP2是一种广泛的AP-1抑制蛋白[2,3]. 尽管JDP2在肿瘤的发生、发展过程中的作用有少量报道, 但是其确切作用机制尚不清楚, 其与胰腺癌的关系的研究则更是空白. 我们实验小组在之前的研究中发现与癌旁相比, JDP2的蛋白表达含量在胰腺癌组织中明显下降[4]. 上皮向间质转化(epithelial-to-mesenchymal transition, EMT)已经在多种恶性肿瘤中得到证明[5-7]. 其典型的特征是细胞极性的消失、细胞和细胞之间黏附能力的丧失、侵袭能力的增强、上皮标志物表达降低以及间质标志物表达的升高. 目前, 关于胰腺癌中JDP2与EMT的关系未见报道. 本研究通过转染pCEFL-HA-JDP2质粒来观察过表达JDP2对胰腺癌EMT形成的影响, 并检测EMT相关因子的表达变化, 以求探讨JDP2在胰腺癌EMT的诱导过程中所发挥的作用.
人胰腺癌细胞株Panc-1购自上海中科院细胞库, 培养于含100 mL/L胎牛血清的DMEM培养基中, 置于37 ℃, 50 mL/L CO2培养箱中, 每2 d换液1次, 每3-4 d传代1次. DMEM培养基和胎牛血清均购自Gibco公司; lipofectamine 2 000购自Invitrogen公司; RNAiso plus及逆转录试剂PrimeScript® RT reagent Kit均购自日本TAKARA公司; TGF-β1购自Repro tech公司; Transwell侵袭小室购自Corning公司; Matrigel胶购自B.D.公司; JDP2、E-cadherin、vimentin、GAPDH引物由南京金斯瑞公司合成; 兔抗羊E-cadherin、vimentin单克隆抗体购自Santa Cruz公司, ECL化学发光液购自碧云天公司.
1.2.1 转染与EMT构建: 表达JDP2质粒pCEFL-HA-JDP2由以色列Ami Aroheim教授馈赠. 当细胞在6孔板上培养达到70%-80%融合时, 用lipofectamine 2 000将pCEFL-HA-JDP2或pCEFL空质粒按照说明书瞬时转染至Panc-1细胞中, 转染48 h后, 继续用含有TGF-β1(10 μg/L)的DMEM培养基培养48 h, 倒置相差显微镜观察细胞形态变化. 成功的转染由RT-PCR验证.
1.2.2 RT-PCR检测vimentin、E-cadherin、JDP2的表达: 细胞总RNA的提取: 收集各实验组细胞, 按照TAKARA公司RNAiso plus试剂盒提取RNA, 电泳鉴定RNA质量, A260测浓度. 引物序列: JDP2: sense primer: (5'-AGA CCC AGA TTG AGG AGC TG-3'), antisense primer: (5'-AGT GGG TTG CCT TCT GAC CTC-3') 124bp; E-cad: sense primer: (5'-TCC CAT CAG CTG CCC AGA AA-3'), antisense primer: (5'-TGA CTC CTG TGT TCC TGT TA-3') 500bp; Vimentin: sense primer: (5'-CCA GTG CGT GAA ATG GAA G-3'), antisense primer: (5'-TCA AGG TCA TCG TGA TGC TG-3')366bp; GAPDH: sense primer: (5'-TGA AGG TCG GAG TCA ACG GAT TTG G-3'), antisense primer: (5'-CAT GTG GGC CAT GAG GTC CAC CAC-3')982bp. PCR扩增条件: 94 ℃变性30 s, 57 ℃退火30 s, 72 ℃延伸1 min, 35个循环. 2%琼脂糖凝胶电泳, 结果采用quantity one 成像分析软件分析. 实验重复3次.
1.2.3 Western blot检测E-cadherin、Vimentin表达: 严格按照RIPA蛋白裂解液试剂盒说明书进行各组蛋白的提取, 将蛋白与5×蛋白上样缓冲液以4:1混合后煮沸变性5 min, 置于10%SDS-聚丙烯酰胺凝胶电泳分离蛋白, 分离的蛋白转移至PVDF膜上之后, 用5%脱脂奶粉配置的TBST室温封闭2 h, 加入E-cadherin(1:800)、vimentin(1:1 000)、GAPDH(1:1 500)一抗后4 ℃封闭过夜, 辣根过氧化物酶标记的二抗室温2 h, TBST洗膜, 5 min×4次, 化学发光法(electrochemiluminescence, ECL)显色. 实验重复3次.
1.2.4 Transwell小室侵袭实验: Transwell小室上室铺50 μL(1 g/L)Matrigel生物胶, 下室中加入含100 mL/L胎牛血清的DMEM培养基600 μL. 所有实验细胞均调整密度为2×105个/孔, 种于小室上室. 放于培养箱中培养24 h. 之后用4%多聚甲醛固定, 0.1%结晶紫染色, 200倍显微镜下计数, 任意选取5个视野, 以其平均细胞数为侵袭至膜上的细胞数, 每组重复3次实验, 求取平均数为结果.
统计学处理 所有计量资料均采用mean±SD表示. 采用SPSS13.0软件对结果进行分析, 应用t检验统计分析; P<0.05有统计学意义.
细胞总的RNA提取经琼脂糖凝胶电泳鉴定.
P-J-T组与P组相比, TGF-β1刺激48 h后细胞形态学变化不明显(图1 B); P-V-T组与P组相比, TGF-β1刺激48 h后细胞大多数变成长梭形, 细胞间紧密连接丢失(图1C).
E-cadherin、vimentin表达及细胞侵袭能力变化与P组相比, P-J-T组E-cadherin的蛋白及mRNA表达略有下调, P-V-T组表达则下调明显(图2A, B); 而P-J-T组vimentin的蛋白表达则略有升高, P-V-T组表达升高明显(图2A, B). 成功的JDP2转染由RT-PCR验证(图2C). 同时transwell侵袭实验证明细胞侵袭能力在P-V-T组显著升高(图3).
JDP2, 作为一种广泛的AP-1抑制蛋白, 可以和自身以及c-Jun, JunB, JunD或ATF-2形成二聚体, 并抑制Jun, c-Fos和ATF-2等的转录活性[3]. JDP2是通过回收HDAC3(histone deacetylase 3)到原癌基因c-jun的调控领域的方式来抑制其表达[8]; 还可以直接抑制HAT(histone acetyltransferase)的活性[9]; 并作为DNA结合蛋白, JDP2具有nucleosome assembly功能[9]; Heinrich等[10]发现, 在他们检测的53例取自七种不同类型恶性肿瘤的标本中, JDP2的表达水平在35.8%的癌组织标本呈不同程度下降, 而只有在5.8%的样品显示相反的结果. 癌基因k-Ras的突变是胰腺癌发生早期关键事件之一, 大约有30%的早期胰腺癌及几乎100%进展期胰腺癌伴有此基因的突变[11-13]. 被激活的k-Ras可以通过包括MEKK/SEK/JNK/AP-1(ATF-2/Jun)途径在内的多种传导途径来诱导细胞的转化[11-13]. c-Jun在胰腺癌中的表达增高, 证明Ras/AP-1传导途径有可能参与胰腺癌的发生. JDP2因为可以和自身以及c-Jun, JunB, JunD或ATF-2形成二聚体, 并抑制c-Jun, c-Fos和ATF-2等的转录活性, 这提示JDP2很可能通过抑制AP-1来阻断Ras信号传导途径. 而作为AP-1的重要成员之一的ATF-2, 则可以同C-Jun、CREB形成二聚体[14,15], 在黑色素瘤细胞中, ATF-2的表达与患者的预后密切相关[16]. 王成等[17]证明ATF-2在结直肠癌组织中的表达明显高于癌旁组织. 在乳腺癌中ATF-2稳定表达则与肿瘤细胞对DNA的损伤耐受有关[18]. ATF-2对脑的正常发育非常关键, 因为敲除ATF-2的小鼠大脑发育异常, 同时造成内耳、小脑及脑室的结构缺陷[19]. 在人结直肠癌细胞系中加入托芬那酸(Tolfenamic acid, TA)刺激后, 磷酸化的ATF-2表达升高, 同时伴有ATF3的表达水平的升高, 而且ATF-2的表达升高是通过P38 MAPK、JNK、ERK通路的激活来实现的[20]. 由上所述, JDP2极可能通过诸如ERK、JNK等通路来抑制如ATF-2或/和c-Jun的表达来调控胰腺癌的EMT, 但是其与胰腺癌的关系, 特别是与胰腺癌的侵袭、转移能力之间的联系, 以及其与胰腺癌EMT之间的关系至今还是空白.
EMT近年来受到越来越多的关注. EMT的证实包括上皮表达标志如E-cadherin表达的下调, 间质表达标志如N-cadherin、vimentin、snail等表达的上调; 同时还有形态学的改变如: 细胞失去极性, 丢失细胞间紧密连接和黏附连接并且可以观察到细胞获得了更强的浸润、转移的能力. 经典的诱导EMT的因子为TGF-β, 另外还有EGF、肝细胞生长因子(HGF)等. 目前已经在多种癌症中证实[21-24]. TGF-β与其受体结合后, 激活细胞内Smad信号通路, 通过抑制E-cadherin的表达来诱导EMT发生[25,26]. 在人的角质细胞中, 由TGF-β诱导产生的EMT需要Ras基因的激活[27]. 而在人胰腺癌中, Collagen I通过激活JNK1而使得胰腺癌的N-cadherin表达上调从而增加其侵袭能力的[28]. 在胰腺癌中, 单独转染带有SNAIL的质粒便可产生EMT[29], 韩磊等[30]则发现, Genistein具有明显的抑制EMT的作用.
我们在本实验中, 首先应用pCEFL-HA-JDP2质粒成功转染入人胰腺癌细胞系Panc-1. P-J-T组细胞与P-V-T组细胞在TGF-β1刺激48 h后, 与P组相比, P-J-T组E-cadherin及vimentin变化不大, 侵袭能力也未见明确增加; 相反的, P-V-T组则构建出经典的EMT模型, 侵袭能力也显著提高. 这说明, JDP2可抑制由TGF-β1产生的EMT, 提示我们在今后的抗肿瘤研究中可以将JDP2作为靶点, 探明其在胰腺癌治疗中的潜在应用价值.
胰腺癌是常见的恶性肿瘤, 由于其早期发生微转移及其临床症状出现较晚而令其治疗效果不佳; JDP2, 作为AP-1类的抑制因子之一, 在多种恶性肿瘤中表达降低, 极可能成为胰腺癌研究的新方向.
谭晓冬, 副教授, 中国医科大学盛京医院胰腺甲状腺外科; 刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科
关于恶性肿瘤侵袭、转移机制的研究目前已经成为研究肿瘤发生与发展的热点, JDP2, 作为一种抑癌因子, 通过调控其表达极有可能成为抑制胰腺癌发生、转移的新的分子靶向治疗.
Heinrich等发现, 在他们检测的53例取自7种不同类型恶性肿瘤的标本中, JDP2的表达水平在35.8%的癌组织标本呈不同程度下降, 而只有在5.8%的样品显示相反的结果.
本研究主要探讨过表达JDP2的胰腺癌细胞系对TGF-β1诱导的上皮向间质转化的抑制作用, 为进一步研究胰腺癌的治疗提供了新的方向.
尽管JDP2在肿瘤发生过程中的作用有零星报道, 但其机制尚不清楚, 本研究将pCEFL-HA-JDP2质粒转染至胰腺癌细胞系Panc-1中, 而此高表达JDP2的细胞系则可以明显抑制由TGF-β1诱导的EMT, 此研究国内外未见报道.
本文立题有一定新意, 实验设计可行, 结果具有一定的学术价值.
编辑: 李军亮 电编:闫晋利
| 1. | Jemal A, Siegel R, Ward E, Murray T, Xu J, Smigal C, Thun MJ. Cancer statistics, 2006. CA Cancer J Clin. 2006;56:106-130. [PubMed] [DOI] |
| 2. | Aronheim A, Zandi E, Hennemann H, Elledge SJ, Karin M. Isolation of an AP-1 repressor by a novel method for detecting protein-protein interactions. Mol Cell Biol. 1997;17:3094-3102. [PubMed] |
| 3. | Jin C, Ugai H, Song J, Murata T, Nili F, Sun K, Horikoshi M, Yokoyama KK. Identification of mouse Jun dimerization protein 2 as a novel repressor of ATF-2. FEBS Lett. 2001;489:34-41. [PubMed] [DOI] |
| 5. | Kang Y, Massagué J. Epithelial-mesenchymal transitions: twist in development and metastasis. Cell. 2004;118:277-279. [PubMed] [DOI] |
| 6. | Thiery JP, Acloque H, Huang RY, Nieto MA. Epithelial-mesenchymal transitions in development and disease. Cell. 2009;139:871-890. [PubMed] [DOI] |
| 7. | Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition. J Clin Invest. 2009;119:1420-1428. [PubMed] [DOI] |
| 8. | Jin C, Li H, Murata T, Sun K, Horikoshi M, Chiu R, Yokoyama KK. JDP2, a repressor of AP-1, recruits a histone deacetylase 3 complex to inhibit the retinoic acid-induced differentiation of F9 cells. Mol Cell Biol. 2002;22:4815-4826. [PubMed] [DOI] |
| 9. | Jin C, Kato K, Chimura T, Yamasaki T, Nakade K, Murata T, Li H, Pan J, Zhao M, Sun K. Regulation of histone acetylation and nucleosome assembly by transcription factor JDP2. Nat Struct Mol Biol. 2006;13:331-338. [PubMed] [DOI] |
| 10. | Heinrich R, Livne E, Ben-Izhak O, Aronheim A. The c-Jun dimerization protein 2 inhibits cell transformation and acts as a tumor suppressor gene. J Biol Chem. 2004;279:5708-5715. [PubMed] [DOI] |
| 11. | Torrisani J, Bournet B, Cordelier P, Buscail L. [New molecular targets in pancreatic cancer]. Bull Cancer. 2008;95:503-512. [PubMed] |
| 12. | Mackenzie RP, McCollum AD. Novel agents for the treatment of adenocarcinoma of the pancreas. Expert Rev Anticancer Ther. 2009;9:1473-1485. [PubMed] [DOI] |
| 13. | Furukawa T. Molecular pathology of pancreatic cancer: implications for molecular targeting therapy. Clin Gastroenterol Hepatol. 2009;7:S35-S39. [PubMed] [DOI] |
| 14. | Benbrook DM, Jones NC. Heterodimer formation between CREB and JUN proteins. Oncogene. 1990;5:295-302. [PubMed] |
| 15. | van Dam H, Castellazzi M. Distinct roles of Jun : Fos and Jun : ATF dimers in oncogenesis. Oncogene. 2001;20:2453-2464. [PubMed] [DOI] |
| 16. | Berger AJ, Kluger HM, Li N, Kielhorn E, Halaban R, Ronai Z, Rimm DL. Subcellular localization of activating transcription factor 2 in melanoma specimens predicts patient survival. Cancer Res. 2003;63:8103-8107. [PubMed] |
| 18. | Papassava P, Gorgoulis VG, Papaevangeliou D, Vlahopoulos S, van Dam H, Zoumpourlis V. Overexpression of activating transcription factor-2 is required for tumor growth and progression in mouse skin tumors. Cancer Res. 2004;64:8573-8584. [PubMed] [DOI] |
| 19. | Mei Y, Yuan Z, Song B, Li D, Ma C, Hu C, Ching YP, Li M. Activating transcription factor 3 up-regulated by c-Jun NH(2)-terminal kinase/c-Jun contributes to apoptosis induced by potassium deprivation in cerebellar granule neurons. Neuroscience. 2008;151:771-779. [PubMed] [DOI] |
| 20. | Lee SH, Bahn JH, Whitlock NC, Baek SJ. Activating transcription factor 2 (ATF2) controls tolfenamic acid-induced ATF3 expression via MAP kinase pathways. Oncogene. 2010;29:5182-5192. [PubMed] [DOI] |
| 21. | Cheng GZ, Chan J, Wang Q, Zhang W, Sun CD, Wang LH. Twist transcriptionally up-regulates AKT2 in breast cancer cells leading to increased migration, invasion, and resistance to paclitaxel. Cancer Res. 2007;67:1979-1987. [PubMed] [DOI] |
| 22. | Taki M, Kamata N, Yokoyama K, Fujimoto R, Tsutsumi S, Nagayama M. Down-regulation of Wnt-4 and up-regulation of Wnt-5a expression by epithelial-mesenchymal transition in human squamous carcinoma cells. Cancer Sci. 2003;94:593-597. [PubMed] [DOI] |
| 23. | Bertran E, Caja L, Navarro E, Sancho P, Mainez J, Murillo MM, Vinyals A, Fabra A, Fabregat I. Role of CXCR4/SDF-1 alpha in the migratory phenotype of hepatoma cells that have undergone epithelial-mesenchymal transition in response to the transforming growth factor-beta. Cell Signal. 2009;21:1595-1606. [PubMed] [DOI] |
| 24. | Wang Z, Li Y, Ahmad A, Banerjee S, Azmi AS, Kong D, Sarkar FH. Pancreatic cancer: understanding and overcoming chemoresistance. Nat Rev Gastroenterol Hepatol. 2011;8:27-33. [PubMed] [DOI] |
| 25. | Thuault S, Valcourt U, Petersen M, Manfioletti G, Heldin CH, Moustakas A. Transforming growth factor-beta employs HMGA2 to elicit epithelial-mesenchymal transition. J Cell Biol. 2006;174:175-183. [PubMed] [DOI] |
| 26. | Thuault S, Tan EJ, Peinado H, Cano A, Heldin CH, Moustakas A. HMGA2 and Smads co-regulate SNAIL1 expression during induction of epithelial-to-mesenchymal transition. J Biol Chem. 2008;283:33437-33446. [PubMed] [DOI] |
| 27. | Davies M, Robinson M, Smith E, Huntley S, Prime S, Paterson I. Induction of an epithelial to mesenchymal transition in human immortal and malignant keratinocytes by TGF-beta1 involves MAPK, Smad and AP-1 signalling pathways. J Cell Biochem. 2005;95:918-931. [PubMed] [DOI] |
| 28. | Shintani Y, Hollingsworth MA, Wheelock MJ, Johnson KR. Collagen I promotes metastasis in pancreatic cancer by activating c-Jun NH(2)-terminal kinase 1 and up-regulating N-cadherin expression. Cancer Res. 2006;66:11745-11753. [PubMed] [DOI] |
| 29. | Nishioka R, Itoh S, Gui T, Gai Z, Oikawa K, Kawai M, Tani M, Yamaue H, Muragaki Y. SNAIL induces epithelial-to-mesenchymal transition in a human pancreatic cancer cell line (BxPC3) and promotes distant metastasis and invasiveness in vivo. Exp Mol Pathol. 2010;89:149-157. [PubMed] [DOI] |