修回日期: 2011-09-13
接受日期: 2011-09-22
在线出版日期: 2011-10-08
目的: 观察ER-α36分子对人胃癌细胞SGC7901在裸鼠体内生长的影响.
方法: 利用慢病毒转染技术构建稳定高表达和低表达ERα-36分子的重组人胃癌SGC7901细胞株. 实验分为空白对照组(SGC7901-Control)、ER-α36低表达组(SGC7901-Low36)和ER-α36高表达组(SGC7901-High36), 每组各3只雄性裸鼠. 将上述细胞(5×106个/mL)接种裸鼠皮下, 建立裸鼠荷瘤模型, 连续观测30 d. 采用瘤结节体积测量和称质量、瘤组织HE染色及免疫组织化学法检测Ki67指数和E-cadherin蛋白表达等方法, 鉴定各组细胞生长的情况.
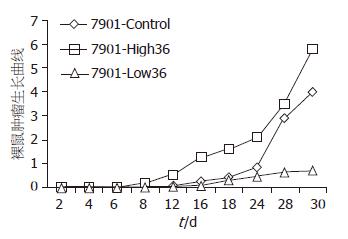
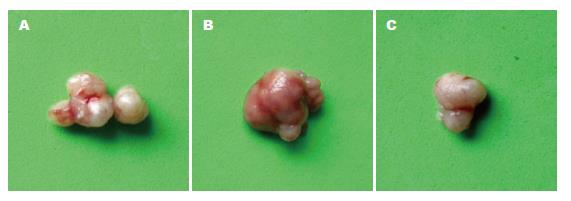
结果: 全组实验动物均出现移植瘤. 第16天开始, SGC7901-High36组裸鼠肿瘤的体积>SGC7901-Control组裸鼠肿瘤的体积>SGC7901-Low36组裸鼠肿瘤的体积, 两两之间有显著性差异(P<0.05). 第30天, SGC7901-High36组肿瘤的质量(2.58 g±0.014 g), 明显大于SGC7901-Control组(1.32 g±0.0245 g)和SGC7901-Low36组(0.471 g±0.021 g), 两两之间有显著性差异(P<0.05). SGC7901-High36组肿瘤细胞的核分裂数(42.33±6.33), 明显高于SGC7901-Control组(28.5±0.35)和SGC7901-Low36组(12.5±2.5), 两两之间有显著性差异(P<0.05). ki67阳性细胞计数, SGC7901-High36组(86.35±5.23), 明显高于SGC7901-Control组(65.44±4.56)和SGC7901-Low36组(18.25±2.56), 两两之间有显著性差异(P<0.05). SGC7901-High36组肿瘤细胞几乎不表达E-cadherin蛋白, 明显低于SGC7901-Control组和SGC7901-Low36组.
结论: ER-α36分子在胃癌细胞的生长与增殖中具有重要作用, 并可能通过靶向肿瘤细胞的粘附分子而促进肿瘤的侵袭与转移.
引文著录: 王绪明, 刘晶晶, 邓昊, 陈莹, 刘丽江. ER-α36对胃癌SGC7901细胞在裸鼠体内生长的影响. 世界华人消化杂志 2011; 19(28): 2919-2924
Revised: September 13, 2011
Accepted: September 22, 2011
Published online: October 8, 2011
AIM: To observe the effect of ER-α36 on the growth of SGC-7901 cells in nude mice.
METHODS: Utilizing lentivirus technology, we developed SGC7901 cell lines stably expressing ER-α36 siRNA vector (SGC7901-Low36) and ER-α36 expression vector (SGC7901-High36). Unmanipulated SGC7901 cells were used as controls (SGC7901-Control). These cells were subcutaneously injected into the nude mice to form SGC7901 transplantable tumors. The size and weight of the tumors were measured. Nuclear division was observed after HE staining, and the expression of Ki67 and E-cadherin was detected by immunohistochemistry.
RESULTS: Transplantable tumors formed in all nude mice. From day 16 to day 30, tumor size was highest in the SGC7901-High36 group, followed by the SGC7901-Control group, and the SGC7901-Low36 group had the least tumor size. There were significant differences (all P < 0.05) in tumor size between any two groups. On day 30, tumor weight was significantly higher in the SGC7901-High36 group than in the SGC7901-Control and SGC7901-Low36 groups (2.58 g ± 0.014 g vs 1.32 g ± 0.0245 g, 0.471 g ± 0.021 g; both P < 0.05). The number of nuclear division phases was significantly higher in the SGC7901-High36 group than in the SGC7901-Control and SGC7901-Low36 groups (42.33 ± 6.33 vs 28.5 ± 0.35, 12.5 ± 2.5; both P < 0.05). The expression of Ki67 was significantly higher in the SGC7901-High36 group than in the SGC7901-Control and SGC7901-Low36 groups (86.35 ± 5.23 vs 65.44 ± 4.56, 18.25 ± 2.56; both P < 0.05). The expression of E-cadherin in tumors in the SGC7901-High36 group was hardly seen, significantly lower than that in the SGC7901-Control and SGC7901-High36 groups.
CONCLUSION: ER-α36 may play an important role in gastric cancer cell growth and proliferation. ER-α36 may target tumor cells through adhesion molecules to promote tumor invasion and metastasis.
- Citation: Wang XM, Liu JJ, Deng H, Chen Y, Liu LJ. ER-α36 promotes the growth of SGC-7901 cells in nude mice. Shijie Huaren Xiaohua Zazhi 2011; 19(28): 2919-2924
- URL: https://www.wjgnet.com/1009-3079/full/v19/i28/2919.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i28.2919
雌激素受体-α36(estrogen receptor-α36, ER-α36)是新近发现的ER-α的同源异构体, 在乳腺癌等的研究中, 已经发现其扮演重要的角色[1-3]. 长期以来一直认为胃癌是非雌激素依赖的肿瘤, 但胃癌男性多于女性且在绝经期后这种差别消失的流行病学特点, 一直暗示我们雌激素可能发挥重要作用. 我们前期的工作[4,5]发现, 人体胃癌组织和胃癌细胞株中均有ER-α36 mRNA及蛋白质的表达, 并且明显高于ER-α66(经典的ER-α). 初步的研究发现, 在癌组织、癌旁组织及正常组织中ER-α36的表达有差异, 并且与胃癌患者的年龄、肿瘤的大小、组织学分级以及淋巴结转移相关. 提示ER-α36与胃癌的发生和发展可能存在一定的关联. 为证实上述的推测, 我们采用慢病毒转染技术, 构建稳定高表达ER-α36和低表达ER-α36的SGC7901人胃腺癌细胞株, 并建立裸鼠移植瘤模型, 观察ER-α36基因高表达及沉默后其移植瘤生长的情况, 进一步探讨ER-α36在胃癌发病中的分子机制, 为深入研究提供理论基础和实验数据, 并为胃癌的靶向治疗提供新的思路.
雄性BALB/c-nu裸鼠9只, 6-8周龄, 20-25 g, 购自湖北省实验动物研究中心, SPF环境下饲养. 本文所用实验动物及所有操作经江汉大学医学院医学伦理学委员会批准, 实验操作过程符合医学伦理学要求. 稳定高表达ER-α36和低表达ER-α36的胃癌SGC7901细胞株由本实验室构建并鉴定. 胃癌细胞株SGC7901用含100 mL/L小牛血清(Gibcol)的RPMI 1640培养基(Gibcol), 置于37 ℃, 50 mL/L CO2的培养箱中培养, 每2-3 d换1次液. 以含100 mL/L胎牛血清的DMEM培养基培养. 兔抗人ER-α36多克隆抗体由Zhaoyi Wang教授馈赠; Ki67小鼠抗人单克隆抗体及E-cadherin小鼠抗人单克隆抗体及SP试剂盒均购自福州迈新生物技术开发有限公司.
1.2.1 SGC7901荷瘤鼠模型的建立及观测: 将裸鼠随机分为3组, 每组3只. 收集处于对数生长期的SGC7901(SGC7901-Control)、ER-α36低表达(SGC7901-Low36)和ER-α36高表达(SGC7901-High36)细胞, 台盼蓝检测细胞活力在90%以上, 分别在每只裸鼠背部皮下接种细胞悬液1 mL(5×106个/mL), 以皮下瘤体结节直径>0.5 cm为接种成瘤标准. 出现肿瘤结节前每2 d观察1次, 肿瘤长出后每4 d测量1次, 按照公式计算肿瘤的近似体积V(mm3)=a×b2/2, 根据体积的均数, 绘制3组裸鼠的皮下移植瘤生长曲线. 接种30 d后, 按照医学伦理学的要求处死动物, 剥离肿块并称重. 同时观察有无肝、肺及脑转移. 常规40 g/L甲醛固定, 石蜡包埋, 常规HE染色及镜下观察, 核分裂象计数每个高倍视野的核分裂个数, 连续计数10个视野为准.
1.2.2 免疫组织化学染色: 严格按照免疫组织化学SP试剂盒说明书进行操作, Ki-67阳性定位于细胞核, E-cadherin阳性定位于细胞膜和细胞质. 参照Couzin等[6,7]的细胞计数方法, 用高倍视野(×400)计数100个肿瘤细胞, Ki-67阳性细胞率(%) = 阳性细胞数/总细胞数×100%. E-cadherin蛋白阳性以(-、+、++)分别表示阴性、阳性和强阳性.
统计学处理 全部数据经SPSS12.0统计学软件处理, Ki-67阳性细胞率用单因素方差分析及t检验, E-cadherin蛋白表达用卡方检验, 以P<0.05为有统计学意义.
3组裸鼠均在8 d开始出现肉眼可见的瘤结节(图1), 至16 d时, 3组间的肿瘤体积出现明显差异, SGC7901-High36组的肿瘤体积明显大于SGC7901-Control组和SGC7901-Low36组(P<0.01, 图2), 至30 d时处死裸鼠, SGC7901-High36组的肿瘤质量为2.58 g±0.014, 明显大于SGC7901-Control组(1.32 g±0.0245 g)和SGC7901-Low36组(0.471 g±0.021 g), 差异具有显著性(P<0.05, 图3).
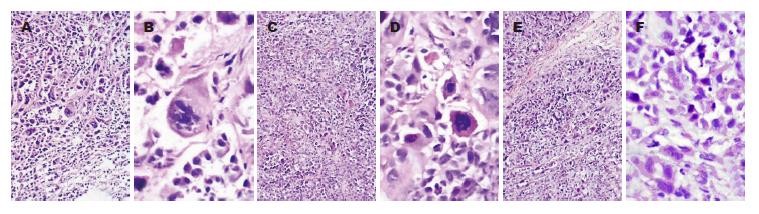
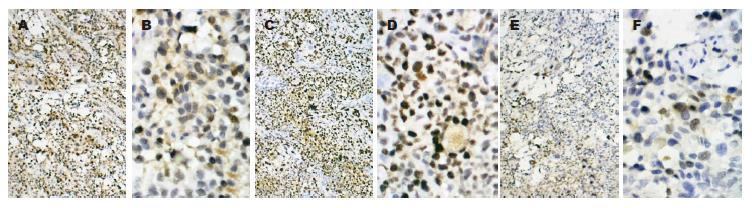
移植瘤细胞呈巢状、弥漫分布, 间质稀少、血管丰富, 部分区域形成腺管样结构, 瘤细胞核仁明显, 核分裂象多见. SGC7901-High36核分裂象为(42.33±6.33), 明显高于SGC7901-Low36组(28.5±0.35)和SGC7901-Control组(12.5±2.5), 差异具有统计学意义(P<0.05, 图4). 肝脏、肺脏及脑组织: 组织结构存在, 均未见癌细胞.
SGC7901-High36组Ki67阳性细胞数为(86.35±5.23), 明显高于SGC7901-Control组(65.44±4.56)和SGC7901-Low36组(18.25± 2.56), 差异具有统计学意义(P<0.05, 图5).
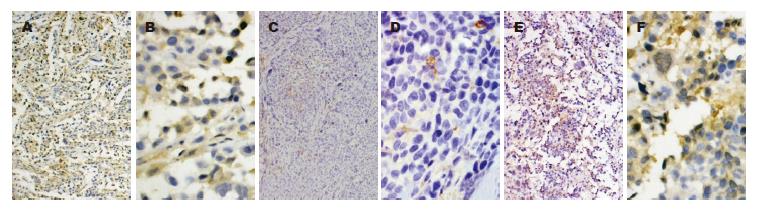
SGC7901-High36组肿瘤组织中几乎不表达E-cadherin蛋白(-)、SGC7901-Control组E-cadherin蛋白的表达为(+)、SGC7901-Low36组E-cadherin蛋白表达为(++)(图6).
胃癌是我国最常见的恶性肿瘤之一, 虽然发病在逐年下降, 但是一经发现仍多为进展期, 5年生存率低. 胃癌的流行病研究发现, 胃癌以男性为主, 男女之比为2-3:1, 这种性别上的差异, 随着女性绝经期的到来而消失, 用雌激素治疗前列腺癌的男性的胃癌发病率也降低. 用他莫昔芬治疗的妇女其胃癌的发病增加, 去除了卵巢的大鼠其胃癌的发病增加, 同时给予雌激素治疗则可降低这种风险[8-11]. 这些研究结果证实, 胃癌的发生与发展与雌激素以及雌激素介导的信号传导之间存在着重要的联系. 尽管胃癌不是传统意义上的性激素依赖肿瘤, 但是雌激素与胃癌之间的关系并不能完全否定. 雌激素(尤其是17β雌二醇, E2β)通过上调c-Myc和cyclin D1的表达, 激活cyclin E-Cdk2的复合体, 促进细胞周期的G1期向S期的转化, 介导细胞的增殖以及肿瘤的形成. 雌激素在乳腺癌等雌激素依赖的肿瘤中的研究已经很深入[12-15]. 由于胃癌中ER-α66(经典的ER-α)的表达率很低(2%-28%), 所以, 对胃癌中雌激素的作用及机制的研究长期没有受到重视[16-20].
ER-α36是Wang等[1-3]新近发现的一种ER-α亚型, 分子量约为3 5700 Da.与ER-α66相比, ER-α36缺少转录激活区AF1和AF2, 但其具有细胞因子的作用, 位于细胞膜和细胞质, 介导快速的雌激素信号转导, 产生多种生物学效应, 并与肿瘤细胞的分化与增殖有密切关系[1-3,7]. 深入的研究发现, ER-α36通过激活MAPK/ERK和PI3K/AKT信号通路的机制刺激乳腺癌细胞的生长, 尤其是在雌激素受体阴性的乳腺癌细胞中发挥更为重要的作用.
ER-α36在胃癌中作用并不清楚, 也未见报道. 我们前期的体外研究发现, 给予17β雌二醇作用胃癌细胞, 不仅产生应答, 并且细胞增生的效应与ER-α36的表达相一致[4,5], 上述效应在慢病毒转染构建的稳定过表达和沉默ER-α36的SGC7901细胞中进一步得到证实(数据未显示). 为进一步印证我们的前期结果和理论推测, 我们进行了体内实验, 将过表达和沉默ER-α36的胃癌SGC7901细胞, 移植至裸鼠体内, 观察ER-α36分子对肿瘤细胞生长的影响. 我们推测, ER-α36可能通过激活MAPK/ERK和PI3K/AKT信号通路促进胃癌细胞的增殖. 结果发现: 高表达ER-α36的胃癌细胞具有更多的细胞核分裂象、更高的细胞增殖指数(Ki67阳性细胞数), 提示当胃癌细胞过表达ER-α36分子时, 则具有生长更为活跃、细胞增殖速率更高的特点, 与ER-α阴性乳腺癌细胞中的研究结果相一致[1].
E-cadherin是分布在上皮组织中的钙依赖性跨膜蛋白, 与细胞间的黏附反应有关, 对维持细胞极性、参与分化调节以及维持组织结构形态和完整性起着重要作用. E-cadherin在肿瘤细胞中的表达减少, 降低了肿瘤细胞相互间的黏附, 使得肿瘤细胞容易脱离癌巢, 由此促进肿瘤细胞的转移[21-27]. 我们的结果显示, 高表达ER-α36的胃癌细胞几乎不表达E-cadherin蛋白, 与对照的低表达ER-α36胃癌细胞明显不同, 提示ER-α36分子对E-cadherin蛋白的表达有抑制作用. 已有研究表明, 低表达E-cadherin蛋白的胃癌病例具有高侵袭和高转移的特点[28-30], 但雌激素受体与胃癌细胞E-cadherin蛋白的表达之间相互关系的研究, 尚少有研究报告. 我们在人体胃癌组织样本中发现高表达ER-α36的胃癌更易发生淋巴结转移的结果[4,5], 支持ER-α36与胃癌的侵袭转移相关的推论. 因此, 在ER-α36和E-cadherin蛋白之间是否存在某种调控机制, 还需要进一步研究证实. 此外, 在本实验中并未发现裸鼠出现肺转移和肝转移病灶, 可能与移植瘤的时间较短有关.
胃癌是我国最常见的恶性肿瘤之一, 总体预后不好. 雌激素与雌激素受体在胃癌的发生与发展中的机制研究虽有报道, 但未取得突破性的进展. ER-α36是新发现的雌激素受体α的亚型, 与经典的ER-α(ER-α66)不同, 具有生长因子的作用, 有研究发现在雌激素受体阴性的乳腺癌、结肠癌等多种肿瘤中发挥重要作用.
肖恩华, 教授, 中南大学湘雅二医院放射教研室; 曹秀峰, 教授, 南京医科大学附属南京第一医院肿瘤中心
胃癌与雌激素的关系研究多集中在ER-α66和ER-β, 其结果不一, 而且很难解释流行病学显示的男性胃癌比绝经前女性胃癌发病率高的现象. 虽然胃癌不是传统意义上的性激素依赖肿瘤, 胃癌中ER-α66(经典的ER-α)的表达率很低(2-28%), 所以, 对胃癌中雌激素的作用及机制长期没有受到重视. ER-α36不同于经典的ER-α, 具有刺激细胞生长和增殖的特性, 与生长因子受体等能发生交叉对话, 对其的深入研究有助于进一步了解雌激素在胃癌发病中所扮演的角色.
王陆佰与Deng等曾采用半定量RT-PCR及免疫印迹方法在人胃腺癌组织中肿块、癌旁组织及正常组织中检测到ER-α36的表达, 并在胃癌细胞株中发现给予雌激素的刺激可介导生长信号的传导, 并且发现ER-α36的表达与胃癌的生物学行为相关.
本项研究在胃癌细胞中ER-α36的表达及信号传导的研究基础之上, 通过构建稳定表达的ER-α36细胞株深入进行体内研究, 发现高表达ER-α36的胃癌细胞具有更为活跃的增殖能力, 为进一步证实胃癌细胞中ER-α36的作用提供了证据.
实验对照的设计合理可靠, 统计学处理方法的使用恰当, 文章的科学性、创新性和可读性较好地反映了我国胃癌的发生发展与雌激素关系基础研究的相关水平.
编辑: 李军亮 电编:闫晋利
| 1. | Wang Z, Zhang X, Shen P, Loggie BW, Chang Y, Deuel TF. A variant of estrogen receptor-{alpha}, hER-{alpha}36: transduction of estrogen- and antiestrogen-dependent membrane-initiated mitogenic signaling. Proc Natl Acad Sci U S A. 2006;103:9063-9068. [PubMed] [DOI] |
| 2. | Wang Z, Zhang X, Shen P, Loggie BW, Chang Y, Deuel TF. Identification, cloning, and expression of human estrogen receptor-alpha36, a novel variant of human estrogen receptor-alpha66. Biochem Biophys Res Commun. 2005;336:1023-1027. [PubMed] [DOI] |
| 3. | Shi YE, Chen Y, Dackour R, Potters L, Wang S, Ding Q, Wang Z, Liu YE. Synuclein gamma stimulates membrane-initiated estrogen signaling by chaperoning estrogen receptor (ER)-alpha36, a variant of ER-alpha. Am J Pathol. 2010;177:964-973. [PubMed] [DOI] |
| 4. | Deng H, Huang X, Fan J, Wang L, Xia Q, Yang X, Wang Z, Liu L. A variant of estrogen receptor-alpha, ER-alpha36 is expressed in human gastric cancer and is highly correlated with lymph node metastasis. Oncol Rep. 2010;24:171-176. [PubMed] |
| 5. | 王 陆佰, 邓 昊, 黄 萱, 陈 莹, 刘 丽江. 胃癌中雌激素受体-α36与α66 mRNA的表达及其临床病理意义. 武汉大学学报(医学版). 2010;31:38-42. |
| 6. | Couzin J. Breakthrough of the year. Small RNAs make big splash. Science. 2002;298:2296-2297. [PubMed] [DOI] |
| 7. | Fasanella S, Leonardi E, Cantaloni C, Eccher C, Bazzanella I, Aldovini D, Bragantini E, Morelli L, Cuorvo LV, Ferro A. Proliferative activity in human breast cancer: Ki-67 automated evaluation and the influence of different Ki-67 equivalent antibodies. Diagn Pathol. 2011;6 Suppl 1:S7. [PubMed] [DOI] |
| 8. | Chandanos E, Lagergren J. The mystery of male dominance in oesophageal cancer and the potential protective role of oestrogen. Eur J Cancer. 2009;45:3149-3155. [PubMed] [DOI] |
| 9. | Chung HW, Noh SH, Lim JB. Analysis of demographic characteristics in 3242 young age gastric cancer patients in Korea. World J Gastroenterol. 2010;16:256-263. [PubMed] [DOI] |
| 10. | Chandanos E, Lagergren J. Oestrogen and the enigmatic male predominance of gastric cancer. Eur J Cancer. 2008;44:2397-2403. [PubMed] [DOI] |
| 11. | Chandanos E, Lindblad M, Jia C, Rubio CA, Ye W, Lagergren J. Tamoxifen exposure and risk of oesophageal and gastric adenocarcinoma: a population-based cohort study of breast cancer patients in Sweden. Br J Cancer. 2006;95:118-122. [PubMed] [DOI] |
| 12. | Fox EM, Andrade J, Shupnik MA. Novel actions of estrogen to promote proliferation: integration of cytoplasmic and nuclear pathways. Steroids. 2009;74:622-627. [PubMed] [DOI] |
| 13. | Ariazi EA, Kraus RJ, Farrell ML, Jordan VC, Mertz JE. Estrogen-related receptor alpha1 transcriptional activities are regulated in part via the ErbB2/HER2 signaling pathway. Mol Cancer Res. 2007;5:71-85. [PubMed] [DOI] |
| 14. | Díaz-Cruz ES, Furth PA. Deregulated estrogen receptor alpha and p53 heterozygosity collaborate in the development of mammary hyperplasia. Cancer Res. 2010;70:3965-3974. [PubMed] [DOI] |
| 15. | Konduri SD, Medisetty R, Liu W, Kaipparettu BA, Srivastava P, Brauch H, Fritz P, Swetzig WM, Gardner AE, Khan SA. Mechanisms of estrogen receptor antagonism toward p53 and its implications in breast cancer therapeutic response and stem cell regulation. Proc Natl Acad Sci U S A. 2010;107:15081-15086. [PubMed] [DOI] |
| 16. | Korenaga D, Orita H, Okuyama T, Kinoshita J, Maekawa S, Ikeda T, Sugimachi K. Sex hormone-receptor-negative tumors have a higher proliferative activity than sex hormone-receptor-positive tumors in human adenocarcinomas of the gastrointestinal tract. Surg Today. 1998;28:1007-1014. [PubMed] [DOI] |
| 17. | Persson C, Inoue M, Sasazuki S, Kurahashi N, Iwasaki M, Ye W, Tsugane S. Female reproductive factors and the risk of gastric cancer in a large-scale population-based cohort study in Japan (JPHC study). Eur J Cancer Prev. 2008;17:345-353. [PubMed] [DOI] |
| 18. | Wang M, Pan JY, Song GR, Chen HB, An LJ, Qu SX. Altered expression of estrogen receptor alpha and beta in advanced gastric adenocarcinoma: correlation with prothymosin alpha and clinicopathological parameters. Eur J Surg Oncol. 2007;33:195-201. [PubMed] [DOI] |
| 19. | Xu CY, Guo JL, Jiang ZN, Xie SD, Shen JG, Shen JY, Wang LB. Prognostic role of estrogen receptor alpha and estrogen receptor beta in gastric cancer. Ann Surg Oncol. 2010;17:2503-2509. [PubMed] [DOI] |
| 20. | Chandanos E, Rubio CA, Lindblad M, Jia C, Tsolakis AV, Warner M, Gustafsson JA, Lagergren J. Endogenous estrogen exposure in relation to distribution of histological type and estrogen receptors in gastric adenocarcinoma. Gastric Cancer. 2008;11:168-174. [PubMed] [DOI] |
| 23. | Pedrazzani C, Corso G, Marrelli D, Roviello F. E-cadherin and hereditary diffuse gastric cancer. Surgery. 2007;142:645-657. [PubMed] [DOI] |
| 24. | Mimata A, Fukamachi H, Eishi Y, Yuasa Y. Loss of E-cadherin in mouse gastric epithelial cells induces signet ring-like cells, a possible precursor lesion of diffuse gastric cancer. Cancer Sci. 2011;102:942-950. [PubMed] [DOI] |
| 25. | Batistatou A, Charalabopoulos AK, Scopa CD, Nakanishi Y, Kappas A, Hirohashi S, Agnantis NJ, Charalabopoulos K. Expression patterns of dysadherin and E-cadherin in lymph node metastases of colorectal carcinoma. Virchows Arch. 2006;448:763-767. [PubMed] [DOI] |
| 26. | Carneiro F, Huntsman DG, Smyrk TC, Owen DA, Seruca R, Pharoah P, Caldas C, Sobrinho-Simões M. Model of the early development of diffuse gastric cancer in E-cadherin mutation carriers and its implications for patient screening. J Pathol. 2004;203:681-687. [PubMed] [DOI] |
| 27. | Al-Moundhri MS, Al-Khanbashi M, Al-Kindi M, Al-Nabhani M, Burney IA, Al-Farsi A, Al-Bahrani B. Association of E-cadherin (CDH1) gene polymorphisms and gastric cancer risk. World J Gastroenterol. 2010;16:3432-3436. [PubMed] [DOI] |
| 28. | Saad AA, Awed NM, Abd Elkerim NN, El-Shennawy D, Alfons MA, Elserafy ME, Darwish YW, Barakat EM, Ezz-Elarab SS. Prognostic significance of E-cadherin expression and peripheral blood micrometastasis in gastric carcinoma patients. Ann Surg Oncol. 2010;17:3059-3067. [PubMed] [DOI] |
| 29. | Maehata Y, Hirahashi M, Aishima S, Kishimoto J, Hirohashi S, Yao T, Takashima H, Tsuneyoshi M, Oda Y. Significance of dysadherin and E-cadherin expression in differentiated-type gastric carcinoma with submucosal invasion. Hum Pathol. 2011;42:558-567. [PubMed] [DOI] |
| 30. | Mao Z, Ma X, Rong Y, Cui L, Wang X, Wu W, Zhang J, Jin D. Connective tissue growth factor enhances the migration of gastric cancer through downregulation of E-cadherin via the NF-κB pathway. Cancer Sci. 2011;102:104-110. [PubMed] [DOI] |