修回日期: 2011-06-17
接受日期: 2011-06-21
在线出版日期: 2011-09-28
目的: 观察白介素-10(interleukin-10, IL-10)基因转化大肠杆菌(E.coli/mIL-10)对葡聚糖硫酸钠(DSS)诱导小鼠结肠炎的影响, 并探讨其相关机制.
方法: 将小鼠IL-10基因序列转化至大肠杆菌(E.coli/mIL-10), 阴性组为空质粒转化大肠杆菌(E.coli0). 60只♀balb/c小鼠随机分成6组: 正常组对照组, DSS组, DSS+E.coli/mIL-10组, DSS+E.coli0, E.coli/mIL-10组和E.coli0组. 建立小鼠急性DSS结肠炎模型. 自小鼠模型建立第1天开始, DSS+E.coli/mIL-10组和正常鼠+E.coli/mIL-10分别给予E.coli/mIL-10灌胃至实验结束, DSS+E.coli0组和E.coli0组分别给予E.coli0灌胃至实验结束(1×108 cfu/天/只), 正常对照组以及DSS组给予同等培养基灌胃至实验结束. 每天观察各组疾病活动指数(DAI), 并在实验结束后检测各组小鼠炎症肠段肿瘤坏死因子(TNF)、髓过氧化物酶(MPO)和核因子(NF)-κB P65的表达.
结果: 自实验第4天开始DSS+E.coli/mIL-10组小鼠DAI明显低于DSS组和DSS+E.coli0组. 实验结束时DSS+E.coli/mIL-10组结肠组织中TNF(172.46±66.71 pg/g组织)、MPO活性(2.35±0.39 U/g组织)比DSS组和DSS+E.coli0组[(237.85±47.01)和(239.81±50.38) pg/g组织]、[(4.15±0.77)和(3.5±1.23) U/g组织]均明显降低; 结肠组织NF-κB阳性表达减少. 正常小鼠给予重组大肠杆菌灌胃后未出现结肠黏膜损伤.
结论: 利用经IL-10基因转化的大肠杆菌可以明显缓解DSS小鼠的结肠炎症损伤, 减低MPO活性、抑制炎症肠段炎症细胞NF-κB的活化及炎性细胞因子的分泌. 利用基因工程技术结合肠道共栖菌表达IL-10可以为IBD治疗提供一个新的方法.
引文著录: 顾秋平, 谢俊锋, 陈江, 张翼, 洪凯, 白爱平. IL-10基因转化的大肠杆菌对小鼠结肠炎的治疗作用. 世界华人消化杂志 2011; 19(27): 2835-2840
Revised: June 17, 2011
Accepted: June 21, 2011
Published online: September 28, 2011
AIM: To evaluate the therapeutic effect of interleukin-10 (IL-10)-secreting Escherichia coli (E. coli) on murine colitis.
METHODS: Sixty 6-8-wk-old female BALB/c mice were divided into six groups: normal control group, dextran sulfate sodium (DSS) group, empty plasmid-transformed E.coli (E.coli0) group, IL-10 gene-transformed E.coli (E.coli/mIL-10) group, DSS + E.coli0 group, and DSS + E.coli/mIL-10 group. The DSS, DSS + E.coli0, and DSS + E.coli/mIL-10 groups were fed 5 % DSS solution for 7 d to induce colitis, while the other groups were given normal tap water. The E.coli0 and DSS + E.coli0 groups were intragastrically given E.coli0; the E.coli/mIL-10 and DSS + E.coli/mIL-10 groups were given recombinant E.coli/mIL-10; and the DSS and normal control groups were given LB (Luria-Bertain) medium. The treatment lasted for 8 days. Disease activity index (DAI) was recorded each day. The expression of TNF-α, NF-κB p65 and myeloperoxidase (MPO) in the colon was measured at the end of the experiment.
RESULTS: Mice in the DSS + E.coli/mIL-10 group showed a lower DAI than those in the DSS and DSS + E.coli0 groups from day 4 to the end of the experiment. The levels of TNF-α and MPO in the colon and the expression of NF-κB P65 in the nuclei of inflammatory cells were lower in the DSS + E.coli/mIL-10 group (172.46 pg/g ± 22.23 pg/g, 2.35 U/g ± 0.15 U/g) than in the DSS (237.85 pg/g ± 14.86 pg/g, 4.15 U/g ± 0.29 U/g) and DSS + E.coli0 groups (239.81 pg/g ± 50.38 pg/g, 3.5 U/g ±1.23 U/g) at the end of experiment. No colonic injury was observed in mice in the normal control, E.coli/IL-10 and E.coli0 groups.
CONCLUSION: Local delivery of IL-10 gene-transformed E.coli ameliorates DSS-inducd murine colitis possibly by decreasing proinflammatory cytokine production and inhibiting NF-κB activation. Gene therapy strategies using engineered E.coli encoding immunoregulatory cytokines may provide a potential approach for treatment of inflammatory bowel disease.
- Citation: Gu QP, Xie JF, Chen J, Zhang Y, Hong K, Bai AP. Treatment of murine colitis with IL-10-secreting Escherichia coli. Shijie Huaren Xiaohua Zazhi 2011; 19(27): 2835-2840
- URL: https://www.wjgnet.com/1009-3079/full/v19/i27/2835.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i27.2835
炎症性肠病(inflammatory bowel disease, IBD)主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn disease, CD)两大类, 是一种以肠道异常免疫反应为主要特点的消化系疾病, 临床疾病特点是慢性、复发性肠道炎症损伤. 许多研究已经证实, 利用IL-10基因缺陷小鼠可建立结肠炎小鼠模型[1], IL-10受体编码基因突变或者缺陷导致IBD的发病[2], IL-10可能参与了IBD的发病. 有研究发现[3], 给予补充重组IL-10可以有限缓解IBD患者的临床症状. 然而, 全身给药的方式并不能达到理想的效果, 如静脉或皮下注射给药途径治疗效果欠佳, 究其原因考虑为IL-10在肠道局部的药物浓度不足和血清中的半衰期较短有关. IL-10基因敲除结肠炎小鼠经重组腺病毒-mIL-10(AdvmuIL-10)灌肠后, 可以有效提高肠道局部的IL-10浓度, 缓解肠道炎症损伤, 避免了全身用药的不良反应[4]. 本实验中, 我们建立了病理学特征与人UC极为相似的小鼠葡聚糖硫酸钠(DSS)急性结肠炎模型, 观察口服IL-10基因转化大肠杆菌在肠道局部表达mIL-10对结肠炎的肠道炎症的抑制作用和可能机制.
DSS(葡聚糖硫酸钠): MP公司, 美国; 兔抗小鼠NF-κB p65IgG(一抗): SanatCurz公司, 美国; 二步法免疫组织化学检测试剂盒(PV-6002)、DAB显色增强剂: 购自北京中杉生物技术有限公司; 小鼠TNF-α ELISA试剂盒: 上海森雄生物工程有限公司; 髓过氧化物酶(MPO)检测试剂盒: 南京建成生物工程研究所.
1.2.1 造模: 按Cooper等[5]的方法建立小鼠急性DSS结肠炎模型. 小鼠自由饮用5%DSS, 每天根据前日小鼠的饮水量重新配制当天的饮水量; 自小鼠模型建立第1天开始, DSS+E.coli/mIL-10组和E.coli/mIL-10分别给予重组大肠杆菌灌胃至实验结束, DSS+E.coli0组和E.coli0组分别给予空质粒大肠杆菌灌胃至实验结束, 正常对照组以及DSS组给予同等培养基灌胃至实验结束, 每日口服细菌量为1×108 cfu/d. 实验的第8天处死小鼠.
1.2.2 结肠炎疾病活动指数的评估: 每日观察并记录小鼠体质量、大便的性状和大便出血(隐血或血便)等, 按Muran等[6]的评分方法, 将体质量下降、大便性状、大便出血等的评分相加, 计算每只小鼠的疾病活动指数(diseaseactiviytindex, DAI), 评估结肠炎严重程度.
1.2.3 结肠组织髓过氧化物酶(MyeloPeroxidase, MPO)活性测定: 按试剂盒说明进行操作. 以生理盐水冲洗结肠组织, 取所留结肠组织并剪碎, 置入冷的生理盐水中制备5%的组织匀浆, 取5%的组织匀浆液0.9 mL并加入100 μL 0.05%H2O2, 充分混匀, 37 ℃水浴15 min; 取上述混匀液0.2 mL加入3 mL含0.03%邻连茴香胺的5 mmol/L PBS液中, 混匀, 37 ℃水浴30 min;加入50 μL 2.0%叠氮钠混匀, 60 ℃水浴10 min后, 立即在460 nm处测各管A值.
1.2.4 结肠组织细胞因子TNF的检检测: 酶联免疫吸附检测按试剂盒说明书进行操作. 先根据试剂盒提供的标准品制作标准曲线. 室温下将100 μL小鼠结肠组织匀浆上清液加入每孔, 让待测抗原与包被的吸附抗体(羊抗小鼠TNF多克隆抗体)结合, 封板胶封住反应孔, 37 ℃孵育120 min. 洗板4次, 加入生物素化抗体(生物素标记的兔抗小鼠TNF多克隆抗体)50 μL/孔, 37 ℃孵育60 min. 洗板4次, 加入辣根过氧化酶(horseradishperoxidase, HRP)标记的亲合素100 μL/孔, 37 ℃孵育40 min. 洗板4次, 加入显色剂100 μL/孔, 37 ℃避光显色20 min. 显色反应经酸终止后即492 nm测定A值.
1.2.5 免疫组织化学检测结肠组织核因子NF-κB p65的表达: 在距肛门4 cm处取0.4 cm×0.5 cm大小的结肠组织块, 4%甲醛溶液固定, 石蜡包埋后切取4 μm切片并置防脱的玻片上, 70 ℃烤箱内过夜. 切片常规脱蜡至水, 双蒸水洗2次后, 用3% H2O2室温下灭活内源性过氧化物酶15 min, 双蒸水洗3次. 将切片浸入0.01 mol/L构椽酸盐缓冲液(pH6.0)中, 电炉煮沸15 min, 自然冷却后以0.1 mol/L PBS洗3次. 加入1∶400兔抗小鼠NF-κB p65多克隆抗体, 4 ℃过夜, 0.1 mol/L PBS洗3次. 加入生物素化山羊抗兔IgG工作液, 37 ℃孵育30 min, 0.1 mol/L PBS洗3次. 加入辣根过氧化物酶标记工作液(HRP)37 ℃孵育40 min, 0.1 mol/L PBS洗4次. DAB显色, 苏木素复染, 1%盐酸酒精分化, 脱水透明, 封片, 显微镜下观察. 实验中以PBS缓冲液代替P65抗体作为空白对照, 以已知P65免疫组织化学染色阳性的切片作为阳性对照. 细胞浆、胞核都出现棕褐色颗粒的细胞为P65阳性细胞, 在400倍高倍镜下阳性细胞数, 并以百分比表示.
统计学处理 采用SPSS16.0统计软件, 所有的数据以mean±SD形式表示, 进行组间方差分析, 方差不齐时采用秩和检验, 以P<0.05为有显著性差异.
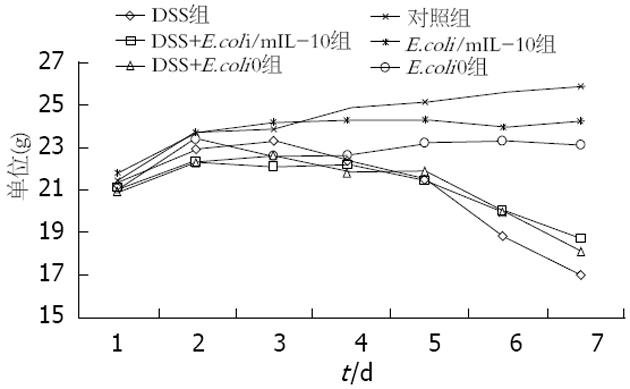
实验开始前各组小鼠体质量无明显差异. DSS组小鼠服在连续饮用DSS水的第2天后出现懒动、进食量减少等, 实验第7天DSS组以及DSS+E.coli0组小鼠的体质量下降明显, 全部的小鼠均出现血便, 而E.coli/mIL-10干预的DSS组小鼠出现大便潜血以及血便较另外两组DSS小鼠晚, 其体质量下降的幅度也相应较小. 对照组、E.coli/mIL-10组以及E.coli0组的小鼠未出现明显的体质量下降、便血、少动等现象, 3组小鼠的体质量菌呈持续增加(图1).
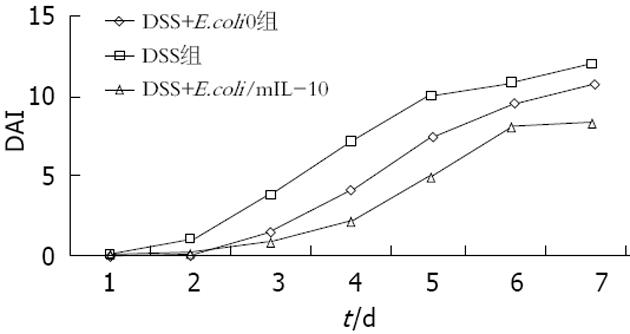
DSS组小鼠服DSS的第4天, 6只小鼠出现大便松散、隐血阳性, 平均DAI评分为7.166, 第5天4只小鼠腹泻血水便, 第6天7只小鼠腹泻血水便, 第7天全部小鼠腹泻血水便, DAI评分为12.124士0.13. E.coli/mIL-10组小鼠出现结肠炎症状如腹泻、便血等较DSS组晚, 症状明显低于DSS组(P<0.05). 而DSS+E.coli0组小鼠出现大便形状改变、便血以及体质量下降与DSS组相似, 在实验第5-7天, 全部小鼠菌出现血便, 与DSS组无明显差异(P>0.05). 对照组各组小鼠的DAI评分为0(图2).
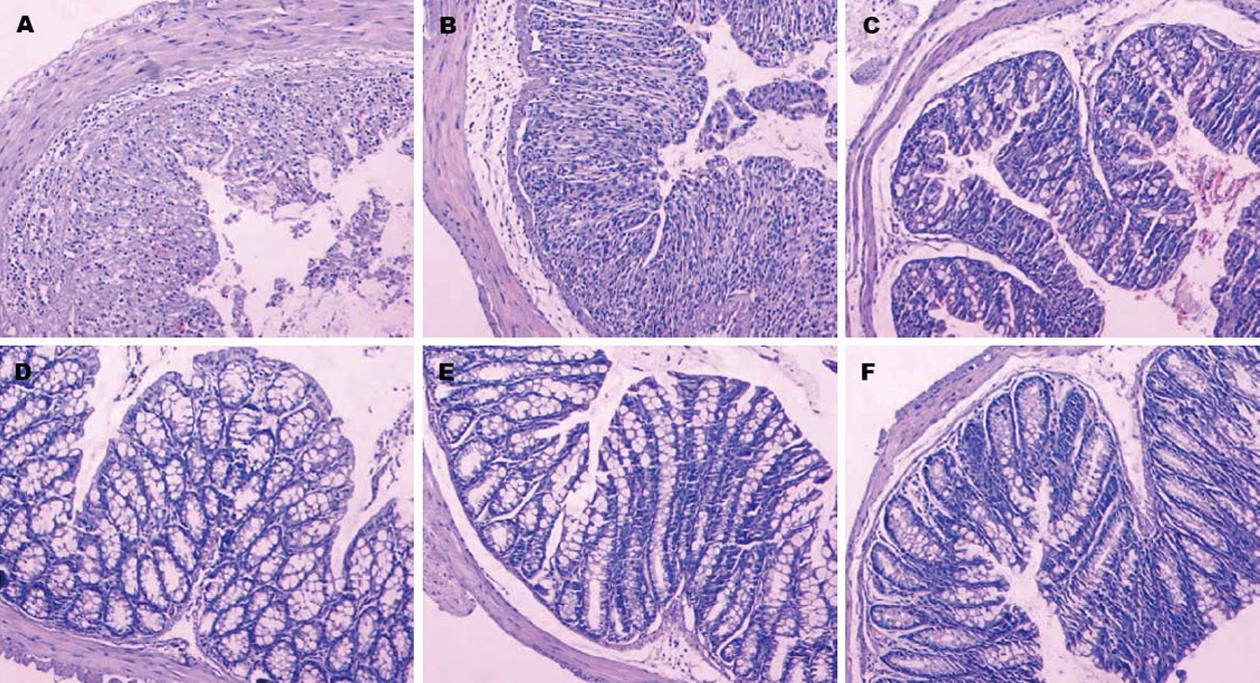
光镜下, 对照组小鼠结肠组织黏膜腺体排列整齐, 隐窝、表面上皮完整, 黏膜固有层有少许LPMC, 无炎性细胞浸润(图3D). DSS组小鼠饮用5% DSS溶液7 d后, 光镜下观察小鼠距肛门4 cm处结肠组织学变化, 发现80% DSS组结肠的全部隐窝被破坏, 仅残留少许肠上皮细胞, 黏膜层、黏膜固有层有大量以中性粒细胞为主的炎性细胞浸润, 可见出血灶(图3A), DSS+E.coli0组结肠组织学变化与DSS组相似(图3B). DSS+E.coli/mIL-10组小鼠结肠黏膜轻度破坏, 腺体减少, 隐窝仅有少量炎性细胞浸润(图3C); 正常小鼠给予E.coli0或者E.coli/mIL-10灌胃后, 结肠未见明显炎症改变, 其结肠组织学变化与正常小鼠无明显差异(图3E, F). E.coli/mIL-10能减轻DSS造成的黏膜损伤, 恢复腺体及绒毛排列, 而空质粒工程菌无此效果; 并且结果显示大肠杆菌灌胃后对小鼠结肠无明显毒性作用(表1).
| 分组 | n | 病理评分 | F值 | P值 |
| DSS组 | 10 | 10.54±4.15 | ||
| DSS-E.coli/IL-10组 | 9 | 6.22±3.30a | 17.69 | <0.05 |
| DSS-E.coli0组 | 9 | 10.0±3.00 | ||
| 对照组 | 9 | 0.88±0.31 | ||
| E.coli/IL-10组 | 9 | 1.22±0.43 | ||
| E.coli0组 | 9 | 1.0±0.40 |
DSS+E.coli/mIl-10组小鼠结肠MPO活性较DSS组以及DSS-E.coli0低(P<0.05), 各组小鼠结肠组织中MPO活性(表2).
将距肛门3 cm处所取的结肠组织块用冷的生理盐水制备成10%的组织匀浆, 检测组织中TNF-α的水平, 结果见表2.
在距肛门4 cm处的结肠组织, 正常小鼠的黏膜层中, 少数隐窝底部上皮细胞和少量的LPMC为P65阳性细胞, 但胞核着色很淡, 黏膜下层细胞很少有P65阳性细胞. DSS组的黏膜层中, 残存的腺体上皮细胞均为P65阳性细胞, 黏膜层浸润的大部分炎性细胞胞核P65染色阳性, 黏膜下层浸润的大量炎性细胞也是P65阳性细胞. DSS+E.coli/mIL-10组小鼠结肠残存的腺体上皮细胞少量P65阳性细胞, 黏膜层炎性细胞中P65阳性细胞数较DSS组明显减少(P<0.05). E.coli0组和E.coli/mIL-10组结肠组织中P65的阳性表达与对照组相似, 黏膜层以及基底层仅少量表达, 无统计学差异(P>0.05, 表2).
IBD被认为是由于肠道黏膜Th1/Th2细胞因子失衡触发局部炎症并导致肠道黏膜异常免疫炎症反应的结果, 然而, 对于其明确的发病机制尚不清楚. 目前, 对于IBD的常规治疗仍首先选择氨基水杨酸(含柳氮磺胺吡啶和5-氨基水杨酸)、皮质激素、免疫抑制药物[硫唑嘌呤(AZA), 6-巯基嘌呤(6-MP), 甲氨蝶呤(MTX), 环孢菌素A(CyA)], 药物的选择取决于临床治疗的目标、病变的范围、对药物的依从性和出现并发症与否[7,8]. 这些药物在临床使用中发挥着重要作用, 但是长期服药带来的不良反应和给患者带来的巨大的经济压力仍亟待解决.
在众多异常炎症性疾病的研究中证实, 利用重组免疫细胞因子或特异性的单克隆抗体中和炎症介质是一种非常有效的方法[9,10]. 目前在IBD的临床试验和应用中显示出较好效果的生物制剂有很多, 包括抗炎细胞因子抗体制剂[11]、抗白细胞黏附分子制剂[12]、Th1细胞极化抑制剂以及重组人细胞因子等.长期研究显示, IL-10参与了IBD的发病, 补充体内IL-10可以达到缓解肠道局部炎症的效果[13,14]. 然而, 系统用药显示IL-10的疗效十分有限的, 考虑为局部药物浓度不足[15], 提高局部药物浓度可明显增加其生物学效应[16]. 本研究利用肠道共栖菌大肠杆菌作为一种生物治疗的运载体, 经过基因修饰后使其具有表达活性mIL-10的能力, 经口服后能明显改善小鼠急性DSS结肠炎病情.
DSS诱导急性小鼠结肠炎的病理生理学特点与人类溃疡性结肠炎十分相似. 本研究中, 给予balb/c小鼠自由饮用5% DSS水7 d后, 出现腹泻、血便以及体质量下降等现象, 组织学改变与 Cooper等[5]报道一致. 自实验开始第4天, DSS+E.coli/mIL-10组小鼠的DAI得分值明显低于DSS组和DSS+E.coli0组. 组织病理学改变显示, 给予E.coli/mIL-10灌胃后, 其黏膜炎症损伤较轻, 而给予正常小鼠口服重组大肠杆菌均未出现黏膜损伤.
研究显示, 肠道异常免疫反应导致过量炎症细胞因子产生在IBD发病中起着重要作用, CD和UC炎症肠黏膜都产生大量的IL-1β、IL-6、IL-8、IL-16和TNF, 这些细胞因子的产生是由一些转录因子所调控的, NF-κB是其中重要的转录因子之一[17,18]. 肠道在炎症状态下, 伴随着NF-κB的明显增高, 炎症细胞因子的产生也与此有密切关系[19,20]. TNF是肠道炎症细胞因子中最重要的一个, 他不仅可以直接导致上皮细胞的损伤而且可以促进其他细胞因子的释放, 扩大肠道黏膜的损伤; 此外, TNF可增加肠道炎症损伤部位微血管的通透性, 导致微血栓形成造成微循环障碍, 加重肠黏膜损伤[21], 利用抗TNF-α抗体可以缓解结肠的炎症反应[22]. 本研究中, 我们检测了各组小鼠结肠TNF-α的含量和NF-κB的活化程度, 结果显示给予E.coli/mil-10口服后可降低结肠组织NF-κB的活化, 减少TNF的释放. 从对照组的各项检测中, 我们发现口服重组大肠杆菌未引起肠道局部炎症反应, 说明大肠杆菌是一种有效、安全的基因治疗运载体.
IL-10重组大肠杆菌可以缓解肠道炎症反应, 但是仍面临许多问题, 如运载体的选择、口服细菌的浓度和防止细菌过度增殖导致细菌移位等. 总之, IL-10的基因治疗是值得期待的, 他有可能为将来IBD的治疗提供新的方法.
炎症性肠病(IBD)的发病被认为是基因的易感性与环境因素之间的相互作用后导致肠道异常免疫反应的结果. 调节肠道免疫反应, 减少促炎症细胞因子过量释放对肠粘膜的损伤是IBD治疗的主要措施之一. 近年来大量的基础及前期临床研究发现, IL-10具有强有力的免疫调节作用, 并证实其对IBD的肠道炎症具有较好的缓解作用. 然而, 不同的给药方式其疗效也截然不同, 探索新型的给药方式并避免不良反应是目前IL-10在IBD相关生物治疗研究中的热点.
陆伦根, 教授, 上海交通大学附属第一人民医院消化科
IL-10相关的生物治疗是目前IBD治疗研究的热点之一, 如何提高肠道局部Il-10浓度发挥更好的生物学效应也是目前面临的难点.
Yao等IL-10基因转化双歧杆菌, 将其给DSS诱导结肠炎小鼠模型灌胃后, 可明显缓解小鼠急性结肠炎模型的肠道炎症反应.
本研究通过将IL-10基因转化肠菌, 使其基因分泌活性IL-10的能力, 使其在肠道定植后表达IL-10并发挥免疫调节作用. 这避免了以往研究将重组IL-10蛋白直接通过系统给药方式所带来的不良反应.
利用基因转化肠菌的方法, 很可能可成为IL-10将来在IBD治疗上的突破口. 本实验显示短期内重组肠菌对正常肠黏膜无明显致病作用, 然而, 重组肠菌在肠道长期表达IL-10对机体的免疫影响仍需进一步研究证实.
本文设计合理, 内容新颖, 对炎症性肠病的理论研究和临床治疗有指导意义.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Kühn R, Löhler J, Rennick D, Rajewsky K, Müller W. Interleukin-10-deficient mice develop chronic enterocolitis. Cell. 1993;75:263-274. [PubMed] [DOI] |
| 2. | Glocker EO, Kotlarz D, Boztug K, Gertz EM, Schäffer AA, Noyan F, Perro M, Diestelhorst J, Allroth A, Murugan D. Inflammatory bowel disease and mutations affecting the interleukin-10 receptor. N Engl J Med. 2009;361:2033-2045. [PubMed] [DOI] |
| 3. | Tilg H, van Montfrans C, van den Ende A, Kaser A, van Deventer SJ, Schreiber S, Gregor M, Ludwiczek O, Rutgeerts P, Gasche C. Treatment of Crohn's disease with recombinant human interleukin 10 induces the proinflammatory cytokine interferon gamma. Gut. 2002;50:191-195. [PubMed] [DOI] |
| 4. | Lindsay JO, Ciesielski CJ, Scheinin T, Brennan FM, Hodgson HJ. Local delivery of adenoviral vectors encoding murine interleukin 10 induces colonic interleukin 10 production and is therapeutic for murine colitis. Gut. 2003;52:363-369. [PubMed] [DOI] |
| 5. | Cooper HS, Murthy SN, Shah RS, Sedergran DJ. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 1993;69:238-249. [PubMed] |
| 6. | Murano M, Maemura K, Hirata I, Toshina K, Nishikawa T, Hamamoto N, Sasaki S, Saitoh O, Katsu K. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis. Clin Exp Immunol. 2000;120:51-58. [PubMed] [DOI] |
| 7. | Hanauer SB, Present DH. The state of the art in the management of inflammatory bowel disease. Rev Gastroenterol Disord. 2003;3:81-92. [PubMed] |
| 8. | 欧阳钦, Rakesh Tandon, KL Goh, 潘国宗, KM Fock, Claudio Fiocchi, SK Lam, 萧树东, 张虎, 梁红亮, 王玉芳. 亚太地区炎症性肠病处理共识意见(二). 胃肠病学. 2006;5:301-305. |
| 9. | Fedorak RN, Gangl A, Elson CO, Rutgeerts P, Schreiber S, Wild G, Hanauer SB, Kilian A, Cohard M, LeBeaut A. Recombinant human interleukin 10 in the treatment of patients with mild to moderately active Crohn's disease. The Interleukin 10 Inflammatory Bowel Disease Cooperative Study Group. Gastroenterology. 2000;119:1473-1482. [PubMed] |
| 10. | Bai A, Peng Z. Biological therapies of inflammatory bowel disease. Immunotherapy. 2010;2:727-742. [PubMed] [DOI] |
| 11. | Caviglia R, Ribolsi M, Rizzi M, Emerenziani S, Annunziata ML, Cicala M. Maintenance of remission with infliximab in inflammatory bowel disease: efficacy and safety long-term follow-up. World J Gastroenterol. 2007;13:5238-5244. [PubMed] |
| 12. | Lanzarotto F, Carpani M, Chaudhary R, Ghosh S. Novel treatment options for inflammatory bowel disease: targeting alpha 4 integrin. Drugs. 2006;66:1179-1189. [PubMed] [DOI] |
| 13. | Ribbons KA, Thompson JH, Liu X, Pennline K, Clark DA, Miller MJ. Anti-inflammatory properties of interleukin-10 administration in hapten-induced colitis. Eur J Pharmacol. 1997;323:245-254. [PubMed] [DOI] |
| 14. | Arnott ID, McNeill G, Satsangi J. An analysis of factors influencing short-term and sustained response to infliximab treatment for Crohn's disease. Aliment Pharmacol Ther. 2003;17:1451-1457. [PubMed] [DOI] |
| 15. | Schreiber S, Fedorak RN, Nielsen OH, Wild G, Williams CN, Nikolaus S, Jacyna M, Lashner BA, Gangl A, Rutgeerts P. Safety and efficacy of recombinant human interleukin 10 in chronic active Crohn's disease. Crohn's Disease IL-10 Cooperative Study Group. Gastroenterology. 2000;119:1461-1472. [PubMed] |
| 16. | Braat H, Rottiers P, Hommes DW, Huyghebaert N, Remaut E, Remon JP, van Deventer SJ, Neirynck S, Peppelenbosch MP, Steidler L. A phase I trial with transgenic bacteria expressing interleukin-10 in Crohn's disease. Clin Gastroenterol Hepatol. 2006;4:754-759. [PubMed] [DOI] |
| 17. | Hegazy SK, El-Bedewy MM. Effect of probiotics on pro-inflammatory cytokines and NF-kappaB activation in ulcerative colitis. World J Gastroenterol. 2010;16:4145-4151. [PubMed] [DOI] |
| 18. | Bai A, Guo Y, Lu N. The effect of the cholinergic anti-inflammatory pathway on experimental colitis. Scand J Immunol. 2007;66:538-545. [PubMed] [DOI] |
| 19. | Sbragia L, Schmidt AF, Moraes S, Bittencourt DG, Gonçalves FL, Pereira LA, Velloso LA. Inflammatory response in a rat model of gastroschisis is associated with an increase of NF-kappaB. Braz J Med Biol Res. 2010;43:160-165. [PubMed] [DOI] |
| 20. | Andoh A, Yagi Y, Shioya M, Nishida A, Tsujikawa T, Fujiyama Y. Mucosal cytokine network in inflammatory bowel disease. World J Gastroenterol. 2008;14:5154-5161. [PubMed] [DOI] |
| 21. | Role of tumor necrosis factor-α in the extraintestinal thrombosis associated with colonic inflammation. Inflamm Bowel Dis. 2010; Dec 16. [Epub ahead of print]. [PubMed] |
| 22. | Vandenbroucke K, de Haard H, Beirnaert E, Dreier T, Lauwereys M, Huyck L, Van Huysse J, Demetter P, Steidler L, Remaut E. Orally administered L. lactis secreting an anti-TNF Nanobody demonstrate efficacy in chronic colitis. Mucosal Immunol. 2010;3:49-56. [PubMed] [DOI] |